Как делают пищевую соду
Карбонат натрия — Википедия
| Карбонат натрия | |||
|---|---|---|---|
| |||
({{{изображение}}}) | |||
| Систематическое наименование | Карбонат натрия | ||
| Традиционные названия | кальцинированная сода, углекислый натрий | ||
| Хим. формула | Na2CO3 | ||
| Молярная масса | 105,99 г/моль | ||
| Плотность | 2,53 г/см³ | ||
| Температура | |||
| • плавления | 854 °C | ||
| • разложения | 1000 °C | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 10,33 | ||
| Растворимость | |||
| • в воде при 20 °C | 21,8 г/100 мл | ||
| Рег. номер CAS | 497-19-8 | ||
| PubChem | 10340 | ||
| Рег. номер EINECS | 207-838-8 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E500(i) | ||
| RTECS | VZ4050000 | ||
| ChEBI | 29377 | ||
| ChemSpider | 9916 | ||
| ЛД50 | 4 г/кг (крысы, орально) | ||
| Пиктограммы СГС | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
Карбона́т на́трия (кальцинированная сода) — неорганическое соединение, натриевая соль угольной кислоты с химической формулой Na2CO3. Бесцветные кристаллы или белый порошок, хорошо растворимый в воде. В промышленности в основном получают из хлорида натрия по методу Солвэ. Применяют при изготовлении стекла, для производства моющих средств, используют в процессе получения алюминия из бокситов и при очистке нефти.
Имеет вид бесцветных кристаллов или белого порошка. Существует в нескольких разных модификациях: α-модификация с моноклинной кристаллической решеткой образуется при температуре до 350 °C, затем, при нагреве выше этой температуры и до 479 °C осуществляется переход в β-модификацию, также имеющую моноклинную кристаллическую решетку. При увеличении температуры выше 479 °C соединение переходит γ-модификацию с гексагональной решеткой. Плавится при 854 °C, при нагреве выше 1000 °C разлагается с образованием оксида натрия и диоксида углерода [1][2].
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O. В интервале 100—120 °C моногидрат теряет воду.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 854 °C | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, малорастворим в этаноле, хорошо растворим в глицерине и воде | |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
- CO32−+h3O⇄HCO3−+OH−{\displaystyle {\mathsf {CO_{3}^{2-}+H_{2}O\rightleftarrows HCO_{3}^{-}+OH^{-}}}}
Первая константа диссоциации угольной кислоты равна 4,5⋅10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
- Na2CO3+h3SO4→Na2SO4+h3O+CO2↑{\displaystyle {\mathsf {Na_{2}CO_{3}+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+H_{2}O+CO_{2}\uparrow }}}
В природе сода встречается в золе некоторых морских водорослей, а также в виде минералов:
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии[3][неавторитетный источник?]. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей, прибрежных и солончаковых растений путём перекристаллизации относительно малорастворимого NaHCO3 из щёлока.
Способ Леблана[править | править код]
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
- Na2SO4+2C→Na2S+2CO2{\displaystyle {\mathsf {Na_{2}SO_{4}+2C\rightarrow Na_{2}S+2CO_{2}}}}
Сульфид натрия реагирует с карбонатом кальция:
- Na2S+CaCO3→Na2CO3+CaS{\displaystyle {\mathsf {Na_{2}S+CaCO_{3}\rightarrow Na_{2}CO_{3}+CaS}}}
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
- 2NaCl+h3SO4→Na2SO4+2HCl{\displaystyle {\mathsf {2NaCl+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+2HCl}}}
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 году 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана, закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)[править | править код]
Карбонат натрияВ 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
- Nh4+CO2+h3O+NaCl→NaHCO3+Nh5Cl{\displaystyle {\mathsf {NH_{3}+CO_{2}+H_{2}O+NaCl\rightarrow NaHCO_{3}+NH_{4}Cl}}}
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
- 2NaHCO3→otNa2CO3+h3O+CO2↑{\displaystyle {\mathsf {2NaHCO_{3}{\xrightarrow[{}]{^{o}t}}Na_{2}CO_{3}+H_{2}O+CO_{2}\uparrow }}}
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
- 2Nh5Cl+Ca(OH)2→CaCl2+2Nh4+2h3O{\displaystyle {\mathsf {2NH_{4}Cl+Ca(OH)_{2}\rightarrow CaCl_{2}+2NH_{3}+2H_{2}O}}}
Полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказала фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).[источник не указан 2912 дней]
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу[править | править код]
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов[править | править код]
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год)[4].
Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах[5].
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii.
Одна из новейших технологий повышения нефтеотдачи пластов — АСП заводнение, в котором применяется сода в сочетании с ПАВ для снижения межфазного натяжения между водой и нефтью.
В фотографии используется в составе проявителей как ускоряющее средство[6].
Самостоятельно добавляется в моторное масло для предотвращения полимеризации. Концентрация 2 г на 1 л масла.[источник не указан 119 дней]
Предельно допустимая концентрация аэрозоли кальцинированной соды в воздухе производственных помещений — 2 мг/м3[1]. Кальцинированная сода относится к веществам 3-го класса опасности. Аэрозоль кальцинированной соды при попадании на влажную кожу и слизистые оболочки глаз и носа может вызвать раздражение, а при длительном воздействии ее — дерматит.
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода, бельевая сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — пищевая сода, натрий двууглекислый, бикарбонат натрия
«Сода» в европейских языках происходит, вероятно, от арабского «suwwad» — общего названия различных видов солянок, растений, из золы которых её добывали в средние века; существуют и другие версии[7]. Кальцинированная сода (карбонат натрия) называется так потому, что для получения её из бикарбоната последний «кальцинируют» (лат. calcinatio, от calx, по сходству с процессом обжига извести), то есть прокаливают.
Из чего делают соду пищевую и кальцинированную: состав
Различными видами соды приходится пользоваться почти каждый день. А вот из чего делают соду, каким способом ее получают известно не всем. Каждый вид соды: пищевая, кальцинированная и каустическая отличается своими свойствами, назначением и способом получения.
Содержание статьи
Исторические факты
Сода давным-давно известна человеку и активно используется для личных нужд.
В Древнем Египте соду получали природным способом из озера. Применяли в качестве моющего средства и в производстве стекла. Понятие «сода» произошло от одноименного растения Salsola Soda, из него делали золу, а потом кальцинированную соду.
Римские врачи при приготовлении лекарств упаривали воду с содовых озер, о чем свидетельствуют записи I в. н. э. До начала серьезных разработок в XVIII в., о соде упоминали как о веществе, шипящем под действием серной или уксусной кислоты.
Промышленное производство соды было запущено в России химиком шведского происхождения Эриком Лаксманом. Он занимался спеканием сульфата натрия природного происхождения с древесным углем на своем стекольном заводе под Иркутском. По причине отсутствия развития технология была утрачена.
В России сода называлась «зодой» и «зудой». До второй половины XIX в. соду импортировали.
Врач-химик из Франции Никола Леблан вел свои исследования и в 1791 г. получил патент на технологию преобразования глауберовой соли в соду. Метод состоял в сплавливании древесного угля, мела или известняка и сульфата натрия. Герцог Орлеанский профинансировал строительство первого содового завода под Парижем.
Первый российский завод появился в Барнауле в 1864 г. благодаря промышленнику М. Прангу. А спустя несколько лет под Березняками построили завод, работающий по технологии бельгийского химика Сольве, разработавшего аммиачную технологию производства соды. Эта разработка отличалась производительностью, а открытие Леблана отступило.
Из чего производят пищевую соду
Гидрокарбонат натрия, он же натрий двууглекислый или пищевая сода – это белый порошок из мелких кристаллов, имеющий своеобразный солоноватый вкус и легко растворимый в воде. Всем знаком и используется в кулинарии, медицине, фармацевтике, в химической и легкой промышленности, для нужд домашнего хозяйства.
На этикетках с продуктами питания пищевая сода обозначается Е500.
Получение соды возможно двумя способами: сухим и мокрым. Процесс основан на насыщении разогретого раствора карбоната натрия углекислотой под давлением.
При мокром кальцинированную соду растворяют с водой, а при сухом используют бикарбонат. Готовая пищевая сода выпадает в виде осадка, а отделившаяся жидкость повторно используется.
По другой технологии основой является насыщенный солевой раствор, который вступает в реакцию с аммиаком. Полученное соединение обрабатывают углекислым газом. Образовывается бикарбонат натрия и нагревается до образования питьевой соды.
Она абсолютно безвредна, не токсична, взрыво и пожаробезопасна. На слизистые поверхности оказывает незначительное раздражающее действие. Поставляется в бумажных пачках и полиэтиленовых мешках различной фасовки.
Кальцинированная сода
Кальцинированная сода или натрий двууглекислый, карбонат натрия (Na2CO3) незаменимый компонент при производстве различных видов стекла, стеклоблоков и керамической плитки. В металлургии: при получении свинца, хрома, вольфрама, стронция, хрома, для очистки выделяемых газов и нейтрализации химических сред. Химическая промышленность тоже не обходится без карбоната натрия, используя его в производстве глицеринов, моющих средств, спиртов, бумажной, красочной и нефтяной промышленности.
Сода бывает в белых гранулах (марка А) или белом порошке (марка Б).
Отличается гигроскопичностью, активно поглощает влагу и углекислый газ, превращаясь в твердое вещество. Быстро слеживается при открытом хранении.
Выработка кальцинированной соды в промышленных масштабах осуществляется несколькими способами:
- Из природной соды;
- Аммиачным способом;
- Из нефелинового сырья;
- Методом карбонизации гидроксида натрия.
В природном состоянии карбонат натрия достаточно распространен. Обнаружен он в соляных озерах и пластах, в золе из морских водорослей, в подземных солях в виде минералов трона, натрона, термонатрита, нахколита.
На планете насчитывается порядка 60 источников соды, которые находятся в Канаде, США, Кении, России, Мексике, ЮАР.
Соду из пластовых минералов получают прокаливанием, а из соленых озер путем кристаллизации.
Наиболее освоенным в промышленных масштабах является аммиачный способ, что объясняется доступностью технологии, малыми затратами и высоким качеством готовой соды.
Раствор хлористого натрия при низкой температуре проходит насыщение аммиаком и двуокисью углеводорода. В результате химической реакции выпадает осадок бикарбоната натрия, его отфильтровывают и прокаливают (кальцинируют). Так получается кальцинированная сода.
Карбонизация гидроксида натрия имела популярность в 60-70-х годах XX в., когда спрос на кальцинированную соду увеличился, а каустической было в избытке. Сейчас способ не применяется из-за высокозатратной технологии.
На бытовом уровне кальцинированной содой стирают грязную одежду, чистят посуду, сантехнику, кафель, удаляют налет и накипь.
Каустическая сода
Каустическая сода или каустик – химическое вещество, широко применяемое в различных отраслях промышленности: для получения бумаги и синтетических волокон, для отбеливания волокон тканей и изготовления шелка, в производстве мыла туалетного и хозяйственного, органических красителей различного назначения, в технологиях очищения нефтепродуктов и минеральных масел, в химической и металлургической промышленности.
Сода – белые непрозрачные кристаллы, тающие под действием воздуха. Полностью растворима в воде с выделением тепла. Раствор каустика обладает мыльным свойством, что с успехом используется в производстве моюще-чистящих средств.
Имеет и другие названия – едкий натр или едкая щелочь и гидроксид натрия (NaOH). Понятие «едкая щелочь» основано на способности разлагать бумагу и прочую органику, а также поражать кожу с образованием ожогов.
Промышленное производство щелочи основано на использовании химического и электрохимического способов.
- Электрохимический способ. В специальных емкостях в растворе поваренной соли происходит процесс электролиза, который сопровождается разложением на ионы. Под действием постоянного тока выделяется водород и газообразный хлор, параллельно накапливаются ионы натрия и ОН, в результате чего образовывается едкий натр.
- Химический способ. Выработка каустика происходит известковым или ферритным способом.
В России в XIX в освоен известковый способ получения соды. Раствор кальцинированной соды подогревают до 60 °С и постепенно добавляют гашеную известь.
Смесь продолжают нагревать и помешивать. Каустификация сопровождается обильным пенообразованием. После отстаивания образовывается жидкий едкий натр и осадок.
Для повышения концентрации или получения твердых кристаллов раствор упаривают.
Ферритный способ включает два этапа. В процессе прокаливания углекислого натрия с окисью железа происходит образование феррита натрия, который на следующем этапе разлагается водой. Раствор каустика упаривают до выпадения кристаллов, а окись железа повторно используют.
Поставляется в каустическая сода в мешках из полипропилена, жидкий едкий натр отгружается в металлических бочках или цистернах.
Производство соды в России
На территории Российской Федерации расположены природные содовые озера в Западной Сибири и в Забайкалье.
Сибири и в Забайкалье.
А крупные содовые предприятия находятся на территории Крыма в г. Красноперекопск и в Башкортостане г. Стерлитамак, рядом с месторождениями известняка и соли.
На выпуске каустической соды специализируются такие предприятия: «Каустик» (г. Волгоград), «Азот» (г.Новомосковск), «Саянскхимпласт», «Усольехимпром», «Химпром» (г.Волгоград).
Польза соды в быту и для здоровья
Целебные свойства соды помогают сохранить красоту и здоровье.
- При желудочных болезнях, связанных с повышенной кислотностью, приступы изжоги устраняются применением вовнутрь раствора соды (1 г на полстакана воды) несколько раз в течение дня.
- При термических и кислотных ожогах участок кожи промывают или прикладывают салфетку, смоченную в содовом растворе.

- Водный раствор пищевой соды или таблетки применяют при укачивании в транспорте.
- Укусы насекомых обрабатывают содовым раствором или наносят кашицу из соды.
- Содовые ванночки для ног помогут снять усталость и избавят от потливости.
- При кашле пьют перед сном горячее молоко с 1 ч. л. соды.
- При болях в горле, зубной боли, флюсе и стоматите показаны содовые полоскания ротовой полости. Разводят 1-2 ч. л. соды в стакане теплой воды.
- Сода активно борется с инфекционными заболеваниями. При нагноении на пальце нужно парить его в содовом растворе (2 ст. л. на 0,5 л воды). Грибковые поражения кожи обрабатывают содовой кашицей комнатной температуры. Устранит запах пота – протирания проблемных участков содовым раствором.

- При экземах помогают содовые ванночки на 20 мин, после чего кожу смазать оливковым маслом или кремом.
- Ванночки помогут избавиться от мозолей и натоптышей на ногах. После процедуры дополнительно обработать пемзой или пилкой для ухода за ногами.
Пищевая сода незаменима в каждом доме и на кухне.
- Эффективное чистящее средство, безопасное для здоровья.
- Щелочной раствор соды хорошо удаляет жиры с посуды.
- Сода удаляет посторонние запахи. Ножи и тарелки можно легко избавить от запаха рыбы или лука, если потереть содой. В холодильнике сода устранит все лишние запахи.
- При варке соду добавляют в фасоль, а мясо натирают содой для размягчения.
- Щепотка соды при приготовлении варенья со шкурками поможет сделать их более мягкими.
- Конечно, ни одна выпечка не обходится без соды, которая делает печенье, пирожки, пряники, вареники мягкими и воздушными.
Гидрокарбонат натрия — Википедия
| Гидрокарбонат натрия | |
|---|---|
| ( {{{картинка}}}) | |
({{{изображение}}}) | |
| Систематическое наименование | гидрокарбонат натрия |
| Традиционные названия | пищевая (питьевая) сода, сода двууглекислая, двууглекислый натрий, бикарбонат натрия, кислый углекислый натрий |
| Хим. формула | CHNaO3 |
| Рац. формула | NaHCO3 |
| Состояние | твёрдое |
| Молярная масса | 84,0066 г/моль |
| Плотность | 2,159 г/см³ |
| Температура | |
| • разложения | 60—200 °C |
| Растворимость | |
| • в воде | 9,59 г/100 мл |
| Рег. номер CAS | 144-55-8 |
| PubChem | 516892 |
| Рег. номер EINECS | 205-633-8 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E500(ii) |
| RTECS | VZ0950000 |
| ChEBI | 32139 |
| ChemSpider | 8609 |
| ЛД50 | 4220 мг/кг |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Гидрокарбона́т на́трия (лат. Natrii hydrocarbonas), другие названия: бикарбона́т на́трия, ча́йная со́да, питьева́я или пищева́я со́да, двууглеки́слый на́трий — химическое неорганическое вещество, натриевая кислая соль угольной кислоты с химической формулой NaHCO3.
В обычном виде — мелкокристаллический порошок белого цвета.
Используется в промышленности, пищевой промышленности, в кулинарии, в медицине как нейтрализатор химических ожогов кожи и слизистых оболочек концентрированными кислотами и для снижения кислотности желудочного сока. Также применяется в буферных растворах.
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты. Проявляет все свойства соли сильного основания и слабой кислоты. В водных растворах имеет слабощелочную реакцию. В широком диапазоне концентраций в водном растворе pH раствора изменяется незначительно, на этом основано применение раствора вещества в качестве буферного раствора.
Реакция с кислотами[править | править код]
Гидрокарбонат натрия реагирует с кислотами с образованием соответствующей кислоте соли, например, хлорида натрия, сульфата натрия и угольной кислоты, которая в процессе реакции распадается на углекислый газ и воду, при этом углекислый газ выделяется из раствора в виде пузырьков:
- NaHCO3+HCl→NaCl+h3CO3,{\displaystyle {\mathsf {NaHCO_{3}+HCl\rightarrow NaCl+H_{2}CO_{3}}},}
- h3CO3→h3O+CO2↑,{\displaystyle {\mathsf {H_{2}CO_{3}\rightarrow H_{2}O+CO_{2}\uparrow }},}
- 2NaHCO3+h3SO4→Na2SO4+2h3O+2CO2↑.{\displaystyle {\mathsf {2NaHCO_{3}+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+2H_{2}O+2CO_{2}\uparrow }}.}
В быту обычно применяется реакция «гашения соды» уксусной кислотой, с образованием ацетата натрия или гашение лимонной кислотой с образование цитрата натрия, реакция с уксусной кислотой:
- NaHCO3+Ch4COOH→Ch4COONa+h3O+CO2↑.{\displaystyle {\mathsf {NaHCO_{3}+CH_{3}COOH\rightarrow CH_{3}COONa+H_{2}O+CO_{2}\uparrow }}.}
При температуре выше 60 °C гидрокарбонат натрия начинает распадаться на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200 °C:
- 2NaHCO3→60−200∘CNa2CO3+h3O+CO2↑.{\displaystyle {\mathsf {2NaHCO_{3}{\xrightarrow {60-200^{\circ }C}}Na_{2}CO_{3}+H_{2}O+CO_{2}\uparrow }}.}
При этом процессе выделения воды в виде водяного пара и углекислого газa масса исходного продукта уменьшается примерно на 37 %.
В промышленности гидрокарбонат натрия получают аммиачно-хлоридным способом[1]. В концентрированный раствор хлорида натрия, насыщенный аммиаком, под давлением пропускают углекислый газ. В процессе синтеза происходят две реакции:
- Nh4+CO2+h3O→Nh5HCO3{\displaystyle {\mathsf {NH_{3}+CO_{2}+H_{2}O\rightarrow NH_{4}HCO_{3}}}}
- Nh5HCO3+NaCl→NaHCO3↓+Nh5Cl.{\displaystyle {\mathsf {NH_{4}HCO_{3}+NaCl\rightarrow NaHCO_{3}\downarrow +NH_{4}Cl}}.}
В холодной воде гидрокарбонат натрия мало растворим, и его отделяют от охлаждённого раствора фильтрованием, а из полученного после фильтрования раствора хлорида аммония снова получают аммиак, возвращаемый в производство вновь:
- 2Nh5Cl+Ca(OH)2→2Nh4↑+CaCl2+2h3O.{\displaystyle {\mathsf {2NH_{4}Cl+Ca(OH)_{2}\rightarrow 2NH_{3}\uparrow +CaCl_{2}+2H_{2}O}}.}
Двууглекислый натрий (бикарбонат) применяется в химической, пищевой, лёгкой, медицинской, фармацевтической промышленности, цветной металлургии, в быту. Зарегистрирован в качестве пищевой добавки E500 (ii), входит в состав пищевой добавки E500.
В химической промышленности[править | править код]
Применяется для производства красителей, пенопластов и других органических продуктов, фторорганических соединений, продуктов бытовой химии, наполнителей в огнетушителях, Реагент для отделения диоксида углерода, сероводорода из газовых смесей, например, отходящих газов топливосжигающих установок. В этом процессе углекислый газ поглощается раствором гидрокарбоната натрия при повышенном давлении и пониженной температуре, далее поглощённый углекислый газ выделяется из раствора при подогреве и снижении давления;
В лёгкой промышленности — в производстве резины для подошв обуви и в производстве искусственных кож, кожевенном производстве при дублении и нейтрализации кожи после кислого дубления, текстильной промышленности при отделке шёлковых и хлопчатобумажных тканей;
В пищевой промышленности — в хлебопечении, производстве кондитерских изделий, приготовлении газированных напитков.
В кулинарии[править | править код]
Основное применение пищевой соды в пищевой промышленности и в быту — кулинария, где применяется, преимущественно, в качестве основного или дополнительного разрыхлителя в составе кислого и пресного теста. При добавлении питьевой соды в кислое тесто происходит реакция с молочной кислотой, продуцированной при заквашивании дрожжевыми микроорганизмами, при этой реакции выделяется углекислый газ, вспучивающий тесто.
При добавлении в пресное тесто углекислый газ выделяется при выпечке из-за термического разложения.
При применении соды в чистом виде важно соблюсти правильную дозировку, так как она оставляет в продукте карбонат натрия, дающий определённый привкус. Порядок замешивания для теста: соду — в муку, кислые компоненты (уксус, кефир и пр.) — в жидкость.
В медицине[править | править код]
Пероральный приём[править | править код]
Применяется в качестве антацидного средства. При пероральном приёме снижает кислотность желудочного сока и используется для лечения язвенной болезни желудка и двенадцатиперстной кишки [2]. Тем не менее, в результате применения может возникнуть кислотный рикошет, так как при реакции содой с соляной кислотой происходит выделение CO2, который оказывает раздражающее действие на стенку желудка, усиливая выделение гастрина[2].
Традиционно раствор питьевой соды используется для дезинфекции зубов и дёсен при зубных болях[3] и полости рта и горла, при сильном кашле, ангине, фарингите[4]. При ринитах, конъюнктивитах, стоматитах, ларингитах и т.п. применяют для полосканий, промываний, ингаляций 0,5 — 2 % растворы[2].
Применяется при почечном тубулярном ацидозе.
Ингаляционное введение[править | править код]
Раствор ингалируется при помощи небулайзера. Усиливает секрецию слизистой трахеобронхиального дерева, тем самым увеличивая количество мокроты и делая её менее вязкой.[2] Может применятся для стимуляции выработки мокроты с целью её бактериологического исследования во фтизиатрии.
Внутривенная инфузия[править | править код]
Препарат выбора для быстрой коррекции метаболического ацидоза во время реанимационных мероприятий. Применяется в качестве антиаритмического средства при отравлении лекарственными средствами удлиняющими интервал QT, такими как трициклические антидепрессанты, кокаин, нейролептики.
Противопоказания[править | править код]
При внутривенном введении быстро повышает pH и вызывает снижение уровня калия и кальция в плазме. Соответственно противопоказан при:
- Изначально высоком pH — метаболическом алкалозе, например, вследствие гипохлоремии — снижении концентрации в крови ионов Cl-, в том числе вызванной рвотой, или снижением всасывания в желудочно-кишечном тракте
- Респираторном ацидозе — так как выделяющийся CO2 усилит его
Является источником натрия и повышает осмоляльность плазмы, тем самым увеличивая объём циркулирующей крови. Задержка натрия усиливает отёки и повышает артериальное давление. Таким образом, использование при артериальной гипертензии, совместно с минералокортикоидами, низконатриевой диете должно быть ограничено. Применение при сниженной скорости клубочковой фильтрации может привести к метаболическому алкалозу.
В альтернативной медицине[править | править код]
В альтернативной медицине питьевая сода иногда заявляется как «лекарство» от рака, однако, никакой экспериментально подтверждённой эффективности применения такого «лечения» не существует[5].
Пожаротушение[править | править код]
Гидрокарбонат натрия вместе с карбонатом аммония используется в качестве наполнителя в огнетушителях с сухим наполнением и в стационарных системах сухого пожаротушения. Это применение обусловлено тем, что от воздействия высокой температуры в очаге горения вещество выделяет углекислый газ, атмосфера которого затрудняет доступ кислорода воздуха в очаг горения.
В быту[править | править код]
Применяется как безопасное для здоровья средство для чистки поверхностей столовой и кухонной посуды, поверхностей кухонных столов, иных поверхностей, соприкасающихся с пищей, путем протирки их с помощью влажной тряпки с сухим порошком питьевой соды.
В транспорте[править | править код]
Применяется для нейтрализации следов электролита — серной кислоты на поверхности пластмассовых корпусов свинцовых аккумуляторов насыщенным водным раствором питьевой соды.
Гидрокарбонат натрия хранят в закрытых упаковках, в сухом месте вдали от источников огня. Гарантийный срок хранения натрия двууглекислого — 12 месяцев со дня изготовления. Срок годности не ограничен.
Вещество нетоксично, пожаро- и взрывобезопасно.
Имеет солоноватый, мыльный вкус. При попадании пыли вещества на слизистые оболочки глаз и носа вызывает лёгкое раздражение. При частой работе в атмосфере, загрязнённой пылью двууглекислого натрия, может возникнуть раздражение верхних дыхательных путей. Предельно допустимая концентрация пыли бикарбоната натрия в воздухе производственных помещений 5 мг/м3[6].
- ГОСТ 2156-76. Натрий двууглекислый. Технические условия (с Изменениями № 1, 2, 3, 4).
- ГОСТ 32802-2014. Добавки пищевые. Натрия карбонаты E500. Общие технические условия.
Из чего делают пищевую соду: добыча, производство и применение
Мы привыкли к тому, что пищевая сода всегда «под рукой». И для приготовления выпечки она нужна, и любые пятна на кухне очистит, отполирует серебро, уничтожит плесень. А почему бы не использовать ее в медицинских целях: подышать над горячим раствором при простуде, принять от изжоги, когда лекарства нет. Даже иногда шипучий напиток из нее делаем.
 В цивилизованном Европейском мире соду знали издавна, она применялась как для производства мыла, стекла, так и для различных красок и даже лекарств
В цивилизованном Европейском мире соду знали издавна, она применялась как для производства мыла, стекла, так и для различных красок и даже лекарствНеприметная бумажная белая пачка стоит на кухонной полочке и может выручить в любой момент. Содовый порошок способен заменить целый ряд химических соединений. Мы к нему привыкли и просто не задумываемся, откуда он берется, и как выглядит производство соды.
Как начали производить соду?
Человек сталкивался с этим веществом еще в глубокой древности. Ей пользовались, извлекая из содовых озер и небольших минеральных месторождений. В Европе с ее помощью выпускали мыло, краски, стекло и даже лекарства. Зола морских водорослей была источником этого белого порошкообразного вещества. Но для промышленности такого ее количества было недостаточно.
В природе существуют содовые озера в Забайкалье и Западной Сибири.
Известно озеро Натрон в Танзании и озеро Серлс в Калифорнии. Большими запасами этого природного вещества владеет США: на свои потребности она использует 40% природной соды и истощения запасов в ближайшие десятилетия не предвидится. Россия не обладает большими месторождениями, поэтому вещество получают только химическими методами.
Одним из первых стал применяться промышленный способ, изобретенный французским химиком Лебланом в 1791 году. Метод основывался на извлечении карбоната натрия из каменной соли. Технология не отличалась совершенством: оставалось значительное количество отходов. Но начало было положено: цена на «белое вещество» снизилась, а необходимость в приобретении − возросла.
Методом Леблана пользовались широко, но он позволял производить только кальцинированную соду. Следующим изобретателем стал француз Огюстен Жан Френель, который в 1810 году провел реакцию получения содового порошка, пропустив каменную соль через аммиачный раствор и углекислый газ. Но в производстве эта разработка оказалась неприбыльной. Было неизвестно, как восстановить аммиак, нужный в циклическом процессе производства.
 На сегодняшний день производство очищенного бикарбоната натрия происходит двумя способами, «сухим» и «мокрым»
На сегодняшний день производство очищенного бикарбоната натрия происходит двумя способами, «сухим» и «мокрым»И только в 1861 году бельгиец Эрнест Сольве, опираясь на труды Френеля, провел реакцию по восстановлению аммиака, сделав производство дешевым и заменив метод Леблана. Особенность метода состояла в том, что он позволял помимо кальцинированной, получать соду пищевую.
В России о «белом веществе» узнали во время правления Петра Первого. До 1860 года она была импортной и называлась «зодой» или «зудой». А 1864 году было налажено свое производство этого продукта.
Состав пищевой соды
Разновидностей «белого вещества» не так уж и мало:
- существует кальцинированная сода или углекислый натрий: Nа2СО3;
- есть еще двууглекислая сода (питьевая сода) или бикарбонат натрия NаНСО3;
- кристаллическая сода Nа2СО3*10Н2О;
- каустическая сода, которая к пищевой имеет весьма отдаленное отношение, это NаОН.
Исходя из метода синтеза, она делится на леблановскую и аммиачную, вторая получается более чистой.
«Белое вещество» в природе встречается редко и к тому же не в чистом виде. Этого количества недостаточно, чтобы удовлетворить мировые потребности. В год производство соды достигает нескольких миллионов тонн.
Пищевая сода имеет химическое название − двууглекислый натрий или гидрокарбонат натрия с формулой NаНСО3. Она содержится в виде растворенного вещества в примесях соленых озер и морской воде, есть в составе горных пород.
Процесс производства из поваренной соли
Получение соды по настоящий день базируется на методе Сольве. По-другому этот метод называют аммиачно-хлоридным. Концентрированный раствор хлорида натрия насыщают аммиаком, затем воздействуют на него углекислым газом.
Образовавшийся гидрокарбонат натрия плохо растворим в холодной воде и его можно легко выделить фильтрованием. Затем проводят процесс кальцинирования с образованием содового порошка.
 Производство кальцинированной соды осуществляется аммиачным методом путем взаимодействия насыщенного водного раствора хлористого натрия и углекислого газа в присутствии аммиака с образованием бикарбоната натрия и последующей его кальцинацией
Производство кальцинированной соды осуществляется аммиачным методом путем взаимодействия насыщенного водного раствора хлористого натрия и углекислого газа в присутствии аммиака с образованием бикарбоната натрия и последующей его кальцинациейПоэтапно процесс выглядит так:
- NaCl + Nh4 + CO2 + h3O = NaHCO3 +Nh5Cl (образование конечного продукта идет в воде при t=+30 − +40 градусов).
- 2NaHCO3 = Na2CO3 + CO2 + h3O (СО2 не выводится из циклически повторяющегося процесса). Это реакция кальцинирования соды.
- 2Nh5Cl +CaO = CaCl2 + h3O + 2Nh4. Так восстанавливается аммиак. Он продолжает участвовать в производстве снова и снова, находя применение в дальнейшем производстве.
По этому методу получают как кальцинированную, так и пищевую соду. Оба вещества востребованы в получении различных продуктов. Метод Сольве дает возможность синтезировать два вида содового порошка одновременно. Теперь становится понятно, из чего делают соду, и какие компоненты участвуют в химических реакциях.
В России вещество производится на двух предприятиях – на заводе «Сода» в г. Стерлитамаке (Республика Башкортостан) и предприятии «Крымский содовый завод» в г. Красноперекопске (Республика Крым). Это продукты высокого качества, соответствующие требованиям ГОСТа.
Процесс производства из природных минералов
Поскольку существуют страны, богатые минералами, в состав которых входит интересующее нас вещество (например, США, Уганда, Турция, Мексика), то известен и более простой способ производства соды из минералов нахколита и трона. Из них можно сделать кальцинированный содовый порошок, а затем превратить его в пищевой.
Трон добывают разными способами:
- Вырезают подземные комнаты, которые поддерживаются специальными приспособлениями. Минерал берут на стенках комнат, а затем по конвейеру перемещают наверх.
- Под землю заливается горячая вода, чтобы растворить минерал. Откачанную жидкость выпаривают и полученные деминерализованные кристаллы обрабатывают.
Кристаллы дробят, нагревают, чтобы удалить ненужные газы, и превращают минерал в содовый порошок. Но в нем еще много примесей, которые удаляют путем добавления воды и последующим фильтрованием. Полученное вещество просушивают, просеивают и уже на предприятии фасуют в подготовленную тару.
Применение кальцинированного содового порошка достаточно широкое. Он нужен для изготовления стекла, мыла, бумаги. С его помощью очищают воду. Использование гидрокарбоната натрия необходимо в медицине и пищевой индустрии.
Как и при любом химическом производстве, получение содового порошка не является экологически чистым. Но разрушительное воздействие на природу было бы значительно более сильным, если бы начали производить те синтетические вещества, которые с успехом может заменить сода.
виды, состав, польза и вред для организма
Пищевая сода, чайная (sodium bicarbonate), бикарбонат натрия или натрий двууглекислый - всем доступное вещество, нетоксичное, обладает рядом удивительно полезных и даже целебных свойств. Она всегда широко применяется в быту, а в последнее время стали много говорить об исцеляющих свойствах соды чайной.
Химическая формула пищевой соды
Сода пищевая, чайная - гидрокарбонат, бикарбонат натрия или двууглекислый натрий . Химическая формула NaHCO 3 – кислая соль угольной кислоты, широко применяется в лёгкой, пищевой промышленности и быту.
Уникальные бактерицидные, противовоспалительные свойства природной соды были известны ещё с древних времён и применялись в лечении различных болезней и недугов не только у людей, но и у животных.
Есть мнение, что даже слегка солоноватый вкус нашей крови объясняется присутствием в ней не поваренной соли, а именно гидрокарбоната натрия. Сода наравне с и всегда присутствовала в жизни живых организмов и даже в их составе!
Содой давно лечились на Востоке. Ю.Н. Рерих в своей работе "По тропам Срединной Азии" описывает, как лечили верблюдов содовым раствором, после их сильнейшего отравления неизвестной травой. Сода спасла животных от неминуемой смерти.
Уникальные свойства пищевой соды
Среди простых людей бытует мнение, что длительный приём соды внутрь вредит слизистой оболочке желудка. И данное мнение поддерживается многими медиками. Особенно нешуточные страсти в последнее время разгорелись вокруг пищевой соды. Попробуем разобраться в фактах, говорящих о пользе соды и заодно об научных экспериментах над ней.
В лаборатории одного из медицинских ВУЗов Белоруссии ещё в советское время были проведены опыты и научно доказано, что сода не влияет на кислотно-выделительную функцию желудка, и её применение возможно, как при пониженной, так и при повышенной кислотности желудочного сока.
Целебные свойства соды , её доступность, неограниченный срок хранения и сегодня позволяют использовать пищевую соду в лечении практических всех болезней! Сода справляется даже там, где другие лекарства бессильны. Столь мощное воздействие на организм объясняется способность пищевой соды ощелачивать организм. Кислая среда в организме - отличная среда микроорганизмам, вызывающим болезни и воспалительные процессы.
Остановимся чуть подробней на вопросе кислотно-щёлочного баланса в организме.
Кислотно-щелочная среда организма. Какой должен быть показатель
Человеческий организм состоит из щелочей и кислот, при этом в здоровом организме щелочей должно быть в 3-4 раза больше. Данное соотношение определяется уровнем рН. По этому показателю можно судить о состоянии нашего с вами здоровье.
При рождении рH крови человека 7,5-7,3. С возрастом этот показатель из-за несоблюдения правильного образа жизни, избыточного питания, вредного влияния внешней среды, уменьшается. В здоровом организме взрослого человека показатель кислотности рH крови должен находиться в пределах 7,35 - 7,45, что встречается крайне редко, в большинстве случаем не превышает 7,15 - 7,20, а при показателе ниже, чем в 6,8 (очень кислая кровь) наступает смерть человека, так называемый ацидоз (БСЭ, т.12, с. 200).
Причины закисления организма человека
Причины возникновения дисбаланса кислотно-щелочного уровня в организме, приводящие к болезням:
- неправильное питание, в котором много белковой пищи и мало растительной;
- фаст фуд, продукты с высоким содержанием консервантов, пищевых добавок, усилителей вкуса, крахмала, сахара;
- загрязнённый воздух, плохая вода, бесконтрольное применение лекарств;
- негативные эмоции, злоба, беспокойство, негодование, ненависть;
- потеря психической энергии приводит к болезням. Поэтому в древнем учении Агни-йоги для восстановления энергетических центров и психики, для профилактики многих болезней рекомендовано принимать пищевую соду ежедневно.
Делаем вывод: в кислом организме легко уживаются все болезни, в щелочном наоборот - организм выздоравливает! Так что мы должны стремиться к ощелачиванию своего организма, в чём нам успешно и помогает обычная чайная сода.
Важно! Однако, чтобы начать лечение содой, стоит проконсультироваться с врачом и помнить, что каждый организм индивидуален. Поэтому начинаем приём осторожно, наблюдая за реакцией организма!
Сода пищевая лечение и приём внутрь
Температура содовых растворов для внутреннего применения должна быть слегка горячей, и ни в коем случае не холодной! Гасим соду горячей водой при температуре +60º С.
При такой температуре гидрокарбонат натрия (та самая пищевая сода из пачки) распадается на карбонат натрия (кальцинированная сода), углекислый газ и воду:
2NaHCO3→ Na2CO3+h3O+Co2
Не путать здесь кальцинированную соду, полученную в реакции (молекулярный вид) от технической кальцинированной соды, продающейся в магазинах!
Ещё лучше применять соду в горячем t+ 60º молоке, что способствует лучшему всасыванию её в кровь.
Как холодное молоко не соединяется с тканями, так горячее - с содой, проникает в центры клеток. Елена Рерих
Концентрация соды в растворе с
Пищевая сода - применение, состав, производство
Первые упоминания о соде ученые нашли примерно за полторы-две тысячи лет до нашей эры. Раньше ее получали из содовых озер, а также из редких месторождений в виде минералов. Однако, о добыче соды методом выпаривания воды содовых озер стало известно в 64 году нашей эры. О точном составе соды долгие годы ничего не было известно. Лишь в 1736 году французский химик, врач и ботаник Анри Луи Дюамель де Монсо первым в мире получил из воды содовых озер очень чистую соду. Он установил, что в составе соды присутствует химический элемент «Натр».
Интересно, что на территории России еще во времена Петра Первого соду называли «зодой» или «зудой» и до 1860 года она было импортным продуктов. В 1864 году в России открыли единственный содовый завод, который функционировал по технологии француза Леблана. На сегодняшний день содовые озера имеются в Забайкалье и в Западной Сибири. Также соду добывают из озера Натрон в Танзании и озера Серлс в Калифорнии.
Характеристики пищевой соды.
Сода пищевая - гидрокарбонат натрия, натрия бикарбонат, питьевая сода, натрий двууглекислый – это кислая соль натрия и угольной кислоты. Что же представляет собой пищевая сода? Вещество это является щелочью. На вид это белый кристаллический порошок, который хорошо растворяется в воде, взрывобезопасный, пожароустойчивый и нетоксичный.
Из главных химических взаимодействий отметим следующие:
- молекулярная масса (согласно международным атомным массам 1971 г.) составляет 84,00
- состав соды пищевой позволяет ей вступать в реакцию с кислотами. При этом выделяется соль и угольная кислота, которая сразу же распадается на углекислый газ и воду: NaHCO3 + HCl → NaCl + H2CO3, H2CO3 → H2O + CO2↑
- в кулинарном деле более популярна реакция с уксусной кислотой, вследствие чего образуется ацетат натрия: NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
- сода отлично растворяется в воде. Для водного раствора питьевой соды характерна слабощелочная реакция
- при 60° C начинается распад гидрокарбоната натрия на карбонат натрия, углекислый газ и воду. Пик эффективности достигается при 200° C - 2NaHCO3 → Na2CO3 + H2O + CO2↑
- если продолжать нагревать до 1000° C (к примеру, в процессе тушения пожара порошковыми системами), карбонат натрия разлагается на углекислый газ и оксид натрия: Na2CO3 → Na2O + CO2.
Из физико-химических показателей отметим:
- белый кристаллический порошок, средний размер кристаллов который составляет 0,05 - 0,20 мм
- плотность равняется 2200 кг/м³. При этом насыпная плотность составляет 0,9 г/см³
- теплота растворения равняется 205 кДж (48,8 ккал) на 1 кг NaHCO3, а уровень теплоемкости - 1,05 кДж/кг•К(0,249 ккал/кг•°С)
- закипает раствор при температуре 851° C
- плавится при 270° C.
Производство пищевой соды
Натуральную соду получают из минерала трона (египетской соли), а также из воды содовых озер. Однако, поскольку залежи трона на планете крайне скудны, а содовых озер лишь несколько штук, то объем добычи соды не может даже наполовину покрыть потребности населения и промышленности. Для обеспечения необходимого количества соды работают специальные содовые заводы.
Первую соду искусственным путем получил в 1793 г. Лебланк. Но, пищевую, очищенную соду получили только в 1861 году.
Из чего делают соду пищевую сегодня? В XIX веке искусственную соду начали получать по методу Леблана, суть которого состоит в следующем: из поваренной соли в присутствии серной кислоты образовывался сульфат натрия, который далее подвергали сплавлению при высокой температуре с углекислым кальцием и углем. Полученный таким образом сплав подвергают выщелачиванию водой. Далее раствор выпаривают и получают чистую соду.
Разработанный бельгийским ученым Э. Сольвэ аммиачный метод получения соды привел к активному ее использованию, прежде всего в кондитерском деле. Первыми соду для выпечки начали применять Франция и Германия. Тесно становилось более рыхлым и объемным, легче усваивалось. В начале XX века популярность соды распространилась и на другие государства, среди которых и Россия.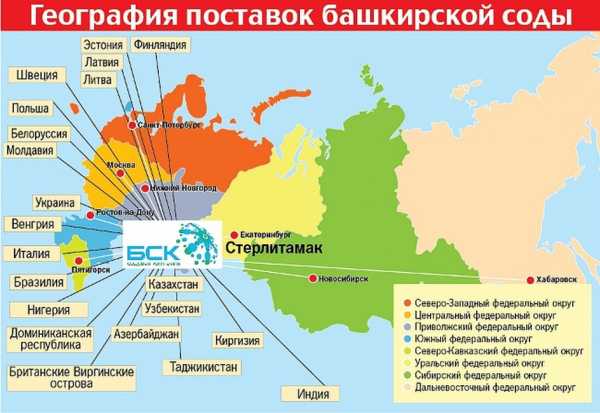 Сегодня промышленное производство соды выглядит следующим образом:
Сегодня промышленное производство соды выглядит следующим образом:
- через высококонцентрированный раствор хлорида натрия пропускают эквимолярный объем газообразного аммиака и диоксида углерода: NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl.
- полученный осадок малорастворимого (9,6 г на 100 г воды при 20° C) гидрокарбоната натрия фильтруют и подвергают кальцинированию (обезвоживанию) путем нагревания до 140 - 160° C. Таким образом, он превращается в карбонат натрия: 2NaHCO3 →(t) Na2CO3 + CO2↑ + H2O
- после этого диоксид углерода и аммиак ( которые были выделены из маточного раствора на первой стадии) процесса по реакции: 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O, возвращают снова в производство
- процесс аммонизации нужен, чтобы ввести в него углекислый газ, плохо растворим в насыщенном растворе
- бикарбонат натрия выпадает в осадок в виде кристаллов. Его нужно отфильтровать от раствора, в котором присутствует хлористый аммоний и непрореагировавший NaCl, а потом прокаливают (кальцинируют). Таким образом, образуется кальцинированная сода
- гашеную известь Са(ОН)2 замешивают с водой. Полученное известковое молоко необходимо для регенерации аммиака из раствора (фильтровой жидкости), которую получили в процессе отделения бикарбоната
- от температуры, объема NaCl в рассоле, уровня насыщения его аммиаком и углекислотой, а также прочих факторов выход бикарбоната достигает 65-75%.
Использование пищевой соды
Пищевая сода применяется в фармацевтической промышленности, цветной металлургии, в быту, кулинарной промышленности. Она является зарегистрированной пищевой добавкой E500. Для чего нужна пищевая сода в различных отраслях, рассмотрим более подробно:
- в химическом производстве ее используют при изготовлении красителей, пенопластов и прочих органических веществ, фторорганических соединений, изделий бытовой химии, а также наполнителей в огнетушителях. Кроме этого, сода является реагентом для отделения диоксида углерода, сероводорода из газовых смесей, к примеру, отходящих газов в топливосжигающих установках
- в лёгкой промышленности соду используют для изготовления резины для подошв обуви, а также в изготовлении искусственных кож, кожевенном производстве в процессе дубления и для нейтрализации кожи по окончанию кислого дубления. Текстильная промышленность использует соду в процессе отделки шёлковых и хлопчатобумажных тканей
- в пищевой промышленности — в хлебопечении, создании кондитерских изделий, а также приготовлении газированных напитков. Добавление пищевой соды в кислое тесто приводит к реакции с молочной кислотой, которая продуцируется во время заквашивания молочнокислыми и бифидо микроорганизмами. Вследствие этого выделяется углекислый газ, который вспучивает тесто. Можно добавлять соду и в пресное тесто. Углекислый газ из нее будет выделяться во время выпечки, вследствие реакции термического разложения
- в медицине раствором питьевой соды дезинфицируют зубы и дёсны при зубных болях, а также полость рта и горла, при кашле, ангине, фарингите. Кроме этого, раствор соды употребляют внутрь в качестве средства от изжоги и болей в желудке. Редко используют внутривенно для быстрого устранения метаболического ацидоза в процессе реанимационных действий
- гидрокарбонат натрия и карбонат аммония являются наполнителем в огнетушителях с сухой смесью, а также в традиционных системах сухого пожаротушения. В этом деле сода популярна, потому что вследствие высокой температуры в очаге горения выделяется много углекислого газа, атмосфера которого не допускает кислород воздуха в очаг горения
- в быту сода применяется для безопасной очистки разных поверхностей, кроме деревянных, так как сода может окрасить древесину в красный цвет
- сода используется в качестве нейтрализатора следов электролита — серной кислоты на поверхности пластмассовых корпусов свинцовых аккумуляторов.
Пищевая сода, применение которой не теряет популярности, является дешевым и эффективным продуктом во многих сферах жизнедеятельности человека.
что это и как применяется
Питьевая сода по праву называют универсальным, и главным доказательством такой характеристики является факт применения порошка более чем в 300 случаях. При этом области, в которых питьевая сода используется, весьма разнообразны – это и кулинария, и химическая промышленность, и косметология. Но отдельно стоит заметить роль соды в лечебной практике, где вещество получило наиболее широкую известность.

Химическая формула
Питьевая сода является натриевой солью угольной кислоты, которая относится к разряду кислых. Химическая формула данного вещества представлена сокращением NaHCO3. Молекула этого соединения выстраивается следующим образом: атом углерода удерживает атомы кислорода, один из которых крепится двойной связью, второй атом кислорода соединяется с катионом водорода, последний же находится возле катиона натрия и является анионом. При этом названная формула подразумевает две составляющие: катион Na+ во внешней сфере, где плюс означает положительный заряд, и во внутренней HCO3– гидрокарбонат-ион с отрицательным зарядом.
В химической промышленности питьевая сода носит название гидрокарбонат натрия, однако известны и другие варианты: бикарбонат натрия, натрий двууглекислый, пищевая сода, а также добавка Е500.
История происхождения
Впервые стали использовать соду для каких-либо целей в Древнем Египте. В те времена существовали озера, на дне которых при пересыхании выделялся белый минерал в виде порошка, сильно напоминающего питьевую соду. Она была одним из главных компонентов при бальзамировании.
Древние врачеватели при создании мумий фараонов обмазывали тела специальным составом, в который входила сода, и оставляли на 40 или даже 70 дней. По их мнению сода выполняла роль адсорбента – вытягивала всю воду. За это время сода останавливала процесс разложения, вымывала из тела жировые ткани, а специалисты по бальзамированию успевали завершить процесс мумификации.
В цивилизованной Европе ее применение носило частный характер, так как базировалось на использовании золы морских водорослей.
В 1791 году французский химик Николя Леблан изобрел промышленный способ добычи соды, но это была кальцинированная сода.

Бельгийский ученый Эрнест Сольве смог получить очищенную, пищевую соду.
Химическая формула и физические свойства
Сода – общедоступное вещество, в быту она имеет несколько названий:
- пищевая сода;
- питьевая сода;
- гидрокарбонат;
- бикарбонат натрия;
- двууглекислый натрий.
Химическая формула соды выглядит так — NaHCO₃ и представляет собой кислую соль угольной кислоты.
Молекулярное строение – каждый из трех атомов кислорода связан с одним атомом углерода (двойная связь), атомом водорода и катионом натрия соответственно.
Польза или вред питьевой соды для здоровья
Уникальность питьевой соды заключается в том, что она обладает следующим воздействием:
- противовоспалительным;
- противомикробным;
- антивирусным.
Но основная польза соды для организма – это ощелачивание. Данный процесс касается уровня рН. Уровень кислотности организма здорового человека не должен быть меньше 7,35. Меньший показатель говорит о нарушении кислотно-щелочного баланса, и в медицине такое состояние называется ацидоз. К слову, уровень рН крови менее 6,8 может привести к летальному исходу. Даже незначительные отклонения от нормы могут спровоцировать возникновение различных проблем и нарушение в работе различных органов.
Помимо медицины, гидрокарбонат натрия применяют в следующих отраслях:
- химическое производство – сода является основным компонентом при изготовлении красителей, органики, бытовой химии, входит в состав смесей для огнетушителей;
- легкая промышленность – сода применяется для обработки кожи и резины для обуви, при производстве текстильной продукции;
- кулинария – использование соды при изготовлении кондитерских и хлебо-булочных изделий придает выпечке воздушность, рыхлость, объем;
- косметология – сода используется как абразив в составе специальных очистительных средств и масок; содовые ванны способствуют коррекции массы тела при похудении;
- в быту соду используют как отличное чистящее средство, обладающее слабым агрессивным воздействием;
- как медицинское средство для обеззараживания, промывания, подсушивания; для приготовления содовых ингаляций при простудных заболеваниях и содовых инъекций при лечении онкологических заболеваний.
Производство
Люди познакомились с пищевой содой очень давно. Она добывалась на некоторых высохших озерах, где соли натрия выпадали на берег белыми сугробами.
Естественное сырье добывали двух видов:
- в виде солей натрия (карбонаты и бикарбонаты),
- в подземных водах, содержащих высокую концентрацию карбоната натрия.
Известная всем химическая формула NaНCO3 получается не естественным, а химическим лабораторным способом. Называется он – аммиачно-хлоридный.
Метод получения гидрокарбоната натрия – аммиачно-хлоридный, разработанный в 19 веке химиком Э. Сольве. Способ актуален и в наши дни.
Промышленный метод производства соды впервые применил французский ученый Н. Леблан, выделив из каменной соли карбонат натрия, в результате получилась кальцинированная сода. Другой француз О.Ж. Френель пропустил каменную соль через аммиачный раствор и углекислый газ. Так был придуман химический способ образования гидрокарбоната или пищевой соды.
Усовершенствовал способ бельгийский химик Э. Сольве, сделав его простым и дешевым. Методом Сольве стали производить (и до сих пор получают) не только кальцинированную, но и пищевую соду.
Области применения
Трудно найти область, где столовая сода не используется:
1) Химическое производство. Гидрокарбонат натрия лежит в основе производства бытовой химии (порошки, чистящие и моющие средства), красителей, органики, составляющих порошка огнетушителя. Известно, что обычную пищевую соду домохозяйки используют как самостоятельное чистящее средство.
2) Легкая промышленность. Сода используется при пропитывании кожи, резины для подошв дубильными веществами. Производство текстиля также не обходится без бикарбоната натрия.
3) Кулинария. Еще не нашли замену соде при создании всевозможных кондитерских изделий и выпечки. Шипучие напитки, типа колы и различных лимонадов, в основе своей имеют реакцию соды и кислоты.
4) Косметология. Во многих масках и очистительных средствах в качестве главного ингредиента входит гидрокарбонат натрия, способный вывести шлаки и лишнюю жидкость, отбелить зубы и лицо, снять покраснение и зуд, убрать неприятный запах.
5) Медицина. Почти во всех рецептах лекарственных препаратов традиционной и народной медицины присутствует бикарбонат натрия. Он способен выводить из организма различные токсины, включая тяжелые металлы.
Известно, что сода спасает от изжоги, но и в основе всех брендовых лекарственных препаратов (Гастал, Гевискон и прочие) лежит способность солей натрия нейтрализовать высокую кислотность (щелочное свойство пищевой соды).
Антисептические свойства пищевой соды незаменимы в борьбе с вирусами, бактериями и грибками.
Народная медицина считает соду просто лекарственной панацеей: сода лечит головную и зубную боль; способна понизить температуру; нейтрализовать ожоги кислотой кожи и слизистых оболочек; и даже вылечить рак.
Советы доктора И.П. Неумывакина об использовании пищевой соды
Известный всему миру профессор, доктор медицинских наук, И.П. Неумывакин более 40 лет посвящал свои научные работы изучению влияния пищевой соды на оздоровление организма. По его мнению, главная причина возникновения болезней – это нарушение кислотно-щелочного баланса. А, как известно, сода способствует его восстановлению.
Профессор разработал специальную схему, по которой следует пить содовый раствор, как для лечения, так и для профилактики различных заболеваний. Попадая в кровь, сода разжижает ее и обновляет структуру, тем самым способствует снижению:
- солевых отложений,
- холестериновых бляшек,
- песка в почках.
И.П. Неумывакин советует не только принимать внутрь содовый раствор, но и полоскать им рот, принимать с ним ванны и делать очищающие маски для лица.
Книги и видеоролики с доктором пользуются огромной популярностью. Беседа «Сода и вода» с И.П. Неумывакиным о здоровье и очищении организма с помощью соды набрала более 1,5 миллиона просмотров:
Техника безопасности
Питьевая сода является абсолютно не токсичным веществом. Но из этого не следует, что она совершенно безопасна. По степени взрывоопасности и пожароопасности имеет 3 класс. Существуют ограничения присутствия бикарбоната натрия в воздухе: 5 мг на кубический метр. А поскольку сода вещество сыпучее, то держать его нужно, как можно дальше от детей и животных.
Упаковываться пищевая сода при больших количествах должна в специальные мешки с плотной многослойной поверхностью (до 50 кг). Индивидуальные упаковки для розничной торговли представляют собой твердую картонную пачку массой 1 кг.
Перевозится сода в любом закрытом транспорте, кроме самолета.
Пищевая сода – универсальное средство, применяемое в различных сферах: бытовой химии, кулинарии, медицине. Но всегда следует помнить, что «лучшее – враг хорошего», и при использовании соды необходимо четко следовать правилам применения и дозировкам.
Применяя раствор внутрь, не забудьте проконсультироваться с врачом.
ИСТОЧНИКИ:https://polzasody.ru/polza-i-vred/pitevaya-soda.htmlhttps://posode.ru/polza-i-vred/pitevaya-soda.htmlhttps://sodaved.ru/vidy/pishhevaya-soda/formula-pishhevoj-sody.html
15 способов применения пищевой соды, о которых мало кто знает
Ребята, мы вкладываем душу в AdMe.ru. Cпасибо за то,
что открываете эту красоту. Спасибо за вдохновение и мурашки.
Присоединяйтесь к нам в Facebook и ВКонтакте
Отгадайте загадку: купил 10 лет назад, а до сих пор не кончилась. Речь идет о соде! Бикарбонат натрия, порошок с мелкими кристалликами, действительно может десятилетиями стоять на полке и совершенно не использоваться. А зря!
AdMe.ru собрал для вас 15 необычных способов, которые точно заставят вас наконец-то достать с полки пищевую соду и использовать ее.
1. Натуральный дезодорант
Если вы по каким-либо причинам не можете использовать магазинное средство от запаха пота, смешайте в отдельной емкости воду с содой или просто возьмите щепотку соды и нанесите на область подмышек. Аналогичным образом можно устранить и запах ног.
2. Снятие зуда
3. Устранение изжоги
Для устранения изжоги можно выпить смесь из половины стакана воды и 1 ч. л. соды или немного молока с щепоткой соды. Также можно воспользоваться следующим рецептом: 100 мл воды, 1/4 ч. л. соды, 1/4 ч. л. лимонной кислоты (или немного лимонного сока), 1/2 ч. л. сахара.
4. Натуральный скраб
Рецепт № 1. Для осветления кожи. 1 ст. л. соды, 1 ч. л. лимонного сока, 4–5 капель масла чайного дерева. Смешать, нанести на лицо и хорошо помассировать с использованием специальной массажной щетки.
Рецепт № 2. От черных точек. 1ч. л. соды, 0,5 ч. л. меда, можно добавить немного растительного масла. Смешать, нанести на проблемные зоны на 5 минут, затем помассировать и смыть.
Рецепт № 3. От морщин. Смешайте 2 ч. л. соды и 1 ч. л. кокосового масла. Тщательно помассируйте лицо в течение 5–7 минут, смойте теплой водой. Повторяйте 1–2 раза в неделю.
5. Для роста волос
Смешайте 9 ст. л. воды и 3 ст. л. соды, наносите смесь с помощью бутылочки с аппликатором на корни и волосы, помассируйте. Затем нанесите смесь из воды и яблочного уксуса, помассируйте и смойте. Такая смесь делает волосы блестящими и здоровыми.
6. От растяжек на коже
Сода: 50 необычных способов применения
В кулинарии сода используется чаще всего, причем речь идет не только о выпечке. Сода с успехом применяется для приготовления различных напитков, мяса, овощей и так далее. Вот лишь несколько примеров.
Если на подобные манипуляции времени нет, добавьте буквально несколько щепоток соды во время приготовления мяса.
Чтобы нежнее и мягче стали котлеты, в фарш также добавляют немножко соды (на 1 кг фарша — на кончике ножа).
Чтобы омлет получился не только вкусным, но и высоким, воздушным, в него также добавляют соду – щепотку на 3 яйца.
Для этого на сотейник объемом 200 мл достаточно добавить щепотку соды.
Чтобы нейтрализовать кислый вкус, тем самым уменьшив количество добавляемого сахара, положите в варенье немного соды – четверть ч. ложки на 1 кг ягод или фруктов.
Поставили на огонь кастрюльку с бобовыми — добавьте в воду несколько щепоток соды. Фасоль (бобы, соя, горох) сварятся гораздо быстрее.
Молоко долго останется свежим, а вкус соды в нем чувствоваться не будет. О том, как сохранить без холодильника другие продукты, вы узнаете из статьи Как обойтись на даче без холодильника.
Чтобы сделать чай или кофе еще более ароматным, а вкус напитка — насыщенным и мягким, добавьте в чашку щепотку соды.
Чтобы капуста сварилась быстрее, а витаминов в ней сохранилось как можно больше, бросьте в воду немного соды (0,5 ч. ложки на 3 л воды).
Сода поможет сохранить насыщенный цвет шпината и капусты брокколи. Для этого во время варки овощей необходимо добавить в воду 1 ч. ложку соды на 2 л воды.
Затем хорошенько промойте проточной водой. К сожалению, полностью избавить плоды от пестицидов таким способом не удастся.
Моющие средства с содой
Учитывая изобилие представленных в магазинах моющих и чистящих средств, делать их своими руками особого смысла вроде бы и нет. Но не стоит игнорировать тот факт, что в безопасности собственноручно изготовленных средств вы будете уверены на 100%. Много времени это не займет, ведь сделать любое из них можно буквально за несколько минут.Для посуды
Сода поможет качественно вымыть посуду. Для этого можно использовать ее в чистом виде — просто как порошок, но это не всегда удобно.
Сода поможет качественно вымыть посуду
Поэтому предлагаем вам несколько вариантов жидких моющих средств с содой.
С мылом, горчицей и аммиаком
Хорошо обезжиривает, легко смывается, экономично в использовании.Для изготовления потребуется:
- пищевая сода —1,5 ст. ложки;
- горчичный порошок — 1,5 ст. ложки;
- горячая вода — 500 мл;
- хозяйственное мыло — 25 г;
- 10% раствор аммиака (нашатырный спирт) — 2 ст. ложки;
- любое эфирное масло — 3 капли.
Способ приготовления:
- Хозяйственное мыло натирают на самой мелкой терке, соединяют с горячей водой и размешивают до тех пор, пока оно не растворится полностью.
- Раствору дают немного остыть и добавляют в него горчичный порошок, соду. Снова хорошенько перемешивают.
- Полученную смесь переливают в любую емкость, которую можно герметично закрыть и которой вам будет удобно постоянно пользоваться.
- Добавляют раствор аммиака (делать это необходимо в хорошо проветриваемом помещении), несколько капель любого эфирного масла.
- Закрывают емкость крышкой, хорошенько встряхивают и оставляют на 4-5 ч.
- По прошествии указанного времени гель-паста готова.
- Используют точно так же, как обычный гель для мытья посуды.
С перекисью
Отлично удаляет жир и дезинфицирует. Хорошо смывается с поверхности посуды.
Сода с перекисью отлично удаляет жир и дезинфицирует
Для изготовления потребуется:
- пищевая сода — 1 ч. ложка;
- перекись водорода (3% раствор) — 1 ч. ложка;
- горячая вода — 150 мл.
Способ приготовления:
- Соду высыпают в воду и хорошенько размешивают до полного растворения.
- Как только сода растворится, добавляют перекись водорода и снова перемешивают.
- Готовую смесь переливают в бутылку с дозатором и используют как обычное средство для мытья посуды.
Универсальное
На основе соды можно сделать универсальное моющее средство.
На основе соды можно сделать универсальное моющее средство
Для изготовления потребуется:
- хозяйственное (или любое другое) мыло — 100 г;
- горячая вода — 100 мл;
- пищевая сода — 3 ст. ложки;
- любимое ароматическое масло — несколько капель.
Способ приготовления:
- Мыло натирают на мелкой терке и, смешав его с горячей водой, взбивают миксером, пока не образуется пена.
- Затем мыльному раствору дают немного остыть.
- Потом в него добавляют соду, по желанию — эфирное масло, и еще раз хорошенько все взбивают (2-3 мин.).
- Получившееся универсальное моющее средство можно использовать как для мытья посуды, так и для чистки плиты, духовки, кафеля и даже сантехники.
Для кафеля, раковины и ванны
Чтобы привести в порядок санузел, не обязательно покупать дорогие чистящие средства.Для кафеля, раковины и ванны
Просто нанесите немного соды на губку и используйте точно так же, как и любое другое моющее средство: тщательно протрите загрязненную поверхность (кафельную плитку, раковину, ванну), и смойте остатки водой.
Для удаления мыльного налета
Устранить мыльный налет на шторке в душе или ванной можно следующим образом:- увлажните загрязненные места;
- на губку (салфетку, щетку) насыпьте немного соды;
- тщательно потрите места, где есть налет;
- ополосните шторку проточной водой.
Для чистки ковровых покрытий
С помощью соды можно качественно очистить загрязненный ковер или палас.
С помощью соды можно очистить загрязненный ковер
Для этого к соде добавляют несколько капель любого эфирного масла (5-10 капель на 200 г порошка), хорошенько все перемешивают и тонким слоем рассыпают по ковру. Оставляют так на 10-12 ч. Затем ковер тщательно чистят жесткой щеткой, после чего хорошенько пылесосят. Так вы не только качественно отчистите ковровое покрытие, но и избавите его от нежелательных запахов.
Для мытья полов
Быстро (и без особых усилий) отмыть грязный пол поможет содовый раствор (100 г соды на 10 л воды).Для чистки расчесок и гребней для волос
Очистить расческу от накопившегося жира, частичек кожи и пыли можно следующим способом: замочите ее в теплом содовом растворе на несколько часов, после чего тщательно промойте под проточной водой и высушите. Приготовление раствора: 1 ч. ложка соды на 200 мл воды.Для чистки сливных труб
Сода поможет прочистить сливные трубы, конечно лишь в том случае, если они не сильно засорены.
Сода поможет прочистить сливные трубы
Для этого в слив засыпают 5 ст. ложек соды. Туда же выливают около 100 мл уксуса, и оставляют на час. Спустя указанное время промывают трубу большим количеством горячей воды.
Для удаления налета
Используя заварочный чайник, вы наверняка замечали налет, который со временем образуется с внутренней стороны.
Для удаления налета
Удалить его поможет содовый раствор. В 500 мл горячей воды растворите 2 ст. ложки соды. Готовый раствор залейте в заварочный чайник, оставьте на 3-5 ч, после чего тщательно вымойте — от налета не останется и следа.
Для чистки кастрюль
В кастрюле, сотейнике или сковороде пригорела пища? Не беда!
Для чистки кастрюль
Налейте в посуду содовый раствор (5 ст. ложек соды на 1 л воды), прокипятите 10-15 мин. Не сливая его, отставьте кастрюльку в сторонку на 10-12 ч. Затем вымойте — остатки пригоревшей пищи легко отойдут. Если не получилось отмыть дочиста — повторите процедуру еще раз.
Для чистки серебра
Чтобы отчистить потемневшее серебро, хорошенько натрите его содовой кашицей, оставьте на час-два, затем промойте проточной водой и насухо вытрите.
Для чистки серебра
Для приготовления кашицы просто смешайте соду с небольшим количеством воды.
Для посудомоечной машины
Заменить покупное моющее средство для посудомоечной машины можно порошком, изготовленным собственными руками: смешав в равных пропорциях соду и аптечную буру.
Для посудомоечной машины
Чтобы посудомоечная машина эффективно работала, она нуждается в регулярном уходе. Очистить (и одновременно дезодорировать) ее можно с помощью обыкновенной соды и уксуса. Установите на ночь в машину стакан с уксусом (на верхнюю полку), а по ее дну рассыпьте тонкий слой соды. Утром включите на полный цикл. Посудомоечная машина станет чистой, а неприятные запахи (если они были) — исчезнут без следа.
Для стирки белья
Во время стирки добавьте в воду немного пищевой соды (100 г на 5 кг белья), она поможет избавиться не только от въевшихся пятен, но и от посторонних запахов. Кроме того, пищевая сода усилит действие стирального порошка и смягчит ткань.
Для стирки белья
Если нужно целенаправленно устранить стойкий неприятный запах, замочите белье в содовом растворе (150 г на 4 л воды) на 8-12 ч после чего постирайте.
Сода — пятновыводитель
Чтобы удалить пятна от вина (соков, варенья, травы и так далее), смешайте в равных пропорциях соду и сок лимона — до получения густой кашицеобразной массы. Нанесите кашицу на пятно и оставьте на 30 минут. Спустя указанное время постирайте изделие.Сода — нейтрализатор запахов
В холодильникеКачественно вымыть холодильник, заодно устранив в нем посторонние запахи, можно достаточно быстро и просто. Не обязательно использовать специальные моющие средства, сгодится обыкновенный содовый раствор — 2 ст. ложки на 1 л воды.
Сода — нейтрализатор запахов
Чтобы неприятные запахи вообще не появились в холодильнике, оставьте в нем открытую емкость с 2-3 ст. ложками соды, которая будет прекрасно поглощать их. Менять соду необходимо примерно раз в две недели.
В мусорном ведре
Чтобы избавить мусорное ведро от нежелательного «аромата» — вымойте его содовым раствором, приготовленным из 1 л воды и 2 ст. ложек соды. После этого насыпьте на дно ведра немножко соды — она нейтрализует все неприятные запахи.
В шкафу
Освежить запах в шкафу можно следующим способом: поставьте в него коробочку с несколькими ложками соды, предварительно смешанной с любимым эфирным маслом (5-10 капель на 100 г соды).
Совет: Если к соде добавить несколько капель лавандового масла — будет двойная польза: и от нежелательных запахов в шкафу избавитесь, и отпугнете моль, которая просто не выносит лавандового аромата.
В туалете
Нейтрализовать неприятный запах в туалете можно, если поставить в санузле небольшую открытую емкость, наполненную содой. Менять порошок необходимо раз в неделю.
Разделочной доски
Сода поможет дезодорировать разделочную доску. Для этого смочите доску водой, посыпьте содой и оставьте так на 8-10 мин. Затем хорошенько вымойте под проточной водой.
Сода для дезинфекции
Стеклянных банокСобираетесь заняться консервацией? Тогда воспользуйтесь содой — с ее помощью вы не только начисто вымоете тару, но и дезинфицируете ее. Несомненно, такая обработка не заменит термической, но для банок под варенье, джем, повидло — вполне подойдет.
Сода для дезинфекции
Клеток, туалетных лотков, игрушек домашних животных
Для мытья и дезинфекции террариумов, клеток, туалетных лотков (кормушек, игрушек и так далее) домашних питомцев отлично подойдет содовый раствор: на 1 л воды — 5 ст. ложек соды. Тщательно вымойте клетку (лоток, игрушку), после чего ополосните водой, чтобы смыть остатки содового раствора.
Сода для ухода за домашними животными
Сода поможет привести в порядок шерсть домашних питомцев, причем купать их при этом совершенно не обязательно. Из 500 мл воды и 2 ч. ложек соды приготовьте содовый раствор, перелейте его в пульверизатор, сбрызните им животное (избегая попадания средства в уши и на слизистые оболочки), и тщательно расчешите. После такой процедуры шерсть вашего любимца станет чище и избавится от нежелательного запаха.
Сода поможет привести в порядок шерсть домашних питомцев
Если с вашим питомцем случился конфуз (или просто он таким образом решил показать, кто в доме главный), избавиться от последствий поможет сода. Сначала, с помощью хорошо впитывающей салфетки, уберите лужу, затем хорошенько посыпьте содой место, на котором она находилась. Через 2-3 мин. аккуратно сметите соду щеткой. Так вы одновременно очистите и дезинфицируете покрытие.
Если подобный конфуз случился не с котенком или щенком, а уже со взрослым котом (к примеру — в любовно-морковный период:)), избавиться от запаха мочи будет несколько сложнее, но тоже возможно.
Последовательность действий:
- уберите лужу;
- на место, где она была, налейте раствор уксуса и воды (1:3). Дождитесь, пока все высохнет;
- затем насыпьте тонкий слой соды, поверх которого распылите раствор, приготовленный из 50 мл воды, 50 мл 3% перекиси водорода и 1/3 ч. ложки жидкого мыла, и оставьте на 5-7 часов;
- спустя указанное время пропылесосьте.
Сода против муравьев
Избавить дом от нашествия муравьев также можно с помощью соды.
Сода против муравьев
Для этого смешайте соду с солью в пропорции 1:1 и рассыпьте в том месте, где завелись муравьи.
Сода – «огнетушитель»
Если на плите загорелся жир, быстро потушить его поможет сода. Просто насыпьте ее на горящее жировое пятно. В данном случае сода выступит в качестве порошкового огнетушителя.
Если на плите загорелся жир, быстро потушить его поможет сода
Конечно, тушить таким образом (пусть даже небольшой) огонь — не самый лучший вариант, но метод простой и действенный, да и сода наверняка под рукой на кухне у каждой хозяйки.
Сода — освежитель воздуха
Чтобы запах в доме был приятным, совсем не обязательно использовать покупные освежители.
Сода — освежитель воздуха
Их можно быстро сделать своими руками, из самых простых средств. О том, как самостоятельно изготовить освежитель на основе соды, вы можете узнать из этой полезной статьи.
Сода — ароматная бомба
На основе соды можно сделать ароматические бомбочки для туалета, которые (за счет своих щелочных компонентов) предупредят образование налета на унитазе.
На основе соды можно сделать ароматические бомбочки для туалета
Кроме того, они прекрасно ароматизируют воду, благодаря чему от унитаза постоянно будет исходить тонкий приятный аромат.
Для изготовления потребуется:
- пищевая сода — 250 г;
- лимонная кислота — 100 г;
- эфирное масло лимона — 30 капель;
- эфирное масло мяты — 30 капель;
- эфирное масло лаванды — 30 капель.
Способ приготовления:
- Соду смешивают с лимонной кислотой.
- К смеси добавляют эфирные масла и все хорошенько перемешивают.
- Добавляют небольшое количество воды (1-2 ст. ложки). В итоге должна получиться масса, по консистенции напоминающая влажный песок.
- Получившуюся смесь аккуратно раскладывают в формочки (идеально подойдут формы для льда) и оставляют для просушки на 5-6 часов.
- Спустя указанное время бомбочки вынимают из форм, дают им еще немного подсохнуть, и используют по назначению.
- Хранить бомбочки лучше в полиэтиленовом пакете либо плотно закрытом пластиковом (стеклянном) лотке.
Сода на садовом участке
Сода — настолько универсальное средство, что ее с успехом можно использовать для ухода за растениями.Против серой гнили
Защитить виноград от серой гнили, и одновременно повысить содержание сахара в ягодах, поможет пищевая сода.
Сода поможет защитить виноград от серой гнили
Для этого 80 г соды разводят в 10 л воды, и опрыскивают полученным раствором виноградную лозу. Этот же раствор можно использовать для обработки фруктовых деревьев против листогрызущих гусениц.
Удобрение для растений
Содовый раствор можно с успехом использовать в качестве удобрения для растений.
Содовый раствор можно с успехом использовать в качестве удобрения для растений
Для приготовления питательного средства в 1 л отстоянной воды необходимо растворить 1 ч. ложку соды. Поливать содовым раствором можно такие растения, как клематис и живокость.
Для здоровья огорода
Чтобы не допустить появления мучнистой росы на огурцах, опрыскайте их содовым раствором (1 ч. ложка на 1 л. воды). Раствором из 10 л воды и 1 ст. ложки соды можно полить огурцы для предотвращения преждевременного пожелтения листьев.
В борьбе с мучнистой росой сода — одно из самых эффективных средств
В борьбе с мучнистой росой сода — одно из самых эффективных средств. Для обработки смородины и крыжовника воспользуйтесь раствором: 5 л воды, 1 ст. ложка растительного масла, 1 ст. ложка соды, 1 ч. ложка жидкого мыла и 1 таблетка аспирина.
Для цветов в срезке
Сода поможет сохранить свежесть срезанных цветов.
Сода поможет сохранить свежесть срезанных цветов
Чтобы букет простоял в вазе как можно дольше, добавьте в воду соду: на 1,5 л - 1 ч. ложку.
Против сорняков
Избавиться от сорняков, которые часто прорастают между тротуарными плитками и в трещинах асфальтного покрытия, достаточно просто.
Сода против сорняков
Просто щедро посыпьте содой места, в которых выросли сорняки.
Сода в домашней косметологии
Поистине чудойственные свойства соды с успехом используют в домашней косметологии. На ее основе готовят различные скрабы, маски и даже глубоко очищающий шампунь.От черных точек
Избавиться от ненавистных черных точек на лице поможет обыкновенная пищевая сода.
Избавиться от черных точек на лице поможет пищевая сода
Для этого 1 ч. ложку соды разводят водой – до получения консистенции густой сметаны. Готовую массу на 10 минут наносят на проблемные участки лица – область носа, подбородка, лоб. Спустя указанное время лицо умывают теплой водой.
Сода вместо скраба
Соду можно использовать в качестве скраба — она способна бережно и качественно очистить кожу. Вариантов приготовления скраба с содой существует множество, вот несколько из них:
Сода вместо скраба
С медом:
Чайную ложку меда смешивают с 0,5 ч. ложки соды. Получившуюся массу наносят на очищенное лицо, бережно массируют кожу в течение 5 мин., после чего скраб смывают прохладной водой.
Со сметаной:
Чайную ложку сметаны смешивают с 0,5 ч. ложки соды до получения однородной массы. Смесь наносят на проблемные участки кожи. Круговыми движениями массируют 3-5 мин. и смывают теплой водой.
Совет: Используйте такой способ очищения кожи лица не чаще одного раза в неделю.
Маски для лица
Маски с содой помогут провести глубокую очистку кожи лица, сделают ее более свежей и шелковистой.
Маски с содой помогут провести глубокую очистку кожи лица
С медом и сливками — удалит отмершие клетки, очистит поры, а также увлажнит и напитает кожу. Для приготовления в одной емкости смешивают: 1 ч. ложку сливок, 1 ч. ложку меда и соду — на кончике ножа. Готовую маску наносят на лицо на 10 мин., после чего смывают теплой водой.
С овсяной мукой — обладает отшелушивающим, очищающим эффектом, смягчает кожу. Для приготовления маски 100 г овсяной муки (смолоть хлопья на кофемолке) смешивают с 1 ч. ложкой соды и разбавляют водой до получения густой кашицы. Готовую смесь на 10 мин. наносят на предварительно очищенную кожу лица. Смывают теплой водой.
Совет: Маски и скрабы с содой необходимо использовать с осторожностью, если:
- у вас сухая либо чувствительная кожа;
- есть склонность к дерматиту;
- имеются воспалительные процессы кожи.
Глубоко очищающий шампунь
Приготовить отличный глубоко очищающий шампунь можно собственными руками.
Приготовить отличный шампунь можно собственными руками
Просто смешайте соду с любым шампунем (1:4), и вымойте волосы этой смесью.
Для повышения упругости кожи
Хотите, чтобы ваша кожа стала более упругой, подтянутой и бархатистой?
Сода для повышения упругости кожи
В этом вам поможет ванна с добавлением 300 г морской соли, 200 г пищевой соды и нескольких капель любого (апельсинового, розмаринового, лимонного и так далее) эфирного масла. Принимать содовые ванны необходимо около 20 мин.
Для снятия усталости ног
Содовая ванночка (1,5 ч. ложки соды на 5 л воды) поможет снять усталость ног.
Сода для снятия усталости ног
А чтобы процедура доставила вам еще большее наслаждение, добавьте в воду пару капель любимого эфирного масла.
Бомбочки для ванны
Бомбочки для ванны не обязательно покупать — их тоже можно сделать самостоятельно.
Бомбочки для ванны
Рецептов их изготовления множество — есть из чего выбрать: с овсяной мукой и молоком, оливковым и миндальным маслом, маисовой мукой и маслом жожоба, кукурузным крахмалом и бурой. Можно добавить лепестки цветов, красители и различные эфирные масла — так они будут не только красиво выглядеть, но и приятно пахнуть. Мы предлагаем сделать бомбочки с хвойным ароматом по следующему рецепту:
Для изготовления потребуется:
- сода — 8 ст. ложек;
- оливковое масло — 5 ст. ложек;
- лимонная кислота — 4 ст. ложки;
- морская соль — 2 ст. ложки;
- эфирное масло сосны — 5-6 капель.
Способ приготовления:
- В глубокой мисочке смешивают соду и лимонную кислоту.
- Морскую соль измельчают с помощью блендера либо кофемолки и соединяют со смесью соды и лимонной кислоты.
- К смеси добавляют 4 ст. ложки оливкового масла, эфирное масло сосны и все тщательно перемешивают. В итоге должна получиться масса, похожая на тугое рассыпчатое тесто.
- Оставшимся оливковым маслом смазывают формочки, в которые и раскладывают смесь, стараясь утрамбовать ее очень плотно. Из данного количества ингредиентов должно получиться около 10 бомбочек.
- Бомбочки оставляют на несколько часов в формочках — чтобы подсохли.
- Затем достают из форм, и оставляют в теплом сухом помещении до полного высыхания.
- Готовые изделия хранят плотно упакованными в полиэтилен.
Сода пищевая в кулинарии: полезные рецепты для приготовления
Практически всем, кто любит, а тем более готовит мучное, известно, что сода нужна, чтобы тесто стало рыхлым и пышным. Сода, погашенная уксусной или лимонной кислотой, придает бисквитному тесту пышность и пористость.

Польза NaHCO3 для здоровья
Сода поможет справиться со многими заболеваниями. Она восстанавливает дефицит натрия в организме.
- NaHCO3 применяют при наличии различных болезней сердца. Она снижает артериальное давление и уменьшает частоту сердечных сокращений.
- Можно просто залить 2,5 грамма бикарбоната натрия стаканом чистой воды. Получившаяся жидкость нейтрализует избыток кислоты в желудке. Его можно употреблять в пищу людям, страдающим изжогой.
- Продукт снижает вероятность недоброкачественной опухоли, позволяет избавиться от камней в почках и желчном пузыре.
- Устраняет усталость и раздражительность, заряжает жизненной энергией.
Состав натурального разрыхлителя
Разрыхлитель изготавливают и в домашних условиях. Сколько же в таком случае брать соды?
Технология изготовления проста:
- Надо взять 12 ч. л. пшеничной муки.
- Затем добавляют следующие ингредиенты: 5 ч. л. соды и 3 ч. л. лимонной кислоты. Можно внести изменения в рецепт: в отдельных случаях лимонную кислоту заменяют измельчённой клюквой или чёрной смородиной. Для приготовления разрыхлителя берут пять чайных ложек молотых ягод.
- После этого надо аккуратно перемешать перечисленные компоненты и поместить их в отдельную ёмкость.
Разрыхлителем, сделанным на основе лимонной кислоты, разрешается пользоваться долгое время.

Продукт, в котором присутствуют ягоды, портится довольно быстро. Поэтому его нужно использовать сразу после приготовления.
Опытные кулинары убеждены, что разрыхлитель, изготовленный дома самостоятельно, придаёт выпечке мягкость. Кондитерские изделия быстро тают во рту и долго не черствеют.
Маленькие тонкости
При приготовлении кулинарных блюд рекомендуется строго соблюдать рекомендованную дозировку.
Внимание! При нехватке соды тесто может получиться жёстким, оно плохо поднимается. При избыточном содержании NaHCO3 блюдо приобретает специфический, слегка мыльный привкус.
Щепотка соды придаёт кофе неповторимый аромат. Но необходимо придерживаться определенной дозировки.
Для того чтобы сделать вкусный напиток дома самостоятельно, в 200 мл кипятка растворяют 5 г бикарбоната натрия. Затем в полученную смесь добавляют немного растворимого кофейного порошка.
Как рассчитать необходимое количество продукта.
Некоторые неопытные хозяйки не знают, как взвесить соду без применения весов.
В одной столовой ложке с горкой содержится примерно 28 г бикарбоната натрия. Сколько же соды в столовой ложке без горки? В ней приблизительно 20 г продукта.Теперь следует подсчитать, сколько граммов соды в чайной ложке с горкой. В ней содержится 12 г бикарбоната натрия, в чайной ложке без горки — 8 г.
При приготовлении некоторых блюд не требуется максимальная точность. Но лучше обратить своё внимание на рецепты со строгой дозировкой.

Мало знать, сколько соды содержится в чайной ложке. Ведь при изготовлении выпечки используются и другие ингредиенты. Так, например, в одной чайной ложке с горкой помещается:
- 5 г мака.
- 8 г манки.
- 5 г топлёного масла.
Пищевая сода в хозяйстве
Сода – нетоксичное натуральное средство, безвредное и не вызывающее аллергии. Гидрокарбонат натрия поможет избавиться от запахов в холодильнике, если поставить в него на 6-10 часов емкость с содовым раствором (3 большие ложки соды на литр жидкости). Чтобы устранить засор в раковине, достаточно вылить в нее смесь из соли, уксуса и соды (1:1:1) и смыть кипятком. Очистить и вернуть цвет старому ковру можно, если посыпать на его влажную поверхность соду, подождать 30-40 минут и тщательно пропылесосить. При помощи соды легко придать блеск стаканам, вазам, бутылкам и чашкам. Сода хорошо удаляет грязь и микробы с кухонных поверхностей, раковины, унитаза. Возвращает белизну белым скатертям, полотенцам и шторам.
Пищевая сода в кулинарии
Сода повсеместно применяется в качестве разрыхлителя для выпечки кондитерской продукции и других изделий из теста. Она уменьшает время приготовления горошка, шпината, фасоли. Возвращает аромат и оттенок замороженным и сухим овощам. Улучшает вкус соусов, смягчает жесткое мясо, придает «пышность» омлету из яиц, делает кофе и чай более прозрачными и ароматными. Промывание овощей раствором соды улучшает их вид, нейтрализует негативные последствия длительного хранения, выводит нитраты.

Сода как лекарство
Гидрокарбонат натрия нашел свое применение и в традиционной, и в народной медицине. Здесь главный принцип – не навредить. Особенно это касается лечения детей – перед использованием соды обязательно нужно проконсультироваться с педиатром.
Болезни почек
Бикарбонат щелочного вещества вырабатывается в организме естественным образом, поддерживая в норме pH и стимулируя ввод и вывод кислот. У людей, страдающих заболеваниями почек, удаление кислот из организма затруднено, что может закончиться метаболическим ацидозом. Повышенная кислотность ухудшает пищеварение, приводит к образованию песка и камней в почках и желчном пузыре, отравлению всего организма токсинами. Сода в сочетании с классической терапией замедляет темп снижения почечной функции, облегчает работу почек, делает мочу щелочной.
Дерматологические заболевания
Содовая ванна успокаивает раздражение и зуд кожи у людей с псориазом. Паста из соды (вода/сода) лечит солнечные ожоги, аллергическую сыпь, укусы насекомых, устраняет дискомфорт и воспаление. Эффективен бикарбонат натрия и против грибка на ногах. Содовые ванночки отлично подсушивают кожу и убивают микробы. Хорошую эффективность показала сода в борьбе с себореей. Она быстро отделяет шелушащуюся кожу и подавляет негативное воздействие грибка.
Простуда
Сода разжижает вязкую мокроту при кашле, если добавить ее в теплое молоко. Детям целебный напиток следует давать только утром, а не перед сном, чтобы не «нагружать» на ночь печень. Можно применять раствор соды для ингаляций и промывания глаз. Благодаря своим противовоспалительным и бактерицидным свойствам, сода быстро избавляет от боли в горле и способствует скорейшему выздоровлению.

Изжога
Все популярные фармацевтические препараты от изжоги производятся на основе соды. Бикарбонат натрия облегчает ее проявления и не вредит здоровью. Рецепт: смешать 250 миллилитров воды и половину чайной ложки соды, выпить через 1-1,5 часа после приема пищи. Важно помнить, что сода – антикислотное вещество. Попадая в желудок, она вступает во взаимодействие с соляной кислотой, вызывая «кислотный рикошет». Выделившийся в результате реакции углекислый газ «заставляет» стенки желудка вырабатывать новые порции соляной кислоты и желудочного сока, раздражая дополнительно желудочные стенки.
Сытный десерт за несколько минут
В одной пачке содержится 0,5 кг NaHCO3. Поэтому одной упаковки хватает на длительное время.
Можно приготовить торт из таких составляющих:
- 4 куриных яйца.
- 1,5 стакана пшеничной муки.
- Стакан сахарного песка.
- Щепотка бикарбоната натрия.
- Небольшое количество уксуса.
Сначала взбивают яйца с сахаром до получения однородной консистенции. Затем соду гасят уксусом. Но его не должно быть слишком много, в противном случае от готового бисквита будет исходить неприятный запах. В смесь нужно добавить предварительно просеянную муку и небольшое количество соды. Тесто кладут в готовую форму для выпечки и ставят в духовку, разогретую до температуры 200 градусов.
При желании можно добавить в него немного яблок, орехов или сухофруктов (например, изюма).
ИСТОЧНИКИ:https://sodasovet.ru/soda-v-kulinarii/https://womanvip.ru/pishhevaja-soda-polza-i-vred/