Фенолят натрия фенол
Фенол: химические свойства, получение и строение
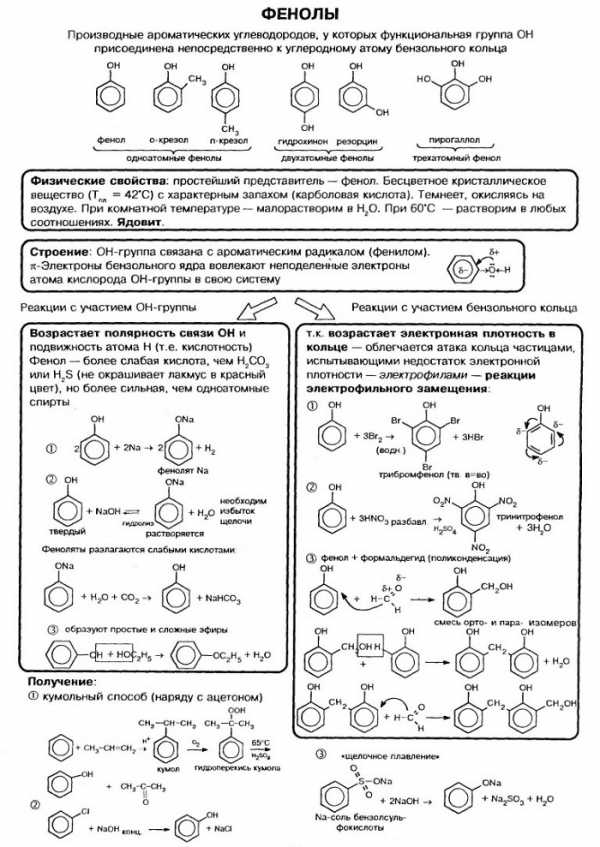
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд спиртов
Химические свойства спиртов
Способы получения спиртов
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.
| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
| Сходство и отличие фенола и спиртов.
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода. Отличия:
|
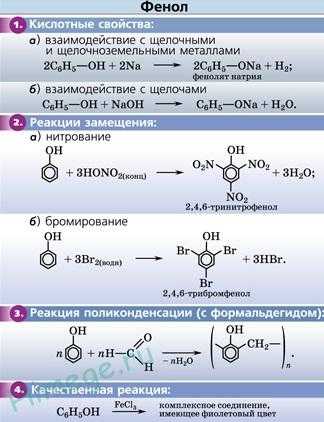
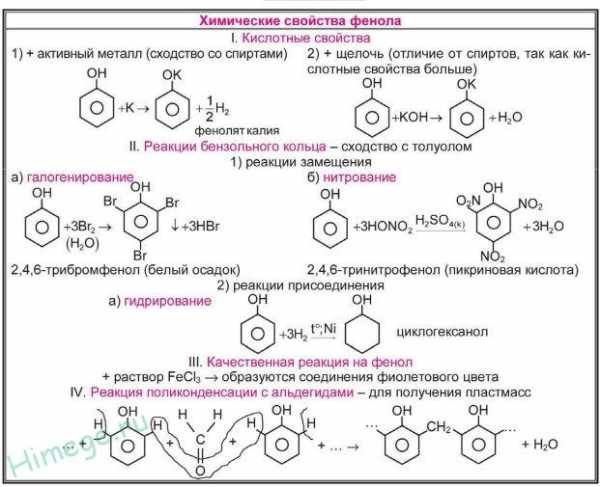
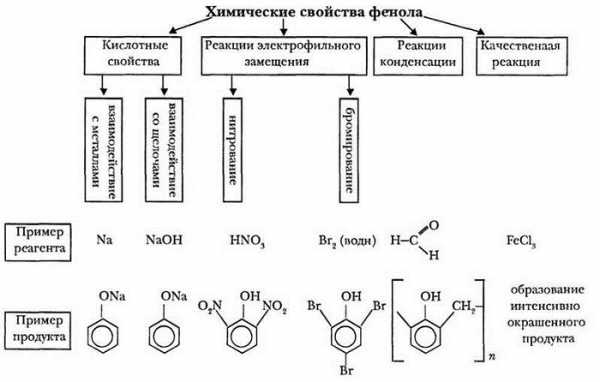
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
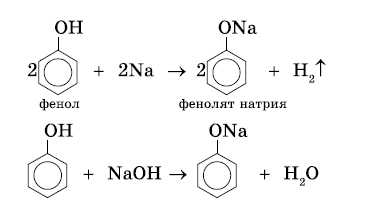
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |
Видеоопыт взаимодействия фенола с гидроксидом натрия можно посмотреть здесь.
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
| Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода. |
Видеоопыт взаимодействия фенола с натрием можно посмотреть здесь.
2. Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
2.1. Галогенирование
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |
Видеоопыт взаимодействия фенола с бромом можно посмотреть здесь.
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |
3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
Видеоопыт взаимодействия фенола с хлоридом железа (III) можно посмотреть здесь.
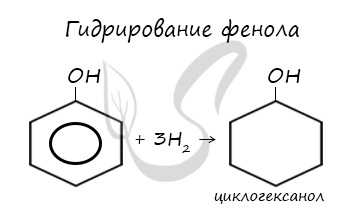
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
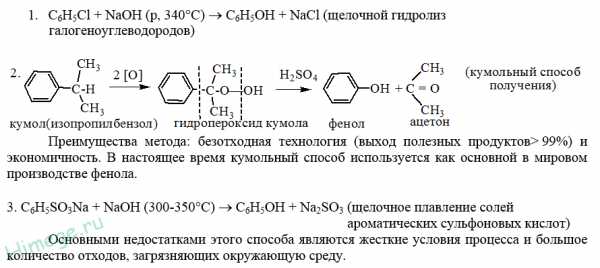
1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
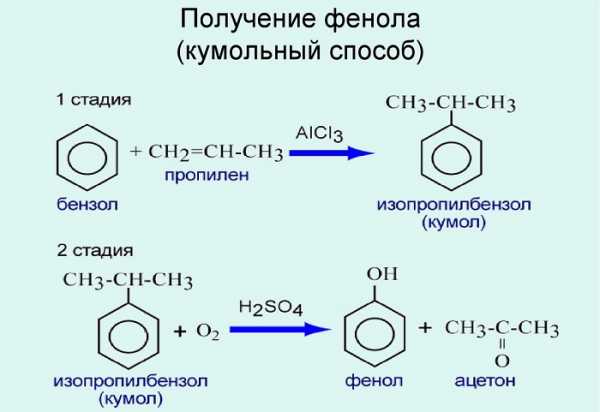
2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Поделиться ссылкой:
Получение фенола,
Получение фенола
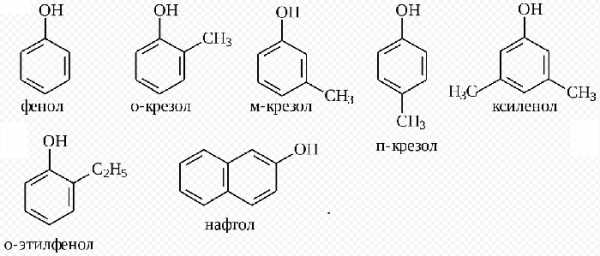
Фенолами называются такие соединения бензольного ряда, в которых один или несколько атомов водорода бензольного кольца замещены гидроксильными группами. В зависимости от количества гидроксилов фенолы подразделяются на одно- и многоатомные. К одноатомным фенолам относятся фенол и его гомологи - крезол, ксиленол, к двухатомным - резорцин.
Фенол и его гомологи получают в процессе сухой перегонки каменного угля, при сухой перегонке сланцев, торфа и древесины. Так же фенолы получают из продуктов термической переработки твердых топлив и из нефтяного сырья.
Получение синтетического фенола. Получение фенола синтетическим путем основано на использовании в качестве исходного сырья бензола, который в свою очередь получают из коксового газа, а также из продуктов химической переработки нефти.
Синтетический фенол получают несколькими способами: сульфированием бензола, хлорированием бензола, алкилированием бензола пропиленом (кумольный способ).
Получение фенола сульфированием бензола. По этому методу фенол получают как в паровой, так и жидкой фазах путем сульфирования бензола концентрированной серной кислотой. Образующуюся бензолсульфокислоту переводят в натриевую соль и сплавляют с едким натром, получая фенолят натрия:
C6H6 + H2S04 -> C6H5S03H + Н20
C6H5S03Na + 2NaOH -> C6H5ONa + Na2S03 + H2O
Подкислением серной кислотой из фенолята натрия выделяют фенол.
Получение фенола хлорированием бензола. Бензол обрабатывают газообразным хлором в присутствии катализаторов. Полученный хлорбензол при повышенной температуре и под давлением подвергают гидролизу при действии водного раствора едкого натра:
C6H6 + CI 2 -> C6H5CI + Н CI
С6Н6 CI + 2NaOH -> C6H5ONa + NaCl + Н20
Выделяемый фенол очищают перегонкой под вакуумом.
Синтез фенола сульфированием бензола ввиду сложности и большого расхода серной кислоты не получил широкого развития. Получение же фенола через хлорбензол в паровой фазе достаточно экономично, но технологически сложно.
Получение фенола из кумола. Кумол или изопропилбензол получают взаимодействием бензола с пропиленом, являющимся продуктом крекинга нефти, по реакции
С6Н6 + СН3—СН = СН2 — C6H5CH (СН3)2
Кумол затем окисляют кислородом воздуха в гидроперекись кумола:
С6Н5СН (СН3)2 + О2 -> С6Н5С (СН3)2ООН
Разложением гидроперекиси серной кислотой получают фенол и ацетон:
С6Н5С (СН3)2 ООН -> C6H5OH + СН3СОСН3
Способ получения фенола из кумола высокопроизводителен и экономичен. При этом процессе одновременно получают ацетон. Из всего производимого в стране синтетического фенола 60% получают кумольным методом.
Получение фенолов из продуктов переработки твердого топлива. Несмотря на значительный рост производства синтетич
Тема №22 «Характерные свойства фенолов»
- НОВОСТИ
- КУРС ХИМИИ
- Дополнительные уроки
- Курс химии
- Разбор заданий ЕГЭ
- ТЕСТЫ
- Вариаты ЕГЭ
- Тесты по заданиям
- Тесты по темам
- СТАТЬИ
- ОПЫТЫ
- ТАБЛИЦА МЕНДЕЛЕЕВА
Поиск
CHEM-MIND.com- НОВОСТИ
- Новости
Алгоритм обучения для подготовки к ЕГЭ по химии
НовостиОтветы в тестах вновь правильно отображаются!
НовостиТехнические проблемы
НовостиНовый раздел на сайте
НовостиС 8 марта
- Новости
- КУРС ХИМИИ
- ВсеДополнительные урокиКурс химииРазбор заданий ЕГЭ Разбор заданий ЕГЭ
Разбор задания №11 ЕГЭ по химии
Разбор заданий ЕГЭРазбор задания №10 ЕГЭ по химии
Разбор заданий ЕГЭРазбор задания №9 ЕГЭ по химии
Разбор заданий ЕГЭРазбор задания №8 ЕГЭ по химии
- ВсеДополнительные урокиКурс химииРазбор заданий ЕГЭ Разбор заданий ЕГЭ
- ТЕСТЫ
- ВсеВариаты ЕГЭТесты по заданиямТесты по темам Тесты по темам
Тест №40 «Высокомолекулярные соединения»
Тесты по темамТест №39 «Химия и проблемы охраны окружающей среды»
Тесты по темамТест №38 «Общие научные принципы химического производства»
Тесты по темамТест №37 «Химическая лаборатория»
- ВсеВариаты ЕГЭТесты по заданиямТесты по темам Тесты по темам
- СТАТЬИ
- Статьи
Решение типовых задач по химии
СтатьиСовременная таблица Менделеева
СтатьиИонные уравнения реакций
СтатьиВнутренний экзамен МГМСУ по химии
СтатьиКниги для подготовки к химии
- Статьи
- ОПЫТЫ
- Опыты
Химическая ракета
ОпытыНеньютоновская жидкость
ОпытыЛодка на диоксиде углерода
ОпытыКак вырастить жеоду в домашних условиях
ОпытыГорящая рука/пузыри
- Опыты
- ТАБЛИЦА МЕНДЕЛЕЕВА
Фенолы — номенклатура, получение, химические свойства » HimEge.ru

Фенолы — органические вещества,молекулы которых содержат радикал фенил,связанный с одной или несколькими гидроксогруппами. Так же как и спирты, фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп.
Одноатомные фенолы содержат в молекуле одну гидроксильную группу:
Многоатомные фенолы содержат в молекулах более одной гидроксильной группы:
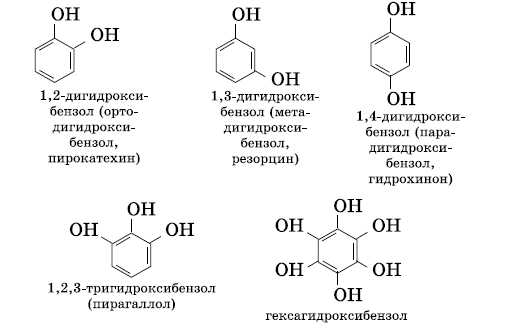
Существуют и многоатомные фенолы, содержащие три и более гидроксильных групп в бензольном кольце.
Познакомимся поподробнее со строением и свойствами простейшего представителя этого класса- фенолом С6Н5ОН . Название этого вещества и легло в основу в основу названия всего касса — фенолы.
Физические свойства фенола
Фенол-твердое, бесцветное кристаллическое вещества, t°плавления=43°С, t°кипения=181°С, с резким характерным запахом.Ядовит.Фенол при комнатной температуре незначительно растворяется в воде. Водный раствор фенола называют карболовой кислотой.При попадании на кожу он вызывает ожоги,поэтому с фенолом нужно обращаться очень осторожно!
Химические свойства фенола
Фенолы в большинстве реакций по связи О–Н активнее спиртов, поскольку эта связь более полярна за счет смещения электронной плотности от атома кислорода в сторону бензольного кольца (участие неподеленной электронной пары атома кислорода в системе p-сопряжения). Кислотность фенолов значительно выше, чем спиртов. Для фенолов реакции разрыва связи С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения. Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара-положениях (+М-эффект ОН-группы)
Кислотные свойства фенола
Атом водорода гидроксильной группы обладает кислотным характером. Т.к. кислотные свойства у фенола выражены сильнее, чем у воды и спиртов, то фенол реагирует не только с щелочными металлами, но и со щелочами с образованием фенолятов:
Кислотность фенолов зависит от природы заместителей (донор или акцептор электронной плотности), положения относительно ОН-группы и от количества заместителей. Наибольшее влияние на ОН-кислотность фенолов оказывают группы, расположенные в орто- и пара-положениях. Доноры увеличивают прочность связи О-Н (тем самым уменьшая подвижность водорода и кислотные свойства), акцепторы уменьшают прочность связи О-Н, при этом кислотность возрастает:
Однако кислотные свойства у фенола выражены слабее, чем у неорганический и карбоновых кислот. Так, например, кислотные свойства фенола примерно в 3000 раз меньше,чем у угольной кислоты. Поэтому, пропуская через водный раствор фенолята натрия углекислый газ, можно выделить свободный фенол.
Добавление к водному раствору фенолята натрия соляной или серной кислоты также приводит к образованию фенола:
Качественная реакция на фенол
Фенол реагирует с хлоридом железа (3) с образованием интенсивно окрашенного в фиолетовый цвет комплексного соединения.Эта реакция позволяет обнаруживать его даже в очень ограниченных количествах.Другие фенолы,содержащие одну или несколько гидроксильных групп в бензольном кольце, также дают яркое окрашивание сине-фиолетовых оттенков в реакции с хлоридом железа(3).
Реакции бензольного кольца фенола
Наличие гидроксильного заместителя значительно облегчает протекание реакций электрофильного замещения в бензольном кольце.
- Бромирование фенола. В отличие от бензола для бромирования фенола не требуется добавление катализатора (бромид железа(3)). Кроме того, взаимодействие с фенолом протекает селективно (избирательно): атомы брома направляются в орто- и пара-положения, замещая находящиеся там атомы водорода. Селективность замещения объясняется рассмотренными выше особенностями электронного строения молекулы фенола.
Так, при взаимодействии фенола с бромной водой образуется белый осадок 2,4,6-трибромфенола:
Эта реакция, так же как и реакция с хлоридом железа(3), служит для качественного обнаружения фенола.
2. Нитрирование фенола также происходит легче, чем нитрирование бензола. Реакция с разбавленной азотной кислотой идет при комнатной температуре. В результате образуется смесь орто- и пароизомеров нитрофенола:
При использовании концентрированной азотной кислоты образуется 2,4,6, тринитритфенол-пикриновая кислота, взрывчатое вещество:
3. Гидрирование ароматического ядра фенола в присутствии катализатора проходит легко:
4. Поликонденсация фенола с альдегидами, в частности, с формальдегидом происходит с образованием продуктов реакции — фенолформальдегидных смол и твердых полимеров.
Взаимодействие фенола с формальдегидом можно описать схемой:
В молекуле димера сохраняются «подвижные» атомы водорода, а значит,возможно дальнейшее продолжение реакции при достаточном количестве реагентов:
Реакция поликонденсаци, т.е. реакция получения полимера, протекающая с выделением побочного низкомолекулярного продукта(воды), может продолжаться и далее (до полного израсходования одного из реагентов) с образованием огромных макромолекул. Процесс можно описать суммарным уравнением:
Образование линейных молекул происходит при обычной температуре. Проведение этой же реакции при нагревании приводит к тому, что образующийся продукт имеет разветвленное строение, он твердый и нерастворим в воде.В результате нагревания фенолформальдегидной смолы линейного строения с избытком альдегида получаются твердые пластические массы с уникальными свойствами. Полимера на основе фенолформальдегидных смол применяют для изготовления лаков и красок, пластмассовых изделий, устойчивых к нагреванию, охлаждению,действию воды, щелочей, кислот.Они обладают высокими диэлектрическими свойствами. Из полимеров на основе фенолформальдегидных смол изготавливают наиболее ответственные и важные детали электроприборов, корпуса силовых агрегатов и детали машин,полимерную основу печатных плат для радиоприборов. Клеи на основе фенолформальдегидных смол способны надежно соединять детали самой различной природы,сохраняя высочайшую прочность соединения в очень широком диапазоне температур. Такой клей применяется для крепления металлического цоколя ламп освещения к стеклянной колбе.Таким образом, фенол и продукты на его основе находят широкое применение.
Получение фенола
Применение фенолов
Фенол — твердое вещество, с характерным запахом, вызывает ожоги при попадании на кожу. Ядовит. Растворяется в воде, его раствор называют карболовой кислотой (антисептик). Она была первым антисептиком введенным в хирургию. Широко используется для производства пластмасс, лекарственных средств (салициловая кислота и ее производные), красителей, взрывчатых веществ.
Фенолы ⚗️ общая структурная формула, химические и физические свойства, способы получения и применения, с какими веществами взаимодействуют
Фенолы – органические соединения. Они в небольших количествах есть в природе. Основную массу фенола и производных на его основе получают синтетическим путём.
Что такое фенол
К фенолам относят производные ароматических углеводородов, в молекулах которых гидроксильные группы связаны с фенил радикалом. Они могут иметь одну или несколько гидроксогрупп.
Самым простым представителем этой группы соединений считают фенол. Он и дал название классу веществ. Это же соединение называют гидроксибензолом.
Общая и структурная формулы
Состав веществ можно выразить общей формулой С6Н6-n(ОН)n.
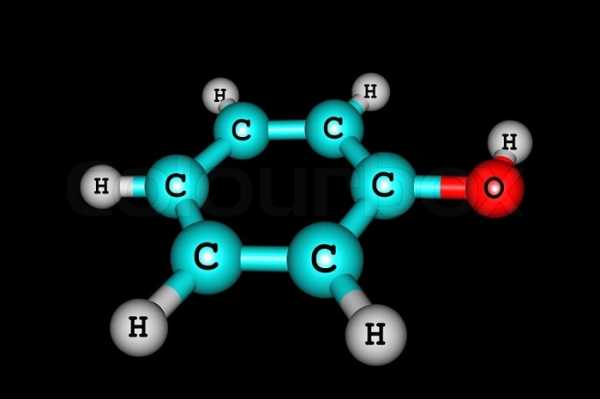
Простейший представитель класса имеет 1 гидроксогруппу. Его молекулярная формула С6Н5ОН. Структурная формула — ОН.
Если в молекуле фенола 1 атом водорода заместить на метильный радикал, получим метилфенол. Если к нему прибавить ещё одно бензольное ядро, получим нафтол.
Химические свойства фенола
Так как гидроксибензол содержит в своём составе 2 группы атомов, выделяют две группы химических свойств.
Свойства, идущие за счет фенил радикала:
-
галогенирование;
-
нитрование;
-
гидрирование;
-
реакция поликонденсации.
Свойства, протекающие за счёт гидроксильной группы (кислотные свойства):
Не следует понимать, что фенол, имея в своем составе черты строения бензола и спиртов, просто повторяет их свойства. На самом деле все сложнее. Чтобы понять особенность его химических взаимодействий, необходимо знать строение вещества. В молекуле фенола наблюдается взаимное влияние атомов.
На атоме кислорода гидроксильной группы есть 2 неподелённые электронные пары. Они взаимодействуют с π – электронной системой фенил радикала.
Результат взаимодействия следующий:
-
Нарушается равномерное распределение электронной плотности в фенил радикале. Она возрастает на атомах 2,4,6, то есть в орто– и параположениях. Именно в этих положениях водород будет легко замещаться на другие атомы.
-
Атом водорода гидроксогруппы, из-за влияния фенил радикала, приобретает положительный заряд и становится более подвижным.
Результатом влияния служат своеобразные свойства фенола. Он реагирует с активными металлами и щелочами. Спирты – только с металлами. В то же время и бензол, и гидроксибензол реагируют с бромной водой. Но у фенола, в отличие от бензола, идет замещение сразу по 3 атомам.
Физические свойства
С6Н5ОН – это белое кристаллическое вещество. В результате окисления кристаллы могут приобретать розовый цвет. Температура плавления 40,90С. Молярная масса 94 г/моль.

В холодной воде фенол является малорастворимым веществом. При температуре выше +700С растворяется хорошо. Карболовая кислота – так называют водный раствор фенола. Лучше растворяется в органических растворителях.
Отличается характерным резким запахом. Вещество ядовито. Проникая в организм человека, вызывает тяжёлое отравление.
С чем реагирует фенол
Гидроксибензол вступает в реакцию с активными металлами. С натрием даёт фенолят натрия. Уравнение выглядит следующим образом:
2 С6Н5ОН + 2Na = 2С6Н5ОNa + H2
В реакциях со щелочами также образует феноляты. Реагируя с гидроксидом калия, образует фенолят калия:
С6Н5ОН + KOН = С6Н5ОK +H2O
Взаимодействуя со спиртами, образует эфиры. Например, в реакции с бутанолом, получают простой эфир:
С6Н5 ОН + НО–С4Н9 = С6Н5–О–С4Н9 +Н2О
Из свойств, протекающих за счёт фенил радикала, можно отметить реакцию нитрования. Взаимодействие с HNO3 даёт 2,4,6 тринитрофенол (пикриновую кислоту):
С6Н5ОН + 3HNO3 = C6H2(NO2)3OH +3H2O
Реагируя с формальдегидом, фенол образует фенолформальдегидную смолу. Это реакция поликонденсации – получение высокомолекулярного вещества из низкомолекулярных веществ с отщеплением побочного продукта. В данном случае – это вода.
Качественные реакции на фенол
К качественным реакциям относят взаимодействие с бромной водой. В результате получают осадок белого цвета:
С6Н5ОН + 3Br2 = C6H2Br3ОН + 3HBr
Ещё одной качественной реакцией является взаимодействие с хлоридом железа(III). Получается фиолетовое окрашивание. Качественные реакции позволяют разделить и определить органические вещества.
Реакция присоединения
К реакциям присоединения относят гидрирование ароматического ядра. Гидрирование – это реакции присоединения водорода. Превращение протекает легко, в присутствии катализатора. В результате разрушается π – электронная система, образуется циклогексанол и циклогексанон:
2С6Н5ОН + 5Н2 = С6Н11ОН + С6Н10О
Окисление
Фенол не устойчив к окислению. Продукты реакции могут быть разными. Это зависит от самого окислителя и от условий, в которых протекает реакция. При окислении перекисью водорода получается двухатомный фенол:
С6Н5ОН + Н2О2 = С6Н4(ОН)2
К реакции окисления относят и реакцию горения. Образуется углекислый газ и вода.
Получение фенола
Фенол в небольшом количестве содержится в каменноугольной смоле. Но потребности в веществе настолько велики, что этого источника недостаточно.
Разработаны разные способы получения:
-
По схеме С6Н6 ----- С6Н5Cl ----- С6Н5ОН. Минусом метода являются жёсткие условия замещения хлора на гидроксогруппу. Реакции приходится проводить при высокой температуре и давлении.
-
Используют для получения бензол и пропилен, в результате чего получают кумол. Затем кумол окисляют, в результате получают ценные продукты – фенол, ацетон.
Применение
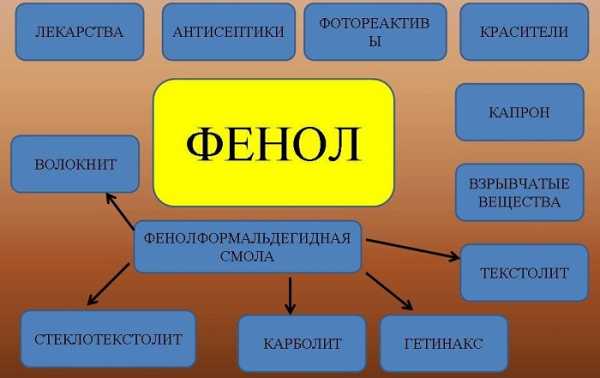
Вещество применяют для производства разнообразной продукции:
-
фенолформальдегидных смол и пластмасс;
-
лекарственных препаратов;
-
взрывчатых веществ;
-
красителей;
-
раствор фенола в воде обладает антисептическими свойствами;
-
искусственных волокон и другой продукции.
Заключение
Фенол и фенольные соединения – очень важная группа веществ. Не следует забывать, что многие из них являются ядами. Все отходы промышленности, содержащие вещество, тщательно очищаются. Их подвергают каталитическому окислению, обработке озоном и другим способам очистки.
Фенолокислоты — Википедия
 Салициловая кислота – один из наиболее известных представителей фенолокислот
Салициловая кислота – один из наиболее известных представителей фенолокислот Фенолокислоты — производные ароматических углеводородов, в молекулах которых атомы водорода бензольного ядра замещены на карбоксильные (-СООН) и гидроксильные (-ОН) группы. Их иногда рассматривают как ароматические кислоты, в молекулах которых атом водорода бензольного ядра замещен на гидроксильные группы. Фенолокислоты одновременно обладают свойствами карбоновых кислот и фенолов. Кроме того для них характерны свойства, обусловленные наличием в молекуле обоих видов функциональных групп и бензольного ядра.
Фенолокислоты представляют собой твердые кристаллические вещества. Фенолокислоты, которые имеют в своем составе один фенольный гидроксил, сравнительно малорастворимые в холодной воде, но хорошо растворяются в горячей воде и многих органических растворителях. С увеличением числа фенольных гидроксилов растворимость фенолокислот увеличивается.
Фенолокислоты очень распространены в природе, поэтому их можно извлечь из природного сырья (такого, например, как боярышник кроваво-красный, рябина черноплодная, прополис). Фенолокислоты является основным компонентом (55—85 %) остатка от перегонки древесной смолы пек древесный.
Нередко для получения фенолокислот применяют синтетические способы. В частности, 2-оксибензойную (салициловую) кислоту добывают из фенолята натрия и углекислого газа в автоклавах при 180 °C с последующей обработкой продукта реакции соляной кислотой синтез Кольбе:
C6H5ONa + С02 180 С → С6Н4 ( ONa ) COOH ; С6Н4 ( ONa ) COOH + НС1 → С6Н4 ( ОН ) СООН + NaCl
Фенолокислоты одновременно обладают свойствами карбоновых кислот и фенолов. Кроме того, для них характерны свойства, обусловленные наличием в молекуле обоих видов функциональных групп и бензольного ядра.
Разложение при нагревании[править | править код]
Фенолокислоты при нагревании разлагаются с образованием фенольных соединений и углекислого газа. Например, при нагревании салициловая кислота разлагается на фенол и углекислый газ:
НОС6Н4СООН → С6Н5ОН + СО2 салициловая кислота фенол углекислый газ
Галловая кислота при нагревании теряет карбоксильную группу и превращается в трехатомный фенол — пирогаллол.
Реакция этерификации (по карбоксильной группе)[править | править код]
Фенолокислоты как и карбоновые кислоты, благодаря наличию карбоксильной и гидроксильной групп способны образовывать эфиры.
Например, образование эфира салициловой кислоты — ацетилсалициловой кислоты:
НОС6Н4СООН + Н3С-С(=О)-О-(О=)С-СН3 → С6Н4(СООН)-О-СО-СН3 + СН3СООН салициловая кислота уксусный эфир ацетилсалициловая кислота уксусная кислота
и образовании эфира галловой кислоты одна молекула галловой кислоты реагирует своим карбоксилом, другая — фенильным гидроксилом. Китайский танин является глюкозидом дигалловой кислоты и глюкозы.
Образование солей[править | править код]
Фенолокислоты, как и карбоновые кислоты, образуют соли. Например, образование салицилата натрия при взаимодействии салициловой кислоты и едкого натрия:
НОС6Н4СООН + NaOH → НОС6Н4СООNa + Н2О салициловая кислота салицилат натрия
Реакция с хлоридом железа(III)(по фенольной группе)[править | править код]
Нередко возникает необходимость в выявлении наличия салициловой кислоты и других фенолокислот в консервированных продуктах. Тогда в пробирку помещают 2—3 мл исследуемого раствора и добавляют несколько капель 1 % раствора хлорида железа(III). Возникает фиолетовая окраска. В отличие от фенола, она может появиться и в спиртовом растворе кислоты. Окраска возникает в результате образования комплексных солей при взаимодействии фенольных групп шести молекул фенолокислоты с молекулой FeCl3.
Галловая кислота легко взаимодействует с хлоридом железа(III) и образует продукт реакции сине-чёрного цвета (чернила).
Реакция нуклеофильного замещения с галогенами[править | править код]
Наличие в молекуле фенолокислот фенольных групп (-ОН) позволяет им вступать в реакции замещения атомов водорода бензольного ядра на галогены при обычных условиях. Бензойная кислота и обычные ароматические кислоты в такие реакции не вступают.
Например, бромирование салициловой кислоты:
НОС6Н4СООН + Br2 → НО(Br)С6Н3СООН + НОС6Н3(Br)СООН + 2НBr салициловая кислота п-бромсалицилова кислота о-бромсалицилова кислота
Фенол]]ьная группа в молекуле салициловой кислоты действует как заместитель первого рода — направляет атомные группы и отдельные атомы на замещение атомом водорода бензольного ядра в о- и п-положении относительно себя.
Типичные представители и их производные, использование фенолокислот в медицине и промышленности[править | править код]
2-оксибензойная или салициловая кислота — типичная фенолокислотa, её иногда называют оксибензойной кислотой НОС6Н4СООН. Соли и эфиры салициловой кислоты — салицилаты. Впервые была добыта с эфиров, содержащихся в тканях некоторых растений, — гаультеровои эфирного масла Gaultheria procumbers. Салициловая кислота — твердое кристаллическое вещество. Обладает бактерицидным действием . Её соли и эфиры широко используют в медицине и ветеринарии как лекарственные препараты. Салициловую кислоту широко используют для производства лекарственных средств (например, ацетилсалициловой кислоты, фенилсалицилата), протравных красителей, фунгицидов (например, салициланилида), пахучих веществ (метилсалицилат, бензилсалицилат), антисептиков в пищевой промышленности, при консервировании, как реагент для колориметрического определения в растворах железа и меди, как кислотно — основной индикатор при люминесцентном анализе (при рН = 2,5…4,6 и при наличии кислоты появляется синяя люминесценция) и т. д.
3,4,5-триоксибензойная, или галловая кислота — фенолокислота, содержащая в составе молекулы одну карбоксильную (-СООН) и три гидроксильные (-ОН) группы. Имеет вяжущий вкус и является составной частью молекул дубильных веществ, в частности главного из них — таннина, которого много в коре дуба и особенно в чернильных орешках. В состав молекулы таннина галловая кислота входит в виде дигалловои кислоты, которая является эфиром, образованным двумя молекулами галловой кислоты.
Таннин — аморфный порошок желтоватого цвета, хорошо растворяется в воде, сильно вяжущий на вкус. В медицине и ветеринарии его используют как вяжущий препарат. Он используется также в кожевенной промышленности для дубления кож и меховых изделий. В химическом анализе его применяют как алкалоидный реактив.
Салицилат натрия — кристаллическое вещество, соль салициловой кислоты, хорошо растворяется в воде и органических растворителях, используется в медицине и ветеринарии как противоревматическое и жаропонижающее средство, сырье для получения других лекарственных средств.
Ацетилсалициловая кислота — белое кристаллическое вещество, эфир салициловой кислоты. Применяется в медицине и ветеринарии как жаропонижающее, противовоспалительное, антиревматическое и антиневралгическое средство. В тканях организма происходит постепенный гидролиз ацетилсалициловой кислоты, с образованием салициловой и ацетатной кислот, что и лежит в основе механизма действия медикамента.
Фенилсалицилат или салол (мусолим) НОС6Н4(СО)ОС6Н5, — кристаллическое вещество, производное салициловой кислоты. Используется в медицине и ветеринарии как дезинфицирующее средство при лечении некоторых кишечных заболеваний, а также при суставном ревматизме.
Оксикислоты
Тюкавкин Н. А. Биоорганическая химия. — М., 2004
2. Образование фенолятов
Фенолы, так же, как и алифатические спирты, обладают кислыми свойствами, т.е. способны образовывать соли – феноляты. Однако они более сильные кислоты и поэтому могут взаимодействовать не только со щелочными металлами (натрий, литий, калий), но и со щелочами и карбонатами:
фенол фенолят натрия
Фенол – очень слабая кислота (рКа=9,98), поэтому феноляты разлагаются не только сильными кислотами, но даже такой слабой кислотой, как угольная кислота (рКа=6,37):
С6Н5 – ОNa + HCl → С6Н5 – ОH + NaCl
С6Н5 – ОNa + CO2 + H2O → С6Н5 – ОH + NaHCO3
С растворами хлорида железа FeCl3 фенол образует комплексные соединения – феноляты железа, имеющие фиолетовую окраску (крезолы – голубая окраска).
Реакция с FeCl3 – качественная реакция на фенолы.
3. Образование простых эфиров
Фенолы более слабые нуклеофилы, чем спирты алифатического ряда. Это объясняется эффектом р,π-сопряжения неподеленной электронной пары кислорода с бензольным кольцом.
Поэтому алкилированию подвергают не сами фенолы, а феноляты.
В качестве алкилирующих агентов используют галогеналканы, алкилсульфаты и спирты.
Реакция протекает по механизму нуклеофильного замещения при насыщенном углеродном атоме: SN2:
фенолят натрия метилфениловый эфир
анизол
4. Образование сложных эфиров
Фенолы как слабые нуклеофилы с трудом реагируют с карбоновыми кислотами.
Ацилирование фенолов легко осуществляется действием галоген-ангидридов и ангидридов карбоновых кислот в присутствии щелочей:
2. Нуклеофильное замещение гидроксильной группы
1. Замещение фенольного гидроксила галогеном
Гидроксильная группа в фенолах с большим трудом замещается галогеном.
При взаимодействии фенола с пентахлоридом фосфора PCl5 основным продуктом является трифенилфосфат и лишь в небольших количествах образуется хлорбензол:
трифенилфосфат хлорбензол
Присутствие электроноакцепторных заместителей в орто- и пара-положениях по отношению к гидроксилу намного облегчает реакции нуклеофильного замещения группы ОН.
Так, пикриновая кислота в тех же условиях легко превращается в 2,4,6-тринитрохлорбензол (пикрилхлорид):
пикриновая кислота пикрилхлорид
2. Взаимодействие с аммиаком
При взаимодействии с аммиаком при повышенной температуре и давлении в присутствии катализатора хлорида алюминия происходит замещение ОН-группы на NH2-группу с образованием анилина:
фенол анилин
3. Восстановление фенола
При восстановлении фенола алюмогидридом лития образуется бензол:
3. Реакции с участием бензольного кольца
1. Реакции электрофильного замещения в бензольном кольце
Гидроксильная группа является заместителем 1 рода, поэтому реакции электрофильного замещения в бензольном ядре протекают с фенолами значительно легче, чем с бензолом, а заместители направляются в орто- и пара-положения.
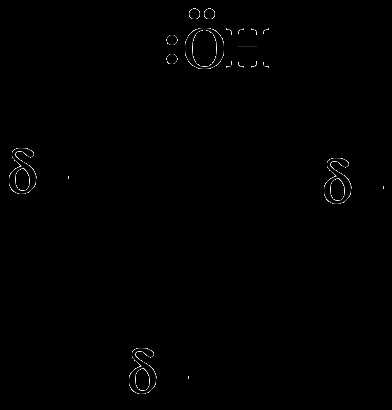 1) Реакции галогенирования
1) Реакции галогенирования
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола:
2,4,6-трибромфенол
Эта реакция является качественной на фенолы.
Легко происходит хлорирование фенола:
2) Реакции нитрования
Фенол легко нитруется разбавленной азотной кислотой при температуре 00С с образованием смеси орто- и пара-изомеров с преобладанием орто-изомера:
 орто- и пара-нитрофенолы
орто- и пара-нитрофенолы
Изомерные нитрофенолы легко разделяются благодаря тому, что только орто-изомер обладает летучестью с водяным паром.
Большая летучесть орто-нитрофенолов объясняется образованием внутримолекулярной водородной связи, в то время как пара-изомер образует межмолекулярные водородные связи:
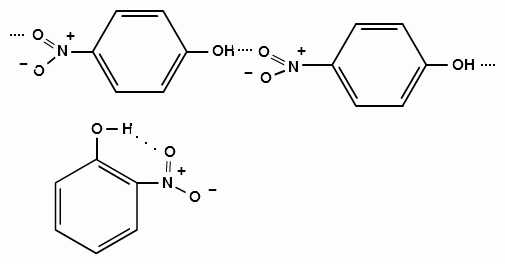
При использовании концентрированной азотной кислоты образуется 2,4,6-тринитрофенол (пикриновая кислота):
пикриновая кислота
Фенолы, подготовка к ЕГЭ по химии
Фенолы - кислородсодержащие ароматические соединения, в молекулах которых содержится одна или несколько гидроксильных групп (OH), присоединенных к бензольному кольцу.
Номенклатура фенолов
Нумерацию атомов углерода в молекуле фенола начинают в такой последовательности, чтобы заместители получили наименьшие номера (идут кратчайшим путем). В основе названия принято сохранять тривиальное название "фенол".
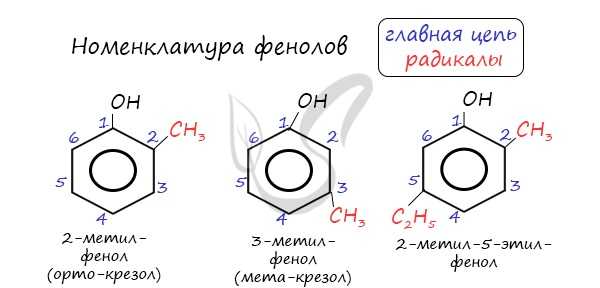
Напомню, что гидроксильная группа является ориентантом I порядка (орто-, пара-ориентант). Поэтому реакции галогенирования, нитрования протекают в орто- и пара-положениях.
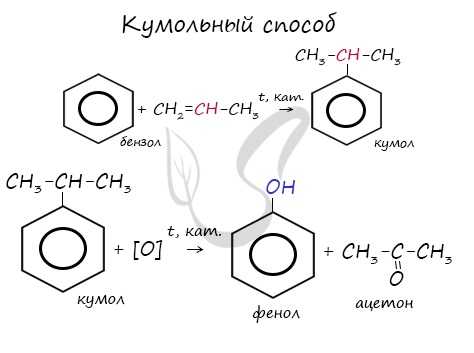
Получение фенолов
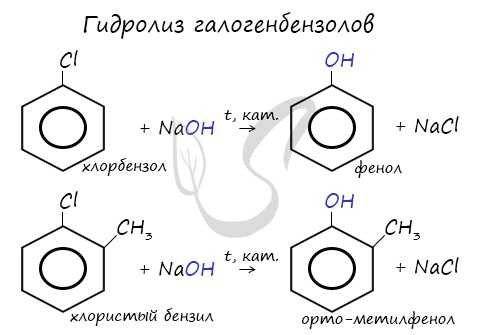
- Гидролиз галогенбензолов
- Кумольный способ
При гидролизе галогенбензолов происходит обмен: гидроксогруппа встает на место атома галогена.
Этим способом получают 95% всего производимого фенола. В ходе этой реакции кумол (изопропилбензол) подвергают окислению, в результате получается фенол и ацетон.
Химические свойства фенолов
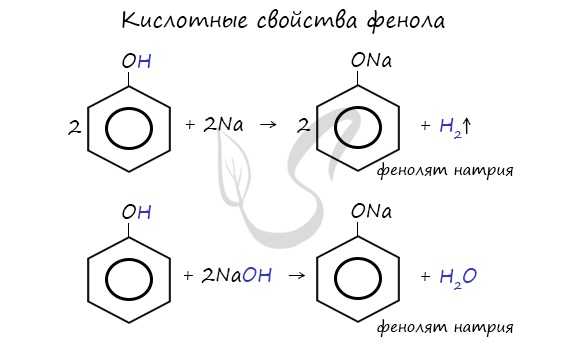
- Кислотные свойства
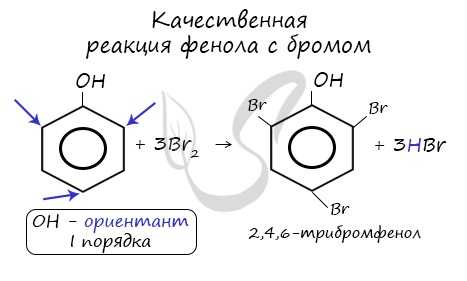
- Галогенирование
- Реакции с кислотами
- Гидрирование
- Поликонденсация фенолов с формальдегидом
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей - фенолятов. В отличие от алифатических одноатомных спиртов, фенолы способны вступать в реакцию с щелочами (KOH, LiOH, NaOH)
Реакция фенола с бромной водой является качественной: в ходе нее выпадает белая взвесь - осадок трибромфенола.
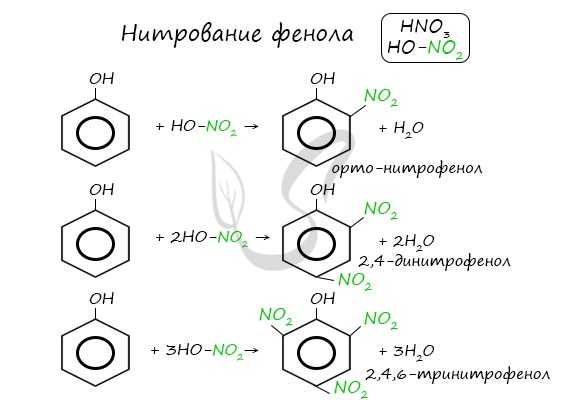
Реакция между фенолом и азотной кислотой происходит по типу замещения. В бензольном кольце появляется новый радикал - нитрогруппа. Важно учитывать, что OH группа фенола является ориентантом I порядка: замещение идет в орто-, пара-положении.
При гидрировании разрываются двойные связи бензольного кольца, образуется циклогексанол.
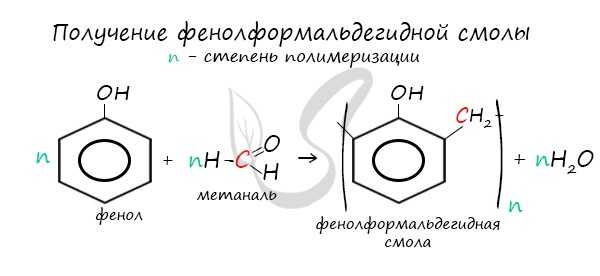
В промышленности получила широкое распространение реакция поликонденсации фенола с формальдегидом, приводящая к образованию смолообразных полимеров (фенолформальдегидные смолы) и воды.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Фенол (гидроксибензол, карболовая кислота)
 Фенол (гидроксибензол, карболовая кислота) – это органическое соединение ароматического ряда с формулой C6H5OH. Относится к одноименному классу – фенолы.
Фенол (гидроксибензол, карболовая кислота) – это органическое соединение ароматического ряда с формулой C6H5OH. Относится к одноименному классу – фенолы.
В свою очередь, Фено́лы — это класс органических соединений ароматического ряда, в молекулах которых гидроксильные группы OH− связаны с атомами углерода ароматического кольца.
По числу гидроксильных групп различают :
- одноатомные фенолы (аренолы): фенол и его гомологи;
- двухатомные фенолы (арендиолы): пирокатехин, резорцин, гидрохинон;
- трёхатомные фенолы (арентриолы): пирогаллол, гидроксигидрохинон, флороглюцин;
- многоатомные фенолы.
 Соответственно, собственно фенол, как вещество, представляет собой простейший представитель группы фенолов и имеет одно ароматическое ядро и одну гидроксильную группу ОН.
Соответственно, собственно фенол, как вещество, представляет собой простейший представитель группы фенолов и имеет одно ароматическое ядро и одну гидроксильную группу ОН.
Свойства фенола
Свежеперегнанный фенол представляет собой бесцветные игольчатые кристаллы с температурой плавления 41 °С и температурой кипения 182 °С. При хранении, особенно во влажной атмосфере и в присутствии небольших количеств солей железа и меди, он быстро приобретает красную окраску. Фенол смешивается в любых соотношениях со спиртом, водой (при нагревании свыше 60 °С), хорошо растворим в эфире, хлороформе, глицерине, сероуглероде.
Из-за наличия -OH гидроксильной группы, фенол имеет химические свойства характерные для спиртов, так и ароматических углеводородов.
По гидроксильной группе фенол вступает в следующие реакции:
- Так как фенол обладает немного более сильными кислотными свойствами, чем у спирты, то под воздействием щелочей он образует соли — феноляты (к примеру, фенолят натрия — C6H5ONa):
C6H5OH + NaOH -> C6H5ONa + H2O
- В результате взаимодействия фенола с металлическим натрием также получается фенолят натрия:
2C6H5OH + 2Na -> 2C6H5ONa + H2
- Фенол непосредственно не этерифицируется карбоновыми кислотами, получение эфиров осуществляют путем взаимодействия фенолятов с ангидридами или галогенангидридами кислот:
C6H5OH + CH3COOH -> C6H5OCOCH3 + NaCl
- При перегонке фенола с цинковой пылью идет реакция замещения гидроксильной группы водородом:
C6H5OH + Zn -> C6H6 + ZnO
Реакции фенола по ароматическому кольцу:
- Фенол вступает в реакции электрофильного замещения по ароматическому кольцу. Группа ОН, являясь одной из самых сильных донорных групп (вследствие уменьшении электронной плотности на функциональной группе), увеличивает реакционную способность кольца к этим реакциям и направляет замещение в орто- и пара-положения. Фенол легко алкилируется, ацилируется, галогенируется, нитруется и сульфируется.
- Реакция Кольбе — Шмитта служит для синтеза салициловой кислоты и её производных (ацетилсалициловой кислоты и других).
C6H5OH + CO2 –NaOH-> C6H4OH(COONa)
C6H4OH(COONa) –h3SO4-> C6H4OH(COOH)
Качественные реакции на фенол:
- В результате взаимодействия с бромной водой:
C6H5OH + 3Br2 -> C6H2Br3OH +3HBr
-
- образуется 2,4,6-трибромфенол — твёрдое вещество белого цвета.
- С концентрированной азотной кислотой:
C6H5OH + 3HNO3 -> C6H2(NO2)3OH + 3H2O
- С хлоридом железа(III) (качественная реакция на фенол):
C6H5OH + FeCl3 -> ⌈Fe(C6H5OH)6⌉Cl3
Реакция присоединения
- Гидрированием фенола в присутствии металлических катализаторов Pt/Pd, Pd/Ni, получают циклогексиловый спирт:
C6H5OH -> C6H11OH
Окисление фенола
Вследствие наличия гидроксильной группы в молекуле фенола, устойчивость к окислению много ниже нежели, чем у бензола. В зависимости от природы окислителя и условия проведения реакции получаются различные продукты.
- Так под действием перекиси водорода в присутствии железного катализатора образуется небольшое количество двухатомного фенола — пирокатехина:
C6H5OH + 2H2O2 – Fe> C6H4(OH)2
- При взаимодействии более сильных окислителей (хромовая смесь, диоксид марганца в кислой среде) образуется пара-хинон.
Получение фенола
Получают фенол из каменноугольной смолы (продукта коксования) и синтетическим путем.
В каменноугольной смоле коксохимического производства содержится от 0,01 до 0,1% фенолов, в продуктах полукоксования от 0,5 до 0,7%; в масле, образующемся при гидрогенизации, и в сточной воде, вместе взятых,— от 0,8 до 3,7%. В смоле бурого угля и сточных водах полукоксования содержится от 0,1 до 0,4% фенолов. Каменноугольную смолу перегоняют, отбирая фенольную фракцию, выкипающую при 160—250 °С. В состав фенольной фракции входят фенол и его гомологи (25—40%), нафталин (25—40%) и органические основания (пиридин, хинолин). Нафталин отделяют фильтрованием, а оставшуюся часть фракции обрабатывают 10—14%-ным раствором едкого натра.
Образовавшиеся феноляты отделяют от нейтральных масел и пиридиновых оснований путем продувки острым паром, а затем обрабатывают диоксидом углерода. Выделенные сырые фенолы подвергают ректификации, отбирая последовательно фенол, крезолы и ксиленолы.
Большая часть фенола, производимого в настоящее время в промышленном масштабе, получается различными синтетическими методами
Синтетические методы получения фенола
- По бензолсульфонатному методу бензол смешивают с купоросным маслом. Полученный продукт обрабатывают содой и получают натриевую соль бензолсульфокислоты, после чего раствор упаривают, отделяют выпавший сульфат натрия, а натриевую соль бензолсульфокислоты сплавляют со щелочью. Образовавшийся фенолят натрия либо насыщайте диоксидом углерода, либо добавляют серную кислоту до начала выделения диоксида серы и отгоняют фенол.
- Хлорбензольный метод заключается в прямом хлорировании бензола газообразным хлором в присутствии железа или его солей и омылении образующегося хлорбензола раствором едкого натра или при гидролизе в присутствии катализатора.
- Модифицированный метод Рашига основан на окислительном хлорировании бензола хлористым водородом и воздухом с последующим гидролизом хлорбензола и выделением фенола перегонкой.
- Кумольный метод заключается в алкилировании бензола, окислении полученного изопропилбензола в гидропероксид кумола и последующем разложении его на фенол и ацетон:
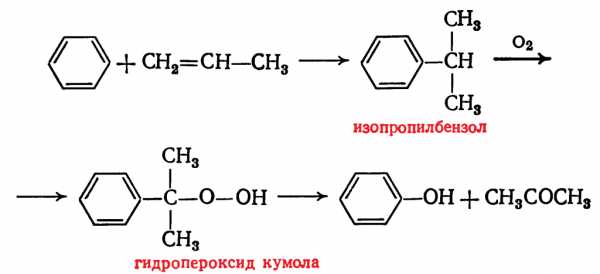 Изопропилбензол получают действием на бензол чистого пропилена или пропан-пропиленовой фракции нефтекрекинга, очищенной от других ненасыщенных соединений, влаги, меркаптанов и сероводорода, отравляющих катализатор. В качестве катализатора используют трихлорид алюминия, растворенный в полиалкилбензоле, например. в диизопропилбензоле. Алкилирование ведут при 85 °С и избыточном давлении 0,5 МПа, что обеспечивает протекание процесса в жидкой фазе. Изопропилбензол окисляют в гидропероксид кислородом воздуха или техническим кислородом при 110—130°С в присутствии солей металлов переменной валентности (железо, никель, кобальт, марганец) Разлагают гидропероксид разбавленными кислотами (серной или фосфорной) или небольшими количествами концентрированной серной кислоты при 30—60 °С. После ректификации получают фенол, ацетон и некоторое количество α-метилстирола. Промышленный кумольный метод, разработанный в СССР, является экономически наиболее выгодным по сравнению с другими методами получения фенола. Получение фенола через бензолсульфокислоту связано с расходованием больших количеств хлора и щелочи. Окислительное хлорирование бензола связано с большим расходом пара—в 3—6 раз большим, чем при применении других методов; кроме того, при хлорировании происходит сильная коррозия аппаратуры, что требует применения специальных материалов. Кумольный метод прост по аппаратурному оформлению и позволяет получать одновременно два технически ценных продукта: фенол и ацетон.
Изопропилбензол получают действием на бензол чистого пропилена или пропан-пропиленовой фракции нефтекрекинга, очищенной от других ненасыщенных соединений, влаги, меркаптанов и сероводорода, отравляющих катализатор. В качестве катализатора используют трихлорид алюминия, растворенный в полиалкилбензоле, например. в диизопропилбензоле. Алкилирование ведут при 85 °С и избыточном давлении 0,5 МПа, что обеспечивает протекание процесса в жидкой фазе. Изопропилбензол окисляют в гидропероксид кислородом воздуха или техническим кислородом при 110—130°С в присутствии солей металлов переменной валентности (железо, никель, кобальт, марганец) Разлагают гидропероксид разбавленными кислотами (серной или фосфорной) или небольшими количествами концентрированной серной кислоты при 30—60 °С. После ректификации получают фенол, ацетон и некоторое количество α-метилстирола. Промышленный кумольный метод, разработанный в СССР, является экономически наиболее выгодным по сравнению с другими методами получения фенола. Получение фенола через бензолсульфокислоту связано с расходованием больших количеств хлора и щелочи. Окислительное хлорирование бензола связано с большим расходом пара—в 3—6 раз большим, чем при применении других методов; кроме того, при хлорировании происходит сильная коррозия аппаратуры, что требует применения специальных материалов. Кумольный метод прост по аппаратурному оформлению и позволяет получать одновременно два технически ценных продукта: фенол и ацетон. - При окислительном декарбоксилировании бензойной кислоты сначала проводят жидкофазное каталитическое окисление толуола в бензойную кислоту, которая в присутствии Сu2+ превращается в бензолсалициловую кислоту. Этот процесс может быть описан следующей схемой: Бензоилсалициловая кислота разлагается водяным паром на салициловую и бензойные кислоты. Фенол образуется в результате быстрого декарбоксилирования салициловой кислоты.
Применение фенола
Фенол используют как сырье для производства полимеров: поликарбоната и эпоксидных смол (сначала синтезируют бисфенол А, а затем – эти полимеры), фенолфольмальдегидных смол, циклогексанола (с последующим получением нейлона и капрона).
В процессе нефтепереработки при помощи фенола проводят очистку масел от смолистых веществ, серосодержащих соединений и полициклических ароматических углеводородов.
Кроме того, фенол служит сырьем для производства ионола, неонолов (ПАВ), креозолов, аспирина, антисептиков и пестицидов.
Фенол хороший консервант и антисептик. Его используют для дезинфекции в животноводстве, в медицине, в косметологии.
Токсические свойства фенола
Фенол токсичен (класс опасности II). При вдыхании фенола нарушаются функций нервной системы. Пыль, пары и раствор фенола при попадании на слизистые оболочки глаз, дыхательных путей, кожу, вызывают химические ожоги. При попадании на кожу фенол всасывается в течение нескольких минут и начинает воздействовать на ЦНС. В больших дозах может вызывать паралич дыхательного центра.Смертельная доза для человека при попадании внутрь 1—10 г, для детей 0,05—0,5 г.
Проект по химии "Фенолы"
Муниципальное бюджетное общеобразовательное учреждение средняя общеобразовательная школа с. Хмелинец Задонского муниципального района Липецкой области
Проектно-исследовательская работа
Фенолы: свойства, применение, вред
Выполнила
ученица 11 класса
Братищева Анна
Учитель химии
Воронина Г.Д.
Хмелинец-2013
Тема работы: свойства, применение и вред класса фенолов.
Актуальность: с развитием науки химия все прочно и прочно укрепляется в нашей жизни. Особое место в ней занимает такой класс веществ как фенолы. Их значение невозможно переоценить, потому как сфера их влияния очень широка. Поэтому необходимо знать, с какими веществами мы сталкиваемся каждый день, какова опасность отравления ими и как обезопасить себя от негативного влияния этих веществ.
Объект: класс фенолов
Предмет: характерные свойства и применение
Цель: доказать значимость фенолов в быту и промышленности
Задачи: 1) дать определение классу фенолов;
2) рассмотреть номенклатуру и изомерию;
3) изучить классификацию фенолов;
4) проанализировать строение молекулы;
5) выявить физические свойства;
6) выделить химические свойства;
7) описать основные методы синтеза фенола;
8) установить сферы применения данного класса веществ;
9) определить вред фенолов для здоровья человека и экологии;
10) описать симптомы отравления и оказание первой помощи.
Гипотеза: благодаря особенностям строения молекулы и химическим свойствам фенолы незаменимы в науке, производстве, медицине и повседневной жизни.
1. Класс фенолы.
Фенолы – это производные ароматических углеводородов, молекулы которых содержат одну или несколько гидроксильных групп, непосредственно соединенных с бензольным кольцом.
Название этого класса соединений происходит от греческого слова «фено» - «несущий свет». Для бензола, впервые выделенного М.Фарадеем в 1825 году из светильного газа, было предложено два названия бензол и «фено», отражающее его происхождение из светильного газа. Общепринятым стало название бензол, a другое название было использовано для обозначения радикала С6Н5.
Первый представитель гомологического ряда фенолов - окси-бензол C6H5OH называют обычно просто бензолом или карболовой кислотой.
2. Изомерия и номенклатура фенолов
Возможны 2 типа изомерии:
изомерия положения заместителей в бензольном кольце
изомерия боковой цепи (строения алкильного радикала и числа радикалов)
Для фенолов широко используют тривиальные названия, сложившиеся исторически. В названиях замещенных моноядерных фенолов используются также приставки орто-, мета- и пара -, употребляемые в номенклатуре ароматических соединений. Для более сложных соединений нумеруют атомы, входящие в состав ароматических циклов и с помощью цифровых индексов указывают положение заместителей.
3. Классификация
Различают одно-, двух-, трехатомные фенолы в зависимости от количества ОН-групп в молекуле:
В соответствии с количеством конденсированных ароматических циклов в молекуле различают сами фенолы (одно ароматическое ядро – производные бензола), нафтолы (2 конденсированных ядра – производные нафталина), антранолы (3 конденсированных ядра – производные антрацена) и фенантролы:

4. Строение молекулы
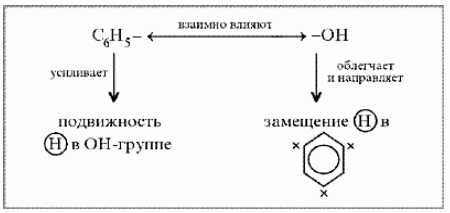
Фенильная группа C6H5 – и гидроксил –ОН взаимно влияют друг на друга.
Неподеленная электронная пара атома кислорода притягивается 6-ти электронным облаком бензольного кольца, из – за чего связь О–Н еще сильнее поляризуется. Фенол - более сильная кислота, чем вода и спирты.
В бензольном кольце нарушается симметричность электронного облака, электронная плотность повышается в положении 2, 4, 6. Это делает более реакционноспособными связи С-Н в положениях 2, 4, 6. и – связи бензольного кольца.
5. Физические свойства
Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления.
Фенол C6H5OH (карболовая кислота) — бесцветное кристаллическое вещество на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком.
6. Химические свойства
I. Свойства гидроксильной группы
Кислотные свойства – выражены ярче, чем у предельных спиртов (окраску индикаторов не меняют):
· С активными металлами-
2C6H5-OH + 2Na → 2C6H5-ONa + h3
фенолят натрия
· Со щелочами -
C6H5-OH + NaOH (водн. р-р) ↔ C6H5-ONa + h3O
! Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой –
C6H5-ONa + h3O + СO2 → C6H5-OH + NaHCO3
По кислотным свойствам фенол превосходит этанол в 106 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2-, Br-)
C6H5-OH< п-нитрофенол < 2,4,6-тринитрофенол
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной
II. Свойства бензольного кольца
1). Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы (см. выше), но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара-положениях (+М-эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Нитрование. Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов:
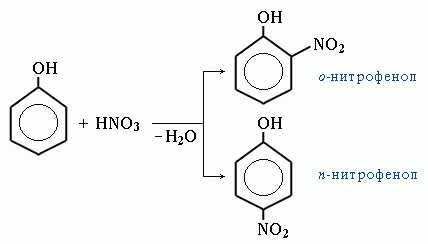
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
Галогенирование. Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол):
Конденсация с альдегидами. Например:
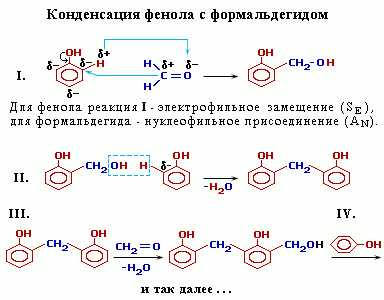
Фенолформальдегидные смолы
2). Гидрирование фенола
C6H5-OH + 3h3 Ni, 170ºC → C6h21 – OH циклогексиловый спирт (циклогексанол)
III. Качественная реакция - обнаружение фенола
6C6H5-OH + FeCl3 → [Fe(C6H5-OH)3](C6H5O)3 + 3HCl
светло- фиолетовый раствор
жёлтый
раствор
7. Синтез фенола
1. Получение из галогенбензолов. При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, при дальнейшей обработке которого кислотой образуется фенол:
С6Н5―Сl + 2NaOH → C6H5―ONa + NaCl + Н2О.
2. При каталитическом окислении изопропилбензола (кумола) кислородом воздуха образуются фенол и ацетон:
Это — основной промышленный способ получения фенола.
3. Получение из ароматических сульфокислот. Реакция проводится при сплавлении сульфокислот с щелочами. Первоначально образующиеся феноксиды обрабатывают сильными кислотами для получения свободных фенолов. Метод обычно применяют для получения многоатомных фенолов:
8. Сферы применения
Разбавленные водные растворы фенола (карболка (5%)) применяют для дезинфекции помещений, белья. Являясь антисептиком, широко применялся в европейской и американской медицине в период 2 мировой войны, но из-за высокой токсичности в настоящее время использование сильно ограничено.
Раствор фенола используют в качестве дезинфицирующего средства (карболовая кислота). Двухатомные фенолы – пирокатехин, резорцин (рис. 3), а также гидрохинон (пара-дигидроксибензол) применяют как антисептики (антибактериальные обеззараживающие вещества), вводят в состав дубителей для кожи и меха, как стабилизаторы смазочных масел и резины, а также для обработки фотоматериалов и как реагенты в аналитической химии.
В виде отдельных соединений фенолы используются ограниченно, зато их различные производные применяют широко. Фенолы служат исходными соединениями для получения разнообразных полимерных продуктов – феноло-альдегидных смол (рис. 7), полиамидов, полиэпоксидов.
На основе фенолов получают многочисленные лекарственные препараты, например, аспирин, салол, фенолфталеин, кроме того, красители, парфюмерные продукты, пластификаторы для полимеров и средства защиты растений.
Широко используется в молекулярной биологии и генной инженерии для очистки ДНК. В смеси с хлороформом ранее использовался для выделения ДНК из клетки.
В настоящее время можно выделить несколько основных направлений использования фенола. Один из них – производство лекарственных средств.
Большинство этих лекарств — производные получаемой из фенола салициловой кислоты: o-HOC6h5COOH. Самое распространенное жаропонижающее — аспирин не что иное, как ацетилсалициловая кислота. Эфир салициловой кислоты и самого фенола тоже хорошо известен под названием салол.
При лечении туберкулеза применяют парааминосалициловую кислоту (сокращенно ПАСК) . Ну и, наконец, при конденсации фенола с фталевым ангидридом получается фенолфталеин, он же пурген.
9. Вред фенолов
Опасность фенола для здоровья человека заключается в том, что он оказывает негативное воздействие на нервную систему. Фенольные пары и пыль, а также раствор фенола, раздражают глаза, слизистые оболочки дыхательных путей, а также кожные покровы. Если фенол попадает в организм, то его всасывание происходит в считанные секунды даже в случае его прохождения через те участки кожи, которые не повреждены.
Буквально через несколько минут после попадания в организм, фенол оказывает паралитическое воздействие на головной мозг человека, а именно – на ткани головного мозга. Первые симптомы отравления фенолом – недолго длящееся возбуждение, после чего наступает паралич дыхательного центра организма. Следует отметить, что попадая в организм даже в минимальном количестве, фенол может вызвать кашель, сильную головную боль, тошноту и общую слабость. Что касается тяжелых случаев отравления этим веществом, то его характерными признаками являются потеря сознания, затруднение дыхания, омертвение роговицы глаза и также сокращением частоты пульса, судорогами и холодным потом.
Доказано, что фенол благоприятствует развитию онкологических заболеваний. К примеру, достаточно часты и документально зарегистрированы случаи частых онкологических заболеваний среди жильцов домов, в материале которых использовалось это вещество.
Сегодня фенол является одним из наиболее опасных для здоровья человека веществ, и, к сожалению, достаточно широко распространенным. Для того, чтобы избежать негативного воздействия фенола на организм и отравления этим материалом, следует свести возможность контакта с ним к минимуму.
При приобретении строительных и отделочных материалов рекомендуется внимательно ознакомиться с их составом – как правило, вероятность наличия фенола особенно высока у материалов, изготовленных на основе полимеров. Рекомендуется выбирать только качественные строительные материалы, избегая подозрительно дешевой продукции. Практически всегда низкая цена свидетельствует о низком качестве продукции, и, как следствие, о том, что в ее составе содержатся вредные вещества. Кроме того, следует обращать внимание и на марку производителя: известные фабрики всегда имеют экологические сертификаты и изготавливают свою продукцию в соответствии с самыми современными требованиями к ее безопасности для здоровья человека. Таким образом, приобретая отделочные или строительные материалы от известных производителей, можно быть уверенным в том, что приобретается экологически чистый и безопасный материал, в составе которого нет вредных веществ, в том числе, и фенола.
10. Симптомы отравления фенолом и первая помощь
При остром отравлении, сопровождающем попадание фенола на кожу или вдыхание его паров, наблюдается сильное жжение в местах, подвергшихся его непосредственному воздействию. Проявляются ожоги слизистых тканей; возникает сильная боль в области рта, в глотке, животе; тошнота, рвота, понос; резкая бледность, слабость, отек легких; возможны острые аллергические проявления; артериальное давление понижено; развивается сердечно-легочная недостаточность, возможны судороги; моча бурая, быстро темнеет на воздухе.
Первая помощь – снять одежду (желательно сразу под душем), промыть пораженное место большим количеством воды. Прикрыть места ожогов фенолом чистой белой тканью. Если брызги фенола попали в глаза, необходимо обильно промывать их водой не менее 15 минут. Промыть желудок водой, внутрь дать активированный уголь. Спирт и вазелиновое масло противопоказаны. Во время стационарного лечения больному даются обволакивающие средства и анальгетики, подается О2 с обеспечением адекватной вентиляции легких, производится коррекция водноэлектролитного баланса.
Хроническое отравление фенолом приводит к анорексии – прогрессирующей потере веса; вызывает диарею, головокружение, трудности при глотании, обильное отделение слюны. При хроническом отравлении фенолами отмечено темное окрашивание мочи. Ученые, исследовавшие последствия фенольных отравлений указывают, что в результате длительного пребывания под воздействием фенола человек может чувствовать боли в мышцах, слабость. Печень у таких людей увеличена. Хроническое отравление фенолом вызывает поражения центральной нервной системы, нервные расстройства, сопровождаемые головными болями и потерей сознания, а также поражения почек, печени, органов дыхания и сердечно-сосудистой системы.
По сообщению Управления по охране окружающей среды США (EPA), максимальная доза фенола, которая условно безопасна при попадании внутрь организма человека, составляет 0,6 мг/1 кг живого веса в течение 1 суток. Данная доза рассчитана без учета возможного канцерогенного эффекта фенолов, который способен проявиться спустя достаточно большой период времени. Следует отметить, что указанная величина служит исключительно в качестве точки отсчета: она показывает, что при концентрациях фенола выше данной, вероятность неблагоприятных последствий для здоровья человека резко возрастает. Аналогичным образом EPA устанавливает допустимое содержание фенола в воздухе – оно составляет 0,006 мг/м3.
В нашей стране ПДК фенола в жилой зоне составляет 0,03 мг/м3 (СанПин 2.1.2.1002-00), а в воздухе рабочей зоны – 0,3 мг/ м3.
Запах фенола – сильный и сладковатый – начинает ощущаться, если концентрация фенола в воздухе превышает 0.04 ppm (0.000004%)
Хроническое отравление фенолом угрожает не только жителям «фенольных домов». Недобросовестные изготовители мебели, строительных и отделочных материалов, лакокрасочных изделий, декоративной косметики и даже детских игрушек могут пренебречь требованиями безопасности и выпускать продукцию с недопустимо высоким содержанием таких токсичных веществ, как фенолы и производные.
Помните, если вас настораживает неприятный запах недавно приобретенной вещи, если вам кажется, что ваше здоровье после покупки мебели или недавнего ремонта пошатнулось, будет лучше вызвать специалиста-эколога, который проведет все нужные исследования и даст необходимые рекомендации, чем пребывать в тревоге и сомнениях, опасаясь за свое здоровье и здоровье своих близких.
Выводы: 1) мы дали определение классу фенолов;
2) рассмотрели номенклатуру и изомерию;
3) изучили классификацию фенолов;
4) проанализировали строение молекулы;
5) выявили физические свойства;
6) выделили химические свойства;
7) описали основные методы синтеза фенола;
8) установили сферы применения данного класса веществ;
9) определили вред фенолов для здоровья человека и экологии;
10) описали симптомы отравления и оказание первой помощи.
Таким образом, в ходе исследовательской деятельности мы доказали, что благодаря особенностям строения молекулы и химическим свойствам фенолы незаменимы в науке, производстве, медицине и повседневной жизни.