Гидроксид магния реагирует с
Гидроксид магния — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 3 декабря 2017; проверки требуют 5 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 3 декабря 2017; проверки требуют 5 правок.Гидрокси́д ма́гния — неорганическое вещество, осно́вный гидроксид металла магния, имеет формулу Mg(OH)2{\displaystyle {\ce {Mg(OH)2}}}. Слабое малорастворимое основание.
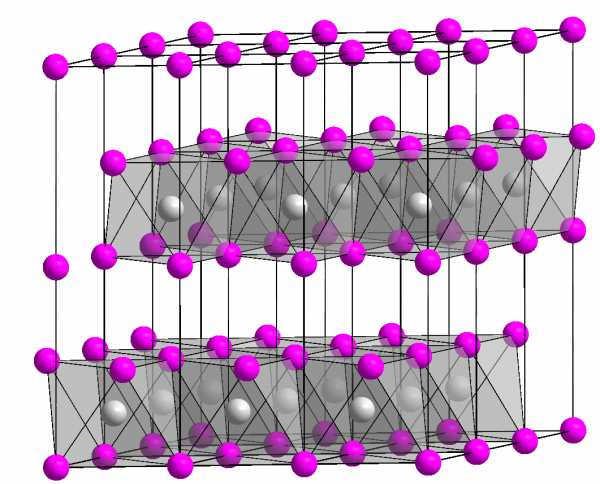
При стандартных условиях гидроксид магния представляет собой аморфное вещество. При температуре выше 350 °C разлагается на оксид магния и воду. Поглощает углекислый газ и воду из воздуха с образованием основного карбоната магния. Гидроксид магния практически нерастворим в воде, но растворим в солях аммония. Является слабым основанием, даже ничтожная его часть, растворившаяся в воде, сообщает раствору слабощелочную реакцию и окрашивает индикаторы, например, фенолфталеин, в розовый цвет. Встречается в природе в виде минерала брусита. [2]
- В общем виде:
Mg2++2 OH−⟶Mg(OH)2↓{\displaystyle {\mathsf {Mg^{2+}+2\ OH^{-}\longrightarrow Mg(OH)_{2}\downarrow }}}
- Примеры:
MgCl2+2NaOH⟶Mg(OH)2↓+2NaCl{\displaystyle {\mathsf {MgCl_{2}+2NaOH\longrightarrow Mg(OH)_{2}\downarrow +2NaCl}}}
Mg(NO3)2+2KOH⟶Mg(OH)2↓+2KNO3{\displaystyle {\mathsf {Mg(NO_{3})_{2}+2KOH\longrightarrow Mg(OH)_{2}\downarrow +2KNO_{3}}}}
MgCl2+CaO⋅MgO+2h3O⟶2Mg(OH)2↓+CaCl2{\displaystyle {\mathsf {MgCl_{2}+CaO\cdot MgO+2H_{2}O\longrightarrow 2Mg(OH)_{2}\downarrow +CaCl_{2}}}}
Mg+2h3O⟶Mg(OH)2↓+h3↑{\displaystyle {\mathsf {Mg+2H_{2}O\longrightarrow Mg(OH)_{2}\downarrow +H_{2}\uparrow }}}
- Как и все слабые основания, гидроксид магния термически неустойчив. Разлагается при нагревании до 350 °C:
Mg(OH)2→ΔTMgO+h3O{\displaystyle {\mathsf {Mg(OH)_{2}{\xrightarrow {\Delta T}}MgO+H_{2}O}}}
Mg(OH)2+2HCl⟶MgCl2+2h3O{\displaystyle {\mathsf {Mg(OH)_{2}+2HCl\longrightarrow MgCl_{2}+2H_{2}O}}}
Mg(OH)2+h3SO4⟶MgSO4+2h3O{\displaystyle {\mathsf {Mg(OH)_{2}+H_{2}SO_{4}\longrightarrow MgSO_{4}+2H_{2}O}}}
Mg(OH)2+SO3⟶MgSO4+h3O{\displaystyle {\mathsf {Mg(OH)_{2}+SO_{3}\longrightarrow MgSO_{4}+H_{2}O}}}
Mg(OH)2+2NaOH⟶Na2[Mg(OH)4]{\displaystyle {\mathsf {Mg(OH)_{2}+2NaOH\longrightarrow Na_{2}[Mg(OH)_{4}]}}}
Mg(OH)2+Sr(OH)2⟶Sr[Mg(OH)4]{\displaystyle {\mathsf {Mg(OH)_{2}+Sr(OH)_{2}\longrightarrow Sr[Mg(OH)_{4}]}}}
Гидроксид магния применяется для связывания диоксида серы, как флокулянт для очистки сточных вод, в качестве огнезащитного средства в термопластических полимерах (полиолефины, ПВХ), как добавка в моющие средства, для получения оксида магния, рафинирования сахара, в качестве компонента зубных паст.
В медицине его применяют в качестве лекарства для нейтрализации кислоты в желудке, а также как очень сильное слабительное.
В Европейском союзе гидроксид магния зарегистрирован в качестве пищевой добавки E528.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2 (Даф-Мед). — 671 с. — ISBN 5-82270-035-5.
Гидроксид магния, характеристика, свойства и получение, химические реакции
Гидроксид магния, характеристика, свойства и получение, химические реакции.
Гидроксид магния – неорганическое вещество, имеет химическую формулу Mg(OH)2.
Краткая характеристика гидроксида магния
Физические свойства гидроксида магния
Получение гидроксида магния
Химические свойства гидроксида магния
Химические реакции гидроксида магния
Применение и использование гидроксида магния
Краткая характеристика гидроксида магния:
Гидроксид магния – неорганическое вещество белого цвета.
Химическая формула гидроксида магния Mg(OH)2.
Практически нерастворим в воде. Является слабым основанием, даже ничтожная его часть, растворившаяся в воде, сообщает раствору слабощелочную реакцию.
Поглощает углекислый газ и воду из воздуха с образованием основного карбоната магния.
Встречается в природе в виде минерала брусита.
Физические свойства гидроксида магния:
| Наименование параметра: | Значение: |
| Химическая формула | Mg(OH)2 |
| Синонимы и названия иностранном языке | magnesium hydroxide (англ.) брусит (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные тригональные кристаллы |
| Цвет | белый, бесцветный |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2344,6 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,3446 |
| Температура разложения, °C | 350 |
| Молярная масса, г/моль | 58,35 |
* Примечание:
— нет данных.
Получение гидроксида магния:
Гидроксид магния получают в результате следующих химических реакций:
- 1. в результате взаимодействия металлического магния с парами воды:
Mg + 2H2O → Mg(OH)2 + H2.
- 2. в результате взаимодействия оксида магния и воды:
MgO + H2O → Mg(OH)2 (t = 100-125 °C).
- 3. в результате взаимодействия растворимых солей магния с щелочью:
MgCl2 + 2NaOH → Mg(OH)2 + 2NaCl,
Mg(NO3)2 + 2KOH → Mg(OH)2 + 2KNO3.
При этом гидроксид магния выпадает в виде осадка.
- 4. в результате взаимодействия хлорида магния с обожженным доломитом:
MgCl2 + CaO·MgO + 2H2O → 2Mg(OH)2 + CaCl2.
При этом гидроксид магния выпадает в виде осадка.
Химические свойства гидроксида магния. Химические реакции гидроксида магния:
Гидроксид магния является основным основанием, т. е. обладает основными свойствами.
Гидроксид магния – слабое малорастворимое основание.
Химические свойства гидроксида магния аналогичны свойствам гидроксидов других основных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида магния с гидроксидом натрия:
Mg(OH)2 + 2NaOH → Na2[Mg(OH)4] (t = 100 °C).
В результате реакции образуется тетрагидроксомагнезиат натрия. В ходе реакции используется насыщенный раствор гидроксида натрия.
2. реакция гидроксида магния с угольной кислотой:
Mg(OH)2 + H2СO3 → MgСO3 + 2H2O.
В результате реакции образуются карбонат магния и вода.
3. реакция гидроксида магния с ортофосфорной кислотой:
Mg(OH)2 + 2H3PO4 → Mg(H2PO4)2 + H2O,
Mg(OH)2 + H3PO4 → MgHPO4 + 2H2O,
3Mg(OH)2 + 2H3PO4 → Mg3(PO4)2 + 6H2O.
В результате реакции образуются в первом случае – дигидроортофосфат магния и вода, во втором – гидроортофосфат магния и вода, в третьем – ортофосфат магния и вода.
4. реакция гидроксида магния с азотной кислотой:
Mg(OH)2 + 2HNO3 → Mg(NO3)2 + 2H2O.
В результате реакции образуются нитрат магния и вода.
Аналогично проходят реакции гидроксида магния и с другими кислотами.
5. реакция гидроксида магния с фтороводородом:
Mg(OH)2 + 2HF → MgF2 + 2H2O.
В результате реакции образуются фторид магния и вода.
6. реакция гидроксида магния с бромоводородом:
Mg(OH)2 + 2HBr → MgBr2 + 2H2O.
В результате реакции образуются бромид магния и вода.
7. реакция гидроксида магния с йодоводородом:
Mg(OH)2 + 2HI → MgI2 + 2H2O.
В результате реакции образуются йодид магния и вода.
8. реакция термического разложения гидроксида магния:
Mg(OH)2 → MgO + H2O (t = 350 °C).
В результате реакции образуются оксид магния и вода.
9. реакция гидроксида магния с пероксидом водорода:
H2O2 + Mg(OH)2 → MgO2 + 2H2O (t < 20 °C).
В результате реакции образуются пероксид магния и вода. В ходе реакции используется концентрированный раствор пероксида водорода.
10. реакция гидроксида магния с оксидом серы:
Mg(OH)2 + SO3 → MgSO4 + 2H2O.
В результате реакции образуются сульфат магния и вода.
11. реакция гидроксида магния с оксидом углерода:
Mg(OH)2 + 2CO2 → Mg(HCO3)2.
В результате реакции образуется гидрокарбонат магния. В ходе реакции гидроксид магния используется в виде суспензии.
12. реакция гидроксида магния с оксидом углерода:
Mg(OH)2 + 2N2O5 → Mg(NO3)2 + 2HNO3 (t = 40-60 °C).
В результате реакции образуются нитрат магния и азотная кислота.
Применение и использование гидроксида магния:
Гидроксид магния используется при очистке воды (как флокулянт), в моющих средствах (как добавка), в качестве наполнителя в зубной пасте, для рафинирования сахара, в качестве пищевой добавки (Е528).
Примечание: © Фото //www.pexels.com, //pixabay.com
карта сайта
гидроксид магния реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения реакции масса взаимодействие гидроксида магния
Коэффициент востребованности 1 590
описание вещества, свойства и применение :: SYL.ru
Гидроксид магния - это неорганическое вещество, оно является малорастворимым соединением, из-за чего при его образовании в водных растворах появляется осадок. Формула гидроксида магния - Mg(OH)2, то есть это двухкислотное основание. Более растворим в воде, чем типичные нерастворимые основания, но менее растворим, чем гидроксид кальция. По этой причине его относят к малорастворимым соединениям.
Распространение в природе
Гидроксид магния в природе встречается в виде минерала брусита. Крупные месторождения этой породы - большая редкость. В России его добывают на Кульдурском месторождении, где его запасы оценивают в 14 миллионов тонн. Добыча на нем идет со скоростью примерно в 250 тысяч тонн продукта в год, но с этого года объемы добычи увеличились вдвое. Причиной этому стал хороший спрос на этот минерал за границей. Самым крупным импортером является Япония.

Выглядит брусит как белые, серые или зеленовато-белые кристаллы со стеклянным блеском на изломе. Имеет довольно низкую твердость, поэтому легко режется ножом. Может содержать примеси. В зависимости от их количества и типа выделяют несколько подвидов этого минерала. Так, ферронемалит содержит в себе, помимо гидроксида магния, 5 % железа в виде оксида, а ферробрусит - уже целых 36 %. Оксид железа имеет бурый цвет (цвет ржавчины), поэтому эти минералы приобретают тот же оттенок вместо привычного светло-зеленого. Существует еще и мангобрусит. В качестве примеси здесь выступает марганец. Такой минерал имеет уже медово-желтый цвет. Но при контакте с кислородом воздуха минерал быстро теряет свой красивый цвет и быстро чернеет.
Применяют данный минерал в основном как сырье. Из него получают оксид и другие соединения магния, флюсы, различные огнеупорные материалы. Но брусит можно применять и без какой-либо обработки. Так, этот минерал используют для очистки газов от хлора и для сорбционного фильтрования воды.
Получение
Основная реакция получения нерастворимых гидроксидов - это реакция взаимодействия щелочей с солями магния. Например, при взаимодействии сульфата магния с гидроксидом натрия. Это хорошая иллюстрация. А еще пример - при взаимодействии хлорида магния и гидроксида калия.
В ионном виде все подобные реакции записываются как:
Mg2+ + OH- → Mg(OH)2
При взаимодействии магния или его оксида с водой может также получаться гидроксид. Данная реакция идет очень медленно и только при нагревании.
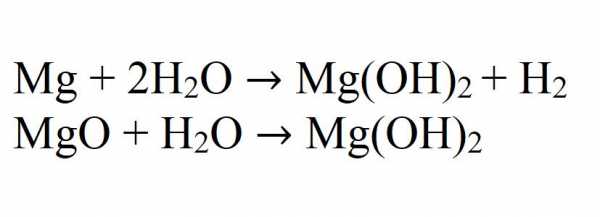
Существует такой достаточно распространенный минерал - доломит. С химической точки зрения он представляет смесь карбоната кальция и магния. При обработке этого минерала водным раствором хлорида магния при нагревании в осадок выпадает нерастворимый гидроксид:
MgCO3·CaCO3 + 2H2O + MgCl2 → Mg(OH)2 + CaCl2 + 2CO2
Физические свойства
В сухом виде гидроксид магния представляет собой белое кристаллическое вещество. Не имеет запаха, но ему присущ вкус щелочи. Он малорастворим в воде (всего 0,6 мг на 100 мл воды). Но даже несмотря на это, его водные растворы имеют слабощелочную среду и окрашивают индикаторы в соответствующие цвета. Зато данное соединение растворяется в растворах солей аммония. Оно не плавится, так как при температуре 480 oC разлагается на оксид магния и воду, как и любое другое нерастворимое основание. Плотность при нормальных условиях: 2,4 г/см3.
Химические свойства
Гидроксид магния - типичное нерастворимое основание. Это и определяет его химические свойства. Так, например, реагирует гидроксид магния с кислотами, кислотными оксидами и неметаллами:
Из-за последней реакции он имеет склонность поглощать углекислый газ прямо из воздуха с образованием карбоната, поэтому хранить данное вещество длительное время открытым не рекомендуется.
Взаимодействует также и с солями, если в результате реакции получается осадок или газ:
Как уже было указано выше, при нагревании идет разложение гидроксида магния по уравнению:
Mg(OH)2 → H2O + MgO
Что касается образования комплексных соединений, где катион магния выступал бы в качестве лиганда, то на этот счет имеются противоречивые сведения. В одних источниках указывается, что магний не склонен к их образованию, и существуют лишь только неустойчивые соединения с галогенидами магния. В других источниках указывается, что гидроксид магния может реагировать с горячими щелочами с образованием гидромагнезатов:
Mg(OH)2 + 2NaOH → Na2[Mg(OH)4]
Применение в медицине
В медицине суспензии на основе гидроксида магния используются как антацидное средство. Этому способствуют основные свойства. Попадая в желудок, гидроксид магния снижает его кислотность, нейтрализуя соляную кислоту. Применяется при гастритах, язвенной болезни желудка и двенадцатиперстной кишки. Препараты на его основе не снижают кислотно-щелочное равновесие и не нарушают секрецию соляной кислоты. Но даже несмотря на это, препарат имеет ряд ограничений и противопоказан людям с гиперчувствительностью к гидроксиду магния.
Продуктом взаимодействия гидроксида магния и соляной кислоты желудочного сока является хлорид магния. Он является сильным слабительным (действие наступает через 2-6 часов). Поэтому гидроксид магния является активным компонентом некоторых препаратов этой области. Избыток магния в организме легко выводится почками, но если человек страдает какими-либо болезнями этих органов, то он может получить избыток магния в организме при приеме препаратов (гипермагнемия).
Еще одно свойство данного соединения - расслабление мускулатуры. Иногда препараты, содержащие гидроксид магния, прописывают женщинам с угрозой выкидыша.
Применение в других отраслях
Гидроксид магния применяется и в пищевой промышленности как добавка Е528. В продуктах он регулирует кислотность и стабилизирует цвет. Еще применяют гидроксид магния для связывания диоксида серы, появление которого нежелательно в пищевых продуктах. Применяют его при производстве консервированных овощей, соусов, маринада и сыра. Эта добавка считается безвредной, но она запрещена в Австралии, Великобритании и Новой Зеландии.
Также гидроксид магния применяется как огнезащитная добавка в полимеры (ПВХ, полиолефины), как добавка в моющие средства и зубные пасты, для рафинирования сахара и очистки сточных вод.
Получаемый из гидроксида магния оксид - довольно полезное соединение. Оно способно выдерживать температуру около 3000 градусов, поэтому его используют как огнеупор. Так, его добавляют в кирпичи, из которых потом делают доменные печи. Используют оксид магния и как сорбент для очистки нефтепродуктов. Абразивные способности данного соединения также высоки. С помощью него очищают и полируют поверхности деталей в электронной промышленности.
Гидроксид магния, характеристика, свойства и получение, химические реакции
Гидроксид магния, характеристика, свойства и получение, химические реакции.
Гидроксид магния – неорганическое вещество, имеет химическую формулу Mg(OH)2.
Краткая характеристика гидроксида магния
Физические свойства гидроксида магния
Получение гидроксида магния
Химические свойства гидроксида магния
Химические реакции гидроксида магния
Применение и использование гидроксида магния
Краткая характеристика гидроксида магния:
Гидроксид магния – неорганическое вещество белого цвета.
Химическая формула гидроксида магния Mg(OH)2.
Практически нерастворим в воде. Является слабым основанием, даже ничтожная его часть, растворившаяся в воде, сообщает раствору слабощелочную реакцию.
Поглощает углекислый газ и воду из воздуха с образованием основного карбоната магния.
Встречается в природе в виде минерала брусита.
Физические свойства гидроксида магния:
| Наименование параметра: | Значение: |
| Химическая формула | Mg(OH)2 |
| Синонимы и названия иностранном языке | potassium hydroxide (англ.) magnesium hydroxide (англ.) брусит (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные тригональные кристаллы |
| Цвет | белый |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2344,6 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,3446 |
| Температура разложения, °C | 350 |
| Молярная масса, г/моль | 58,35 |
* Примечание:
— нет данных.
Получение гидроксида магния:
Гидроксид магния получают в результате следующих химических реакций:
- 1. в результате взаимодействия металлического магния с парами воды:
Mg + 2H2O → Mg(OH)2 + H2.
- 2. в результате взаимодействия оксида магния и воды:
MgO + H2O → Mg(OH)2 (t = 100-125 °C).
- 3. в результате взаимодействия растворимых солей магния с щелочью:
MgCl2 + 2NaOH → Mg(OH)2 + 2NaCl,
Mg(NO3)2 + 2KOH → Mg(OH)2 + 2KNO3.
При этом гидроксид магния выпадает в виде осадка.
- 4. в результате взаимодействия хлорида магния с обожженным доломитом:
MgCl2 + CaO·MgO + 2H2O → 2Mg(OH)2 + CaCl2.
При этом гидроксид магния выпадает в виде осадка.
Химические свойства гидроксида магния. Химические реакции гидроксида магния:
Гидроксид магния является основным основание, т. е. обладает как основными свойствами.
Гидроксид магния — слабое малорастворимое основание.
Химические свойства гидроксида магния аналогичны свойствам гидроксидов других основных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида магния с гидроксидом натрия:
Mg(OH)2 + 2NaOH → Na2[Mg(OH)4] (t = 100 °C).
В результате реакции образуется тетрагидроксомагнезиат натрия. В ходе реакции используется насыщенный раствор гидроксида натрия.
2. реакция гидроксида магния с угольной кислотой:
Mg(OH)2 + H2СO3 → MgСO3 + 2H2O.
В результате реакции образуются карбонат магния и вода.
3. реакция гидроксида магния с ортофосфорной кислотой:
Mg(OH)2 + 2H3PO4 → Mg(H2PO4)2 + H2O,
Mg(OH)2 + H3PO4 → MgHPO4 + 2H2O,
3Mg(OH)2 + 2H3PO4 → Mg3(PO4)2 + 6H2O.
В результате реакции образуются в первом случае — дигидроортофосфат магния и вода, во втором – гидроортофосфат магния и вода, в третьем – ортофосфат магния и вода.
4. реакция гидроксида магния с азотной кислотой:
Mg(OH)2 + 2HNO3 → Mg(NO3)2 + 2H2O.
В результате реакции образуются нитрат магния и вода.
Аналогично проходят реакции гидроксида магния и с другими кислотами.
5. реакция гидроксида магния с фтороводородом:
Mg(OH)2 + 2HF → MgF2 + 2H2O.
В результате реакции образуются фторид магния и вода.
6. реакция гидроксида магния с бромоводородом:
Mg(OH)2 + 2HBr → MgBr2 + 2H2O.
В результате реакции образуются бромид магния и вода.
7. реакция гидроксида магния с йодоводородом:
Mg(OH)2 + 2HI → MgI2 + 2H2O.
В результате реакции образуются йодид магния и вода.
8. реакция термического разложения гидроксида магния:
Mg(OH)2 → MgO + H2O (t = 350 °C).
В результате реакции образуются оксид магния и вода.
9. реакция гидроксида магния с пероксидом водорода:
H2O2 + Mg(OH)2 → MgO2 + 2H2O (t < 20 °C).
В результате реакции образуются пероксид магния и вода. В ходе реакции используется концентрированный раствор пероксида водорода.
10. реакция гидроксида магния с оксидом серы:
Mg(OH)2 + SO3 → MgSO4 + 2H2O.
В результате реакции образуются сульфат магния и вода.
11. реакция гидроксида магния с оксидом углерода:
Mg(OH)2 + 2CO2 → Mg(HCO3)2.
В результате реакции образуется гидрокарбонат магния. В ходе реакции гидроксид магния используется в виде суспензии.
12. реакция гидроксида магния с оксидом углерода:
Mg(OH)2 + 2N2O5 → Mg(NO3)2 + 2HNO3 (t = 40-60 °C).
В результате реакции образуются нитрат магния и азотная кислота.
Применение и использование гидроксида магния:
Гидроксид магния используется при очистке воды (как флокулянт), в моющих средствах (как добавка), в качестве наполнителя в зубной пасте, для рафинирования сахара, в качестве пищевой добавки (Е528).
Примечание: © Фото //www.pexels.com, //pixabay.com
карта сайта
Еще интересные технологии:
гидроксид магния реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения реакции масса взаимодействие гидроксида магния
Коэффициент востребованности 5
comments powered by HyperComments
Источник публикации ©МИА «Россия сегодня»
Гидроксид магния | Info-Farm.RU
Гидроксид магния, магний гидроксид — неорганическое соединение состава Mg (OH) 2. Белые кристаллы, которые плохо растворяются в воде. Соединение проявляет слабые основные свойства.
Применяется как препарат для снижения кислотности желудочного сока и как антидот при отравлениях мышьяком. Промежуточное соединение в синтезе металлического магния.
Распространение в природе
Минералы, в состав которых входит гидроксид магния, довольно малораспространенными. Среди таких минералов наибольшее значение имеет брусит. Кроме основного соединения, Mg (OH) 2, в нем могут находиться примеси MnO, FeO, Fe 2 O 3. Брусит образуется в результате гидролиза растворимых в лугах природных соединений магния.
Также Mg (OH) 2 встречается в составе минерала гидромагнезиту, который по составу приближен к смеси гидроксида и карбоната магния, — 4MgCO 3 · Mg (OH) 2 · 2H 2 O.
Физические свойства
Гидроксид магния являются белыми кристаллами, которые плохо растворяются в воде и не проводят ток. Активно осушает воздух путем поглощения воды и углекислого газа. Хорошо растворяется в солях аммония.
Получение
Учитывая малую распространенность гидроксида магния в минеральных залежах, его добывают другим способом. Для нужд промышленности Mg (OH) 2 получают преципитацией морской воды и рассолов. Впервые добычи гидроксида из морской воды применили в 1865 году на побережье французского Средиземноморья.
В лабораторных в языках гидроксид магния можно синтезировать сожжением металлического магния в паре воды:
Также применяется осаждения малорастворимого гидроксида при взаимодействии солей магния с щелочами и гидроксидом аммония.
Однако, осаждения с помощью гидроксида аммония происходит полностью из-за постоянного уменьшения ионов OH -.
Химические свойства
Гидроксид магния разлагается при нагревании свыше 350 ° C вакууме и при 800 ° C — на воздухе:
Соединение является слабым основанием, взаимодействует с кислотами, солями аммония и кислотными оксидами (активно поглощает из воздуха углекислый газ):
При нагревании реагирует с некоторыми неметаллами, которые в результате образуют соответствующие гидриды:
Комплексообразования с неорганическими лигандами для катионы Mg 2+ нехарактерное (неустойчивые комплексы с оксигеновмиснимы молекулами известны для галогенидов магния), поэтому в лугах Mg (OH) 2 нерастворимый.
Применение
Гидроксид магния применяется как промежуточное соединение в синтезе металлического магния. Применяется для очистки сахара, воды в котельных, в изготовлении зубных паст.
В медицине
Гидроксид магния широко используется как антацидное средство при повышенной кислотности желудочного сока (при гастритах, язвенной болезни желудка и двенадцатиперстной кишки). Входит в состав препарата «Маалокс» (акроним от «ма навоз ал Юминов окс ид»), а также его аналога «альмагель», которые снижают кислотность.
Нейтрализуя хлорную кислоту, содержащуюся в желудке превращается в хлорид магния, который обладает слабительным действием. Применяется при отравлении кислотами и соединениями мышьяка.
Видео по теме
Изображения по теме
Оксид магния — Википедия
Материал из Википедии — свободной энциклопедии
Окси́д ма́гния (жжёная магнезия) — химическое соединение с формулой MgO, белые кристаллы, малорастворимые в воде, пожаро- и взрывобезопасен.
Основная форма — минерал периклаз.
Легкий, рыхлый порошок белого цвета, легко впитывает воду. На этом свойстве основано его применение в спортивной гимнастике: нанесенный на ладони спортсмена, порошок предохраняет его от опасности сорваться с гимнастического снаряда. Температура плавления — 2825 °C. Температура кипения — 3600 °C. Плотность=3,58 г/см3.
Реагирует с разбавленными кислотами с образованием солей, плохо — с холодной водой, образуя Mg(OH)2:
С горячей водой реагирует лучше, реакция идет быстрее.
- MgO+2HCl→MgCl2+h3O{\displaystyle {\mathsf {MgO+2HCl\rightarrow MgCl_{2}+H_{2}O}}}
- MgO+h3O→Mg(OH)2{\displaystyle {\mathsf {MgO+H_{2}O\rightarrow Mg(OH)_{2}}}}
Оксид магния получают обжигом минералов магнезита и доломита.
- CaCO3∗MgCO3→MgO+CaO+2CO2{\displaystyle {\mathsf {CaCO_{3}*MgCO_{3}\rightarrow MgO+CaO+2CO_{2}}}}
- MgCO3→MgO+CO2{\displaystyle {\mathsf {MgCO_{3}\rightarrow MgO+CO_{2}}}}
В промышленности применяется для производства огнеупоров, цементов, очистки нефтепродуктов, как наполнитель при производстве резины, наполнитель в ТЭНах. Сверхлегкий оксид магния применяется как очень мелкий абразив для очистки поверхностей, в частности, в электронной промышленности.
В медицине применяют при повышенной кислотности желудочного сока, так как она обусловливается избыточным содержанием соляной кислоты. Жжёную магнезию принимают также при случайном попадании в желудок кислот.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E530.
Является абсолютным отражателем — веществом с коэффициентом отражения, равным единице в широкой спектральной полосе. Может применяться как доступный эталон белого цвета.
- Кнунянц И. Л. и др. т.2 Даффа-Меди // Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5.
Гидроксид магния - это... Что такое Гидроксид магния?
Гидрокси́д ма́гния — неорганический гидроксид щелочноземельного металла магния. Относится к классу нерастворимых оснований.
Описание
При стандартных условиях гидроксид магния представляет собой бесцветные кристаллы с гексагональной решёткой. При температуре выше 350 °C разлагается на оксид магния и воду. Поглощает углекислый газ и воду из воздуха с образованием основного карбоната магния. Гидроксид магния практически нерастворим в воде, но растворим в солях аммония. Является основанием средней силы. Встречается в природе в виде минерала брусита.[2]
Получение
- В общем виде:
- Примеры:
Химические свойства
- Разложение при нагревании до 350 °C:
- Взаимодействие с горячими концентрированными растворами щелочей с образованием гидроксомагнезатов:
Применение
Гидроксид магния используется в качестве пищевой добавки, для связывания диоксида серы, как флокулянт для очистки сточных вод, в качестве огнезащитного средства в термопластических полимерах (полиолефины, ПВХ), как добавка в моющие средства, для получения оксида магния, рафинирования сахара, в качестве компонента зубных паст.
В медицине его применяют в качестве лекарства для нейтрализации кислоты в желудке, а также как очень сильное слабительное.
В Европейском союзе гидроксид магния зарегистрирован в качестве пищевой добавки E528.