Лоратадин какое поколение
Обзор антигистаминных средств первого и второго поколений, рациональный подход к использованию в клинической практике | #07/11
Исторически сложилось так, что под термином «антигистаминные препараты» понимают средства, блокирующие Н1-гистаминовые рецепторы, а лекарства, воздействующие на Н2-гистаминовые рецепторы (циметидин, ранитидин, фамотидин и др.), называют Н2-гистаминоблокаторами. Первые используются для лечения аллергических заболеваний, вторые применяются в качестве антисекреторных средств.
Гистамин, этот важнейший медиатор различных физиологических и патологических процессов в организме, был химически синтезирован в 1907 году. Впоследствии его выделили из тканей животных и человека (Windaus A., Vogt W.). Еще позднее были определены его функции: желудочная секреция, нейромедиаторная функция в ЦНС, аллергические реакции, воспаление и др. Спустя почти 20 лет, в 1936 году, были созданы первые вещества, обладающие антигистаминной активностью (Bovet D., Staub A.). И уже в 60-е годы доказана гетерогенность рецепторов в организме к гистамину и выделены три их подтипа: Н1, Н2 и Н3, различающиеся по строению, локализации и физиологическим эффектам, возникающим при их активации и блокаде. С этого времени начинается активный период синтеза и клинического тестирования разнообразных антигистаминных препаратов.
Многочисленные исследования показали что гистамин, воздействуя на рецепторы респираторной системы, глаз и кожи, вызывает характерные симптомы аллергии, а антигистаминные препараты, селективно блокирующие Н1-тип рецепторов, способны их предотвращать и купировать.
Большинство используемых антигистаминных средств обладает рядом специфических фармакологических свойств, характеризующих их как отдельную группу. Сюда относятся следующие эффекты: противозудный, противоотечный, антиспастический, антихолинергический, антисеротониновый, седативный и местноанестезирующий, а также предупреждение гистамининдуцированного бронхоспазма. Некоторые из них обусловлены не гистаминовой блокадой, а особенностями структуры.
Антигистаминные препараты блокируют действие гистамина на Н1-рецепторы по механизму конкурентного ингибирования, причем их сродство к этим рецепторам значительно ниже, чем у гистамина. Поэтому данные лекарственные средства не способны вытеснить гистамин, связанный с рецептором, они только блокируют незанятые или высвобождаемые рецепторы. Соответственно, Н1-блокаторы наиболее эффективны для предупреждения аллергических реакций немедленного типа, а в случае развившейся реакции предупреждают выброс новых порций гистамина.
По своему химическому строению большинство из них относятся к растворимым в жирах аминам, которые обладают сходной структурой. Ядро (R1) представлено ароматической и/или гетероциклической группой и связано при помощи молекулы азота, кислорода или углерода (Х) с аминогруппой. Ядро определяет выраженность антигистаминной активности и некоторые из свойств вещества. Зная его состав, можно предсказать силу препарата и его эффекты, например способность проникать через гематоэнцефалический барьер.
Существует несколько классификаций антигистаминных препаратов, хотя ни одна из них не является общепринятой. Согласно одной из наиболее популярных классификаций, антигистаминные препараты по времени создания подразделяют на препараты первого и второго поколения. Препараты первого поколения принято также называть седативными (по доминирующему побочному эффекту), в отличие от неседативных препаратов второй генерации. В настоящее время принято выделять и третье поколение: к нему относятся принципиально новые средства — активные метаболиты, обнаруживающие, помимо наивысшей антигистаминной активности, отсутствие седативного эффекта и характерного для препаратов второго поколения кардиотоксического действия (см. табл.).

Кроме того, по химическому строению (в зависимости от Х-связи) антигистаминные препараты подразделяют на несколько групп (этаноламины, этилендиамины, алкиламины, производные альфакарболина, хинуклидина, фенотиазина, пиперазина и пиперидина).
Антигистаминные препараты первого поколения (седативные). Все они хорошо растворяются в жирах и, помимо Н1-гистаминовых, блокируют также холинергические, мускариновые и серотониновые рецепторы. Являясь конкурентными блокаторами, они обратимо связываются с Н1-рецепторами, что обусловливает использование довольно высоких доз. Для них наиболее характерны следующие фармакологические свойства.
- Седативное действие, определяется тем, что большинство антигистаминных препаратов первой генерации, легко растворяясь в липидах, хорошо проникают через гематоэнцефалический барьер и связываются с Н1-рецепторами головного мозга. Возможно, их седативный эффект складывается из блокирования центральных серотониновых и ацетилхолиновых рецепторов. Степень проявления седативного эффекта первого поколения варьирует у разных препаратов и у разных пациентов от умеренной до выраженной и усиливается при сочетании с алкоголем и психотропными средствами. Некоторые из них используются как снотворные (доксиламин). Редко вместо седатации возникает психомоторное возбуждение (чаще в среднетерапевтических дозах у детей и в высоких токсических у взрослых). Из-за седативного эффекта большинство лекарств нельзя использовать в период выполнения работ, требующих внимания. Все препараты первого поколения потенцируют действие седативных и снотворных лекарств, наркотических и ненаркотических анальгетиков, ингибиторов моноаминооксидазы и алкоголя.
- Анксиолитическое действие, свойственное гидроксизину, может быть обусловлено подавлением активности в определенных участках подкорковой области ЦНС.
- Атропиноподобные реакции, связанные с антихолинергическими свойствами препаратов, наиболее характерны для этаноламинов и этилендиаминов. Проявляются сухостью во рту и носоглотке, задержкой мочи, запорами, тахикардией и нарушениями зрения. Эти свойства обеспечивают эффективность обсуждаемых средств при неаллергическом рините. В то же время они могут усилить обструкцию при бронхиальной астме (в связи с увеличением вязкости мокроты), вызвать обострение глаукомы и привести к инфравезикальной обструкции при аденоме предстательной железы и др.
- Противорвотный и противоукачивающий эффект также, вероятно, связаны с центральным холинолитическим действием препаратов. Некоторые антигистаминные (дифенгидрамин, прометазин, циклизин, меклизин) средства уменьшают стимуляцию вестибулярных рецепторов и угнетают функцию лабиринта, в связи с чем могут использоваться при болезнях движения.
- Ряд Н1-гистаминоблокаторов уменьшает симптомы паркинсонизма, что обусловлено центральным ингибированием эффектов ацетилхолина.
- Противокашлевое действие наиболее характерно для дифенгидрамина, оно реализуется за счет непосредственного действия на кашлевой центр в продолговатом мозге.
- Антисеротониновый эффект, свойственный прежде всего ципрогептадину, обусловливает его применение при мигрени.
- Альфа1-блокирующий эффект с периферической вазодилятацией, особенно присущий антигистаминным препаратам фенотиазинового ряда, может приводить к транзиторному снижению артериального давления у чувствительных лиц.
- Местноанестезирующее (кокаиноподобное) действие характерно для большинства антигистаминных средств (возникает вследствие снижения проницаемости мембран для ионов натрия). Дифенгидрамин и прометазин являются более сильными местными анестетиками, чем новокаин. Вместе с тем они обладают системными хинидиноподобными эффектами, проявляющимися удлинением рефрактерной фазы и развитием желудочковой тахикардии.
- Тахифилаксия: снижение антигистаминной активности при длительном приеме, подтверждающее необходимость чередования лекарственных средств каждые 2–3 недели.
- Следует отметить, что антигистаминные препараты первого поколения отличаются от второго поколения кратковременностью воздействия при относительно быстром наступлении клинического эффекта. Многие из них выпускаются в парентеральных формах. Все вышесказанное, а также низкая стоимость определяют широкое использование антигистаминных средств и в наши дни.
Более того, многие качества, о которых шла речь, позволили занять «старым» антигистаминным средствам свою нишу в области лечения некоторых патологий (мигрень, нарушения сна, экстрапирамидные расстройства, тревога, укачивание и др.), не связанных с аллергией. Немало антигистаминных препаратов первого поколения входит в состав комбинированных препаратов, применяющихся при простуде, как успокаивающие, снотворные и другие компоненты.
Наиболее часто используются хлоропирамин, дифенгидрамин, клемастин, ципрогептадин, прометазин, фенкарол и гидроксизин.
Хлоропирамин (Супрастин) — один из самых широко применяемых седативных антигистаминных препаратов. Обладает значительной антигистаминной активностью, периферическим антихолинергическим и умеренным спазмолитическим действием. Эффективен в большинстве случаев для лечения сезонного и круглогодичного аллергического риноконъюнктивита, отека Квинке, крапивницы, атопического дерматита, экземы, зуда различной этиологии; в парентеральной форме — для лечения острых аллергических состояний, требующих неотложной помощи. Предусматривает широкий диапазон используемых терапевтических доз. Не накапливается в сыворотке крови, поэтому не вызывает передозировку при длительном применении. Для Супрастина характерно быстрое наступление эффекта и кратковременность (в том числе и побочного) действия. При этом хлоропирамин может комбинироваться с неседативными Н1-блокаторами с целью увеличения продолжительности противоаллергического действия. Супрастин в настоящее время является одним из самых продаваемых антигистаминных препаратов в России. Это объективно связано с доказанной высокой эффективностью, управляемостью его клинического эффекта, наличием различных лекарственных форм, в том числе и инъекционных, и невысокой стоимостью.
Дифенгидрамин (Димедрол), — один из первых синтезированных Н1-блокаторов. Он обладает достаточно высокой антигистаминной активностью и снижает выраженность аллергических и псевдоаллергических реакций. За счет существенного холинолитического эффекта имеет противокашлевое, противорвотное действие и в то же время вызывает сухость слизистых, задержку мочеиспускания. Вследствие липофильности Димедрол дает выраженную седатацию и может использоваться как снотворное. Оказывает значительный местноанестезирующий эффект, вследствие чего иногда применяется как альтернатива при непереносимости новокаина и лидокаина. Димедрол представлен в различных лекарственных формах, в том числе и для парентерального применения, что определило его широкое использование в неотложной терапии. Однако значительный спектр побочных эффектов, непредсказуемость последствий и воздействия на ЦНС требуют повышенного внимания при его применении и по возможности использования альтернативных средств.
Клемастин (Тавегил) — высокоэффективный антигистаминный препарат, сходный по действию с дифенгидрамином. Обладает высокой антихолинергической активностью, однако в меньшей степени проникает через гематоэнцефалический барьер, чем и обусловлена невысокая частота наблюдения седативного эффекта — до 10%. Также существует в инъекционной форме, которая может использоваться как дополнительное средство при анафилактическом шоке и ангионевротическом отеке, для профилактики и лечения аллергических и псевдоаллергических реакций. Однако известна гиперчувствительность к клемастину и другим антигистаминным средствам, обладающим сходной с ним химической структурой.
Диметенден (Фенистил) — наиболее близок к антигистаминным препаратам второго поколения, от препаратов первого поколения отличается значительно меньшей выраженностью седативного и мускаринового эффекта, высокой противоаллергической активностью и длительностью действия.
Таким образом, антигистаминные средства первого поколения, влияющие как на Н1-, так и на другие рецепторы (серотониновые, центральные и периферические холинорецепторы, aльфа-адренорецепторы), обладают различными эффектами, что определило их применение при множестве состояний. Но выраженность побочных действий не позволяет рассматривать их как препараты первого выбора при лечении аллергических заболеваний. Опыт, накопленный при их применении, позволил разработать препараты однонаправленного действия — второе поколение антигистаминных средств.
Антигистаминные препараты второго поколения (неседативные). В отличие от предыдущего поколения они почти не обладают седативным и холинолитическим эффектами, а отличаются избирательностью действия на Н1-рецепторы. Однако для них в разной степени отмечен кардиотоксический эффект.
Наиболее общими для них являются следующие свойства.
- Высокая специфичность и высокое сродство к Н1-рецепторам при отсутствии влияния на холиновые и серотониновые рецепторы.
- Быстрое наступление клинического эффекта и длительность действия. Пролонгация может достигаться за счет высокого связывания с белком, кумуляции препарата и его метаболитов в организме и замедленного выведения.
- Минимальный седативный эффект при использовании препаратов в терапевтических дозах. Он объясняется слабым прохождением гематоэнцефалического барьера вследствие особенностей структуры этих средств. У некоторых особенно чувствительных лиц может наблюдаться умеренная сонливость.
- Отсутствие тахифилаксии при длительном применении.
- Способность блокировать калиевые каналы сердечной мышцы, что ассоциируется с удлинением интервала QT и нарушением ритма сердца. Риск возникновения данного побочного эффекта увеличивается при сочетании антигистаминных средств с противогрибковыми (кетоконазолом и интраконазолом), макролидами (эритромицином и кларитромицином), антидепрессантами (флуоксетином, сертралином и пароксетином), при употреблении грейпфрутового сока, а также у пациентов с выраженными нарушениями функции печени.
- Отсутствие парентеральных форм, однако некоторые из них (азеластин, левокабастин, бамипин) имеются в виде форм для местного применения.
Ниже представлены антигистаминные средства второй генерации с наиболее характерными для них свойствами.
Лоратадин (Кларитин) — один из самых покупаемых препаратов второго поколения, что вполне объяснимо и логично. Его антигистаминная активность выше, чем у астемизола и терфенадина, вследствие большей прочности связывания с периферическими Н1-рецепторами. Препарат лишен седативного эффекта и не потенцирует действие алкоголя. Кроме того, лоратадин практически не взаимодействует с другими лекарственными средствами и не обладает кардиотоксическим действием.
Нижеследующие антигистаминные средства относятся к препаратам местного действия и предназначены для купирования локальных проявлений аллергии.
Азеластин (Аллергодил) — высокоэффективное средство для лечения аллергического ринита и конъюнктивита. Применяемый в виде назального спрея и глазных капель азеластин практически лишен системного действия.
Цетиризин (Зиртек) — высокоселективный антагонист периферических Н1-рецепторов. Является активным метаболитом гидроксизина, обладающим гораздо менее выраженным седативным действием. Цетиризин почти не метаболизируется в организме, и скорость его выведения зависит от функции почек. Характерной его особенностью является высокая способность проникновения в кожу и, соответственно, эффективность при кожных проявлениях аллергии. Цетиризин ни в эксперименте, ни в клинике не показал какого-либо аритмогенного влияния на сердце.
Выводы
Итак, в арсенале врача имеется достаточное количество антигистаминных препаратов с различными свойствами. При этом необходимо помнить, что они обеспечивают лишь симптоматическое облегчение при аллергии. Кроме того, в зависимости от конкретной ситуации можно использовать как различные препараты, так и многообразные их формы. Для врача также важно помнить о безопасности антигистаминных средств.
К недостаткам большинства антигистаминных препаратов 1-го поколения относится феномен тахифилаксии (привыкание), требующий смены препарата каждые 7–10 дней, хотя, к примеру, для диметиндена (Фенистил) и клемастина (Тавегил) показана эффективность в течение 20 дней без развития тахифилаксии (Kirchhoff C. H. et al., 2003; Koers J. et al., 1999).
Продолжительность действия от 4–6 часов для дифенгидрамина, 6–8 часов у диметиндена, до 12 (а в некоторых случаях и 24) часов у клемастина, поэтому препараты назначаются 2–3 раза в сутки.
Несмотря на вышеперечисленные недостатки, антигистаминные препараты 1-го поколения занимают прочные позиции в аллергологической практике, особенно в педиатрии и гериатрии (Лусс Л. В., 2009). Наличие инъекционных форм данных лекарственных средств делает их незаменимыми в острых и неотложных ситуациях. Дополнительный антихолинергический эффект хлоропирамина значительно уменьшает зуд и кожные высыпания при атопическом дерматите у детей; снижает объем назальной секреции и купирование чихания при ОРВИ. Терапевтический эффект антигистаминных препаратов 1-го поколения при чихании и кашле в значительной мере может быть обусловлен блокадой Н1- и мускариновых рецепторов. Ципрогептадин и клемастин наряду с антигистаминовым действием обладают выраженной антисеротониновой активностью. Диментиден (Фенистил) дополнительно угнетает действие других медиаторов аллергии, в частности кининов. Более того, установлена более низкая стоимость антигистаминных средств 1-го поколения по сравнению с препаратами 2-го поколения.
Указывается эффективность пероральных антигистаминных препаратов 1-го поколения, не рекомендуется их использование в комбинации с оральными деконгестантами у детей.
Следовательно, преимуществами антигистаминных препаратов 1-го поколения являются: длительный опыт (в течение 70 лет) применения, хорошая изученность, возможность дозированного применения их у детей грудного возраста (для диметиндена), незаменимость при острых аллергических реакциях на пищевые продукты, лекарственные препараты, укусы насекомых, при проведении премедикации, в хирургической практике.
Особенностями анигистаминных препаратов 2-го поколения является высокое сродство (аффинность) к Н1-рецепторам, длительность действия (до 24 часов), низкая проходимость через гематоэнцефалический барьер в терапевтических дозах, отсутствие инактивации препарата пищей, отсутствие тахифилаксии. Практически данные препараты не подвергаются метаболизму в организме. Не вызывают развитие седативного эффекта, однако у некоторых пациентов может наблюдаться сонливость при их использовании.
Преимущества антигистаминных препаратов 2-го поколения заключается в следующем:
- У препаратов 2-го поколения за счет их липофобности и плохого проникновения через гематоэнцефалический барьер практически отсутствует седативный эффект, хотя у некоторых больных он может наблюдаться.
- Продолжительность действия до 24 часов, поэтому большинство из этих препаратов назначается один раз в сутки.
- Отсутствие привыкания, что делает возможным назначение в течение длительного времени (от 3 до 12 месяцев).
- После отмены препарата терапевтический эффект может длиться в течение недели.
Антигистаминные препараты 2-го поколения характеризуются противоаллергическим и противовоспалительным действием. Описаны определенные антиаллергические эффекты, однако их клиническое значение остается неясным.
Длительная (годы) терапия пероральными антигистаминными средствами как первого, так и второго поколения безопасна. Некоторые, но не все препараты этой группы подвергаются метаболизму в печени под действием системы цитохрома Р450 и могут взаимодействовать с другими лекарственными веществами. Установлена безопасность и эффективность пероральных антигистаминных средств у детей. Их можно назначать даже маленьким детям.
Таким образом, имея столь широкий круг антигистаминных препаратов, врач имеет возможность выбирать лекарственное средство в зависимости от возраста пациента, конкретной клинической ситуации, диагноза. Антигистаминные препараты 1-го и 2-го поколения остаются неотъемлемой частью комплексного лечения аллергических заболеваний у взрослых и детей.
Литература
- Гущин И. С. Антигистаминные препараты. Пособие для врачей. М.: Авентис Фарма, 2000, 55 с.
- Коровина Н. А., Чебуркин А. В., Захарова И. Н., Заплатников А. Л., Репина Е. А. Антигистаминные препараты в практике детского врача. Рук-во для врачей. М., 2001, 48 с.
- Лусс Л. В. Выбор антигистаминных препаратов в лечении аллергических и псевдоаллергических реакций // Рос. аллергологический журнал. 2009, № 1, с. 1–7.
- ARIA // Allergy. 2008. V. 63 (Suppl. 86). P. 88–160
- Gillard M., Christophe B., Wels B., Chaterlian P., Peck M., Massingham R. Second generation h2 antagonists potency versus selectivity // Annual Meeting of The European Hisamine Research Society, 2002, 22 may, Eger, Hungary.
О. Б. Полосьянц, кандидат медицинских наук
ГКБ № 50, Москва
Контактная информация об авторе для переписки: 127206, Россия, Москва, ул. Вучетича, д. 217
Купить номер с этой статьей в pdf
АНТИГИСТАМИННЫЕ ПРЕПАРАТЫ: от димедрола к телфасту | #03/01
Исторически сложилось так, что под термином «антигистаминные препараты» понимают средства, блокирующие Н1-гистаминовые рецепторы, а лекарства, воздействующие на Н2-гистаминовые рецепторы (циметидин, ранитидин, фамотидин и др.), называют Н2-гистаминоблокаторами. Первые используются для лечения аллергических заболеваний, вторые применяются в качестве антисекреторных средств.
Гистамин, этот важнейший медиатор различных физиологических и патологических процессов в организме, был химически синтезирован в 1907 году. Впоследствии его выделили из тканей животных и человека (Windaus A., Vogt W.). Еще позднее были определены его функции: желудочная секреция, нейромедиаторная функция в ЦНС, аллергические реакции, воспаление и др. Спустя почти 20 лет, в 1936 году, были созданы первые вещества, обладающие антигистаминной активностью (Bovet D., Staub A.). И уже в 60-е годы доказана гетерогенность рецепторов в организме к гистамину и выделены три их подтипа: Н1, Н2 и Н3, различающиеся по строению, локализации и физиологическим эффектам, возникающим при их активации и блокаде. С этого времени начинается активный период синтеза и клинического тестирования разнообразных антигистаминных препаратов.
Многочисленные исследования показали что гистамин, воздействуя на рецепторы респираторной системы, глаз и кожи, вызывает характерные симптомы аллергии, а антигистаминные препараты, селективно блокирующие Н1-тип рецепторов, способны их предотвращать и купировать.
Большинство используемых антигистаминных средств обладает рядом специфических фармакологических свойств, характеризующих их как отдельную группу. Сюда относятся следующие эффекты: противозудный, противоотечный, антиспастический, антихолинергический, антисеротониновый, седативный и местноанестезирующий, а также предупреждение гистамининдуцированного бронхоспазма. Некоторые из них обусловлены не гистаминовой блокадой, а особенностями структуры.
Антигистаминные препараты блокируют действие гистамина на Н1-рецепторы по механизму конкурентного ингибирования, причем их сродство к этим рецепторам значительно ниже, чем у гистамина. Поэтому данные лекарственные средства не способны вытеснить гистамин, связанный с рецептором, они только блокируют незанятые или высвобождаемые рецепторы. Соответственно, Н1-блокаторы наиболее эффективны для предупреждения аллергических реакций немедленного типа, а в случае развившейся реакции предупреждают выброс новых порций гистамина.
По своему химическому строению большинство из них относятся к растворимым в жирах аминам, которые обладают сходной структурой. Ядро (R1) представлено ароматической и/или гетероциклической группой и связано при помощи молекулы азота, кислорода или углерода (Х) с аминогруппой. Ядро определяет выраженность антигистаминной активности и некоторые из свойств вещества. Зная его состав, можно предсказать силу препарата и его эффекты, например способность проникать через гематоэнцефалический барьер.
Существует несколько классификаций антигистаминных препаратов, хотя ни одна из них не является общепринятой. Согласно одной из наиболее популярных классификаций, антигистаминные препараты по времени создания подразделяют на препараты первого и второго поколения. Препараты первого поколения принято также называть седативными (по доминирующему побочному эффекту) в отличие от неседативных препаратов второй генерации. В настоящее время принято выделять и третье поколение: к нему относятся принципиально новые средства — активные метаболиты, обнаруживающие, помимо наивысшей антигистаминной активности, отсутствие седативного эффекта и характерного для препаратов второго поколения кардиотоксического действия (см. таблицу).
Кроме того, по химическому строению (в зависимости от Х-связи) антигистаминные препараты подразделяют на несколько групп (этаноламины, этилендиамины, алкиламины, производные альфакарболина, хинуклидина, фенотиазина, пиперазина и пиперидина).
Антигистаминные препараты первого поколения (седативные). Все они хорошо растворяются в жирах и, помимо Н1-гистаминовых, блокируют также холинергические, мускариновые и серотониновые рецепторы. Являясь конкурентными блокаторами, они обратимо связываются с Н1-рецепторами, что обусловливает использование довольно высоких доз. Для них наиболее характерны следующие фармакологические свойства.
- Седативное действие, определяется тем, что большинство антигистаминных препаратов первой генерации, легко растворяясь в липидах, хорошо проникают через гематоэнцефалический барьер и связываются с Н1-рецепторами головного мозга. Возможно, их седативный эффект складывается из блокирования центральных серотониновых и ацетилхолиновых рецепторов. Степень проявления седативного эффекта первого поколения варьирует у разных препаратов и у разных пациентов от умеренной до выраженной и усиливается при сочетании с алкоголем и психотропными средствами. Некоторые из них используются как снотворные (доксиламин). Редко вместо седатации возникает психомоторное возбуждение (чаще в среднетерапевтических дозах у детей и в высоких токсических у взрослых). Из-за седативного эффекта большинство лекарств нельзя использовать в период выполнения работ, требующих внимания. Все препараты первого поколения потенцируют действие седативных и снотворных лекарств, наркотических и ненаркотических анальгетиков, ингибиторов моноаминооксидазы и алкоголя.
- Анксиолитическое действие, свойственное гидроксизину, может быть обусловлено подавлением активности в определенных участках подкорковой области ЦНС.
- Атропиноподобные реакции, связанные с антихолинергическими свойствами препаратов, наиболее характерны для этаноламинов и этилендиаминов. Проявляются сухостью во рту и носоглотке, задержкой мочи, запорами, тахикардией и нарушениями зрения. Эти свойства обеспечивают эффективность обсуждаемых средств при неаллергическом рините. В то же время они могут усилить обструкцию при бронхиальной астме (в связи с увеличением вязкости мокроты), вызвать обострение глаукомы и привести к инфравезикальной обструкции при аденоме предстательной железы и др.
- Противорвотный и противоукачивающий эффект также, вероятно, связаны с центральным холинолитическим действием препаратов. Некоторые антигистаминные (дифенгидрамин, прометазин, циклизин, меклизин) средства уменьшают стимуляцию вестибулярных рецепторов и угнетают функцию лабиринта, в связи с чем могут использоваться при болезнях движения.
- Ряд Н1-гистаминоблокаторов уменьшает симптомы паркинсонизма, что обусловлено центральным ингибированием эффектов ацетилхолина.
- Противокашлевое действие наиболее характерно для дифенгидрамина, оно реализуется за счет непосредственного действия на кашлевой центр в продолговатом мозге.
- Антисеротониновый эффект, свойственный прежде всего ципрогептадину, обусловливает его применение при мигрени.
- α1-блокирующий эффект с периферической вазодилятацией, особенно присущий антигистаминным фенотиазинового ряда, может приводить к транзиторному снижению артериального давления у чувствительных лиц.
- Местноанестезирующее (кокаиноподобное) действие характерно для большинства антигистаминных средств (возникает вследствие снижения проницаемости мембран для ионов натрия). Дифенгидрамин и прометазин являются более сильными местными анестетиками, чем новокаин. Вместе с тем они обладают системными хинидиноподобными эффектами, проявляющимися удлинением рефрактерной фазы и развитием желудочковой тахикардии.
- Тахифилаксия: снижение антигистаминной активности при длительном приеме, подтверждающее необходимость чередования лекарственных средств каждые 2-3 недели.
- Следует отметить, что антигистаминные препараты первого поколения отличаются от второго поколения кратковременностью воздействия при относительно быстром наступлении клинического эффекта. Многие из них выпускаются в парентеральных формах. Все вышесказанное, а также низкая стоимость определяют широкое использование антигистаминных средств и в наши дни.
Более того, многие качества, о которых шла речь, позволили занять «старым» антигистаминным средствам свою нишу в области лечения некоторых патологий (мигрень, нарушения сна, экстрапирамидные расстройства, тревога, укачивание и др.), не связанных с аллергией. Немало антигистаминных препаратов первого поколения входит в состав комбинированных препаратов, применяющихся при простуде, как успокаивающие, снотворные и другие компоненты.
Наиболее часто используются хлоропирамин, дифенгидрамин, клемастин, ципрогептадин, прометазин, фенкарол и гидроксизин.
Хлоропирамин (супрастин) — один из самых широко применяемых седативных антигистаминных препаратов. Обладает значительной антигистаминной активностью, периферическим антихолинергическим и умеренным спазмолитическим действием. Эффективен в большинстве случаев для лечения сезонного и круглогодичного аллергического риноконъюнктивита, отека Квинке, крапивницы, атопического дерматита, экземы, зуда различной этиологии; в парентеральной форме — для лечения острых аллергических состояний, требующих неотложной помощи. Предусматривает широкий диапазон используемых терапевтических доз. Не накапливается в сыворотке крови, поэтому не вызывает передозировку при длительном применении. Для супрастина характерно быстрое наступление эффекта и кратковременность (в том числе и побочного) действия. При этом хлоропирамин может комбинироваться с неседативными Н1-блокаторами с целью увеличения продолжительности противоаллергического действия. Супрастин в настоящее время является одним из самых продаваемых антигистаминных препаратов в России. Это объективно связано с доказанной высокой эффективностью, управляемостью его клинического эффекта, наличием различных лекарственных форм, в том числе и инъекционных, и невысокой стоимостью.
Дифенгидрамин, наиболее известный в нашей стране под названием димедрол, — один из первых синтезированных Н1-блокаторов. Он обладает достаточно высокой антигистаминной активностью и снижает выраженность аллергических и псевдоаллергических реакций. За счет существенного холинолитического эффекта имеет противокашлевое, противорвотное действие и в то же время вызывает сухость слизистых, задержку мочеиспускания. Вследствие липофильности димедрол дает выраженную седатацию и может использоваться как снотворное. Оказывает значительный местноанестезирующий эффект, вследствие чего иногда применяется как альтернатива при непереносимости новокаина и лидокаина. Димедрол представлен в различных лекарственных формах, в том числе и для парентерального применения, что определило его широкое использование в неотложной терапии. Однако значительный спектр побочных эффектов, непредсказуемость последствий и воздействия на ЦНС требуют повышенного внимания при его применении и по возможности использования альтернативных средств.
Клемастин (тавегил) — высокоэффективный антигистаминный препарат, сходный по действию с дифенгидрамином. Обладает высокой антихолинергической активностью, однако в меньшей степени проникает через гематоэнцефалический барьер. Также существует в инъекционной форме, которая может использоваться как дополнительное средство при анафилактическом шоке и ангионевротическом отеке, для профилактики и лечения аллергических и псевдоаллергических реакций. Однако известна гиперчувствительность к клемастину и другим антигистаминным средствам, обладающим сходной с ним химической структурой.
Ципрогептадин (перитол) наряду с антигистаминным обладает значительным антисеротониновым действием. В связи с этим он в основном используется при некоторых формах мигрени, демпинг-синдроме, как средство, повышающее аппетит, при анорексии различного генеза. Является препаратом выбора при холодовой крапивнице.
Прометазин (пипольфен) — выраженное воздействие на ЦНС определило его применение при синдроме Меньера, хорее, энцефалите, морской и воздушной болезни, как противорвотное средство. В анестезиологии прометазин используется как компонент литических смесей для потенцирования наркоза.
Квифенадин (фенкарол) — обладает меньшей антигистаминной активностью, чем дифенгидрамин, однако характеризуется и меньшим проникновением через гематоэнцефалический барьер, что определяет более низкую выраженность его седативных свойств. Кроме того, фенкарол не только блокирует гистаминовые Н1-рецепторы, но и снижает содержание гистамина в тканях. Может использоваться при развитии толерантности к другим седативным антигистаминным препаратам.
Гидроксизин (атаракс) — несмотря на имеющуюся антигистаминную активность, как противоаллергическое средство не используется. Применяется как анксиолитическое, седативное, миорелаксирующее и противозудное средство.
Таким образом, антигистаминные средства первого поколения, влияющие как на Н1-, так и на другие рецепторы (серотониновые, центральные и периферические холинорецепторы, a-адренорецепторы), обладают различными эффектами, что определило их применение при множестве состояний. Но выраженность побочных действий не позволяет рассматривать их как препараты первого выбора при лечении аллергических заболеваний. Опыт, накопленный при их применении, позволил разработать препараты однонаправленного действия — второе поколение антигистаминных средств.
Антигистаминные препараты второго поколения (неседативные). В отличие от предыдущего поколения они почти не обладают седативным и холинолитическим эффектами, а отличаются избирательностью действия на Н1-рецепторы. Однако для них в разной степени отмечен кардиотоксический эффект.
Наиболее общими для них являются следующие свойства.
- Высокая специфичность и высокое сродство к Н1-рецепторам при отсутствии влияния на холиновые и серотониновые рецепторы.
- Быстрое наступление клинического эффекта и длительность действия. Пролонгация может достигаться за счет высокого связывания с белком, кумуляции препарата и его метаболитов в организме и замедленного выведения.
- Минимальный седативный эффект при использовании препаратов в терапевтических дозах. Он объясняется слабым прохождением гематоэнцефалического барьера вследствие особенностей структуры этих средств. У некоторых особенно чувствительных лиц может наблюдаться умеренная сонливость, которая редко бывает причиной отмены препарата.
- Отсутствие тахифилаксии при длительном применении.
- Способность блокировать калиевые каналы сердечной мышцы, что ассоциируется с удлинением интервала QT и нарушением ритма сердца. Риск возникновения данного побочного эффекта увеличивается при сочетании антигистаминных средств с противогрибковыми (кетоконазолом и интраконазолом), макролидами (эритромицином и кларитромицином), антидепрессантами (флуоксетином, сертралином и пароксетином), при употреблении грейпфрутового сока, а также у пациентов с выраженными нарушениями функции печени.
- Отсутствие парентеральных форм, однако некоторые из них (азеластин, левокабастин, бамипин) имеются в виде форм для местного применения.
Ниже представлены антигистаминные средства второй генерации с наиболее характерными для них свойствами.
Терфенадин — первый антигистаминный препарат, лишенный угнетающего действия на ЦНС. Его создание в 1977 году явилось результатом исследования как типов гистаминовых рецепторов, так и особенностей структуры и действия имеющихся Н1-блокаторов, и положило начало разработке новой генерации антигистаминных препаратов. В настоящее время терфенадин используется все реже, что связано с выявленной у него повышенной способностью вызвать фатальные аритмии, ассоциированные с удлинением интервала QT (torsade de pointes).
Астемизол — один из самых длительно действующих препаратов группы (период полувыведения его активного метаболита до 20 суток). Ему свойственно необратимое связывание с Н1-рецепторами. Практически не оказывает седативного действия, не взаимодействует с алкоголем. Поскольку астемизол оказывает отсроченное воздействие на течение заболевания, при остром процессе его применение нецелесообразно, однако может быть оправданно при хронических аллергических заболеваниях. Так как препарат обладает свойством кумулироваться в организме, возрастает риск развития серьезных нарушений сердечного ритма, иногда фатальных. В связи с этими опасными побочными явлениями продажа астемизола в США и некоторых других странах приостановлена.
Акривастин (семпрекс) — препарат с высокой антигистаминной активностью при минимально выраженном седативном и антихолинергическом действии. Особенностью его фармакокинетики является низкий уровень метаболизма и отсутствие кумуляции. Акривастин предпочтителен в тех случаях, когда нет необходимости постоянного противоаллергического лечения ввиду быстрого достижения эффекта и краткосрочного действия, что позволяет использовать гибкий режим дозирования.
Диметенден (фенистил) — наиболее близок к антигистаминным препаратам первого поколения, однако отличается от них значительно меньшей выраженностью седативного и мускаринового эффекта, более высокой противоаллергической активностью и длительностью действия.
Лоратадин (кларитин) — один из самых покупаемых препаратов второго поколения, что вполне обьяснимо и логично. Его антигистаминная активность выше, чем у астемизола и терфенадина, вследствие большей прочности связывания с периферическими Н1-рецепторами. Препарат лишен седативного эффекта и не потенцирует действие алкоголя. Кроме того, лоратадин практически не взаимодействует с другими лекарственными средствами и не обладает кардиотоксическим действием.
Нижеследующие антигистаминные средства относятся к препаратам местного действия и предназначены для купирования локальных проявлений аллергии.
Левокабастин (гистимет) используется в виде глазных капель для лечения гистаминозависимого аллергического конъюнктивита или в виде спрея при аллергическом рините. При местном применении в системный кровоток попадает в незначительном количестве и не оказывает нежелательных воздействий на центральную нервную и сердечно-сосудистую системы.
Азеластин (аллергодил) — высокоэффективное средство для лечения аллергического ринита и коньюнктивита. Применяемый в виде назального спрея и глазных капель, азеластин практически лишен системного действия.
Другое топическое антигистаминное средство — бамипин (совентол) в виде геля предназначен для использования при аллергических поражениях кожи, сопровождающихся зудом, при укусах насекомых, ожогах медуз, обморожениях, солнечных ожогах, а также термических ожогах легкой степени.
Антигистаминные препараты третьего поколения (метаболиты). Их принципиальное отличие в том что они являются активными метаболитами антигистаминных препаратов предыдущего поколения. Их главной особенностью является неспособность влиять на интервал QT. В настоящее время представлены двумя препаратами — цетиризином и фексофенадином.
Цетиризин (зиртек) — высокоселективный антагонист периферических Н1-рецепторов. Является активным метаболитом гидроксизина, обладающим гораздо менее выраженным седативным действием. Цетиризин почти не метаболизируется в организме, и скорость его выведения зависит от функции почек. Характерной его особенностью является высокая способность проникновения в кожу и, соответственно, эффективность при кожных проявлениях аллергии. Цетиризин ни в эксперименте, ни в клинике не показал какого-либо аритмогенного влияния на сердце, что предопределило область практического использования препаратов-метаболитов и определило создание нового средства — фексофенадина.
Фексофенадин (телфаст) представляет собой активный метаболит терфенадина. Фексофенадин не подвергается в организме превращениям и его кинетика не меняется при нарушении функции печени и почек. Он не вступает ни в какие лекарственные взаимодействия, не оказывает седативного действия и не влияет на психомоторную деятельность. В связи с этим препарат разрешен к применению лицам, деятельность которых требует повышенного внимания. Исследование влияния фексофенадина на величину QT показало как в эксперименте, так и в клинике полное отсутствие кардиотропного действия при использовании высоких доз и при длительном приеме. Наряду с максимальной безопасностью данное средство демонстрирует способность купировать симптомы при лечении сезонного аллергического ринита и хронической идиопатической крапивницы. Таким образом, особенности фармакокинетики, профиль безопасности и высокая клиническая эффективность делают фексофенадин наиболее перспективным из антигистаминных препаратов в настоящее время.
Итак, в арсенале врача имеется достаточное количество антигистаминных препаратов с различными свойствами. При этом необходимо помнить, что они обеспечивают лишь симптоматическое облегчение при аллергии. Кроме того, в зависимости от конкретной ситуации можно использовать как различные препараты, так и многообразные их формы. Для врача также важно помнить о безопасности антигистаминных средств.
| I поколение | II поколение | III поколение |
|
|
|
Вернуться
Антигистаминные препараты нового (4-го) поколения – список
Содержание:
Каждый год число аллергических реакций, включая дерматиты неуклонно растет, что связано с ухудшением экологической обстановки и «разгрузкой» иммунной системы в условиях цивилизации.
Аллергия – реакция повышенной чувствительности организма к чужеродному химическому веществу – аллергену. В его качестве могут выступать пищевые продукты, шерсть домашних животных, пыль, лекарства, бактерии, вирусы, вакцины и многое другое.
В ответ на попадание аллергена в органах и клетках иммунной системы начинается интенсивная выработка особого вещества – гистамина. Это вещество соединяется с Н1 – гистаминовыми рецепторами и вызывает появление признаков аллергии.
Если убрать провоцирующий фактор, проявления аллергии со временем пройдут, но в крови останутся клетки, хранящие память об этом веществе. При следующей встрече с ним аллергическая реакция может проявиться с большей силой.
Как действуют антигистаминные средства?
 Эти препараты связываются с Н1-гистаминовыми рецепторами и блокируют их. Таким образом гистамин не может связаться с рецепторами. Стихают явления аллергии: бледнеет сыпь, снижается отечность и зуд кожи, облегчается носовое дыхание и уменьшается явления конъюнктивита.
Эти препараты связываются с Н1-гистаминовыми рецепторами и блокируют их. Таким образом гистамин не может связаться с рецепторами. Стихают явления аллергии: бледнеет сыпь, снижается отечность и зуд кожи, облегчается носовое дыхание и уменьшается явления конъюнктивита.
Первые антигистаминные лекарства появились в 1930-х гг. По мере развития науки и медицины было создано второе, а затем третье поколение антигистаминных средств. В медицине применяют все три поколения. Список антигистаминных препаратов постоянно пополняется. Выпускаются аналоги, появляются новые формы выпуска.
Рассмотрим самые популярные препараты, начиная с последнего поколения.
Справедливости ради – деление на первое, второе и третье поколения имеет смысл, т.к. вещества различаются по свойствам и побочным действиям.Деление же на третье и четвертое поколение весьма условно, и зачастую не несет ничего, кроме красивого маркетингового слогана.
Иногда эти препараты относят и к третьему и к четвертому поколениям одновременно. Мы не будем запутывать Вас еще сильнее и назовем все это проще:
Последнее поколение – метаболиты
Наиболее современные лекарства. Отличительная особенность этого поколения в том, что препараты являются пролекарством. При попадании в организм они метаболизируются – активируются в печени. У лекарств отсутствует седативное действие, также они не влияют на работу сердца.
Антигистаминные препараты нового поколения успешно применяются для лечения всех видов аллергий и аллергических разновидностей дерматита у детей, людей, страдающих сердечно-сосудистыми заболеваниями. Также эти средства назначают людям, чья профессия связана с повышенным вниманием (водители, хирурги, пилоты).
Аллегра (Телфаст)
Инструкция и цена
Синоним: Фексадин
Действующее вещество – фексофенадин. Лекарство не только блокирует гистаминовые рецепторы, но и уменьшает его выработку. Применяется при хронической крапивнице и сезонной аллергии. Противоаллергическое действие сохраняется до 24 часов после окончания курса лечения. Не вызывает привыкания.
Выпускается только в виде таблеток. Раньше таблетки назывались Телфаст, сейчас — Аллегра. Они противопоказаны детям до 12 лет, беременным и кормящим женщинам.
Цетиризин
Инструкция и цена
Синонимы: Цетрин, Зодак, Зиртек
Эффект после приема развивается через 20 минут и сохраняется в течение 3 суток после отмены препарата. Применяется для лечения и профилактики аллергии. Цетиризин не вызывает сонливости и снижения внимания. Возможно длительное его применение. Препарат выпускается в виде капель (торговое название «Зиртек», «Зодак»), сиропа («Цетрин», «Зодак») и таблеток.
В детской практике используется с 6 месяцев в виде капель, с 1 года в виде сиропа. С 6 лет допускается прием таблеток. Дозировка подирается врачом индивидуально.
Беременным Цетиризин строго противопоказан. На период применения желательно прекратить грудное вскармливание.
Ксизал
Инструкция и цена
Синонимы: Левоцетиризин, Супрастинекс
Лекарство назначается для лечения круглогодичной и сезонной аллергии, крапивницы и кожного зуда. Действие наступает через 40 минут после приема. Выпускается в виде капель и таблеток.
В детской практике применяются капли с 2 лет и таблетки с 6 лет. Дозировку определяет врач в соответствии с массой и возрастом ребенка.
Беременным препарат противопоказан. Допускается прием во время грудного вскармливания.
Дезлоратадин
Инструкция и цена
Синонимы: Лордестин, Дезал, Эриус.
Препарат обладает антигистаминным и противовоспалительным эффектом. Хорошо устраняет признаки сезонной аллергии и хронической крапивницы. При приеме в лечебных дозах возможно появление сухости во рту и головной боли. Выпускается в форме сиропа, таблеток.
Детям назначается с 2 лет в виде сиропа. Таблетки разрешены для детей старше 6 лет.
Беременным и кормящим Дезлоратадин противопоказан. Возможно его применение при угрожающих жизни состояниях: отек Квинке, удушье (бронхоспазм).
Антигистаминные средства 3 поколения эффективно устраняют проявления аллергии. В терапевтических дозах не вызывают сонливости и снижения внимания. Однако при превышении рекомендуемых дозировок могут отмечаться головокружения, головная боль, увеличение частоты сердечных сокращений.
Если вы пользовались каким-либо их препаратов, не забудьте оставить отзыв в комментариях.
Второе поколение – неседативные
Препараты этой группы обладают выраженным антигистаминным эффектом, длительность которого составляет до 24 часов. Это позволяет принимать их 1 раз в сутки. Лекарства не вызывают сонливость и нарушения внимания, поэтому они называются неседативными.
Неседативные препараты активно используются для лечения:
Эти средства также применяются для снятия сильного зуда при ветряной оспе. К противоаллергическим средствам 2 поколения нет привыкания. Они быстро всасываются из пищеварительного тракта. Их можно принимать в любое время, даже во время еды.
Не рекомендуется 2-е поколение пожилым и людям с болезнями сердца.
Лоратадин
Инструкция и цена
Синонимы: Лорагексал, Кларитин, Ломилан
Действующее вещество – лоратадин. Лекарство избирательно воздействует на Н1 гистаминовые рецепторы, что позволяет быстро устранить аллергию и снизить количество побочных эффектов:
- тревожность, нарушения сна, депрессия;
- частое мочеиспускание;
- запоры;
- возможны приступы удушья;
- повышение массы тела.
Выпускается в форме таблеток и сиропа (торговые названия «Кларитин», «Ломилан»). Сироп (суспензию) удобно дозировать и давать маленьким детям. Действие развивается через 1 час после приема.
У детей Лоратадин применяется с 2 лет в форме суспензии. Дозировка подбирается врачом в зависимости от массы тела и возраста ребенка.
Лоратадин запрещен для применения в первые 12 недель беременности. В крайнем случае он назначается под строгим контролем врача.
Кестин
Инструкция и цена
Синоним: Эбастин
Это средство избирательно блокирует Н1 гистаминовые рецепторы. Не вызывает сонливости. Действие наступает через 1 час после приема. Антигистаминный эффект сохраняется в течение 48 часов.
У детей используется с 12 лет. Кестин оказывает токсическое действие на печень, вызывает нарушения ритма, снижает частоту сердечных сокращений. Беременным противопоказан.
Рупафин
Инструкция и цена
Синоним: Рупатадин
Лекарство используется при лечении крапивницы. После приема внутрь быстро всасывается. Одновременный прием пищи усиливает действие Рупафина. Он не используется у детей младше 12 лет и беременных женщин. Применение в период грудного вскармливания возможно только под строгим медицинским наблюдением.
Антигистаминные препараты 2 поколения отвечают всем современным требованиям, предъявляемым к лекарственным средствам: высокая эффективность, безопасность, длительное действие, удобство применения.
Однако следует помнить, что превышение лечебной дозировки приводит к обратному эффекту: появляется сонливость и усиливается побочное действие.
Первое поколение – седативные
 Седативными препараты называют потому, что они вызывают успокоительный, снотворный, подавляющий сознание эффект. У каждого представителя этой группы седативный эффект выражен в разной степени.
Седативными препараты называют потому, что они вызывают успокоительный, снотворный, подавляющий сознание эффект. У каждого представителя этой группы седативный эффект выражен в разной степени.
Кроме того, у первого поколения лекарств кратковременное противоаллергическое действие – от 4 до 8 часов. К ним может развивается привыкание.
Тем не менее, препараты проверены временем и, зачастую, недороги. Это объясняет их массовость.
Антигистаминные первого поколения назначаются для лечения аллергических реакций, снятия кожного зуда при инфекционных сыпных заболеваниях, для снижения риска поствакцинальных осложнений.
Наряду с хорошим противоаллергическим действием они вызывают ряд побочных эффектов. Для снижения их риска лечение назначается на 7–10 дней. Побочные явления:
- сухость слизистых, жажда;
- повышение частоты сердечных сокращений;
- падение артериального давления;
- тошнота, рвота, дискомфорт в желудке;
- повышение аппетита.
Препараты первого поколения не назначают людям, чья деятельность связана с повышенным вниманием: пилоты, водители, т.к. они могут ослабить внимание и мышечный тонус.
Супрастин
Инструкция и цена
Синонимы: Хлоропирамин
Выпускается как в виде таблеток так и в ампулах. Действующее вещество хлоропирамин. Один из самых часто применяемых противоаллергических препаратов. Супрастин обладает выраженным антигистаминным действием. Назначается для лечения сезонного и хронического насморка, крапивницы, атопического дерматита, экземы, отека Квинке.
Супрастин хорошо снимает зуд, в т. ч. после укуса насекомых. Применяется в комплексной терапии сыпных заболеваний, сопровождающиеся кожным зудом и расчёсами. Выпускается в виде таблеток, растворов для инъекций.
Супрастин разрешен для лечения грудных детей, начиная с одного месяца. Дозировка подбирается индивидуально в зависимости от возраста и массы тела ребенка. Эти средства применяются в комплексной терапии ветряной оспы: для снятия кожного зуда и в качестве успокоительного. Также супрастин входит в литическую смесь («тройчатку»), которую назначают при высокой и не сбиваемой температуре.
Супрастин противопоказан для применения при беременности и грудном вскармливании.
Тавегил
Инструкция и цена
Синоним: Клемастин
Применяется в тех же случаях, что и супрастин. Препарат обладает сильным антигистаминным действием длительностью до 12 часов. Тавегил не снижает артериальное давление, снотворный эффект менее выражен, чем у супрастина. Лекарство выпускается в нескольких формах: таблетки и раствор для инъекций.
Применение у детей. Тавегил применяется с 1 года. Сироп назначают детям с 1 года, таблетки можно применять с 6 лет. Дозировка определяется индивидуально в зависимости от возраста и массы тела ребенка. Дозу подбирает врач.
Тавегил запрещен для применения при беременности.
Фенкарол
Инструкция и цена
Синоним: Квифенадин
Фенкарол блокирует Н-1 гистаминовые рецепторы и запускает фермент, утилизирующий гистамин, поэтому эффект от препарата более стойкий и длительный. Фенкарол практически не вызывает успокоительный и снотворный эффект. Кроме того, имеются указания, что это лекарство имеет антиаритмический эффект. Фенкарол выпускается в форме таблеток и порошка для приготовления суспензии.
Квифенадин (Фенкарол) применяется для лечения всех видов аллергических реакций, особенно сезонной аллергии. Это средство входит в комплексное лечение паркинсонизма. В хирургии его используют в составе медикаментозной подготовки к наркозу (премедикации). Фенкарол применяется для профилактики реакций «хозяин–чужой» (когда организм отторгает чужеродные клетки) при переливаниях компонентов крови.
В детской практике препарат назначается с 1 года. Для детей предпочтительнее суспензия, она имеет апельсиновый вкус. Если ребенок отказывается принимать сироп, возможно назначение таблетированной формы. Дозировка определяется врачом с учетом веса и возраста ребенка.
Фенкарол противопоказан в 1 триместре беременности. Во 2 и 3 триместре применение его возможно под медицинским контролем.
Фенистил
Инструкция и цена
Синоним: Диметинден
Препарат применяется для лечения всех видов аллергий, кожного зуда при ветрянке, краснухе, профилактики аллергических реакций. Фенистил вызывает сонливость только в начале лечения. Через несколько суток седативное действие исчезает. Лекарство имеет ряд других побочных эффектов: головокружение, мышечные спазмы, сухость слизистой оболочки рта.
Фенистил выпускается в виде таблеток, капель для детей, геля и эмульсии. Гель и эмульсия применяются наружно после укусов насекомых, контактных дерматитах, солнечных ожогах. Существует еще и крем, но это совсем другой препарат на базе другого вещества и используется он при «простуде на губах«.
В детской практике Фенистил в виде капель применяется с 1 мясца. До 12 лет назначаются капли, старше 12 лет разрешены капсулы. Гель используется у детей с рождения. Дозировку капель и капсул подбирает врач.
Беременным разрешено применение препарата в виде геля и капель с 12 недель беременности. Со второго триместра Фенистил назначается только при угрожающих жизни состояниях: отек Квинке и острая пищевая аллергия.
Диазолин
Инструкция и цена
Синоним: Мебгидролин
Лекарство обладает низкой антигистаминной активностью. У Диазолина довольно большое количество побочных проявлений. При его приёме возникают головокружения, боли в желудке, тошнота и рвота, учащение сердцебиения, частые мочеиспускания. Но вместе с тем, Диазолин не вызывает сонливость. Он разрешен для длительного лечения у водителей и пилотов.
Выпускается в форме таблеток, порошка для приготовления суспензии и драже. Длительность противоаллергического действия до 8 часов. Принимается 1-3 раза в день.
У детей лекарство назначается с 2 летнего возраста. До 5 лет предпочтительнее Диазолин в виде суспензии, старше 5 лет допускается прием таблеток. Дозировка подбирается врачом индивидуально.
Диазолин противопоказан в первом триметре беременности.
Несмотря на все недостатки, препараты первого поколения широко применяются в медицинской практике. Они хорошо изучены, разрешены для лечения детей раннего возраста. Лекарства выпускаются в разных формах: растворы для инъекций, суспензии, таблетки, что делает удобным их использование и подбор индивидуальной дозировки.
Если статья оказалась полезной – не забудьте поделиться ей.
Антигистаминные препараты хорошо справляются с аллергическим дерматитом, и (в большинстве случаев) с атопическим тоже.
Следует помнить, что лекарства должны приниматься в строго определенной дозе, по инструкции. В противном случае возможно появление нежелательных эффектов, даже (!) усиление аллергической реакции.
Подбор лекарства и его дозы должен выполнять врач. Противоаллергическое лечение, особенно детей и беременных женщин, должно проводится под строгим медицинским наблюдением.
Антигистаминные препараты: первое и второе поколения
Аллергия готовься!
Для начала выясним, что способствует развитию аллергической реакции. От чего у нас могут появится внезапный кожный зуд, отек слизистой дыхательных путей, боли в животе и прочие проявления острой аллергии? Виной тому - выброс гистамина, медиатора, который выделяется в ответ на попадание аллергена.
Поэтому в борьбе с проявлениями аллергии важное место занимает прием препаратов, блокирующих рецепторы гистамина, снижающих его влияние на организм. Они называются антигистаминными. Существует два поколения антигистаминных лекарственных препаратов.1, 2 Рассмотрим их подробнее.
Антигистаминные препараты 1 поколения
Каждое их поколение – это своеобразный эволюционный виток в развитии лекарственных средств. Чем они новее, тем благоприятнее их профиль безопасности, риск формирования лекарственной устойчивости ниже, а продолжительность действия выше.2
Первое поколение появилось в начале 20 века, и их эффекты связаны с блокирующим действием на гистаминовые рецепторы. Однако, к сожалению для аллергиков, связь с этими рецепторами очень непрочная и легко обратимая, и именно по этой причине клинический эффект данных препаратов быстро снижается, и требуется частый прием этих лекарств. В среднем, он появляется через 30 минут после приема, а длительность его действия ограничена 4-12 часами. Связано это с тем, что эти препараты быстро метаболизируются и выводятся с мочой.1
К сожалению, у антигистаминных препаратов 1 поколения есть ряд серьезных побочных эффектов, значительно ограничивающих их применение. Дело в том, что действующие вещества проникают через гематоэнцефалический барьер (своего рода физиологический фильтр между кровеносной системой и центральной нервной системой, через который в мозг поступают питательные, биоактивные вещества и часть лекарственных средств), где происходит их связывание с рецепторами головного мозга, развивается блокада центральных серотониновых и м-холинорецепторов. Это может стать причиной развития седативного эффекта разной степени выраженности, от незначительного до сильного.
Есть и другие побочные эффекты - сухость во рту, усиление обструкции (непроходимости) дыхательных путей, повышение вязкости мокроты, тахикардия, нечеткость зрения. Из негативных свойств стоит отметить развитие тахифилаксии, то есть снижения эффекта через определенный промежуток приема, обычно через 15-20 дней.1, 2
Наиболее известные антигистаминные препараты 1 поколения:
-
Димедрол.
-
Мебгидролин.
Может вызывать чувство головокружения, торможение психической активности. Из-за раздражающего влияния на слизистую желудка рекомендуется принимать после еды. -
Хлоропирамин.
Может использоваться при конъюнктивите и аллергии на коже. Для быстрого эффекта назначается в инъекциях.1, 2
Антигистаминные препараты 2 поколения
Препараты 2 поколения отличаются минимальным влиянием на серотониновые и, так называемые, м-холинорецепторы, а также тем, что к ним очень чувствительны гистаминовые рецепторы. Эти препараты действуют продолжительнее — до 48 часов, поэтому их можно принимать реже, что может снизить риск побочных эффектов.1
Они практически не вызывают седативного действия, нет у них и эффекта тахифилаксии, поэтому они могут назначаться длительно (по рекомендации врача). Однако стоит помнить, что препараты 2 поколения могут оказывать нежелательное воздействие на сердце, поэтому при их длительном приеме необходимо контролировать работу сердечной мышцы.1
Антигистаминные препараты второго поколения:
-
Лоратадин
Действует длительно, до 24 часов. Снимает зуд, отеки, нормализует проницаемость капилляров. -
Цетиризин
Применяется для предотвращения и снижения симптомов аллергии. Действует быстро, эффект отмечается примерно через 20 минут и сохраняется больше суток.3 -
Эбастин.
Назначается при проявления аллергии на коже и слизистой глаз. Не проникает в головной мозг, поэтому на нервную систему и психические реакции влияние Эбастина минимально.
Активные метаболиты препаратов 2 поколения
Существуют абсолютно современные разработки, которые практически лишены недостатков лекарств от аллергии предыдущих поколений. Они не влияют на сердце и центральную нервную систему, не подавляют психические реакции, не приводят к привыканию.
К этим препаратам можно отнести фексофенадин и дезлоратадин. Первый показан при сезонном аллергическом рините и при хронической крапивнице, препятствует выбросу гистамина и развитию реакций на аллерген. При этом действие начинается примерно через 1 час после приема дозы, и длится до суток. Второй препарат назначается при аллергическом насморке, крапивнице. Он блокирует выброс биологически-активных факторов аллергии и предупреждает симптомы заболевания. Снимает спазм, уменьшает отеки и зуд, нормализует проницаемость капилляров. Эффект появляется относительно быстро, примерно в течение 30 минут после приема дозы и продолжается до 24 часов.
Современные антигистаминные препараты в лечении аллергических заболеваний | Горячкина Л.А.
На протяжении 60 лет антигистаминные препараты (АГП) используются в терапии следующих аллергических заболеваний:
• аллергический ринит (сезонный и круглогодичный)
• аллергический конъюнктивит
• кожные аллергические заболевания (атопический дерматит, острая и хроническая крапивница, отек Квинке и др.)
• аллергические реакции на укусы и ужаления насекомых
• профилактика осложнений при СИТ и др.
Попытки использовать вновь получаемые антигистаминные препараты шире, чем это логически обосновано, дискредитируют даже те лекарственные средства, эффективность которых для лечения гистаминергических симптомов чрезвычайно высока.
Аллергические заболевания, в частности, аллергический ринит, атопическая астма, хроническая идиопатическая крапивница, атопический дерматит, относятся к числу наиболее распространенных патологических состояний у человека. Хотя эти заболевания обычно не создают угрозы для жизни, тем не менее они могут значительно ухудшить качество жизни больных. Аллергические заболевания имеют сходный патогенез и по сути дела могут рассматриваться, как местные проявления системного аллергического воспаления. Одним из главных медиаторов аллергических реакций является гистамин, поэтому средствами выбора в лечении аллергических заболеваний, прежде всего ринита и хронической крапивницы, остаются блокаторы Н1–гистаминовых рецепторов.
АГП I поколения
Фармакологические эффекты антигистаминных препаратов I поколения (этаноламины, этилендиамины и др.) определяются их чрезвычайно высокой липофильностью и способностью блокировать рецепторы разных типов:
- антигистаминное действие (блокада рецепторов гистамина)
- антихолинергическое действие (уменьшение экзокринной секреции, повышение вязкости секретов)
- центральная холинолитическая активность (седативное и снотворное действие)
- усиление действия депрессантов ЦНС
- потенцирование эффекта катехоламинов (колебания АД)
- местное анестезирующее действие.
Фармакологические особенности действия антигистаминных препаратов I поколения дают большой спектр побочных эффектов.
Побочные действия АГП I поколения
- Седативный и снотворный эффекты: сонливость, чувство усталости или возбуждения, дрожь, нарушение сна
- Нарушение координации движений, концентрации внимания и атаксия (эффекты потенцируются алкоголем)
- Головокружение, головные боли, понижение давления
- Сухость во рту, онемение слизистой полости рта
- Боли в желудке, запоры, тошнота, задержка мочи (атропиноподобные эффекты)
- Кожные высыпания
- Бронхоспазм
- Кардиоваскулярные эффекты, тахикардия
- При парентеральном введении – транзиторное падение артериального давления, периферическая вазодилатация.
- Работа, требующая психической и двигательной активности, внимания
- Заболевания: бронхиальная астма, язвенная болезнь желудка и двенадцатиперстной кишки с пилородуоденальным стенозом, гиперплазия предстательной железы, задержка мочеиспускания, сердечно–сосудистые заболевания
- Фармакологическая несовместимость со следующими препаратами: холинолитиками, противосудорожными препаратами, нейролептиками, трициклическими антидепрессантами, ингибиторами МАО, средствами для лечения паркинсонизма и диабета.
Широкий спектр фармакологической активности расширяет возможности их использования не только при аллергических заболеваниях:
Широкий спектр фармакологической активности расширяет возможности их использования не только при аллергических заболеваниях:
- Аллергические реакции немедленного типа (ринит, конъюнктивит, зуд, сенная лихорадка, атопический и контактный дерматит, сывороточная болезнь)
- Профилактическое применение при введении либераторов гистамина (тубокурарин)
- Бессонница
- Паркинсонизм
- Рвота беременных
- Вестибулярные расстройства
- Простудные заболевания.
Антигистаминные препараты I поколения используют и будут использовать, главное – делать это разумно, учитывая все характеристики этих препаратов. Они существуют в виде раствора, поэтому в тех ситуациях, когда требуется применение растворов, нужно использовать антигистаминные препараты I поколения.
Для лечения хронических заболеваний, требующих длительного применения препаратов, более показано использование антигистаминных препаратов II поколения (лоратадин, цетиризин, эбастин и др.) и их метаболитов, которые в литературе нередко называют препаратами III поколения (фексофенадин, дезлоратадин, норастемизол и др.).
АГП II поколения
У антигистаминных препаратов II поколения (астемизол, терфенадин) в терапевтических дозах отсутствует седативный эффект, однако при применении их в практике обнаружились осложнения другого рода.
Начиная с 1986 г., в ряде публикаций дано описание удлинения интервала QT и трепетания–мерцания желудочков сердца, связанных с применением астемизола. Пациенты отрицали факт превышения дозы препарата, однако уровни его в плазме и кинетика выведения четко указывали на передозировку.
Воздействие на деятельность сердца также описывалось у терфенадина, примененного в комбинации с кетоконазолом или эритромицином. Это обусловлено повышением концентрации терфенадина в плазме под действием вышеперечисленных препаратов, ингибирующих цитохром Р450.
Использование этих препаратов в терапевтических дозах вызывало нарушения сердечного ритма (кардиотоксический эффект), что связано с особенностями их метаболизма и фармакокинетики. Антигистаминное действие осуществляется за счет активных метаболитов, которые образуются в печени при участии ферментов системы цитохрома P450. Макролиды и противогрибковые препараты обладают способностью ингибировать активность этого фермента, следствием чего является накопление исходного препарата в крови и ткани сердца, что приводит к нарушениям сердечного ритма. Не исключена возможность этих осложнений и при применении эбастина.
Кроме того, к факторам риска развития аритмий при приеме АГП относят: нарушение функций печени, злоупотребление алкоголем, электролитные нарушения, заболевания сердца, одновременное использование противоаритмических и психотропных средств.
Лоратадин, метаболизирующийся двумя изоферментами системы цитохрома Р450, подобных осложнений лишен. Лоратадин не имеет отрицательного влияния на деятельность сердца, что является бесспорным преимуществом этого препарата.
Метаболиты антигистаминных препаратов II поколения (фексофенадин, дезлоратадин, норастемизол и др.) при отсутствии седативного, кардиотоксического и других нежелательных эффектов имеют значительно лучший профиль безопасности.
Однако АГП подавляют не все симптомы аллергии, например, они оказывают небольшое влияние на заложенность носа у больных сезонным аллергическим ринитом и малоэффективны при атопической астме. Это не удивительно, так как препараты этой группы действуют лишь на один компонент аллергического каскада, что определяет необходимость разработки новых, более эффективных противоаллергических средств. Ниже обсуждаются механизмы действия и результаты клинических исследований дезлоратадина (Эриус), который не только селективно блокирует Н1–гистаминовые рецепторы, но и обладает выраженной противоаллергической и противовоспалительной активностью за счет подавления различных элементов раннего и позднего аллергического ответа.
Дезлоратадин
Дезлоратадин – активный метаболит лоратадина, хорошо известного селективного блокатора Н1–гистаминовых рецепторов II поколения. Дезлоратадин обладает сходными фармакодинамическими свойствами, однако по активности превосходит лоратадин (в 2,5–4 раза) и другие препараты этой группы. В экспериментальных исследованиях антигистаминные средства располагались в следующем порядке по сродству к Н1–гистаминовым рецепторам (по убыванию): дезлоратадин > хлорфенирамин > гидроксизин > мизоластин > терфенадин > цетиризин > эбастин > лоратадин > фексофенадин [2,11]. In vitro дезлоратадин обладает значительно менее выраженным сродством к Н2– и мускариновым рецепторам, чем к Н1–рецепторам [15,16]. Селективность препарата подтверждают и результаты плацебо–контролируемых фармакологических и клинических исследований, в которых дезлоратадин не вызывал антихолинергических симптомов, таких как сухость во рту и нарушение зрения [11].
Доклинические исследования показали, что дезлоратадин ингибирует многие медиаторы, принимающие участие в развитии системного аллергического воспаления, включая цитокины и хемокины, а также молекулы адгезии. Например, дезлоратадин снижал выброс гистамина, триптазы, лейкотриена С4 и простагландина D2 тучными клетками и базофилами in vitro [8,11,14], стимулированную секрецию тучными клетками человека интерлейкинов 3 и 4, фактора некроза опухоли a и гранулоцитарно–макрофагального колониестимулирующего фактора [19], секрецию интерлейкина–8 тучными клетками, базофилами и эндотелиальными клетками [20,23], и высвобождение RANTES в препаратах эпителия полипов носа [18], активность молекул адгезии, в том числе Р–селектина и ICAM–1, in vitro [23,25]. Недавно опубликованы данные о подавляющем действии препарата на хемотаксис и активацию эозинофилов in vitro и образование супероксидного радикала [1]. Таким образом, дезлоратадин обладает широким спектром противоаллергической и противовоспалительной активности, что должно способствовать повышению его эффективности при лечении аллергических заболеваний.
У здоровых людей дезлоратадин метаболизируется главным образом, путем глюкуронирования с образованием 3–ОН формы. Фармакокинетика дезлоратадина линейная и пропорциональна дозе. Период его полувыведения составляет 21–24 ч, что позволяет назначать этот препарат один раз в сутки. У больных с нарушением функции печени Cmax и AUC дезлоратадина были значительно выше, чем у здоровых людей, хотя концентрация препарата не превышала таковую при применении дезлоратадина в высокой дозе (45 мг/сут) в течение 10 дней. В более низкой терапевтической дозе 5 мг/сут дезлоратадин, вероятно, безопасен для больных с нарушенной функцией печени.
Прием пищи может оказать нежелательное влияние на скорость и степень всасывания лекарственных веществ. Фармакокинетика и биодоступность дезлоратадина были сходными при приеме препарата натощак или после стандартизированной пищи у здоровых людей (Cmax натощак и после еды составила 3,3 и 3,53 нг/мл соответственно, р=0,17) [9]. Таким образом, дезлоратадин можно принимать как после еды, так и натощак.
Клиническая эффективность
Сезонный аллергический ринит
Сезонный аллергический ринитОдно из главных показаний к применению блокаторов Н1–гистаминовых рецепторов – аллергический ринит. Эффективность дезлоратина в дозе 5 мг 1 раз в сутки у больных сезонным аллергическим ринитом изучалась в 4 рандомизированных, двойных слепых, плацебо–контролируемых исследованиях [22,24,25,30]. В эти исследования включали больных старше 12 лет, у которых имелись среднетяжелый и тяжелый сезонный аллергический ринит, по крайней мере, двухлетний анамнез поллиноза, положительная кожная проба на сезонный аллерген в течение предыдущего года и отсутствовали анатомические изменения носа. В течение 3–4-х дней вводного периода и во время лечения больные оценивали выраженность различных симптомов ринита по 4–балльной шкале (0 – нет, 3 – выраженный). До приема утренней дозы пациенты давали оценку симптомам, которая отражает эффект препарата в конце интервала дозирования (действие некоторых лекарственных средств может оказаться неполным в течение этого интервала). Кроме того, утром и вечером больные оценивали выраженность симптома за предыдущие 12 ч. Затем определяли среднее значение полученных индексов. Критерием эффективности была динамика индексов отдельных симптомов и суммарного индекса симптомов.
Во всех исследованиях дезлоратадин по эффективности достоверно превосходил плацебо и уменьшал все симптомы ринита (ринорею, зуд, чихание и т.д.). Особый интерес представляют результаты изучения деконгестивного действия дезлоратадина при аллергическом рините. АГП, как правило, слабо влияют на заложенность носа, поэтому в клинических исследованиях этот симптом обычно даже не учитывается при расчете суммарного индекса симптомов. Лечение дезлоратадином привело к значительному уменьшению индекса заложенности носа (по сравнению с плацебо) в течение нескольких часов после приема первой дозы, и деконгестивный эффект сохранялся на протяжении всего исследования (15–28 дней). F.Horak и соавт. [12] использовали специальную камеру, позволяющую провести контролируемую провокацию аллергеном, для оценки эффектов дезлоратадина на симптомы сезонного аллергического ринита. Медиана времени до уменьшения симптомов составила 48,5 мин, что указывало на быстрый эффект первой дозы. У всех 28 пациентов, подвергавшихся действию аллергена в течение 4 ч на 1–й и 4–й дни применения дезлоратадина, отмечено уменьшение суммарных индексов симптомов по крайней мере на 25% в течение 160 мин, а у 19 (68%) – в течение 60 мин. У больных, у которых суммарный индекс симптомов уменьшился, по крайней мере, на 2 балла, средний индекс заложенности носа уменьшился почти на 10% через 10 мин, на 22% через 20–30 мин, на 40% через 60 мин и почти на 50% через 90–120 мин (рис.1).
Рис. 1. Снижение индекса заложенности носа при применении дезлоратадина
Таким образом, дезлоратадин оказался единственным блокатором Н1–гистаминовых рецепторов, который в контролируемых исследованиях давал постоянный деконгестивный эффект. Этот эффект проявлялся в течение нескольких минут или часов после приема первой дозы и сохранялся до 4 недель. Напротив, в сходных двойных слепых плацебо–контролируемых рандомизированных исследованиях других антигистаминных препаратов, таких как цетиризин (5–10 мг 1 раз в сутки), признаков деконгестивного действия не выявлено [13,28] или оно было непостоянным. Деконгестивный эффект дезлоратадина имеет важное клиническое значение. Обструкцией носа страдают 47–64% больных сезонным и круглогодичным аллергическим ринитом [34], почти в два раза повышен риск нарушений дыхания во время сна [37]. Кроме того, отечность и воспаление слизистой оболочки носа могут ограничить всасывание других лекарственных средств [21]. Больные, страдающие заложенностью носа, чаще дышат через рот, что может способствовать ингаляции аллергенов и прогрессированию ринита [5]. Следует отметить, что обструкция носа связана с воспалительными изменениями слизистой оболочки носовой полости, которые возникают в результате повышения секреции различных провоспалительных медиаторов. Соответственно, деконгестивное действие дезлоратадина подтверждает тот факт, что его эффект нельзя объяснить только блокадой Н1–гистаминовых рецепторов.В нескольких многоцентровых рандомизированных двойных слепых плацебо–контролируемых исследованиях изучалась эффективность дезлоратадина у больных сезонным аллергическим ринитом, сочетавшимся с бронхиальной астмой [4,26]. Критериями включения в эти исследования были наличие сезонного аллергического ринита и астмы в течение по крайней мере 2 лет, применение только агонистов b2–адренорецепторов по потребности, объем форсированного выдоха за 1 с (ОФВ1) і 70% от должного и положительная кожная проба на сезонный аллерген в течение года до начала исследования. Из исследований исключали больных, получавших кортикостероиды, антигистаминные средства или деконгестанты в любых формах, пользовавшихся сальбутамолом более 12 раз в сутки, а также пациентов, страдавших другими серьезными заболеваниями. Все 4–недельные исследования предполагали 3–4–дневный вводный период, во время которого больные оценивали исходную выраженность симптомов по 4–балльной шкале (0 – нет, 3 – выраженный). Симптомы оценивали в конце интервала дозирования перед приемом утренней дозы (т.е. в конце действия препарата). Кроме того, утром и вечером оценивали выраженность симптомов за предыдущие 12 ч и определяли среднее значение двух индексов. Исследования проводили во время сезона аллергии.
У 311 больных сезонным аллергическим ринитом/ астмой терапия дезлоратадином 1 раз в сутки привела к значительному уменьшению симптомов ринита. В группе дезлоратадина суммарный индекс симптомов ринита за предыдущие 12 ч снизился по сравнению с исходным на 31–35% на 1–2 неделе и 1–4 неделе соответственно, а в группе плацебо – на 20–25% (р<0,001 для каждого сравнения между группами). Уже на 1–й день (в течение 12 ч после приема первой дозы) дезлоратадин снижал суммарный индекс симптомов на 21% по сравнению с исходным, а плацебо – на 7% (р<0,001) [33]. Сходные данные получили Nathan и соавт. [24], которые оценивали эффект дезлоратадина на заложенность носа у 613 больных, страдавших сезонным аллергическим ринитом и астмой в течение, по крайней мере, 2 лет. Динамика заложенности носа, как и суммарного индекса симптомов, в группе дезлоратадина была значительно более выраженной, чем в группе плацебо. Деконгестивный эффект проявлялся уже на 1–й день приема дезлоратадина.
В перечисленных клинических исследованиях продемонстрированы безопасность и хорошая переносимость дезлоратадина. Частота нежелательных явлений в основной и контрольной группах была сходной. Головная боль была единственным нежелательным явлением (его частота превышала 5%), однако она была одинаковой в группах сравнения [33]. Клинически значимых изменений электрокардиографических (например, интервала QT) или лабораторных параметров не выявили.
Таким образом, результаты клинических исследований демонстрируют эффективность дезлоратадина у больных астмой и сопутствующим аллергическим ринитом, что позволяет включать препарат в схему лечения таких пациентов. Эти данные еще раз подтверждают тот факт, что эффекты дезлоратадина не ограничиваются блокадой Н1–рецепторов. Однако следует отметить, что эффективность дезлоратадина у больных астмой без аллергического ринита еще предстоит изучить в клинических исследованиях.
Хроническая идиопатическая крапивница
Хроническая идиопатическая крапивница (ХИК) – это распространенное заболевание кожи, поражающее около 0,1–3% населения США и Европы и проявляющееся зудом и кожными высыпаниями, которые могут сохраняться годами. У больных ХИК наблюдается ухудшение качества жизни, главным образом в результате зуда кожи, плохого сна и обезображивающих высыпаний. Влияние этого заболевания на качество жизни можно сравнить с таковым при хронической болезни сердца [27]. Основой лечения ХИК являются антигистаминные средства, хотя они не всегда дают адекватный эффект, что заставляет продолжать поиск новых препаратов, обладающих более высокой фармакологической активностью и длительностью действия.
Недавно завершено двойное слепое плацебо–контролируемое многоцентровое исследование дезлоратадина у 190 больных среднетяжелой и тяжелой хронической идиопатической крапивницей [32]. При обострении заболевания пациентам назначали дезлоратадин 5 мг/сут или плацебо. Длительность лечения могла достигать 6 недель. Первичным критерием эффективности была средняя динамика индекса зуда в течение первых 7 дней лечения по сравнению с исходным показателем. В группе дезлоратадина индекс зуда уменьшился на 56%, а в группе плацебо – на 22% (р<0,001). При лечении дезлоратадином была отмечена также большая динамика вторичных показателей эффективности по сравнению с плацебо: числа высыпаний (–48% и –16%, р<0,001), размера самых крупных волдырей (–49% и –17%, р<0,001) и суммарного индекса симптомов (–51,6% и 19,3%, р<0,001). Терапия дезлоратадином по сравнению с плацебо привела также к значительному улучшению сна и повседневной активности. В течение первой недели лечения степень нарушения сна при применении дезлоратадина и плацебо уменьшилась на 53% и 18% соответственно (р<0,001). Сходную динамику претерпела степень нарушения повседневной активности, которая уменьшилась на 50% и 20% (р<0,001) в двух группах соответственно. Через 6 недель в группе дезлоратадина сохранялось статистически значимое уменьшение зуда по сравнению с группой плацебо (р<0,001), что указывало на стойкость эффекта препарата. По всем другим показателям эффективности (включая нарушения сна и повседневной активности) дезлоратадин также значительно превосходил плацебо.
Одной из главных целей лечения ХИК является быстрое купирование симптомов. После приема первой дозы препарата зуд уменьшился на 45% в группе дезлоратадина и только на 20% в группе плацебо (р<0,001). Динамика суммарного индекса симптомов, степени нарушения сна, повседневной активности, числа и размера высыпаний отражала быстрое начало действия и длительность эффекта дезлоратадина.
Как больные, так и исследователи высоко оценивали общую положительную динамику симптомов ХИК и ответ на лечение дезлоратадином. Переносимость дезлоратадина была хорошей. С лечением связывали лишь один случай нежелательных явлений (головная боль), однако этот пациент продолжил участие в исследовании.
Таким образом, дезлоратадин по сравнению с плацебо давал быстрый, выраженный и стойкий эффект у больных хронической идиопатической крапивницей и уменьшал нарушения сна и повседневной активности, что могло способствовать улучшению качества жизни обследованных больных.
Заключение
Дезлоратадин (Эриус) – мощный и селективный блокатор Н1–гистаминовых рецепторов, по фармакологической активности превосходящий другие препараты этой группы. Дезлоратадин дает не только антигистаминный эффект, но и блокирует многие другие медиаторы, участвующие в развитии системного аллергического воспаления, т.е. оказывает противоаллергическое и противовоспалительное действие. Важным достоинством препарата является удобная схема применения (один раз в сутки).
В двойных слепых плацебо–контролируемых рандомизированных исследованиях доказана эффективность дезлоратадина в дозе 5 мг один раз в сутки у больных сезонным аллергическим ринитом и хронической идиопатической крапивницей, которые являются основными показаниями к назначению Н1-блокаторов. В отличие от других АГП II поколения, у больных сезонным аллергическим ринитом дезлоратадин уменьшал не только чихание, ринорею и зуд, но и заложенность носа. Продемонстрирована также эффективность дезлоратадина у больных с сочетанием аллергического ринита и атопической астмы.
Дезлоратадин хорошо переносится, не вызывает сонливости и удлинения интервала QT на ЭКГ. Безопасность дезлоратадина подтверждает многолетний опыт применения лоратадина, активным метаболитом которого он является.
Литература:
1. Agrawal D., Berro A., Townely R. Desloratadine attenuation of eosinophil chemotaxis, adhesion, and superoxide generation. Allergy,. 2000, 55 (suppl. 63), S276, Abstract 990.
2. Anthes J., Richard C., West R. et al. Functional characteristics of desloratadine and other anhistamines in human Yl receptors. Allergy, 2000, 55 (suppl. 63), S279 (Abstract 994).
3. Baena–Cagnani C. and the Desloratadine Study Group. Desloratadine improved asthma symptoms and decreased beta2–agonist use in patents with seasonal allergic rhinitis and concomitant asthma. XXth Congress of Europ. Academy of Allergology and Clinical Immunology, Berlin, 2001.
4. Baena–Cagnani C. Desloratadine activity in concurrent seasonal allergic rhinitis and asthma. Allergy, 2001, 56 (suppl. 65), 21–27.
5. Corren J. Allergic rhinitis and asthma: how important is the link? J. Allergy Clin. Immunol., 1997, 99, S781–S786.
6. DuBuske L. Second–generation antihistamies: the risk of ventricular arrhythmias. Clin. Ther., 1999, 21 (2), 281–285.
7. Geha R., Meltzer E. Desloratadine: a new, nonsedating, oral antihistamine. J. Allergy Clin. Immunol., 2001, 107 (4), 751–762.
8. Genovese A., Patella V., De Crcsccnzo G. ct al. Loratadine and desethoxycar–bonyl–loratadine inhibit the immunological release of mediators from human Fc epsilon R1+ cells. Clin. Exp. Allergy, 1997, 27, 559–567.
9. Gupta S., Banfield C., Kantesaria B. et al. Pharmacokinetic and safety profile of desloratadine and fexofenadine when coadministered with azithromycin: a randomized, placebo–controlled, parallel–group study. Clin. Ther., 2001, 23 (3), 451–466.
10. Gupia S., Padhi d., Banfield C. el al. The oral bioavailabuity of desloratadine is unaffected by food. Allergy, 2000, 55 (suppl. 63), Abstract 959.
11. Henz B. The pharmacological profile of desloratadie: a review. Allergy, 2001, 56 (suppl. 65), 7–13.
12. Horak F., Stubner U., Zieglmayer R. et al. Onset and duration of action of desloratadine. XIX Congress of Europ. Academy of Allergology and Clinical Immunology, Lisbon, 2000.
13. Howarth P., Stem M., Roi L. et al. Double–blind, placebo–controlled study comparing the efficacy and safety of fexofenadine hydrochloride (120 and 180 mg once daily) and cetirizine in seasonal allergic rhinitis. J. Allergy Clin. Immunol., 1999, 104, 927–933.
14. Kleine–Tebbe J., Josties C., Frank G. et ai. Inhibition of IgE–mediated and IgE–independent histamine release from human basophil leukocytes in vitro by Hl–antagonist, descarbo–ethoxyloratadine. J. Allergy Clin. Immunol., 1994, 93, 494–500.
15. Kreutner W., Hey J., Anthes J. et al. Preclinical pharmacology of desloratadine, a selective and nonsedating histamine HI receptor antagonist, 1st communication: receptor selectivity, antihistaminic activity, and antiallergic effects. Arzneimittelforschung, 2000, 50, 345–352.
16. KLreutner W., Hey J., Anthes J. et al. Preclinical studies of desloratadine, a nonsedating, selective histamine HI receptor antagonist with antiallergic activity. Allergy, 2000, 55 (suppl. 63), S278 (Abstract 997).
17. Kreutner W., Hey J., Chiu P., Barnett A. Preclinical pharmacology of desloratadine, a selective and nonsedating histamine HI–receptor antagonist, 2nd communication: lack of central nervous system and cardiovascular effects. Arzneimittelfoschung. 2000, 50 (5), 441–448.
18. Lebel B., Bousquet J., Czarlewski W., CampbcU A. Loratadine reduces RANTES release by an epithelial cell line. J. Allergy Clin. Tmmunol., 1997, 99, (S444), Abstract 1802.
19. Lippert U., Moller A., Welker P. et al. Inhibition of cytokine secretion from human leukemic mast cells and basophils by HI– and h3–receptor antagonists. Exp. Dermatol., 2000, 9, 118–124.
20. Lippert U., Kruger–Krasagakes S., Moller A. el al. Pharmacological modulation of IL–6 and IL–8 secretion by the HI–antagonist descarboethoxy–loratadine and dex–amethasone by human mast and basophilic cell lines. Exp. Dermatol., 1995, 4, 272–276.
21. Lipworth B., Jackson C. Safety of inhaled and intranasal corticosteroids: lessons for the new millenium. Drug Saf., 2000, 23, 11–33.
22. Lorber R., Salmun L., Danzig M. Desloratadine is effective at relieving nasal congestion, as demonstrated in three placebo–controlled trials in patients with seasonal allergic rhinitis. New Trends in Allergy – V meeting, Davos, 2000. .
23. Molet S., Gosset P., Lasalle P. et al. Inhibitory activity of loratadine and descar–boxyethoxyloratadine on histamine–induced activation of endothelial cells. Qm Exp. Allergy, 1997, 27, 1167–1174.
24. Nathan R. and the Desloradine Study Group. Desloratadine relieved nasal congestion in patients with seasonal allergic rhinitis. Annual meeting of American College of Allergy, Asthma and Immunology, Seattle, 2000.
25. Nayak A., Lorber R., Salmun L. Decongestant effects of desloratadine in patients with seasonal allergic rhinitis. J. Allergy Clin. Immunol., 2000, 105 (1) Abstract 1122.
26. Norman P., Dimmann A., Rabasseda. Desloratadine: a preclinical and clinical overview. Drugs Today, 2001, 37 (4), 215–227.
27. O’Doj^iell B., Lawlor R., Simpson J. el al. The impact of chronic urticaria on the quality of life. Br. J. Dermatol., 1997, 136, 197–201.
28. Pearlman D., Lumry W., Winder J., Noonan M. Once–daily cetirizine effective in the treatment of seasonal allergic rhinitis: a randomized, double–blind, placebo–controlled study. Clin. Pediatr. (Phila), 1997, 36. 209–215.
29. Pedersen P., Weeke E. Asthma and allergic rhinitis in the same patients. Allercv, 1983, 38, 25–29.
30. Premier B. and the Desloratadine Study Group. Desloratadine once daily reduces nasal congestion in patients with seasonal allergic rhinitis, 17th Int. Congress of Allergology and Clinical Immunology, Sydney, 2000.
31. Ratner P. and the Desloratadine Study Group. Desloratadine improved ASTHMA symptoms and reduced bronchodilatator use in 2 studies of patients with asthma and SAR. Ann. Meeting of American College of Allergy, Asthma in4 Immunology, Seattle, 2000.
32. Ring J., Hein R., Gauger A. Desloratadine in the treatment of chronic idiopathic urticaria. Allergy, 2001, 56 (suppl. 65), 28–32. Bachcrt C. Decongestant efficacy of desloratadine in patients with seasonal allergic rhinitis. Allergy, 2001, $6 (suppl. 65), 14–20.
33. Schenkel E. and the Desloratadine Study Group. Desloratadine improved SAR symptoms in patients with mild–to–moderate asthma and SA–R. Ann. Meeting of American College of Allergy, Asthma and Immunology, Seattle, 2000.
34. Sibbald B., Rink E. Epidemiology of seasonal and perennial rhinitis: clinical presentation and medical history. Thorax, 1991, 46, 895–901.
35. Vignota A., Crampette L., Mondain M. et al. Inhibitory activity of loratadine and descarboethoxyloratadine on expression of ICAM–1 and HLA–DR by nasal epithelial cells. Allergy, 1995, 50, 200–203.
36. Worldwide variation in prevalence of symptoms of asthma, allergic rhinoconjunc–tivitis and atopic eczema: ISSAC– International Study of Asthma and Allergies in Childhood Steering Committee. Lancety. 1998, 351 (9111), 1225–1232.
37. Young T., Finn L., Kom H. et al. Nasal obstruction as a risk factor for sleep–disordered breathing. J. Allergy Clin. Tmmunol., 1997, 99, S757–S762.
Дезлоратадин –
Эриус (торговое название)
(Shering Plough)
Лоратадин –
Веро-лоратадин (торговое название)
(Верофарм)
Лоратадин — антигистаминное средство II поколения
SummaryЛоратадин обладает достаточной активностью, продолжительностью антигистаминного действия, хорошими фармакокинетическими свойствами и соотношением «цена/качество», минимальными побочными эффектами, что позволяет рекомендовать его при лечении аллергических заболеваний у детей.
Введение
В последнее время в клинической практике при лечении таких заболеваний, как аллергический ринит, аллергический конъюнктивит, атопический дерматит и другие, получили широкое распространение антигистаминные средства II поколения (акривастин, астемизол, дезлоратадин, диметинден, левокабастин, левоцетиризин, лоратадин, мизоластин, рупатадин, терфенадин, фексофенадин, цетиризин, эбастин), которые отличаются высокой селективностью к гистаминовым рецепторам H1, продолжительностью антигистаминного действия, низкой способностью проникать через гематоэнцефалический барьер. По уровню антиаллергической активности антигистаминные средства II поколения сопоставимы с препаратами I поколения, но при этом не вызывают m-холинолитических эффектов [1, 3, 14, 35, 39].
Одним из представителей антигистаминных препаратов является хорошо зарекомендовавший себя в педиатрической практике лоратадин — эфир 4-(8-хлор-5,6-дигидро-11Н-бензол[5,6]циклогепта[1,2-b] пиридин-11-илидин)-1-пиперидинакарбоксиловой кислоты [2, 13, 18], 3D-модель молекулы которого представлена на рис. 1.
Механизм действия лоратадина
В реализации патогенеза аллергических заболеваний одну из основных ролей играет производное гистидина — гистамин (5[2-аминоэтил]имидазол). Основными продуцентами гистамина являются тучные клетки и базофилы, в которых гистамин находится в цитоплазматических гранулах и высвобождается во время аллергической реакции немедленного типа, которая характерна для острой крапивницы, аллергического ринита и конъюнктивита, поллинозов, пищевой аллергии и аллергии на лекарственные препараты, яды насекомых, для ангионевротического отека и др. [12]. Гистамин реализует свое действие через взаимодействие с трансмембранными гистаминовыми рецепторами (HR) — HRH1, HRH2, HRH3 и HRH4. Гистаминовые рецепторы являются G-протеинсвязанными рецепторами (GPCR — G-protein-coupled receptors), которые были открыты в 1937 году, вслед за этим открытием появились и первые антигистаминные препараты. Молекула GPCR характеризуется наличием в ее пространственной структуре семи α-спиралей, пересекающих клеточную мембрану, ее N-конец расположен внеклеточно, C-конец — внутриклеточно. Ген HRH1 расположен на хромосоме 3 [29, 34]. Гистаминовые рецепторы H1 экспрессируются на мембранах самых разнообразных клеток — нейронов, миоцитов гладких мышц сосудов и бронхов, эпителиоцитов, гепатоцитов, хондроцитов, нейтрофилов, эозинофилов, моноцитов, дендритных клеток, Т- и В-лимфоцитов [34]. До недавнего времени считалось, что гистамин является прямым агонистом HRH1. Однако установлено, что HRH1 существует в двух изоформах — активной и неактивной — и характеризуется агонистнезависимой трансдукцией сигнала возбуждения. Даже при отсутствии гистамина система HRH1 конститутивно возбуждена [8, 30, 31]. Поэтому предполагается, что антигистаминные лекарственные средства не конкурируют с молекулой гистамина, а стабилизируют неактивную изоформу HRH1 [31].
Антигистаминные лекарственные средства, в том числе и лоратадин, стабилизируя неактивную форму HRH1, обусловливают превалирование их представительства на мембранах эндотелиоцитов, эпителиоцитов, миоцитов гладких мышц респираторного тракта и способствуют снижению сосудистой проницаемости, вазодилатации посткапилляров, подавлению активности секреции желез слизистой оболочки дыхательных путей, а также вызывают бронходилатацию, уменьшают раздражение слизистых носовой полости и зуд кожи [10, 12, 41].
Лоратадин является лекарственным средством с выраженным антигистаминным действием. В экспериментальных исследованиях показано, что лоратадин более эффективно защищает морских свинок от летального исхода при введении им смертельной дозы гистамина, чем астемизол, дифенгидрамин, прометазин, терфенадин [20].
Лоратадин, подавляя эффекты возбуждения HRH1, ингибирует аллергическое воспаление [42]. Полагают, что противовоспалительное действие антигистаминных препаратов реализуется за счет: 1) HRH1-независимой стабилизации мембран тучных клеток и базофилов, в основе которой лежит супрессия трансмембранного транспорта ионов Ca2+ [37]; 2) ингибирования процессов возбуждения фактора транскрипции NF-kB [31]. Снижение активности NF-kB сопровождается ингибированием продукции гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), IL-1, IL-6, IL-8, IL-10, IL-11, эотаксина, RANTES (regulated upon activation, normal T-cell expressed and secreted), TNF-α и NO эндотелиоцитами, дендритными клетками, макрофагами и мононуклеарами периферической крови [23]. Показано, что лоратадин ингибирует продукцию ICAM-1, E-селектина и LFA-1 (leucocyte-associated antigen). У больных с поллинозом на фоне терапии лоратадином происходит снижение содержания ICAM-1 в назальном секрете и бронхоальвеолярной жидкости [17, 32, 33]. Снижая продукцию эотаксина, RANTES, лоратадин подавляет хемотаксис эозинофилов [15]. Лоратадин также подавляет высвобождение гистамина тучными клетками [22]. Данный препарат оказывает влияние как на Th2-, так и на Th3-зависимые процессы воспаления — он ингибирует экспрессию IFN-γ, индуцированную IL-12, а также экспрессию IL-5, индуцированную IL-4 [7].
Фармакокинетические особенности лоратадина
Абсорбция
Лоратадин, как и другие антигистаминные препараты II поколения, хорошо всасывается в пищеварительном тракте и достаточно быстро достигает целевых тканей. Уровень абсорбции лоратадина из пищеварительного тракта составляет 90 %. После приема препарата его содержание в сыворотке периферической крови достигает максимальной концентрации (Cmax) через 1–1,5 часа, а время достижения Cmax его основного метаболита дескарбоэтоксилоратадина (ДЭЛ) — приблизительно 2,5 ч (табл. 1) [13, 36]. При приеме 20 мг лоратадина среднее значение Cmax в сыворотке крови для лоратадина составляет 10,8 μг/л, а для ДЭЛ — 9,9 μг/л [44].
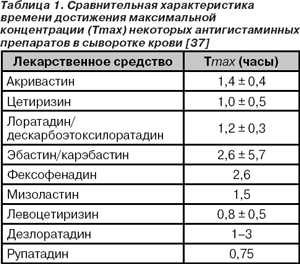
Антигистаминные лекарственные средства II поколения характеризуются высоким аффинитетом и селективностью к HRH1 и после приема внутрь быстро достигают пиковой концентрации в тканях [12]. Лоратадин отличается достаточно быстрым началом антигистаминного действия, которое проявляется через 30 минут после приема внутрь, в то время как эбастин оказывает свое действие через 1 час. Прием пищи удлиняет Тmax лоратадина и дезлоратадина на 1 час, но их уровень Cmax не зависит от приема пищи. Антигистаминный эффект лоратадина достигает максимума через 8–12 ч и длится 24 ч [37].
Биотрансформация
Антигистаминные средства II поколения преимущественно являются пролекарствами [37, 38]. В организме человека большинство антигистаминных средств подвергаются биотрансформации группой микросомальных ферментов, принадлежащих системе цитохрома P450 семейства гемопротеинов, которые преимущественно локализованы в гепатоцитах и энтероцитах [21, 43]. Исключение составляют акривастин, цетиризин, левоцетиризин, дезлоратадин и фексофенадин [38]. Гены ферментов системы цитохрома P450 классифицированы в 14 семейств и 17 субсемейств, из которых значимыми в метаболизме человека являются CYP1A2, CYP2C9, CYP2C19, CYP2D6 и CYP3A4, а в биотрансформации антигистаминных лекарственных средств — CYP3A4 и CYP2D6 [28].
Лоратадин в результате биотрансформации, преимущественно под влиянием цитохрома CYP3A4 и в меньшей степени — цитохрома CYP3D6, превращается в активный метаболит ДЭЛ (рис. 2). Однако при одновременном приеме лоратадина и ингибиторов CYP3A4 лоратадин превращается в ДЭЛ преимущественно под влиянием CYP3D6. Ингибирующим действием на систему цитохрома Р450 обладают антибактериальные (макролиды, исключая азитромицин), противогрибковые средства (кетоконазол, итраконазол, флуконазол), ингибиторы ВИЧ-протеаз (индинавир, ритонавир), блокаторы гистаминовых рецепторов H2 (циметидин, ранитидин), антагонисты кальция, а также флавоноид сока грейпфрута. Поэтому одновременное применение лоратадина и ингибиторов системы цитохрома Р450 может сопровождаться повышением концентрации лоратадина в сыворотке крови. Однако данный эффект не имеет клинического значения [9, 26, 40]. Ускоряет процесс биотрансформации лоратадина его одновременный прием с бензодиазепинами [14].
Скорость биотрансформации антигистаминных лекарственных средств также зависит от генетически детерминированных особенностей функционирования системы Р450, возраста, наличия заболеваний печени [14].
Элиминация лоратадина
Время полувыведения лоратадина составляет 8,4 ч, его метаболитов — 28 ч. Элиминация лоратадина происходит преимущественно через почки — около 27 % введенной дозы выводится с мочой на протяжении первых суток [14]. Время полувыведения лоратадина составляет около 5,9 часа, а ДЭЛ — 13,4 часа [44].
Лоратадин может экскретироваться с молоком женщины. Так, показано, что примерно 0,46 % принятой дозы выделяются грудной железой [19].
Побочное действие
Частота возникновения побочных явлений при применении лоратадина не выше, чем при применении плацебо. Наиболее частыми побочными явлениями при лечении лоратадином являются головная боль, головокружение, тошнота, сухость во рту, повышенная утомляемость, кашель, тахикардия, повышенный аппетит. Отмечены единичные случаи потери сознания, алопеции, анафилаксии, нарушения функции печени. Лоратадин не обладает кардиотоксическим действием и не оказывает побочное действие на функционирование центральной нервной системы. Показано, что даже длительная (на протяжении 90 дней) терапия лоратадином дозами, которые превышают в 4 раза средние терапевтические, не приводит к значимому увеличению интервала Q–T на ЭКГ, появлению синдрома пируэта (torsade de pointes) — двунаправленной веретенообразной желудочковой аритмии. Лоратадин и его активные метаболиты не оказывают антихолинергического и седативного действия, не влияют на скорость психомоторных реакций [6, 11, 16, 24, 25, 27].
Фармакокинетика лоратадина у детей первых двух лет жизни при применении однократной дозы 2,5 мг не отличается от фармакокинетики у взрослых и детей старше 2 лет.
Сравнительная характеристика лоратадина и некоторых антигистаминных лекарственных средств II поколения
Сравнительная характеристика лоратадина с другими антигистаминными препаратами II поколения (табл. 2) показала, что лоратадин отличается более быстрым проявлением антигистаминного эффекта, достаточной продолжительностью действия, отсутствием кардиотоксического, седативного действия, не способствует увеличению массы тела; при этом затраты пациентов на лечение средние.
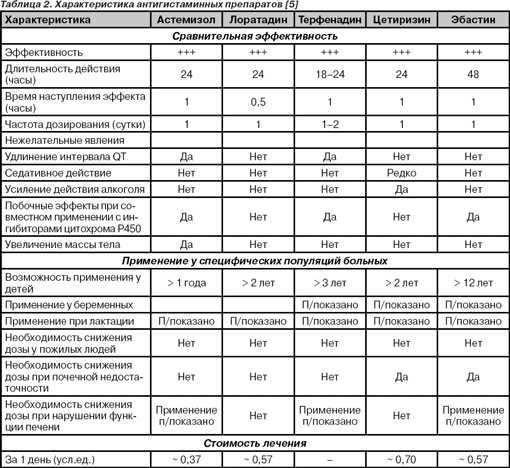
Показания
Показаниями для назначения лоратадина являются: аллергический ринит, аллергический конъюнктивит, хроническая крапивница и другие аллергические заболевания кожи [4].
Противопоказания
Противопоказаниями для назначения лоратадина являются повышенная чувствительность к лекарственному средству или прочим компонентам препарата; возраст до 1 года. Эффективность и безопасность применения лоратадина у детей в возрасте до 1 года не доказаны.
Назначение
Одним из препаратов, содержащих лоратадин, является препарат Лорано (фирмы Sandoz), который выпускается в удобной для применения у детей суспензионной форме (5 мг лоратадина в 5 мл, фл. 120 мл). Препарат Лорано, помимо действующего лекарственного средства лоратадина, содержит такие ингредиенты, как полисорбат 80, натрия цитрата дигидрат, натрия бензоат, глицерол. Учитывая, что препарат Лорано содержит глицерол, не рекомендуется назначать его в больших дозах, это может быть причиной головной боли и нарушений со стороны ЖКТ. При приеме препарата Лорано согласно рекомендациям с каждой дозой суспензии в организм поступает до 3 г сахарозы. При максимальной суточной дозе общее количество сахарозы не превышает 5 г. Препарат не следует назначать пациентам с редкими наследственными формами непереносимости фруктозы, синдромом мальабсорбции глюкозо-галактозы или сахаразо-изомальтазной недостаточностью [4].
Препарат Лорано назначают взрослым и детям старше 12 лет по 2 мерные ложки (10 мл) суспензии; детям в возрасте от 6 до 12 лет (массой тела > 30 кг) по 2 мерные ложки (10 мл) суспензии; детям в возрасте от 2 до 6 лет (массой тела < 30 кг) по 1 мерной ложке (5 мл) суспензии; детям в возрасте от 1 года до 2 лет по 1/2 мерной ложки (2,5 мл) суспензии 1 раз в сутки [4].
Таким образом, достаточная активность, продолжительность антигистаминного действия, хорошие фармакокинетические свойства, отсутствие серьезных побочных действий и профиль соотношения «цена/качество» лоратадина (препарат Лорано) позволяют рекомендовать его при лечении аллергических заболеваний у детей.
Bibliography1. Борисова Е.О. Антигистаминные средства: этапы развития // Фарм. вестник. — 2005. — № 17 (380).
2. Голопихо Л.I. Лоратадин — новий антигiстамiнний препарат // Фармацевтичний журнал. — 1994. — № 1. — С. 101-102.
3. Гущин И.С. Антигистаминные препараты. Пособие для врачей. — М., 2000. — 64 с.
4. Компендиум 2006 — лекарственные средства / Под ред. В.Н. Коваленко, Л.П. Викторова. — 2006. — Т. 1. — С. Л814-Л815.
5. Смоленов И.В., Смирнов Н.А. Современные антигистаминные препараты. http://www.volgadmin.ru/vorma/archiv/5/2.htm
6. Adelsberg B.R. Sedation and performance issues in the treatment of allergic conditions // Arch. Intern. Med. — 1997. — Vol. 157. — P. 494-500.
7. Ashenager M.S., Grgela T., Aragane Y., Kawada A. Inhibition of cytokine-induced expression of T-cell cytokines by antihistamines // J. Investig. Allergol. Clin. Immunol. — 2007. — Vol. 17, № 1. — P. 20-26.
8. Bakker R.A., Wieland K., Timmerman H., Leurs R. Constitutive activity of the histamine H(1) receptor reveals inverse agonism of histamine H(1) receptor antagonists // Eur. J. Pharmacol. — 2000. — Vol. 387. — P. R5-R7.
9. Barecki M.E., Casciano C.N., Johnson W.W., Clement R.P. In Vitro Characterization of the Inhibition Profile of Loratadine, Desloratadine, and 3-OH-Desloratadine for Five Human Cytochrome P-450 Enzymes // Drug Metab. Dispos. — 2001. — Vol. 29, № 9. — P. 1173-1175.
10. Boyle J., Ridout F., Meadows R., Johnsen S., Hindmarch I. Suppression of the histamine-induced wheal and flare response by fexofenadine HCl 60 mg twice daily, loratadine 10 mg once daily and placebo in healthy Japanese volunteers // Curr. Med. Res. Opin. — 2005. — Vol. 21. — P. 1495-1503.
11. Bradley C.M., Nicholson A.N. Studies on the central effects of the h2-antagonist, loratadine // Eur. J. Clin. Pharmacol. — 1987. — Vol. 32. — P. 419-421.
12. Camelo-Nunes I.C. New antihistamines: a critical view // J. Pediatr. (Rio J). — 2006. — Vol. 82, № 5 (Suppl.). — P. S173-S180.
13. Classification of loratadine based on the biopharmaceutics drug classification concept and possible in vitro-in vivo correlation / M.Z. Khan, D. Rausl, R. Zanoski, S. Zidar, J.H. Mikulciс, L. Krizmaniс, M. Eskinja, B. Mildner, Z. Knezeviс // Biol. Pharm. Bull. — 2004. — Vol. 27, № 10. — P. 1630-1635.
14. Comparative pharmacology of the h2 antihistamines / A. del Cuvillo, J. Mullol, J. Bartra, I. Dаvila, I. Jаuregui, J. Montoro, J. Sastre, A.L. Valero // J. Investig. Allergol. Clin. Immunol. — 2006. — Vol. 16, Suppl 1. — P. 3-12.
15. Eda R., Sugiyama H., Hopp R.J., Bewtra A.K., Townley R.G. Effect of loratadine on human eosinophil function in vitro // Ann. Allergy. — 1993. — Vol. 71. — P. 373-378.
16. Effect of h2 antihistamines upon the cardiovascular system / I. Dаvila, J. Sastre, J. Bartra, A. del Cuvillo, I. Jаuregui, J. Montoro, J. Mullol, A.L. Valero // J. Investig. Allergol. Clin. Immunol. — 2006. — Vol. 16, Suppl. 1. — P. 13-23.
17. Effect of loratadine on nitrogen dioxide-induced changes in electrical resistance and release of inflammatory mediators from cultured human bronchial epithelial cells / H. Bayram, J.L. Devalia, O.A. Khair, M.M. Abdelaziz, R.J. Sapsford, W. Czarlewski, A.M. Campbell, J. Bousquet, R.J. Davies // J. Allergy Clin. Immunol. — 1999. — Vol. 104. — P. 93-99.
18. Evaluation of the CNS properties of SCH 29851, a potent non-sedating antihistamine / A. Barnett, L.C. Iorio, W. Kreutner, S. Tozzi, H.S. Ahn, A. Gulbenkian // Agents Actions. — 1984. — Vol. 14. — P. 590-597.
19. Excretion of loratadine in human breast milk / J. Hilbert, E. Radwanski, M.B. Affrime, G. Perentesis, S. Symchowicz, N. Zampaglione // J. Clin. Pharmacol. — 1988. — Vol. 28. — P. 234-239.
20. Gambardella R.A. Comparison of the efficacy of azelastine nasal spray and loratadine tablets in the treatment of seasonal allergic rhinitis //J. Intern. Med. Research. — 1993. — Vol. 21. — P. 268-275.
21. Gonzalez F.J. The molecuylar biology of Cytochrome P450s // Pharmacol. Rev — 1988. — Vol. 40. — P. 244-276.
22. Grant J.A., Riethuisen J.M., Moulaert B., DeVos C. A double-blind, randomized, single-dose, crossover comparison of levocetirizine with ebastine, fexofenadine, loratadine, mizolastine, and placebo suppression of histamine-induced wheal-and-flare response during 24 hours in healthy male subjects // Ann. Allergy Asthma Immunol. — 2002. — Vol. 88. — P. 190-197.
23. Graziano F.M., Cook E.B., Stahl J.L. Antihistamines and epithelial cells // Allergy Asthma Proc. — 2000. — Vol. 21. — P. 129-140.
24. Hindmarch I., Johnson S., Meadows R., Kirkpatrick T., Shamsi Z. The acute and sub-chronic effects of levocetirizine, cetirizine, loratadine, promethazine and placebo on cognitive function, psychomotor performance, and weal and flare // Curr. Med. Res. Opin. — 2001. — Vol. 17. — P. 241-255.
25. Hindmarch I., Shamsi Z., Stanley N., Fairweather D.B. A doubleblind, placebo-controlled investigation of the effects of fexofenadine, loratadine and promethazine on cognitive and psychomotor function // Br. J. Clin. Pharmacol. — 1999. — Vol. 48. — P. 200-206.
26. Identification of human liver cytochrome P450 enzymes that metabolize the nonsedating antihistamine loratadine. Formation of descarboethoxyloratadine by CYP3A4 and CYP2D6 / N. Yumibe, K. Huie, K.J. Chen, M. Snow, R.P. Clement, M.N. Cayen // Biochem. Pharmacol. — 1996. — Vol. 51. — P. 165-172.
27. Initial and steady-state effects of diphenhydramine and loratadine on sedation, cognition, mood, and psychomotor performance / G.G. Kay, B. Berman, S.H. Mockoviak, C.E. Morris, D. Reeves, V. Starbuck, E. Sukenik, A.G. Harris // Arch. Intern. Med. — 1997. — Vol. 157. — P. 2350-2356.
28. Interactions of the h2 antihistamines / J. Bartra, A.L. Valero, A. del Cuvillo, I. Dбvila, I. Jбuregui, J. Montoro, J. Mullol, J. Sastre // J. Investig. Allergol. Clin. Immunol. — 2006. — Vol. 16, Suppl. 1. — P. 29-36.
29. International Union of Pharmacology. XLVI. G protein-coupled receptor list / S.M. Foord, T.I. Bonner, R.R. Neubig, E.M. Rosser, J.P. Pin, A.P. Davenport et al. // Pharmacol. Rev. — 2005. — Vol. 57. — P. 279-288.
30. Jutel M., Blaser K., Akdis C.A. Histamine in chronic allergic responses // J. Invest. Allergol. Clin. Immunol. — 2005. — Vol. 15. — P. 1-8.
31. Leurs R., Church M.K., Taglialatela M. h2-antihistamines: inverse agonism, anti-inflammatory actions and cardiac effects // Clin. Exp. Allergy. — 2002. — Vol. 32. — P. 489-498.
32. Loratadine reduces ICAM-1 expression on conjunctiva after specifi c challenge in pollen allergic patients / G. Ciprandi, A. Catrullo, P. Cerqueti, M.A. Tosca, G.W. Canonica // Allergy. — 1998. — Vol. 53. — P. 545-546.
33. Loratadine treatment of rhinitis due to pollen allergy reduces epithelial ICAM-1 expression / G. Ciprandi, C. Pronzato, V. Ricca, G. Passalacqua, M. Danzig, G.W. Canonica // Clin. Exp. Allergy. — 1997. — Vol. 27. — P. 118-123.
34. MacGlashan D. Jr. Histamine: a mediator of inflammation // J. Allergy Clin. Immunol. — 2003. — Vol. 112. — P. S53-S59.
35. Philpot E.E. Safety of second generation antihistamines // Allerg. Asthma. Proc. — 2000. — Vol. 21. — P. 15-19.
36. Radwanski E., Hilbert J., Symchowicz S., Zampaglione N. Loratadine: Multiple-dose pharmacokinetics // J. Clin. Pharmacol. — 1987. — Vol. 27. — P. 530-533.
37. Simons F.E.R. Advances in h2-Antihistamines // N. Eng. J. Med. — 2004. — Vol. 351. — P. 2203-2217.
38. Simons F.E., Simons K.J. Clinical pharmacology of h2-antihistamines // Clin. Allergy Immunol. — 2002. — Vol. 17. — P. 141-178.
39. Slater J.W., Zechnich A.D., Haxby D.G. Second-generation antihistamines: a comparative review // Drugs. — 1999. — Vol. 57, № 1. — P. 31-47.
40. Steady-State Pharmacokinetics and Electrocardiographic Pharmacodynamics of Clarithromycin and Loratadine after Individual or Concomitant Administration / R.A. Carr, A. Edmonds, H. Shi, C.S. Locke, L.E. Gustavson, J.C. Craft, S.I. Harris, R. Palmer // Antimicrob. Agents Chemother. — 1998. — Vol. 42, № 5. — P. 1176-1180.
41. Van Cauwenberge P., Juniper E.F. Comparison of the efficacy, safety and quality of life provided by fexofenadine hydrochloride 120 mg, loratadine 10 mg and placebo administered once daily for the treatment of seasonal allergic rhinitis // Clin. Exp. Allergy. — 2000. — Vol. 30. — P. 891-899.
42. Walsh G.M. Anti-inflammatory properties of antihistamines: an update // Clin. Exp. Allergy Rev. — 2005. — Vol. 5. — P. 21-25.
43. Wrighton S.A., Stevens J.C. The human hepatic cytochrome P450 involved in drug metabolism // Crit. Rev. Toxicol. — 1992. — Vol. 22. — P. 1-21.
44. Zhang Y.F., Chen X.Y., Zhong D.F., Dong Y.M. Pharmacokinetics of loratadine and its active metabolite descarboethoxyloratadine in healthy Chinese subjects // Acta Pharmacol. Sin. — 2003. — Vol. 24, № 7. — P. 715-718.
45. http://www.3dchem.com/molecules.asp?ID=148.