Гуморальный иммунный ответ это
Леточный иммунный ответ. Гуморальный иммунный ответ. Защитные функции иммуноглобулинов ( антител ).
Клеточный иммунный ответнаправлен против внутриклеточно паразитирующих микроорганизмов, основная защитная роль в нем принадлежитактивированным макрофагамицитотоксическим лимфоцитам(CD8+ CTL).
Макрофаги, инфицированные микроорганизмами, получают от Thl в качестве сигналов активации цитокины: гамма-интерферон и туморнекротизирующий фактор (ТНФ), которые действуют через свои рецепторы, вызывая усиленную продукцию макрофагами супероксидных и нитроксидных радикалов, убивающих внутриклеточные паразиты.
Цитотоксические CD8+CTL способны убивать зараженные вирусами клетки при непосредственном контакте с ними. В месте контакта из CTL в мембрану клетки-мишени проникают порообразующие белки — перфорины, формирующие в мембране микроканалы, через которые в клетку-мишень проникают ферменты — фрагментины, вызывающие разрушение ядра клетки и ее гибель.
Гуморальный иммунный ответ
Гуморальный иммунный ответзащищает преимущественно против внекле-точно паразитирующих микроорганизмов, которые доступны действию специфических антител. Продуцентами антител (иммуноглобулинов) являются потомки активированных В-лимфоцитов — плазматические клетки.
В-лимфоцит получает сигнал активации при соединении его антиген-распознающего рецептора с антигеном. Для активной пролиферации и дифференцировки в плазматические клетки потомки В-лимфоцита получают дополнительные сигналы активации — продуцируемые Th3 цитокины: интерлейкины-4, -5, -6, -10, -13. Те же цитокины усиливают продукцию и секрецию специфических для данного антигена антител зрелыми плазматическими клетками.
Таблица 8.5. Защитные функции иммуноглобулинов (антител) разных изотипов
| Изотипы (классы) иммуноглобулинов | Локализация | Защитные функции |
| Иммуноглобулин G | Кровяное русло и ткани | Нейтрализация токсинов и вирусов, активация системы комплемента, усиление фагоцитоза |
| Иммуноглобулин М | Только кровяное русло | Активация системы комплемента |
| Иммуноглобулин А (секреторный) | Секреты на слизистых оболочках, грудное молоко | Препятствие адгезии бактерий и вирусов на слизистых оболочках, их связывание |
Специфические антитела—иммуноглобулиныпротив конкретных антигенов бактерий (стафилококки, стрептококки, возбудители дифтерии, кишечных инфекций, клостридии и др.), связываясь с бактериальными токсинами, вызывают их нейтрализацию, т. е. утрату токсического действия на организм. Сами бактерии, связавшиеся со специфическими антителами, быстрее и легче захватываются и убиваются фагоцитирующими клетками или лизируются активированной системой комплемента.
Иммуноглобулиныделятся на пять классов (изотипов): IgG, IgM, IgA, IgE, IgD. В нормальной сыворотке крови 80 % всех иммуноглобулинов составляют IgG, на долю IgM приходится 6 %, на долю IgA— 13 %, а на долю IgE и IgD — сотые или тысячные доли процента. Главными защитными иммуноглобулинами являются IgG. У иммуноглобулинов разных изотипов различаются защитные свойства (табл. 8.5).
Иммунный ответ
В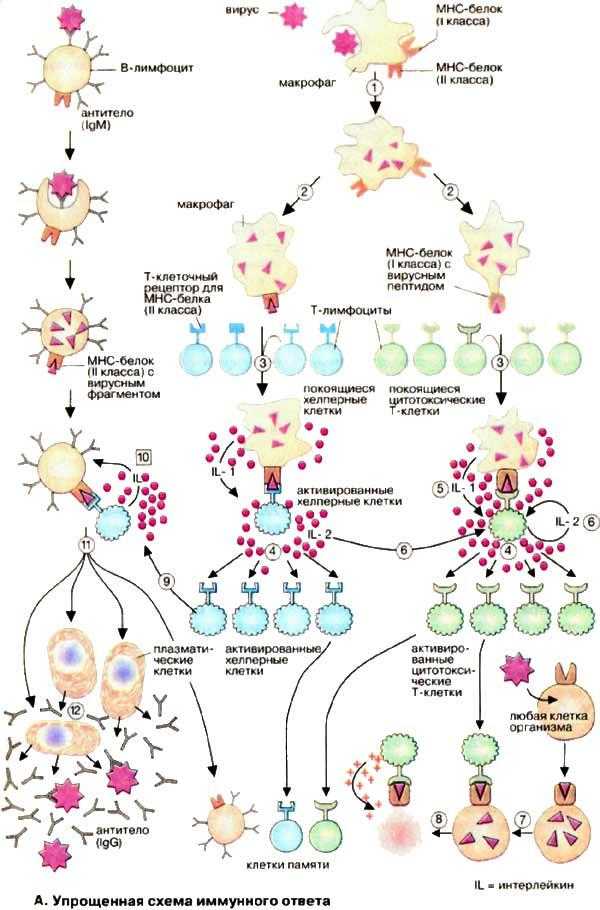 ирусы, бактерии, грибы и паразиты, проникающие в организм позвоночных, могут узнаваться иммунной системой и уничтожаться ею. По аналогичному механизму опознаются системой и устраняются трансформированные клетки организма, например опухолевые.Иммунная системав состоянии опознавать инородные тела, специфически реагировать на них и сохранять это событие в «памяти».
ирусы, бактерии, грибы и паразиты, проникающие в организм позвоночных, могут узнаваться иммунной системой и уничтожаться ею. По аналогичному механизму опознаются системой и устраняются трансформированные клетки организма, например опухолевые.Иммунная системав состоянии опознавать инородные тела, специфически реагировать на них и сохранять это событие в «памяти».
Ответ на структуру чужеродного вещества, антиген, осуществляемый клетками иммунной системы,лимфоцитами(см с.268), бывает различного типа.
За клеточный иммунитет ответственныТ - лимфоциты(Т - клетки). Эти иммунные клетки названы так из-за тимуса, в котором они подвергаются основным стадиям своей дифференциации (школа Т-клеток). Активность Т-клеток направлена против зараженной вирусом клетки организма, а также на защиту от грибов и паразитов. Т-Клетки принимают активное участие в процессе отторжения чужеродной ткани и помогают в формировании гуморального иммунного ответа (см. ниже). По своей функции они делятся на цитотоксические Т-клетки — Т-киллеры(на схеме зеленого цвета) иклетки-помощники — Т-хелперы(на схеме голубого цвета).
В свою очередь гуморальный иммунный ответнаправлен на активациюВ-лимфоцитов(В-клетки, на схеме светло-коричневый цвет), которые созревают в костном мозге в отличие от Т-клеток тимуса. В-Клетки несут на своей поверхностиантитела(см. с.288) и выделяют их в плазму. Антитела обладают способностью специфически связывать соответствующие антигены. Связывание антител с антигенами — решающее звено в системе защиты организма от внеклеточных вирусов и бактерий. В результате такого связывания последние опознаются как инородные тела и в дальнейшем уничтожаются.
"Память" иммунной системы представлена так называемыми "клетками памяти". Эти наиболее долгоживущие клетки существуют для каждого типа иммунных клеток.
А. Упрощенная схема иммунного ответа
Проникший в организм вирус эндоцитируется макрофагамии затем частично разрушается в эндоплазматическом ретикулуме (1). В результате образуются чужеродные фрагменты, которые экспонируются на клеточной поверхности макрофагов (2). Эти фрагменты «презентируются» специальной группой мембранных белков (белки ГКГС, см. с.292). Комплекс из вирусного фрагмента и белка главного комплекса гистосовместимости [ГКГС (МНС)] распознается и связывается Т-клетками с помощью специфических (Т-клеточных) рецепторов. Среди огромного числа Т-клеток только немногие обладают подходящим рецептором (3), Связывание приводит к активации этих Т-клеток и появлению их селективных копий (4, "клональная селекция"). В активации Т-клеток участвуют различные гормоноподобные Сигнальные белки,интерлейкины[ИЛ (IL), см. с.378]. Эти белки секретируются теми клетками иммунной системы, которые активируются при связывании с Т-клетками. Так, активированные макрофаги с презентируемым вирусным фрагментом секретируют IL-1 (5), а Т-клетки продуцируют IL-2 (6), который стимулирует их собственное клональное копирование и репликацию Т-хелперных клеток.
Клонированные и активированные Т-клетки осуществляют различные функции в зависимости от их типа. Цитотоксические Т-клетки(на схеме зеленого цвета) способны узнавать и связывать те клетки организма, которые инфицированы вирусами и на своих рецепторах ГКГС несут фрагменты вируса (7). Цитотоксические Т-клетки секретируютперфорин — белок, который делает проницаемой мембрану связанной инфицированной клетки, что и приводит к ее лизису (8).
Т-Хелперы(на схеме голубого цвета), напротив, связываются сВ-клетками, которые презентируют на своей поверхности фрагменты вируса, связанные с белком ГКГС (9). Это ведет к селективному клонированию индивидуальных В-клеток и их массированной пролиферации, Интерлейкин стимулирует (10) созревание В-клеток — превращение вплазматические клетки(11), способные синтезировать и секретировать антитела (12).
Рецепторы зрелых Т-клеток (их строение и функции).
T-лимфоциты, илиТ-клетки(t —лат.thymus— тимус) —лимфоциты, развивающиеся умлекопитающихвтимусеиз предшественников —претимоцитов, поступающих в него из красного костного мозга. В тимусе T-лимфоциты дифференцируются, приобретая Т-клеточные рецепторы (TCR) и поверхностные маркеры. Играют важную роль вприобретённом иммунном ответе. Обеспечивают распознавание и уничтожение клеток, несущих чужеродныеантигены, усиливают действиемоноцитов,NK-клеток, а также принимают участие в переключенииизотиповиммуноглобулинов(в начале иммунного ответаB-клеткисинтезируютIgM, позже переключаются на продукциюIgG,IgE,IgA).
У всех T-лимфоцитов в мембране присутствует комплекс CD3 (CD — англ. Cluster of Differentiation), связанный сTCRи обеспечивающий передачу сигнала о взаимодействии TCR c антигеном. В зависимости от типа T-лимфоцита у него на поверхности имеются молекулыCD4(Т-хелпер) илиCD8(Т-киллер).
Лишь небольшая часть претимоцитов созревает в Т-клетки — в процессе отбора тимоциты, не обладающие необходимыми рецепторами или имеющие рецепторы к антигенам собственного организма, погибают путем апоптоза.
Существует несколько видов Т-лимфоцитов:
Т-киллеры
Т-хелперы
Т-регуляторы
Т-амплифайеры
Т-контрсупрессоры
Т-клетки памяти
Т-киллеры,цитотоксические T-лимфоциты,CTL(от англ. to kill — убивать) — видлимфоцитов, осуществляющийлизисповреждённыхклетоксобственного организма. Мишени Т-киллеров — это клетки, поражённые внутриклеточнымипаразитами(к которым относятсявирусыи некоторые видыбактерий),опухолевые клетки. Т-киллеры являются основным компонентом антивирусного иммунитета.
2.5.4. Гуморальный иммунный ответ
Многие бактерии, вызывающие заболевания у человека, размножаются в экстрацеллюлярной среде, кроме того, большинство интрацеллюлярных патогенгов могут распространяться от клетки к клетке через экстрацеллюлярные жидкости.
Гуморальный иммунный ответ опосредуется молекулами антител, которые секретируются плазматическими клетками, и ведет к разрушению экстрацеллюлярных микроорганизмов, а также предотвращает распространение интрацеллюлярных инфекций.
Имеются 3 пути реализации антителами защиты хозяина против инфекций:
1. Нейтрализация - когда антитела предупреждают прилипание патогенов к эпителию.
2. Опсонизация - когда антитела содействуют фагоцитозу бактерий. Комплексы антител с бактериями присоединяются к поверхности фагоцита за счет Fc-рецептора на поверхности фагоцита.
3. Активация комплемента.
В-лимфоциты являются предшественниками плазматических клеток.
В ранней фазе В-клеточного ответа важная роль принадлежит молекулам поверхностной мембраны Т-хелперов, относящимся к семейству TNF и известных как CD40-ligand, которые связываются с молекулами CD40 на поверхности В клеток. CD40 - это член семейства TNF-рецепторов, которые аналогичны TNF-рецептору на макрофагах и Fas-R на мишенях цитотоксических клеток. Активация T-клеток вызывает экспрессию на поверхности T-клеток молекул CD40-ligand, которые связываются с молекулой CD40 на B-клеточной поверхности. Связывание CD40-ligand с рецептором индуцирует поверхностную экспрессию B7.1 и B7.2, что вызывает активацию примитивных T-клеток.
Связывание CD40 с CD40-Ligand помогает переходу В-клеток в клеточный цикл и является первоначальным для В-клеточного ответа на тимус-зависимые антигены (рис. 3).
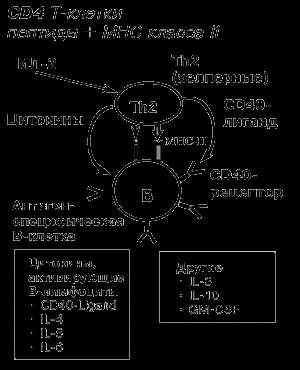
Рис. 3.Индукция гуморального иммунного ответа.
Цитокины, секретируемые Т-хелперами (IL-4, 5, 6), необходимы для активации В клеток.
Для успешного синтеза специфических антител необходим целый ряд межклеточных взаимодействий. Поверхностные иммуноглобулины на В-лимфоцитах служат в качестве рецепторов для антигена на В-лимфоцитах, а также играют важную роль в их активации, а именно:
Подобно рецепторам к антигенам на Т-лимфоцитах, они связывают антиген, что является прямым сигналом для активации В-лимфоцитов.
Они поставляют антиген внутрь клетки, где он разрушается и возвращается на поверхность В-клетки в виде пептидов, связанных с молекулами МНС класса II.
Затем комплекс "пептиды + молекулы МНС класса II" распознается антиген-специфическими зрелыми Т-хелперами (Th3), что в свою очередь является триггерным фактором для пролиферации В-лимфоцитов и дифференцировки их в плазматические антитело-секретирующие клетки.
Антигены, которые требуют Т-клеточной помощи для активации В-лимфоцитов, называются тимус-зависимыми. У лиц, у которых тимус недоразвит, нет эффективного иммунного ответа к тимус-зависимым антигенам.
Некоторые микробные агенты, части микробной клетки, такие как бактериальные полисахариды, могут напрямую активировать В-клетки в отсутствие Th3-клеток и обеспечивать низкий уровень антител, но быстро продуцируемых, против многих важных бактериальных патогенов. Такие антигены называют тимус-независимыми. Антитела, индуцированные благодаря только одним микробным антигенам, являются менее разнообразными и менее функционально универсальными, чем индуцированные с помощью Т-клеток.
Таким образом, антительный ответ инициируется, когда В-клетки связывают антиген и есть сигнал хелперных Т-клеток (Th3) или благодаря преимущественному действию некоторых микробных антигенов на B-лимфоциты.
Общее правило адаптивного иммунитета - это то, что нативные антиген-специфические лимфоциты не могут быть активированы только одним антигеном. Нативные Т-клетки требуют ко-стимулирующего сигнала от профессиональных АРС. Нативные В-клетки требуют дополнительных сигналов, которые идут от зрелых хелперных Т-клеток (Th3) или, в некоторых случаях, напрямую - от микробных антигенов.
Второй сигнал требуется для активации В-клеток при внедрении как тимус-зависимых, так и для тимус-независимых антигенов.
Итак, первый сигнал - для активации В-лимфоцитов исходит от специфического рецептора антигена, это разпознавание специфического антигена.
Второй сигнал исходит: а) в случае тимус-зависимых антигенов исходит от хелперных Th3 клеток, которые распознают фрагменты антигена, связанные с молекулами МНС класса 2 на поверхности В-лимфоцитов; б) в случае тимус-независимых антигенов исходит от самих антигенов.
В-клетки становятся мишенями для зрелых хелперных Т-клеток, когда антигены связываются с поверхностными иммуноглобулинами на В-лимфоцитах, интернализируются и возвращаются на поверхность В-лимфоцитов как пептиды, связанные с молекулами МНС-класса II.
Чтобы нативный антиген-специфический В-лимфоцит и антиген-специфический хелперный Т-лимфоцит, встретились для инициации Т-клеточно-зависимого антительного ответа, необходимо, чтобы В-клетки мигрировали через лимфоидные ткани.
Известно, что В-клетки мигрируют через периферические лимфоидные органы во многом теми же путями, что и Т-клетки, причем число антиген-специфических В-клеток увеличивается в лимфоузлах, дренирующих место инфекции. Далее происходит цепь взаимосвязанных процессов[89].
| 1. | Инициальная фаза В-клеточной пролиферации имеет место в Т-клеточной зоне лимфоидных тканей, обычно около лимфоидных фолликулов. Рециркулирующие В-клетки входят в лимфоидные органы через высокие эндотелиальные венулы и мигрируют к первичному фолликулу. |
| 2. | Антиген-специфические В-клетки стимулируются к пролиферации благодаря активирующему действию Т-хелперов (Th3). |
| 3. | Первичное взаимодействие антиген-специфических В-клеток с соответствующими хелперными Т-клетками имеет место в маргинальной Т- и В- зонах лимфоидной ткани. |
| 4. | Активированные В-клетки (лимфобласты) затем мигрируют в первичные лимфоидные фолликулы, где они быстро пролиферируют, формируя герминативные центры. Герминативные центры - это место соматических гипермутаций и селекции высокоаффинных В-клеток на сети фолликулярных дендритных клеток. |
| 5. | В лимфоидных фолликулах (первичных фолликулах) имеет место экспансия В-клеточных клонов. Эти фолликулы появляются спустя 5 дней после первичной иммунизации, что коррелирует со временем, необходимым для дифференцировки хелперных Т-клеток. |
| 6. | Пролиферирующие В-клетки формируют первичный фолликул и начинается секреция антител плазматическими клетками. |
Плазматическая клетка - это терминальная стадия дифференцировки B-клеток (табл. 10). Плазматические клетки секретируют антитела с высокой скоростью. Они не могут долго взаимодействовать с T-хелперами, так как у них снижено содержание поверхностных иммуноглобулиновых рецепторов и молекул МНС класса II (табл. 11).
Таблица 10.Стадии дифференцировки B-клеток[89]
| ||||||||||||||||||||||||||||||
Таблица 11.Особенности, свойственные В-клеткам и плазматическим клеткам
|
Специальные регионы лимфоидных тканей обеспечивают микроокружение, где антиген-специфические В-клетки могут взаимодействовать со зрелыми Т-хелперами, специфичными для того же антигена.
Антителосекретирующие плазматические клетки, которые дифференцируются в лимфоидных тканях, остаются в медуллярной зоне лимфоузлов и в красной пульпе селезенки. Обе эти зоны содержат большое количество макрофагов, которые помогают ограничивать инфекционные агенты в лимфоидной ткани.
Другие пути миграции у IgА-секретирующих плазмобластов. Обычно их миграция начинается в пейеровых бляшках и через эфферентные лимфатические пути - к мезентериальным лимфоузлам и далее они переходят в кровь; с кровью они распределяются затем к Lamina propria тонкого кишечника, в пот, слезы, слюнные железы, грудное молоко.
В итоге, В-клетки, покидающие герминативные центры, дифференцированы либо в антитело-секретирующие плазматические клетки, либо в В-клетки памяти.
Который из этих 2-х путей будет иметь В-клетка - определяется благодаря сигналам от фолликулярных дендритных клеток и Т-клеток. Хотя сигнал для дифференцировки в плазматические клетки не достаточно хорошо известен, предполагается, что это CD23 на поверхности фолликулярных дендритных клеток.
ИММУННЫЙ ОТВЕТ ГУМОРАЛЬНОГО ТИПА
Иммунные реакции подразделяют на два типа: гуморальные и клеточные. Первый тип основан на наличии антител, а второй — на действии активированных тимусзависимых лимфоцитов. Для иммунного ответа гуморального типа характерна выработка антител, которые одновременно являются эффекторами В-системы иммунитета. Различают два типа гуморального иммунного ответа: Т-зависимый и Т-независимый.
Формирование иммунного ответа происходит в несколько
этапов.
Первый этап — распознавание антигена лимфоцитами. Поступивший в организм Т-независимый антиген связывается с рецепторами лимфоцита, представляющими собой IgM, встроенные в мембрану В-лимфоцита. Это служит сигналом к дальнейшей пролиферации и дифференцировке. Важную роль в процессе распознавания антигена играют и другие рецепторы, например рецептор к Fc-фрагменту Ig. В зависимости от природы антигена происходят характерные изменения антигенных рецепторов: связывающийся мультивалентный антиген или комплекс «антиген — антитело» вызывают в течение нескольких минут перегруппировку рецепторов, равномерно распределенных на поверхности клетки, на одном из полюсов клетки (образуются так называемые «шапочки»). Затем лимфоцит освобождает свою мембрану от этих «шапочек», содержащих антигенсвязывающие рецепторы, либо отторгая их, либо поглощая путем пиноцитоза. Спустя несколько часов утраченные мембраной лимфоцита антигенсвязывающие рецепторы вновь синтезируются и встраиваются в мембрану.
На втором этапе происходит межклеточная кооперация — к индукции иммунного ответа подключаются антигенпре-зентирующие клетки (А-клетки): макрофаги, моноциты, дендро-циты, интерстициальные клетки, клетки Лангерганса, эпидермис, эндотелий, а также Т-лимфоциты. Поскольку не все антигены после связывания с рецепторами В-лимфоцитов могут индуцировать их пролиферацию и дифференцировку, в большинстве случаев для индукции иммунного ответа необходима межклеточная кооперация.
Антиген поглощают и перерабатывают преимущественно клетки, способные к фагоцитозу и пиноцитозу. А-клетки с помощью лизосомальных гидролаз расщепляют антиген, а затем выводят на свою поверхность продукты этого расщепления (антигенные детерминанты, которые значительно более иммуногенны, чем на-тивный антиген) и соединяют их с белками антигенной природы главного комплекса гистосовместимости МНС (англ. major hysto-compatibility complex) класса II в пределах одного вида.
Затем А-клетка осуществляет презентацию этого комплекса Г-лимфоциту. Субпопуляции Т-лимфоцитов (Т-хелперов и Т-ин-
дукторов) имеют специализированные рецепторы для антигенов МНС класса П. Презентация антигена А-клеткой приводит к межклеточной кооперации и формированию двойного сигнала. А-клетки несут антигены и белок МНС класса II, а Т-лимфоциты имеют рецепторы для обеих структур, благодаря чему А-клетки и Т-лимфоциты связываются рецепторами двух типов.
В кооперации А-клеток и Т-лимфоцитов участвуют медиаторы — IL-1 и интерферон. IL-1 вырабатывается макрофагами (А-клетки) и выступает в роли дополнительного сигнала для Т-индукторов и Т-хелперов, а интерферон, вырабатываемый Т-лимфоцитами, активируют макрофаги.
Таким образом, большинство антигенов становятся иммуно-генными только после переработки макрофагами и представления лимфоцитами.
Иммунный ответ на Т-зависимые антигены начинается с активации Т-индукторов. После переработки Т-зависимого антигена А-клетка осуществляет его презентацию Т-индуктору, который вслед за этим начинает вырабатывать и секретировать IL-2 — универсальный стимул для активации эффекторных Т-лимфоцитов независимо от их типа (Т-хелпер, цитотоксическая Т-клетка).
Действие IL-2 направлено в основном на клетки-предшественники соответствующих эффекторных лимфоцитов, вызывая диф-ференцировку и пролиферацию антигенстимулированного клона. Презентация антигена приводит к стимуляции индукторных клеток и экспрессии рецепторов для IL-2, а продукция IL-2, в свою очередь, способствует их собственной активации.
Презентирующие антиген А-клетки взаимодействуют с анти-генспецифическими лимфоцитами через их рецепторы и стимулируют Т-индукторы и предшественники эффекторных Т-лимфоцитов. Стимулированные индукторы начинают продуцировать IL-2, активируя таким образом кооперирующихся с ними через А-клетку антигенстимулированных предшественников других типов Т-клеток (покоящиеся, не стимулированные лимфоциты не несут на своей поверхности рецепторов к IL-2 и не могут быть им активированы).
Оптимальный иммунный ответ реализуется только при взаимодействии Т- и В-клеток: В-лимфоциты распознают детерминанты гаптена, а Т-клетки — носителя. Вторичная иммунная реакция на гаптен возможна только в случае, если после контакта с антигеном образуются клетки памяти, специфичные как к гаптену, так и к носителю (к носителю специфичны Т-хелперные клетки). Взаимодействие Т-хелпера с В-лимфоцитом осуществляется следующим образом. Известно, что Т- и В-лимфоциты связаны друг с другом антигенным мостиком. При этом определенную роль может играть особое представление антигена через Т-клетку, что служит стимулом для В-клетки. По аналогии с А-клетками В-клетки тоже могут осуществлять презентацию антигена в комп-
лексе с белками МНС класса II, а поскольку Т-лимфоциты (индукторы и хелперы) несут эти структурные рецепторы, то между Т- и В-лимфоцитами возникает достаточно прочная связь, а такая кооперация служит сигналом для В-клетки.
Кроме того, на В-клетки действуют также растворимые медиаторы Т-хелперов — антигенспецифические и антигеннеспецифичес-кие хелперные факторы. Антигеннеспецифические хелперные факторы вырабатываются и секретируются стимулированными антигеном и активированными IL-2 Т-лимфоцитами. Фактор действует непосредственно на В-лимфоциты, стимулированные антигеном. Его действие облегчается благодаря формирующемуся антигеном мостику, соединяющему В-лимфоцит с Т-лимфоцитом.
Активация В-лимфоцитов Т-клетками может происходить и при участии макрофагов, осуществляющих презентацию антигена, в частности, антигенспецифические В- и Т-лимфоциты посредством рецепторов связываются с одним и тем же макрофагом, что обеспечивает оптимальные условия для межклеточной кооперации.
Аналогичная ситуация возникает и в том случае, когда макрофаги с помощью собственных Fc-рецепторов связывают антитела. Это происходит прежде всего при вторичном иммунном ответе, поскольку при первичном антитела еще отсутствуют.
На третьем этапе благодаря клеточной кооперации начинается биосинтез антител: активируются структурные гены, кодирующие синтез константного и вариабельного фрагментов иммуноглобулинов.
Биосинтез тяжелых (Н) и легких (L) цепей иммуноглобулинов происходит на полисомах. Вся полипептидная цепь сразу синтезируется в соответствии со структурой мРНК. L-цепь синтезируется в течение 30...45 с, а Н-цепь в два раза дольше. Н- и L- цепи выделяются в эндоплазматический ретикулум, где они быстро объединяются в полную молекулу иммуноглобулина.
Сначала образуются мономерные молекулы, это справедливо и для IgM, и IgA. Если синтез отдельных цепей и их соединение в целую молекулу протекают довольно быстро, то транспортировка этой молекулы к мембране клетки и встраивание углеводородов продолжается полчаса, причем последние углеводороды могут встраиваться непосредственно перед секрецией иммуноглобулина или во время транспортировки молекулы через мембрану. Антителообразующие клетки вырабатывают также и J-цепи, которые необходимы только для полимерных иммуноглобулинов. Образование полимера, например IgM, происходит непосредственно перед началом секреции и сопровождается встраиванием J-цепи.
Регуляция выработки антител.Первичный иммунный ответ. Как правило, иммунный ответ складывается из трех этапов.
| АНТИТЕЛООБРАЗОВАНИЕ |
| Моноклональные антитела |
| Обшая иммунная реакция |
В латентной фазе циркулируют в крови лишь свободные антигены, а антитела отсутствуют, поскольку все образующиеся в эту фазу антитела связываются с антигенами в иммунные комплексы, которые элиминируются (выводятся) организмом. Эта фаза длится около недели.
Далее следует log-фаза. Она характеризуется синтезом специфических антител и нарастанием их количества в сыворотке крови. По достижении максимального уровня (пик-фаза) синтез антител может прекратиться, а вследствие катаболизма Ig их общая концентрация начинает снижаться.
Вторичный иммунный ответ возникает при повторном контакте организма с антигеном. По сравнению с первичным он отличается более короткой латентной фазой, интенсивным антителообразованием и более высоким максимальным уровнем антител, который сохраняется в крови несколько месяцев. Это явление имеет важное значение для клиники, так как достигнутый высокий уровень иммунитета обеспечивает организму лучшую защиту. Во многом это обусловлено образованием долго-живущих клеток памяти (малые лимфоциты), которые вовлекаются в пролиферацию и синтез антител при повторном контакте с антигеном.
Дальнейшее введение антигена после вторичных реакций также повышает титр антител. Продолжительность этого процесса зависит и от самого антигена, то есть от того, какое количество таких гипериммунизаций необходимо провести, чтобы достичь максимального титра антител. После достижения максимальной концентрации дальнейшее введение антигена может привести к снижению титра антител, что связано либо с механизмом регуляции по типу обратной связи, либо с выработкой клеток-супрессоров.
В процессе иммунного ответа меняется уровень антител. Тимус-независимые антигены стимулируют синтез только IgM. Тимусза-висимые антигены сначала индуцируют выработку преимущественно высокомолекулярных антител (IgM), а затем низкомолекулярных Ig (IgG и IgA), причем при первичном иммунном ответе выработка IgM значительно опережает по времени синтез IgG, а фаза выработки IgG оказывается более продолжительной.
При вторичном иммунном ответе синтез IgM и IgG начинается почти одновременно, причем IgG синтезируются более активно. Эти различия обусловлены разной степенью диффе-ренцировки В-лимфоцитов к началу реакции. До контакта с антигеном в крови присутствуют клетки, которые первоначально могут синтезировать только /gM-антитела. Под действием Т-лимфоцитов происходит переключение синтеза с IgM на IgG и IgA. Параллельно в ходе первичного иммунного ответа появляются классоспецифические клетки памяти для IgM, IgG, IgA, IgE, но не для IgD. При повторном контакте с антигеном
Морфофшиологи- Дифференциация Клетки Функциональные ческие изменения В-лимфоцитов «памяти» особенности
плазмоцитов
Рис. 4.4. Схема антитело-образования
активируются эти клетки памяти, усиливается их пролиферация с последующим биосинтезом определенного класса Ig (рис. 4.4).
АНТИТЕЛА
Антителам присущи следующие основные биологические
свойства.
1. Специфичность — способность Ig реагировать только с определенным антигеном, что обусловлено наличием у них антидетерминант, контактирующих с соответствующими детерминантами.
2 Валентность — количество антидетерминант в молекуле антитела. Чаще всего антитела бивалентны, но существуют 5- и даже 10-валентные.
3. Аффинность, аффинитет — прочность соединения между детерминантами (эпитопом) антигена и антидетерминантами (пара-топом) антигена.
4 Авидность — прочность связи антигена с антителом, ълаго-даря поливалентности антигена связь между двумя антигенами осуществляется при помощи нескольких антител.
5. Гетерогенность — неоднородность, обусловленная наличием трех видов антигенных детерминант:
A. Изотипические, характеризующие принадлежность Ig к оп
ределенному классу;
Б. Аллотипические, соответствующие аллельным вариантам иммуноглобулина;
B. Идиотипические, отражающие индивидуальные особеннос
ти иммуноглобулина.
Организм способен реагировать на поступление чужеродных антигенов синтезом белков, обладающих специфическим срод-
ством с антигеном, вызвавшим этот синтез. Эти белки получили название антител. Хотя антитела отличаются друг от друга не только по способности связывать разные антигены, но и по своим физико-химическим свойствам, структурно все они сходны. Эта высокоспециализированная группа белков, построенных из поли-пептидных цепей двух основных типов (легких и тяжелых), получила название иммуноглобулинов.
Иммуноглобулины синтезируются в пузырьках пластинчатого аппарата (Гольджи) В-лимфоцитов. По мере созревания пузырек подходит к поверхности клетки, при контакте с ней происходит разрыв наружной мембраны клетки и мембраны пузырька. Свободные иммуноглобулины поступают в плазму, а связанные с мембраной остаются на поверхности клетки. Таким образом, итоговой фазой В-клеточного иммунитета является продукция /g-антител, которая происходит постоянно. Одновременно в организме синтезируются до 105... 107 антител различной специфичности. Интактный В-лимфоцит синтезирует в один час примерно 250...500 молекул IgM и большую часть их отдает в экстрацеллю-лярную жидкость. После специфической антигенной стимуляции и трансформации лимфоцитов в плазматические клетки этот синтез возрастает в тысячи раз.
Наиболее полно изучено строение антител, представленных иммуноглобулинами класса G (рис. 4.5).
На схеме видно, что молекула IgG под действием протеолити-ческого фермента папаина расщепляется на три больших фрагмента. Два из них идентичны и обладают свойством взаимодействовать с одной молекулой антигена. Они были обозначены как Fab-фрагменты (Fragment antigen binding), связывающие антиген.
Гипервариабельные участки легкой цепи Лёгкая м цепь
| (Связывание _ антигена) F°° |
| Гипервариабельные участки тяжелой цепи |
| Межцепьевые " дисульфитные связи |
| Шарнирная область Участок связывания комплемента Углевод |
| (Эффекторные I биологические Fc |
| Внутрицепьевые дисульфидные связи |
| VL и Vfj: вариабельные области Ci и Сн'- константные области |
| Рис. 4.5. Структура молекулы иммуноглобулина G |
Тяжёлая цепь v*v /^Тяжелая цепь
Третий фрагмент, содержащий углеводный компонент, был получен при изучении его свойств в кристаллическом состоянии, за что и назван Fc-фрагментом (Fragment cristalline). В дальнейшем было показано, что Fc-фрагмент взаимодействует с мембранами клеток, выполняя транспортную функцию, фиксацию Cql компонента комплемента и т. д.
Все иммуноглобулины — это тетрамеры, состоящие из четырех полипептидных цепей. Две из них представлены длинными (около 450 аминокислотных остатков), или тяжелыми (heavy), Н-цепями, а две другие — короткими (около 220 аминокислотных остатков), или легкими (light), L-цепями. Легкие цепи являются общими для всех классов и подклассов иммуноглобулинов и могут произвольно сочетаться с любой тяжелой цепью. У большинства позвоночных легкие цепи разделяются по антигенным свойствам на два типа — «каппа» (с-тип) и «лямбда» (1-тип).
Изучение первичной структуры полипептидных цепей иммуноглобулинов показало, что N-концевые участки тяжелых и легких цепей, включающие около 100 аминокислотных остатков, обладают уникальной структурой и аминокислотной последовательностью. Они представляют собой вариабельные области (V-область) тяжелых (VH) и легких (VL) цепей. Указанные вариабельные области, с одной стороны, образуют антигенсвязывающие центры антител, а с другой — определяют их многообразие. Остальная (С-концевая) последовательность тяжелой и легкой цепей идентична у всех молекул данного класса или подкласса, но различна у молекул, относящихся к разным классам и подклассам. Она носит название константная область (С-область). В зависимости от структуры константной области тяжелых цепей молекулы иммуноглобулинов делят на классы. В настоящее время известно пять классов иммуноглобулинов, обозначаемые как IgA, IgM, IgG, IgD и IgE. Тяжелые цепи иммуноглобулинов каждого класса различаются по своим фи-шко-химическим, антигенным и иммунологическим свойствам. Эти цепи обозначаются греческими буквами в соответствии с латинским обозначением класса иммуноглобулинов: IgA (а-цепь), IgM (m-цепь), IgG (g-цепь), IgD (d-цепь) и IgE (е-цепь).
В N-концевой части Н- и L-цепей иммуноглобулинов имеются участки, отличающиеся чрезвычайно высокой вариабельностью (гипервариабельные участки): HI; Н2; НЗ; LI; L2; L3. Каждый из них содержит около шести аминокислотных остатков. Вместе эти участки образуют антигенсвязывающий центр.
Цепи иммуноглобулинов состоят из доменов — структурных единиц, содержащих около 110 остатков аминокислот. Тяжелые цепи образуют четыре домена: один вариабельный и три константных, обозначаемые Сн1; Сц2; СцЗ. Легкие цепи содержат но два домена — вариабельному (VL) и константному (Q,). Каждый домен представляет собой плотно упакованную глобулу, так как аминокислотные последовательности обладают определенным
сходством друг с другом. И эти участки полипептидной цепи замыкаются внутрицепочной дисульфидной связью.
Каждый из Fab-фрагментов состоит из одной L-цепи (VL- и CL-домены) и половины одной Н-цепи (VH- и Сн-Домены), а Fc-фрагмент образован остатками двух Н-цепей, включающих Сн2 и Сн3 домены.
Классы иммуноглобулинов различаются по своим химическим и биологическим свойствам. Так, их различная скорость полимеризации выражается в том, что /gG существуют в виде мономера с молекулярной массой 160 000, тогда как IgA состоит из одной или двух, а IgM, как правило, из пяти соответствующих субъединиц.
Биологические и иммунологические различия между классами иммуноглобулинов имеют большое практическое значение, так как они обусловливают характер реакции, следующей за образованием комплекса антиген — антитело.
Защитное действие антител может выражаться в прямом повреждении микроорганизмов или в нейтрализации синтезируемого ими токсина. Нейтрализация токсина состоит в прямой блокаде токсофорной группы антителами (антигенные и токсинные детерминанты идентичны). Однако связывание токсина и антитела может вызывать и пространственные изменения конфигурации, которые делают невозможной адсорбцию токсина на субстрате — клетке, чувствительной к токсину.
Иммуноглобулины класса G оказывают сильное нейтрализующее действие на токсины и вирусы, а также способны к преципитации, обладают опсонизирующим действием (опсонины — греч. Opsonion — снабжение пищей — антитела, в присутствии комплемента стимулирующие поглощение чужеродных частиц, бактерий, вирусов и их разрушение лейкоцитами), усиливая фагоцитоз. При умеренном нагревании IgG может связываться с антителом, т. е. начинается реакция, названная связыванием комплемента, ответственность за которую несет Fc-фрагмент. При этом кроме непосредственной нейтрализации вирусов и токсинов IgG способствуют также зависящему от комплемента фагоцитозу и внутриклеточной инактивации микроорганизмов. На долю IgG приходится около 80 % всех иммуноглобулинов.
Более сложной, чем при нейтрализации токсинов, представляется роль антител в разрушении и устранении самого возбудителя. У некоторых грамотрицательных бактерий антитела в связи с неспецифически реагирующими факторами комплемента сыворотки могут вызывать бактериолиз. Антитела и комплемент, однако, не вызывают цитолиз непосредственно, а лишь изменяют вначале поверхность бактериальной клетки таким образом, что она становится доступной действию имеющегося в организме фермента лизоцима. Лизоцим реагирует с мурамилпептидом клеточной стенки и вызывает разрыв в одном или нескольких местах поверхности. Повышение давления внутри клетки, дохо-
дящее до 20 ати, приводит к тому, что микроорганизм с поврежденной стенкой лопается.
Другой путь возможного действия антител — опсонизация заключается в изменении поверхности микробной клетки таким образом, что она становится более удобной для поглощения ее фагоцитами. Как и бактериолиз, опсонизация протекает на фоне активации комплемента, вызванной реакцией антиген — антитело. В отличие от цитолиза, требующего для своего осуществления присутствия на бактериальной клетке всех девяти факторов комплемента, в опсонизации участвуют только четыре компонента комплемента Q...C4.
Особенно выражено опсонизирующее действие антител при колиинфекции новорожденных домашних животных. Большое значение имеют опсонизирующие антитела и для защиты против диплококков и стрептококков. Гладкая поверхность капсулы у диплококков мешает их поглощению фагоцитами. Лишь когда под действием антител их поверхность меняется, т. е. становится шероховатой, они могут быть фагоцитированы и затем уничтожены внутри клетки. Стрептококки поддаются фагоцитозу даже при отсутствии специфических антител, но из-за присутствия особого белка, названного М-антигеном, инактивируются не полностью. Часть их снова выходит из фагоцитов и продолжает размножаться дальше. Антитела, направленные против М-антигена патогенного типа стрептококков, способствуют внутриклеточной инактивации этих микроорганизмов.
Ведущее место в реакциях бактериолиза и опсонизации принадлежит IgM. Этот класс иммуноглобулинов является самым «древним» в филогенетическом отношении. В ходе иммунного ответа вначале также появляются антитела /gM-клас-са. У новорожденных первые антитела принадлежат к IgM. В сыворотке молекулы IgM существуют в виде пентамера с молекулярной массой 950000. Пять мономерных субъединиц расположены радиально, причем Fc-фрагменты направлены к центру круга, а Fab-фрагменты — кнаружи (рис. 4.6).
Поскольку IgM в полной мере не способны к нейтрализации
токсинов, то животные раннего p„c 4.6. Строение пентамерной структу-
постнатального периода наибо- ры иммуноглобулина м
11 — 3389
лее подвержены токсикоинфекциям. IgM составляют примерно 3...10 % иммуноглобулинов сыворотки крови.
Характерная особенность структуры IgM определяется тем, что она призвана оказывать особое защитное действие против микроорганизмов и других крупных антигенов, имеющих на своей поверхности антигенную мозаику из повторяющихся детерминантов. Антитела IgM связывают соответствующий антиген каждым из своих пяти участков связывания. Такие повторы антигенных детерминантов характерны для О-антигенов из клеточной стенки грамот-рицательных бактерий, жгутиков бактерий и вирусов, имеющих капсиды. Даже если каждый отдельный участок связывания проявляет лишь небольшую авидность, общая авидность всей молекулы повышается из-за суммирования нескольких таких связей.
Если антитела IgM реагируют таким образом с антигеном, то при нахождении антигена близко к поверхности клетки комплемент настолько активируется, что вызывает локализованное повреждение нижележащей клеточной мембраны. Так, единственная молекула IgM в силу активирования комплемента может вызвать лизис клетки (например, бактерии или эритроцита). Антитела класса IgG, напротив, могут вызвать клеточный лизис путем активирования комплемента только в том случае, когда две молекулы антитела вступают в реакцию на поверхности клетки очень близко друг от друга, но для этого необходимо очень много (тысячи) молекул IgG.
Если антиген не связан с поверхностью клетки, а существует в свободном виде с множеством детерминантов, то антитела IgM не имеют никаких преимуществ перед IgG- Напротив, их участки связывания, характеризующиеся низкой авидностью, не могут все связываться с одной и той же молекулой антитела и легко диссоциируют. Поэтому антитела IgG более эффективны при нейтрализации бактериальных токсинов и при защите клеток от адсорбирования на них вируса.
Сравнение активности антител IgG и IgM по отношению к одному и тому же поверхностному антигену сальмонелл показало, что на основе соотношения масс последние в 20 раз активнее при агглютинации [лат. agglutinatio — склеивание в глыбки (комочки) микробов, эритроцитов или других клеток и выпадение их в осадок в присутствии электролитов] сальмонелл, более чем в 100 раз активнее в инактивации микробной клетки с участием комплемента и более чем в 1000 раз эффективнее в опсонизации микроорганизмов и других клеток.
Сывороточные антитела IgA в отличие от IgM и IgG не способны к связыванию комплемента и поэтому не могут вызывать ни иммуноприлипания, ни цитолиза или конглютинации. Считают, что этому классу иммуноглобулинов принадлежит функция защиты организма от проникновения возбудителя и развития инфекции. Этот класс иммуноглобулинов участвует в элиминации пи-
щевых и других чужеродных антигенов, которые могут проникнуть в организм через слизистые оболочки, а также в регуляции иммунного ответа на эти антигены.
Иммуноглобулины А составляют лишь 10...15 % всех иммуноглобулинов сыворотки. Однако они преобладают в экстра-васкулярных секретах. Большая часть IgA в слюне, слезах, пищеварительных соках, секретах слизистой носа находится в виде секреторного IgA (SIgA), т. е. полимерной формы, состоящей из двух /gA-мономеров, соединяющей молекулы гликопротеина, называемого секреторным компонентом. Биологическая роль секреторного компонента сводится к повышению устойчивости IgA от разрушения протеолитическими ферментами (рис. 4.7).
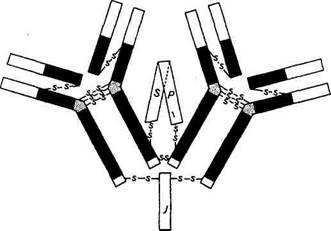 |
| Рис. 4.7. Схема строения секреторного иммуноглобулина А |
Иммуноглобулин ыЕ — это мономеры, содержание которых в сыворотке крови ничтожно мало — 0,00005...0,0003 г/л, или 0,002 % общего количества Ig. За сутки их синтезируется 0,02 мг/кг; период полураспада в сыворотке крови составляет 2...3 сут, а в коже — 9...14сут. К классу IgE относится основная масса аллергических антител-реагинов. Уровень их значительно повышается у организмов, страдающих аллергией и зараженных гельминтами. IgE связываются с Fc-рецепторами тучных клеток и базофилов. При контакте с аллергеном образуются мостики IgE — антиген — IgE, что сопровождается поступлением ионов кальция в клетку-мишень, активацией в ней биохимических процессов и выделением биологически активных веществ, вызывающих аллергические реакции немедленного типа. Эозинофильный хемотаксический фактор, выделяемый тучными клетками, способствует аккумуляции
эозинофилов и деструкции гельминтов. Предполагается также, что IgE, покрывая паразита, аккумулирует макрофаги благодаря Fc-рецепторам этих клеток.
Иммуноглобулины D — это мономеры; их содержание в крови составляет 0,03...0,04 г/л, или до 1 % общего количества иммуноглобулинов. В сутки их синтезируется от 1 до 5 мг/кг, а период полураспада колеблется в пределах 2...8 сут. IgD участвуют в развитии местного иммунитета, обладают антивирусной активностью, в редких случаях активируют комплемент. Плазматические клетки, секретирующие IgD, локализуются преимущественно в миндалинах и аденоидной ткани. IgD выявляются на В-клетках, отсутствуют на моноцитах, нейтрофилах и Т-лимфоцитах. Полагают, что IgD участвуют в дифференцировке В-клеток, способствуют развитию антиидиотипического ответа, участвуют в аутоиммунных процессах.
Основная масса IgM и IgD находится в плазме, a IgG и IgA распределяются примерно в одинаковых соотношениях между плазмой и межсосудистой тканью.
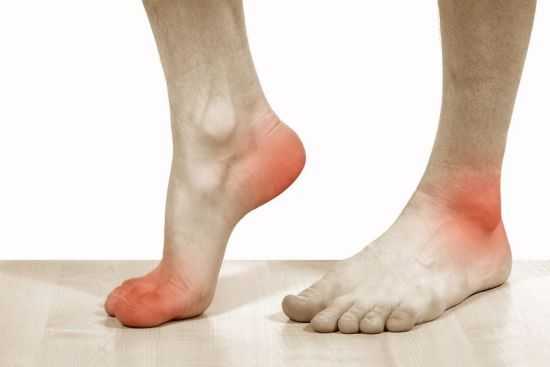
что это такое и как он функционирует
Иммунная система отвечает сохранность и нормальное функционирование органов и систем, оберегая их от опасных агентов.
 Фото 1. Иммунитет отвечает за способность организма противостоять угрозам. Источник: Flickr (Danielle Scruggs).
Фото 1. Иммунитет отвечает за способность организма противостоять угрозам. Источник: Flickr (Danielle Scruggs).Что такое гуморальный иммунитет
При гуморальном иммунном ответе задействуются молекулы, которые находятся в крови. Важнейшую роль в его функционировании играют B-лимфоциты. Этим он отличается от клеточного иммунитета, работа которого зависит от T-лимфоцитов.
Обратите внимание! Гуморальный иммунитет направлен на уничтожение патогенов, которые находятся в крови и во внеклеточном пространстве.
B-лимфоциты — это клетки иммунной системы, которые вырабатываются печенью плода, находящегося в утробе матери, а после рождения — в красном костном мозге, содержащемся в трубчатых костях.
На поверхности каждого B-лимфоцита находится антигенраспознающий рецептор. Антигены — это любые вещества, которые организм рассматривает как потенциально опасные. В частности, они входят в состав болезнетворных вирусов и бактерий. После контакта с антигеном B-лимфоциты могут превращаться в плазматические клетки, способные производить иммуноглобулины.
Иммуноглобулины (антитела, Ig) — это белковые соединения, которые препятствуют размножению патогенных микроорганизмов и нейтрализуют выделяемые ими токсины.
Различают 5 классов иммуноглобулинов:
Они различаются по составу, строению и выполняемым функциям.
Как действует гуморальный иммунитет
B-лимфоциты образуются из стволовых клеток в костном мозге. После созревания они попадают в кровеносное русло. На их поверхности находятся иммуноглобулины класса M, которые могут отделяться от лимфоцитов и циркулировать в крови независимо от них.
Когда в организм попадает антиген, иммуноглобулин M связывается с ним и инактивирует его. Антитела запускают схему активации комплемента (комплекса сложных белков в крови, протеиновые ферменты, которые защищают от чужеродных агентов), что приводит к уничтожению патогена.
После того, как это происходит, B-лимфоциты превращаются в плазматические клетки. Они начинают вырабатывать иммуноглобулины разных классов, рассчитанные на борьбу с аналогичными антигенами.
Антитела связывают патогены и лишают их возможности повреждать ткани организма.
Гуморальный иммунный ответ
Иммунную реакцию, которая состоит в активации B-лимфоцитов и выработке ими иммуноглобулинов, называют гуморальным иммунным ответом.
Обратите внимание! Образование специфических антител, рассчитанных на борьбу с определенными антигенами, является главной целью иммунного ответа. После попадания в кровь иммуноглобулины обеспечивают надежную защиту от патогенных веществ и микроорганизмов.
Выделяют два этапа гуморального иммунного ответа:
- индуктивную — на этой стадии происходит распознавание антигена;
- продуктивную — на этом этапе B-лимфоциты превращаются в плазматические клетки и выделяют антитела, затем иммунные реакции замедляются вплоть до полного прекращения.
В продуктивной фазе гуморального иммунного ответа образуются клетки памяти, которые активируются, если происходит повторная встреча с антигеном.
 Фото 2. Вырабатываемые в крови антитела способны противостоять патогенной микрофлоре. Источник: Flickr (NavySoul).
Фото 2. Вырабатываемые в крови антитела способны противостоять патогенной микрофлоре. Источник: Flickr (NavySoul).В этом случае возникает вторичная иммунная реакция. Она развивается так же, как первичная, но протекает гораздо быстрее.
Клеточный иммунитет
При работе этого типа иммунитета активируются клетки иммунной системы. Главными из них являются T-киллеры, натуральные киллеры и макрофаги.
- T-киллеры — это клетки, которые борются с вирусами, внутриклеточными бактериями и раковыми клетками. Они представляют собой разновидность лимфоцитов. Натуральные киллеры — еще один вид лимфоцитов. Они отвечают за борьбу с вирусами и раковыми клетками.
- Макрофаги — это клетки иммунной системы, которые способны поглощать и переваривать бактерий, остатки погибших клеток и другие патогенные частицы. Этот процесс называют фагоцитозом, а клетки, которые способны его осуществлять — фагоцитами. Макрофаги представляют собой одну из разновидностей фагоцитов.
- Цитокины — это белковые молекулы, которые обеспечивают передачу информации от одних клеток иммунитета к другим. Таким образом осуществляется координация их активности. Эти молекулы отвечают и за согласование работы иммунной системы с деятельностью нервной и эндокринной систем. Кроме того, цитокины могут самостоятельно подавлять вирусы.
Обратите внимание! Клеточный иммунитет отвечает за уничтожение внутриклеточных бактерий, патогенных грибков, чужеродных клеток и тканей, а также раковых клеток. Он борется с патогенами, которые недоступны для гуморального иммунного ответа.
Как действует клеточный иммунитет
Различают неспецифический и специфический клеточный иммунитет.
Первый предполагает захват, поглощение и переваривание патогенов фагоцитами. Они постепенно обволакивают чужеродный агент, а после этого разрушают его с помощью специальных ферментов.
За специфический клеточный иммунитет отвечают T-киллеры, натуральные киллеры и другие лимфоциты.
Первыми в дело вступают Т-хелперы, которые запускают иммунную реакцию. Т-киллеры в ходе иммунного ответа вступают во взаимодействие с клетками, зараженными вирусами и внутриклеточными бактериями, а также раковыми клетками, и уничтожают их.
Натуральные киллеры, в свою очередь, борются с клетками, которые недоступны для действия T-киллеров.
После того, как патогены уничтожены, в дело вступают T-супрессоры, подавляющие иммунную реакцию.
Иммунный ответ
Иммунный ответ– это процесс вз/д клеток иммунной системы, который индуцируется антигеном и приводит к образованию АТ или иммунных лимфоцитов. При этом специфические реакции всегда сопровождается неспецифическими: такими как фагоци- тоз, активация комплемента, НК-клеток и т.д.
По механизму формирования различают 2 типа иммунного ответа: гуморальный и клеточный.
Гуморальный иммунный ответ– это основа антитоксического, антибактериального и антигрибкового иммунитета. В его развитии участвуют В-ЛФ: онив плазматические клетки, синтезирующие антитела; и В-клетки памяти.
Клеточный иммунный ответформируется в основном на АГ вирусов, опухолевых клеток и пересаженных чужеродных клеток. Его основные эффекторные клетки – Т-лимфоциты:CD8+–цитотоксические Т-ЛФ и Т-клетки с фенотипомCD4+, ответственные за гиперчувствительность замедленного типа – ТГЗТ-ЛФ, а также Т-клетки памяти.
Развитие того или иного типа иммунного ответанаправляется цитокинами Т-хелперов. В зависимости от секретируемых цитокинов Т-хелперы подразделяются на Т-хелперы 1-го, 2-го и 3-го типа.
Т-хелперы 1го типа выделяют ИЛ -2, 7, 9, 12, 15, γ-ИФН иTNF-α. Эти цитокины – основные индукторыклеточногоиммунного ответа и соответствующего воспаления.
Т-хелперы 2го типа выделяют ИЛ – 2,4,5, 6,10, 13, 14 и др., которые активируютгуморальныйиммунный ответ.
Т-хелперы 3го типа выделяют трансформирующий фактор роста -β (TGF- β) – это основнойсупрессориммунного ответа - их название – Т-супрессоры (не все авторы признают существование отдельной популяции Тх-3).
Др. гуморальные факторы супрессии - см. регуляция им. ответа.
Т-хелперы всех 3-х типов дифференцируются из наивного CD4+-Т-лимфоцита (Тх-0), созревание которого в тот или иной тип Т-хелперов (1-ый, 2-ой или 3-ий) зависит:
от природы антигена;
наличия в окружающей клетку среде определенных цитокинов.
Лимфоциты получают цитокиновые сигналы от АПК, NK-клеток, тучных клеток и др: для образования Тх-1 нужны ИЛ-12,2,18, ИФН –γ,TNF-α/β; для образования Тх-2 нуженИЛ-4 .
Механизм иммунного ответа
Для реализации иммунного ответа необходимы три типа клеток – макрофаг (или дендритная клетка), Т-лимфоцит и В-лимфоцит (трехклеточная система кооперации).
Основными стадиями иммунного ответаявляются:
1. Эндоцитоз антигена, его обработка и презентация ЛФ;
2. Распознавание антигена лимфоцитами;
3. Активация лимфоцитов;
4. Клональная экспансия или пролиферация лимфоцитов;
5. Созревание эффекторных клеток и клеток памяти.
6. Деструкция антигена.
Гуморальный иммунный ответ.
1.Стадия поглощения, переработки и презентации антигена.
Антигенпрезентирующая клетка (АПК – макрофаг, дендритная клетка или В-ЛФ) фагоцитирует АГ и направляется к лимфоузлам, по пути в клетке идет процессинг (катализ) антигена с помощью ферментов до пептидов. В результате из АГ освобождается антигенная детерминанта (это иммуноактивный пептид или информационная часть), которая загружается на молекулу HLA-2 и выводится на поверхность клетки для презентации. В лимфоузле АПК представляет расщепленный антиген лимфоциту. В этом процессе участвует наивныйCD4+-лимфоцит, который контактирует с несущей частью антигена ( а также получает цитокиновый сигнал – ИЛ -4 от АПК, дендритных кл. и др.) и дифференцируется в Т-хелпер 2-го типа.
2.Стадия распознавания.
В основе современных представлений об этой стадии лежат следующие постулаты:
На мембране ЛФ находятся специфические АГ-связывающие рецепторы, и их экспрессия не зависит от того, встречался ранее организм с данным АГ или нет.
На одном лимфоците находится рецептор только одной специфичности (см. выше).
Лимфоциты с рецепторами определенной специфичности составляют клон (т.е.это потомки одной родительской клетки).
Лимфоциты могут узнать чужеродный АГ на поверхности макрофага только на фоне собственного» HLA-антигена (так называемое двойное распознавание)соединение антигена сHLA-молекулой необходимо.
В -ЛФ распознают антиген (на мембране АПК на фоне HLA-2) с помощью Тх–2 (внеклеточные вирусы) или без него (АГ бактерий).
При этом В-ЛФ распознаёт информационную часть антигена с помощью BCR(это поверхностныеIgMиD, ассоциированные сCD-молекулами (19, 21, 79 или 81).
Т-хелпер несущую, с помощьюTCR, ассоциированного сCD4, некоторые Т –независимые бактериальные АГ распознаются рецепторомBCRбез помощи Т-хелперов).
3.Стадия активации.
Ещё во время распознавания В-лф получает сигналы:
а)специфический – информация об АГ от Тх-2 (ч/з антигенный мостик или путем секреции растворимой части АГ)
б)неспецифические сигналы активации:
- через ИЛ-1, секретируемый макрофагом,
- через цитокины Т-хелпера 2готипа (н-р ИЛ-2), секреция которых также индуцируется макрофагальным ИЛ-1.
Сигнальная трансдукция включает сложные клеточные реакции активируются тирозинкиназы (связанные с CD-79), фосфолипаза С-, протеинкиназа С, происходит мобилизация внутриклеточного Са и включается транскрипция гена, кодирующего ИЛ -2 (этот цитокин - ключевой ростовый фактор для ЛФ в иммунном ответе). Меняется также обмен арахидоновой кислоты и включается транскрипция генов структурных белков, обеспечивавющих митозы.
4.Стадия клональной пролиферации. После распознавания антигена и активации В-лимфоциты начинают размножаться (пролиферировать). Этот процесс протекает в лимфатических узлах и регулируется цитокинами Т-хелпера 2-го типа: ИЛ-2, 4, 5, 6, 10, 13, 14 и др.
5.Стадия дифференцировки.после пролиферации В-лимфоциты созревают и превращаются в плазматические клетки, которые мигрируют в костный мозг и слизистые оболочки, где синтезируют антитела, поступающие в кровь (этоIgM- уже в первые сутки клинического проявления инфекции иIgG– на 5 -7 сутки ; раннее появлениеIgGв сыворотке крови указывает на уже имеющуюся иммунную память к данной инфекции) или в слизистые секреты (этоIgА). Часть активирован- ных В-ЛФ не дифференцируется в плазматические клетки, а сохраняется как долгоживущиеВ-клетки памяти. Они обеспечивают более быстрый и эффективный вторичный иммунный ответ при повторном контакте с антигеном. После окончания иммунного ответа образуются также долгоживущие плазматические клетки, которые поддерживают синтезIgбез антигенной стимуляции1,5 года. В эту стадиюлимфоузлы, миндалины, селезенка.
6.Стадия деструкции антигенапроисходит с привлечением неспецифических факторов защиты.
Механизмы деструкции антигена:
Комплементзависимый лизис иммунных комплексов АГ+АТ;
Фагоцитоз и расщепление растворимых ИК макрофагами;
Антителозависимая клеточная цитотоксичность (АЗКЦ) – АТ опсонизируют клетки-мишени, а затем клетки-киллеры присоединяются к Fc-фрагменту антитела и разрушают клетку-мишень. Киллерами могут быть НК-клетки, моноциты/макрофаги, гранулоциты.
Клеточный иммунный ответреализуется аналогично. В реакциях участвуют 2 типа Т-лимфоцитов - ЦТЛ или ТГЗТ-ЛФ , которые распознают АГ на поверхности АПК (дендритной клетки или м/ф) на фонеHLA–1. В распознавании участвуют Тх–1. Распознавание антигена Т-клетками происходит с помощью рецептораTCR, который как уже говорилось, на ЦТЛ ассоциирован с молекулой (корецептором)CD8, на ТГЗТ-лимфоцитах - с СD4.
Т-хелперы 1-го типа секретируют цитокины – (ИЛ-2, 7, 9, 12, 15, ИФ-, ФНО), стимулирующие в лимфоузлах и селезенке размножение и созревание Т-ЛФ (ЦТЛ или ТГЗТ-клеток) в зрелые клетки.
Клоны CD8+-ЦТЛ нарастают быстро, клоныCD4+-ТГЗТ-лф – медленно.
Часть Т-клеток превращается в Т-клетки памятис фенотипом (соответственно)CD4+ илиCD8+, морфологически, в отличие от В-ЛФ они не меняются.
Конечной стадией клеточного иммунного ответа является деструкция антигена несколькими путями:
цитолизаклеток-мишеней лимфоцитами с помощью белков – перфоринов, образующих поры в клеточной мембране. Перфорины содержатся в гранулахNK-кл и ЦТЛ, в присутствии Са2+образуют трансмембранный канал на мембране кл.-мишени, по структуре близки к С9.
индукции апоптоза (из гранул ЦТЛгранзимы, это сериновые эсте- разы, проникающие в клетки-мишени ч/з “перфориновые” поры, они активируют гены, кодирующие Е для фрагментации ДНК или дезинтеграции содержимого клетки ).
фагоцитозакл-к – мишеней (при участии в иммунном ответе клеток воспаления -ТГЗТи соответственно реакции ГЗТ). ТГЗТ-лф ч/з секретируемые цитокины ( ИФ-γ и МИФ) привлекают м/ф и нейтрофилы в очаг иммунного воспаления и активируют их. Активированные макрофаги и нейтрофилы фагоцитируют клетки-мишени.
Иммунная система — Википедия
Имму́нная систе́ма — система органов, существующая у позвоночных животных и объединяющая органы и ткани, которые защищают организм от заболеваний, идентифицируя и уничтожая опухолевые клетки и патогены. Иммунная система распознаёт множество разнообразных возбудителей — от вирусов до паразитических червей — и отличает их от биомолекул собственных клеток. Распознавание возбудителей усложняется их адаптацией и эволюционным развитием новых методов успешного инфицирования организма-хозяина.
Конечной целью иммунной системы является уничтожение чужеродного агента, которым может оказаться болезнетворный микроорганизм, инородное тело, ядовитое вещество или переродившаяся клетка самого организма. Этим достигается биологическая индивидуальность организма.
В иммунной системе развитых организмов существует множество способов обнаружения и удаления чужеродных агентов: этот процесс называется иммунным ответом. Все формы иммунного ответа можно разделить на врождённые и приобретённые реакции. Основное различие между ними в том, что приобретённый иммунитет высокоспецифичен по отношению к конкретному типу антигенов и позволяет быстрее и эффективнее уничтожать их при повторном столкновении. Антигенами называют молекулы, воспринимаемые как чужеродные агенты и вызывающие специфические реакции организма. Например, у перенёсших ветрянку, корь, дифтерию людей часто возникает пожизненный иммунитет к этим заболеваниям. В случае аутоиммунных реакций антигеном может служить молекула, произведённая самим организмом.
Некоторые вещества, вырабатываемые иммунной системой, активно влияют на работу центральной нервной системы[1].
Защитные механизмы, направленные на распознавание и обезвреживание возбудителей, существуют даже у прокариот: например, ряд бактерий обладает ферментными системами, которые предотвращают заражение бактерии вирусом. Другие базовые иммунные механизмы развились в процессе эволюции у древних эукариот и сохранились у их современных потомков, в том числе у растений и животных. К таким механизмам относятся антимикробные пептиды, дефензины, рецепторы распознавания специфических последовательностей и система комплемента.
Короткие фрагменты РНК, которые избирательно синтезируются только в клетках половых органов (открыты в 2000-х годах), способны подавлять активность транспозонов (могут вызывать мутации при перемещении по геному) и передаются по материнской линии потомству. Потомство дрозофил получает в комплекте с ДНК такой молекулярный переключатель, который подавляет активность вредных генетических элементов[2].
Более сложные механизмы развились относительно недавно, в ходе эволюции позвоночных[3].
Иммунная система у позвоночных (например, у человека) состоит из множества видов белков, клеток, органов и тканей, взаимодействия между которыми сложны и динамичны. Благодаря такой усовершенствованной иммунной реакции система позвоночных со временем приспосабливается, и распознавание конкретных чужеродных веществ или клеток становится более эффективным. В процессе адаптации создаётся иммунологическая память, которая позволяет ещё более эффективно защищать организм при следующей встрече с этими возбудителями. Такой вид приобретённого иммунитета лежит в основе методик вакцинации.
У теплокровных сохранение гомеостаза уже обеспечивается двумя иммунными механизмами (разными по времени эволюционного появления): температура (общее воздействие) и антитела (избирательное воздействие).
Иммунная система человека и других позвоночных представляет собой комплекс органов и клеток, способных выполнять иммунологические функции. Прежде всего иммунный ответ осуществляют лейкоциты. Бо́льшая часть клеток иммунной системы происходит из кроветворных тканей. У взрослых людей развитие этих клеток начинается в костном мозге. Лишь Т-лимфоциты дифференцируются внутри тимуса (вилочковой железы). Зрелые клетки расселяются в лимфоидных органах и на границах с окружающей средой, около кожи или на слизистых оболочках.
Организм животных, обладающих механизмами приобретённого иммунитета, производит множество разновидностей специфических иммунных клеток, каждая из которых отвечает за какой-то определённый антиген. Наличие большого количества разновидностей иммунных клеток необходимо для того, чтобы отражать атаки микроорганизмов, способных мутировать и изменять свой антигенный состав. Значительная часть этих клеток завершает свой жизненный цикл, так и не приняв участие в защите организма, например, не встретив подходящих антигенов.
Иммунная система защищает организм от инфекции в несколько этапов, при этом с каждым этапом повышается специфичность защиты. Самая простая линия защиты представляет собой физические барьеры, которые предотвращают попадание возбудителей инфекции — бактерий и вирусов — в организм. Если возбудитель проникает через эти барьеры, промежуточную неспецифическую реакцию на него осуществляет врождённая иммунная система. Врождённая иммунная система обнаруживается у всех растений и животных[4]. На случай, когда возбудители успешно преодолевают воздействие врождённых иммунных механизмов, у позвоночных существует третий уровень защиты — приобретённая иммунная защита. Эта часть иммунной системы адаптирует свою реакцию во время инфекционного процесса, чтобы улучшить распознавание чужеродного биологического материала. Такой улучшенный ответ сохраняется после уничтожения возбудителя в виде иммунологической памяти. Она позволяет механизмам приобретённого иммунитета развивать более быструю и более сильную ответную реакцию при каждом появлении такого же возбудителя[5].
| Врождённый иммунитет | Приобретённый иммунитет |
|---|---|
| Реакция неспецифична | Специфическая реакция, привязанная к чужеродному антигену |
| Столкновение с инфекцией приводит к немедленной максимальной реакции | Между контактом с инфекцией и максимальным ответом латентный период |
| Клеточные и гуморальные звенья | Клеточные и гуморальные звенья |
| Не обладает иммунологической памятью | Столкновение с чужеродным агентом приводит к иммунологической памяти |
| Обнаруживается практически у всех форм жизни | Обнаружена только у некоторых организмов |
Как врождённый, так и приобретённый иммунитет зависят от способности иммунной системы отличать свои молекулы от чужих. В иммунологии под своими молекулами понимают те компоненты организма, которые иммунная система способна отличить от чужеродных[6]. Напротив, чужими называют молекулы, которые распознаются как чужеродные. Один из классов "чужих" молекул называют антигенами (термин произошёл от сокращения англ. antibody generators — «вызывающие антитела») и определяют как вещества, связываемые со специфическими иммунными рецепторами и вызывающие иммунный ответ[7].
Организмы защищены от инфекций рядом механических, химических и биологических барьеров. Примерами механических барьеров, служащих первым этапом защиты от инфекции, могут служить восковое покрытие многих листьев растений, экзоскелет членистоногих, скорлупа яиц и кожа[8]. Однако организм не может быть полностью отграничен от внешней среды, поэтому существуют и другие системы, защищающие внешние сообщения организма — дыхательную, пищеварительную и мочеполовую системы. Эти системы можно разделить на постоянно действующие и включающиеся в ответ на вторжение. Пример постоянно действующей системы — крохотные волоски на стенках трахеи, называемые ресничками, которые совершают быстрые движения, направленные вверх, удаляя частицы пыли, пыльцу растений или другие мелкие инородные объекты, чтобы они не могли попасть в лёгкие. Аналогичным образом, изгнание микроорганизмов осуществляется при помощи промывного действия слёз и мочи. Слизь, секретируемая в дыхательную и пищеварительную систему, служит для связывания и обездвиживания микроорганизмов[9].
Если постоянно действующих механизмов оказывается недостаточно, то включаются «аварийные» механизмы очистки организма, такие как кашель, чихание, рвота и диарея.
Помимо этого, существуют химические защитные барьеры. Кожа и дыхательные пути выделяют антимикробные пептиды, например бета-дефензины[10]. Такие ферменты, как лизоцим и фосфолипаза A, содержатся в слюне, слезах и грудном молоке, и также обладают антимикробным действием[11][12]. Выделения из влагалища служат химическим барьером после начала менструаций, когда они становятся слабокислыми. Сперма содержит дефензины и цинк для уничтожения возбудителей[13][14]. В желудке соляная кислота и протеолитические ферменты служат мощными химическими защитными факторами в отношении попавших с пищей микроорганизмов.
В мочеполовом и желудочно-кишечном трактах существуют биологические барьеры, представленные дружественными микроорганизмами — комменсалами. Приспособившаяся к обитанию в этих условиях неболезнетворная микрофлора конкурирует с патогенными бактериями за пищу и пространство, и, в ряде случаев, изменяя условия обитания, в частности pH или содержание железа[15]. Это снижает вероятность достижения болезнетворными микробами достаточных для возникновения патологии количеств. Поскольку большая часть антибиотиков неспецифически воздействует на бактерии, и, зачастую, не затрагивает грибы, антибактериальная терапия может приводить к чрезмерному «разрастанию» грибковых микроорганизмов, что вызывает такие заболевания, как молочница (кандидоз)[16]. Есть убедительные сведения, подтверждающие, что введение пробиотической флоры, например чистых культур лактобацилл, которые содержатся, в частности, в йогурте и других кисломолочных продуктах, помогает восстановить нужный баланс микробных популяций при кишечных инфекциях у детей. Также существуют обнадёживающие данные в исследованиях применения пробиотиков при бактериальном гастроэнтерите, воспалительных заболеваниях кишечника, инфекциях мочевыводящих путей и послеоперационных инфекциях[17][18][19].
Если микроорганизму удаётся проникнуть через первичные барьеры, он сталкивается с клетками и механизмами системы врождённого иммунитета. Врождённая иммунная защита неспецифична, то есть её звенья распознают и реагируют на чужеродные тела независимо от их особенностей[8]. Эта система не создаёт длительной невосприимчивости к конкретной инфекции. Система врождённого иммунитета осуществляет основную защиту у большинства живых многоклеточных организмов[4]. С рождения у людей иммунитет одинаковый, но он меняется в процессе роста.
Гуморальные и биохимические факторы[править | править код]
Воспаление[править | править код]
Воспаление — одна из наиболее ранних реакций иммунной системы на инфекцию[20]. К симптомам воспаления относятся покраснение и отёк, что свидетельствует об усилении притока крови к вовлечённым в процесс тканям. В развитии воспалительной реакции важную роль играют эйкозаноиды и цитокины, высвобождаемые повреждёнными или инфицированными клетками. К эйкозаноидам относятся простагландины, вызывающие повышение температуры и расширение кровеносных сосудов, и лейкотриены, которые привлекают определённые виды белых кровяных телец (лейкоцитов)[21][22]. К наиболее распространённым цитокинам относятся интерлейкины, отвечающие за взаимодействие между лейкоцитами, хемокины, стимулирующие хемотаксис, и интерфероны, обладающие противовирусными свойствами, в частности способностью угнетать синтез белка в клетках макроорганизма[23]. Кроме того, могут играть роль выделяемые факторы роста и цитотоксические факторы. Эти цитокины и другие биоорганические соединения привлекают клетки иммунной системы к очагу инфекции и способствуют заживлению повреждённых тканей путём уничтожения возбудителей[24].
Система комплемента[править | править код]
Система комплемента представляет собой биохимический каскад, который атакует мембрану чужеродных клеток. В него входят более 20 различных белков. Комплемент является основным гуморальным компонентом врождённого иммунного ответа[25][26]. Система комплемента имеется у многих видов, в том числе у ряда беспозвоночных[27].
У человека этот механизм активируется путём связывания белков комплемента с углеводами на поверхности микробных клеток, либо путём связывания комплемента с антителами, которые прикрепились к этим микробам (второй способ отражает взаимосвязь механизмов врождённого и приобретённого иммунитета). Сигнал в виде прикреплённого к мембране клетки комплемента запускает быстрые реакции, направленные на разрушение такой клетки[28]. Скорость этих реакций обусловлена усилением, возникающим вследствие последовательной протеолитической активации молекул комплемента, которые сами по себе являются протеазами. После того, как белки комплемента прикрепились к микроорганизму, запускается их протеолитическое действие, что, в свою очередь, активирует другие протеазы системы комплемента, и так далее. Таким образом возникает каскадная реакция, усиливающая исходный сигнал при помощи управляемой положительной обратной связи[29]. В результате каскада образуются пептиды, привлекающие иммунные клетки, усиливающие проницаемость сосудов и опсонизирующие поверхность клетки, помечая её «к уничтожению». Кроме того, отложение факторов комплемента на поверхности клетки может напрямую разрушать её посредством разрушения цитоплазматической мембраны[25].
Существуют три пути активации комплемента: классический, лектиновый и альтернативный. За неспецифическую реакцию врождённого иммунитета без участия антител отвечают лектиновый и альтернативный пути активации комплемента. У позвоночных комплемент также участвует в реакциях специфического иммунитета, при этом его активация обычно происходит по классическому пути[7].
Клеточные факторы врождённого иммунитета[править | править код]
Лейкоциты (белые кровяные тельца) часто ведут себя подобно независимым одноклеточным организмам, и представляют собой главное клеточное звено врождённого (гранулоциты и макрофаги) и приобретённого (в первую очередь лимфоциты, но их действия тесно связаны с клетками врождённой системы) иммунитета. К клеткам, воплощающим неспецифическую («врождённую») иммунную реакцию, относятся фагоциты (макрофаги, нейтрофилы и дендритные клетки), тучные клетки, базофилы, эозинофилы и естественные киллеры. Эти клетки распознают и уничтожают чужеродные частицы путём фагоцитоза (заглатывания и последующего внутриклеточного переваривания) либо, в случае крупных чужеродных тел (например, паразитов или крупных опухолевых клеток), путём выделения разрушительных частиц при непосредственном контакте[27]. Кроме того, осуществляющие неспецифический иммунитет клетки являются важными посредниками в процессе активации механизмов приобретённого иммунитета[5].
Фагоциты[править | править код]
Активация NK-клетки отсутствием комплекса ГКГС-I на инфицированной клетке.Фагоцитоз представляет собой важную особенность клеточного звена врождённого иммунитета, которую осуществляют клетки, называемые фагоцитами, которые «переваривают» чужеродные микроорганизмы или частицы. Фагоциты обычно циркулируют по организму в поисках чужеродных материалов, но могут быть призваны в определённое место при помощи цитокинов[8]. После поглощения чужеродного микроорганизма фагоцитом он оказывается в ловушке внутриклеточного пузырька, который называется фагосомой. Фагосома сливается с другим пузырьком — лизосомой, в результате чего формируется фаголизосома. Микроорганизм погибает под воздействием пищеварительных ферментов, либо в результате дыхательного взрыва, при котором в фаголизосому высвобождаются свободные радикалы[30][31]. Фагоцитоз эволюционировал из способа получения захвата питательных веществ, но эта роль у фагоцитов была расширена, став защитным механизмом, направленным на разрушение патогенных возбудителей[32]. Фагоцитоз, вероятно, представляет собой наиболее старую форму защиты макроорганизма, поскольку фагоциты обнаруживаются как у позвоночных, так и у беспозвоночных животных[33].
К фагоцитам относятся такие клетки, как мононуклеарные фагоциты (в частности — моноциты и макрофаги), дендритные клетки и нейтрофилы. Фагоциты способны связывать микроорганизмы и антигены на своей поверхности, а затем поглощать и уничтожать их. Эта функция основана на простых механизмах распознавания, позволяющих связывать самые разнообразные микробные продукты, и относится к проявлениям врождённого иммунитета. С появлением специфического иммунного ответа мононуклеарные фагоциты играют важную роль в его механизмах путём представления антигенов Т-лимфоцитам. Для эффективного уничтожения микробов фагоцитам требуется активация.
Нейтрофилы и макрофаги представляют собой фагоциты, которые путешествуют по организму в поисках проникших сквозь первичные барьеры чужеродных микроорганизмов[34]. Нейтрофилы обычно обнаруживаются в крови и представляют собой наиболее многочисленную группу фагоцитов, обычно представляющую около 50—60 % общего количества циркулирующих лейкоцитов[35]. Во время острой фазы воспаления, в частности, в результате бактериальной инфекции, нейтрофилы мигрируют к очагу воспаления. Этот процесс называется хемотаксисом. Они обычно являются первыми клетками, реагирующими на очаг инфекции. Макрофаги представляют собой клетки многоцелевого назначения, обитающие в тканях и производящие широкий спектр биохимических факторов, включая ферменты, белки системы комплемента и регуляторные факторы, например интерлейкин-1[36]. Кроме того, макрофаги выполняют функцию уборщиков, избавляя организм от изношенных клеток и другого мусора, а также функцию антиген-презентирующих клеток, активирующих звенья приобретённого иммунитета[5].
Дендритные клетки представляют собой фагоциты в тканях, которые соприкасаются с внешней средой, то есть расположены они, главным образом, в коже, носу, лёгких, желудке и кишечнике[37]. Они названы так, поскольку напоминают дендриты нейронов наличием многочисленных отростков, однако дендритные клетки никоим образом не связаны с нервной системой. Дендритные клетки служат связующим звеном между врождённым и приобретённым иммунитетом, поскольку они представляют антиген Т-клеткам, одному из ключевых типов клеток приобретённого иммунитета[37].
Вспомогательные клетки[править | править код]
Вспомогательными клетками считаются тучные клетки, базофилы, эозинофилы, тромбоциты. Также в иммунной защите участвуют соматические клетки различных тканей организма. Тучные клетки находятся в соединительной ткани и слизистых оболочках и участвуют в регуляции воспалительной реакции[38]. Они очень часто связаны с аллергией и анафилаксией[35]. Они во многом напоминают базофилы — одну из малочисленных подгрупп зернистых лейкоцитов. Базофилы и эозинофилы родственны нейтрофилам. Эозинофилы секретируют биохимические медиаторы, которые участвуют в защите от крупных многоклеточных паразитов, а также играют роль в аллергических реакциях, например при бронхиальной астме[39]. Естественные киллеры (или натуральные, или нормальные, от англ. Natural killer) представляют собой лейкоциты группы лимфоцитов, которые атакуют и уничтожают опухолевые клетки, или инфицированные вирусами клетки[40].
Система приобретённого иммунитета появилась в ходе эволюции низших позвоночных. Она обеспечивает более интенсивный иммунный ответ, а также иммунологическую память, благодаря которой каждый чужеродный микроорганизм «запоминается» по уникальным для него антигенам[41]. Система приобретённого иммунитета антигенспецифична и требует распознавания специфических чужих («не своих») антигенов в процессе, называемом презентацией антигена. Специфичность антигена позволяет осуществлять реакции, которые предназначены конкретным микроорганизмам или инфицированным ими клеткам. Способность к осуществлению таких узконаправленных реакций поддерживается в организме «клетками памяти». Если макроорганизм инфицируется микроорганизмом более одного раза, эти специфические клетки памяти используются для быстрого уничтожения такого микроорганизма.
Лимфоциты[править | править код]
Клетки иммунной системы, на которые возложены ключевые функции по осуществлению приобретённого иммунитета, относятся к лимфоцитам, которые являются подтипом лейкоцитов. Большая часть лимфоцитов отвечает за специфический приобретённый иммунитет, так как могут распознавать возбудителей инфекции внутри или вне клеток, в тканях или в крови.
Основными типами лимфоцитов являются B-клетки и Т-клетки, которые происходят из плюрипотентных гемопоэтических стволовых клеток; у взрослого человека они образуются в костном мозге[27], а Т-лимфоциты дополнительно проходят часть этапов дифференцировки в тимусе. B-клетки отвечают за гуморальное звено приобретённого иммунитета, то есть вырабатывают антитела, в то время как Т-клетки представляют собой основу клеточного звена специфического иммунного ответа.
В организме предшественники лимфоцитов непрерывно продуцируются в ходе дифференциации стволовых кроветворных клеток, при этом вследствие мутаций генов, кодирующих вариабельные цепи антител, возникает множество клеток, чувствительных к множеству потенциально существующих антигенов. На этапе развития лимфоциты проходят отбор: остаются только значимые с точки зрения защиты организма, а также те, которые не несут угрозы собственным тканям организма. Параллельно с этим процессом лимфоциты разделяются на группы, способные выполнять ту или иную функцию защиты. Существуют разные виды лимфоцитов. В частности, по морфологическим признакам их разделяют на малые лимфоциты и большие гранулярные лимфоциты (БГЛ). По структуре внешних рецепторов среди лимфоцитов выделяют, в частности, B-лимфоциты и Т-лимфоциты.
Как B-, так и Т-клетки несут на своей поверхности рецепторные молекулы, которые распознают специфические мишени. Рецепторы представляют собой как бы «зеркальный отпечаток» определённой части чужеродной молекулы, способный присоединяться к ней. При этом одна клетка может содержать рецепторы только для одного вида антигенов.
Т-клетки распознают чужеродные («не-свои») мишени, такие как патогенные микроорганизмы, только после того, как антигены (специфические молекулы чужеродного тела) будут обработаны и презентированы в сочетании с собственной («своей») биомолекулой, которая называется молекулой главного комплекса гистосовместимости (англ. major histocompatibility complex, MHC). Среди Т-клеток различают ряд подтипов, в частности, Т-киллеры, Т-хелперы и регуляторные Т-клетки.
Т-киллеры распознают только антигены, которые объединены с молекулами главного комплекса гистосовместимости I класса, в то время как Т-хелперы распознают только антигены, расположенные на поверхности клеток в сочетании с молекулами главного комплекса гистосовместимости II класса. Это различие в презентации антигена отражает разные роли указанных двух типов Т-клеток. Другим, менее распространённым подтипом Т-клеток, являются γδ Т-клетки, которые распознают неизменённые антигены, не связанные с рецепторами главного комплекса гистосовместимости[42].
У Т-лимфоцитов круг задач весьма широк. Часть из них — регуляция приобретённого иммунитета с помощью специальных белков (в частности, цитокинов), активация B-лимфоцитов для образования антител, а также регуляция активации фагоцитов для более эффективного разрушения микроорганизмов. Эту задачу выполняет группа Т-хелперов. За разрушение собственных клеток организма путём выделения цитотоксичных факторов при непосредственном контакте отвечают Т-киллеры, которые действуют специфически.
В отличие от Т-клеток, B-клетки не нуждаются в обработке антигена и экспрессии его на поверхности клетки. Их рецепторы к антигену представляют собой фиксированные на поверхности B-клетки антителоподобные белки. Каждая прошедшая дифференцировку линия B-клеток экспрессирует уникальное только для неё антитело, и никакое другое. Таким образом, полный набор антигенных рецепторов всех B-клеток организма представляет все антитела, которые организм может вырабатывать[27]. Функция B-лимфоцитов заключается прежде всего в выработке антител — гуморального субстрата специфического иммунитета, — действие которых направлено прежде всего против внеклеточно расположенных возбудителей.
Кроме того, существуют лимфоциты, неспецифически проявляющие цитотоксичность — естественные киллеры.
Т-киллеры[править | править код]
Цитотоксическая Т-клетка распознает антиген, представленный комплексом ГКГС-I инфицированной клетки.Т-киллеры представляют собой подгруппу Т-клеток, функцией которых является разрушение собственных клеток организма, инфицированных вирусами или другими патогенными внутриклеточными микроорганизмами[43], либо клеток, которые повреждены или неверно функционируют (например, опухолевые клетки). Как и B-клетки, каждая конкретная линия Т-клеток распознает только один антиген. Т-киллеры активируются при соединении своим Т-клеточным рецептором (ТКР) со специфическим антигеном в комплексе с рецептором главного комплекса гистосовместимости I класса другой клетки. Распознавание этого комплекса рецептора гистосовместимости с антигеном осуществляется при участии расположенного на поверхности Т-клетки вспомогательного рецептора CD8. В лабораторных условиях Т-клетки обычно выявляют именно по экспрессии CD8. После активации Т-клетка перемещается по организму в поисках клеток, на которых белок I класса главного комплекса гистосовместимости содержит последовательность нужного антигена. При контакте активированного Т-киллера с такими клетками он выделяет токсины, образующие отверстия в цитоплазматической мембране клеток-мишеней, в результате ионы, вода и токсин свободно перемещаются в клетку-мишень и из неё: клетка-мишень погибает[44]. Разрушение собственных клеток Т-киллерами важно, в частности, для предотвращения размножения вирусов. Активация Т-киллеров жёстко управляется и обычно требует очень сильного сигнала активации от комплекса белка гистосовместимости с антигеном, либо дополнительной активации факторами Т-хелперов[44].
Т-хелперы[править | править код]
Т-хелперы регулируют реакции как врождённого, так и приобретённого иммунитета, и позволяют определять тип ответа, который организм окажет на конкретный чужеродный материал[45][46]. Эти клетки не проявляют цитотоксичности и не участвуют в уничтожении инфицированных клеток или непосредственно возбудителей. Вместо этого они управляют иммунным ответом, направляя другие клетки на выполнение этих задач.
Активация иммунного ответа.Т-хелперы экспрессируют Т-клеточные рецепторы (ТКР), которые распознают антигены, связанные с молекулами II класса главного комплекса гистосовместимости. Комплекс молекулы главного комплекса гистосовместимости с антигеном также распознается корецептором клеток-хелперов CD4, который привлекает внутриклеточные молекулы Т-клетки (например, Lck), ответственные за активацию Т-клетки. Т-хелперы обладают меньшей чувствительностью к комплексу молекулы главного комплекса гистосовместимости и антигена, чем Т-киллеры, то есть для активации Т-хелпера требуется связывание гораздо большего количества его рецепторов (около 200—300) с комплексом молекулы гистосовместимости и антигена, в то время как Т-киллеры могут быть активированы после связывания с одним таким комплексом. Активация Т-хелпера также требует более продолжительного контакта с антиген-презентирующей клеткой[47]. Активация неактивного Т-хелпера приводит к высвобождению им цитокинов, которые оказывают влияние на активность многих видов клеток. Цитокиновые сигналы, создаваемые Т-хелперами, усиливают бактерицидную функцию макрофагов и активность Т-киллеров[8]. Кроме того, активация Т-хелперов вызывает изменения в экспрессии молекул на поверхности Т-клетки, в частности лиганда CD40 (также известного под обозначением CD154), что создаёт дополнительные стимулирующие сигналы, обычно требуемые для активации вырабатывающих антитела B-клеток[48].
Гамма-дельта Т-клетки[править | править код]
5—10 % Т-клеток несут на своей поверхности гамма-дельта-ТКР и обозначаются как γδ Т-клетки.
B-лимфоциты и антитела[править | править код]
Дифференциация В-клетки в плазматическую клеткуВ-клетки составляют 5—15 % циркулирующих лимфоцитов и характеризуются поверхностными иммуноглобулинами, встроенными в клеточную мембрану и выполняющими функцию специфического антигенного рецептора. Этот рецептор, специфичный лишь для определённого антигена, называется антителом. Антиген, связываясь с соответствующим антителом на поверхности В-клетки, индуцирует пролиферацию и дифференцировку В-клетки до плазматических клеток и клеток памяти, специфичность которых такая же, как и специфичность исходной В-клетки. Плазматические клетки секретируют большое количество антител в виде растворимых молекул, распознающих исходный антиген. Секретируемые антитела имеют ту же специфичность, что и соответствующий В-клеточный рецептор.
Антигенпрезентирующие клетки[править | править код]
См. Дендритные клетки
Иммунологическая память — это способность иммунной системы отвечать более быстро и эффективно на антиген (патоген), с которым у организма был предварительный контакт.
Такая память обеспечивается предсуществующими антигенспецифическими клонами как В-клеток, так и Т-клеток, которые функционально более активны в результате прошедшей первичной адаптации к определённому антигену.
Пока неясно, устанавливается ли память в результате формирования долгоживущих специализированных клеток памяти или же память отражает собой процесс рестимуляции лимфоцитов постоянно присутствующим антигеном, попавшим в организм при первичной иммунизации.
Иммунологические расстройства у человека[править | править код]
Иммунодефициты[править | править код]
Иммунодефициты (ИДС) — это нарушения иммунологической реактивности, которые обусловлены выпадением одного или нескольких компонентов иммунного аппарата или тесно взаимодействующих с ним неспецифических факторов.
Аутоиммунные процессы[править | править код]
Аутоиммунные процессы — это в значительной степени хронические явления, которые приводят к долговременному повреждению тканей. Это связано в первую очередь с тем, что аутоиммунная реакция постоянно поддерживается тканевыми антигенами.
Гиперчувствительность[править | править код]
Гиперчувствительность — это термин, используемый для обозначения иммунного ответа, который протекает в аггравированной и неадекватной форме, в результате чего происходит повреждение тканей.
Другие защитные механизмы макроорганизма[править | править код]
К аспектам иммунологии опухолей относятся три основных направления исследований:
- Использование методов иммунологии для диагностики опухолей, определения прогноза и выработки тактики лечения заболевания;
- Осуществление иммунотерапии в качестве дополнения к другим видам лечения и для иммунокоррекции — восстановления деятельности иммунной системы;
- Определение роли иммунологического наблюдения за опухолями у человека.
Физиологические механизмы[править | править код]
Применяемые в медицине методы воздействия[править | править код]
Существует несколько методов влияния на иммунный ответ для подавления нежелательных эффектов, вызываемых аутоиммунными заболеваниями, аллергиями, пересадкой органов, либо для стимулирования защитного ответа против определенных патогенов (иммунизация при помощи вакцин[49]) или отдельных видов опухолей.
Иммуносупрессия[править | править код]
Иммуносупрессия (иммунодепрессия) — угнетение иммунитета с помощью лекарственных препаратов (иммуносупрессоров) при аутоиммунных заболеваниях или воспалениях, при которых происходит избыточное повреждение тканей. Длительная постоянная иммуносупрессия необходима после пересадки органов для предотвращения отторжения органа[50][51].
Противовоспалительные лекарственные средства часто применяются для управления эффектами воспаления. Наиболее сильное действие среди них оказывают Глюкокортикоиды, однако они часто имеют нежелательные побочные эффекты, и их применение требует контроля.[52] В малых дозах противовоспалительные средства применяются вместе с цитотоксинами или иммуносупрессорами (например, Метотрексат или Азатиоприн).
Цитотоксические препараты, применяемые в химиотерапии, подавляют иммунный отве
Гуморальный иммунный ответ — формы, механизм, типы, схема, первичный, вторичный, развитие, регуляция, формирование, контроль, вики — Wiki-Med
Содержание (план)
Гуморальный иммунный ответ на данный антиген может реализовываться как по Т-зависимому механизму так и по Т-независимому пути. Как Т-зависимый, так и Т-независимый иммунный ответ являются специфическими, поскольку осуществляются на конкретный антиген.
Т-зависимый иммунный ответ
После антигенной презентации В-лимфоциты покидают Т-клеточную зону, поскольку последующие этапы их преобразования происходят в герминативных центрах фолликулов лимфоузлов (В-клеточных зонах). Содержащиеся здесь фолликулярные ДК благодаря наличию Fc-рецепторов и СRII накапливают на своей поверхности непроцессированные антигены в виде иммунных комплексов. Повторное взаимодействие прибывших из Т-зон В-лимфоцитов с описанными антигенами обеспечивает более эффективную активацию и аффинную селекцию В-клеток путем гипермутагенеза их иммуноглобулиновых рецепторов. При соматическом гипермутагенезе рецепторов антигенного распознавания В-клеток происходит незначительная реорганизация антигенсвязывающих сайтов рецепторов на фоне пролиферации материнских В-клеток. Это приводит к возникновению целого ряда В-лимфоцитов с несколько отличными рецепторами к одному и тому же антигену. Путем повторных взаимодействий с антигеном, содержащимся на поверхности фолликулярной ДК, отбирается тот лимфоцит, иммуноглобулиновый рецептор которою наиболее комплементарен данной антигенной субстанции. Именно такой лимфоцит получает самый мощный активационный сигнал для дальнейшей пролиферации, поэтому именно он и образует антигенспецифический клон В-клеток. В последующем такие клетки окончательно дифференцируются в плазмоциты, которые уже не способны к размножению. Эти плазматические клетки обеспечивают продукцию антител, причем сначала синтезируются только IgM. Хотя эти иммуноглобулины недостаточно специфичны, они имеют максимальное количество центров связывания антигена (5), что чрезвычайно важно на начальном этапе иммунного ответа, когда регистрируется наибольшее содержание свободного патогена. В последующем происходит переключение класса синтезируемых плазматической клеткой антител. Для этой необходимо соответствующее цитокиновое влияние и повторное взаимодействие CD40L антигенспецифического Т-хелпера с молекулой CD40, экспрессия которой сохраняется на мембране плазмоцита. На рис. 29 представлен интерфейс взаимодействия Т-хелпера с В-лимфоцитом
При реализации гуморального иммунного ответа по Т-зависимому пути выработка антител (иммуноглобулинов) осуществляется после получения сигналов от АПК и Т-хелперов. Т-зависимый иммунный ответ осуществляется на большинство антигенов. Его особенностями являются продукция IgM, а затем — IgG, IgA, реже — IgE, наличие иммунной памяти. Материал с сайта http://wiki-med.com
При взаимодействии антигена с синтезированными IgM и IgG образуются иммунные комплексы (антиген-антитело), которые активируют систему комплемента. В дальнейшем иммунные комплексы поглощаются макрофагами, процессируются и иммуногенные пептиды захваченного патогена представляются Т-хелперам. Таким образом, происходит самоподдержание иммунных реакций до полной элиминации патогена.
Т-независимый иммунный ответ
На некоторые антигены, содержащие многократно повторяющиеся детерминанты (декстраны, липополисахариды и др.), осуществляется Т-независимый иммунный ответ. В этом случае полноценная активация В-лимфоцита достигается без привлечения Т-хелпера. В результате Т-независимого иммунного ответа продуцируется только IgM и не остается иммунной памяти.
На этой странице материал по темам:т-зависимые и т-независимый гуморальный ответ
т-независимый иммунный ответ примеры
гуморальный плазмоциты иммунитет схема
т-зависимый гуморальный иммунный ответ
регуляция иммунного ответа лекция
Иммунитет — Википедия
Иммуните́т (лат. immunitas) — невосприимчивость, сопротивляемость организма к инфекционным агентам и чужеродным веществам, которые вызывают деструкцию его клеток и тканей. Иммунитет характеризуется изменением функциональной активности преимущественно иммуноцитов с целью поддержания гомеостаза внутренней среды.
Простейшие защитные механизмы, имеющие своей целью распознавание и обезвреживание патогенов, существуют даже у прокариот: например, ряд бактерий обладает ферментными системами, которые препятствуют заражению бактерии вирусом[1]. Одноклеточные эукариотные организмы применяют токсичные пептиды, чтобы предотвратить проникновение бактерий и вирусов в свои клетки.
По мере эволюции сложно организованных многоклеточных организмов у них формируется многоуровневая иммунная система, важнейшим звеном которой становятся специализированные клетки, противостоящие вторжению генетически чужеродных объектов[2].
У таких организмов иммунный ответ происходит при столкновении данного организма с самым различным чужеродным в антигенном отношении материалом, включая вирусы, бактерии и другие микроорганизмы, обладающие иммуногенными свойствами молекулы (прежде всего белки, а также полисахариды и даже некоторые простые вещества, если последние образуют комплексы с белками-носителями — гаптены[3]), трансплантаты или мутационно изменённые собственные клетки организма. Как отмечает В. Г. Галактионов, «иммунитет есть способ защиты организма от всех антигенно чужеродных веществ как экзогенной, так и эндогенной природы; биологический смысл подобной защиты — обеспечение генетической целостности особей вида в течение их индивидуальной жизни». Биологическим смыслом такой защиты является обеспечение генетической целостности особей вида на протяжении их индивидуальной жизни, так что иммунитет выступает как фактор стабильности онтогенеза[4].
Характерные признаки иммунной системы[5]:
- способность отличать «своё» от «чужого»;
- формирование памяти после первичного контакта с чужеродным антигенным материалом;
- клональная организация иммунокомпетентных клеток, при которой отдельный клеточный клон способен, как правило, реагировать лишь на одну из множества антигенных детерминант.
Иммунная система исторически описывается состоящей из двух частей — системы гуморального иммунитета и системы клеточного иммунитета. В случае гуморального иммунитета защитные функции выполняют молекулы, находящиеся в плазме крови, а не клеточные элементы. В то время как в случае клеточного иммунитета защитная функция связана именно с клетками иммунной системы.
Иммунитет так же классифицируют на врождённый и адаптивный.
Врождённый (неспецифический, наследственный[6]) иммунитет обусловлен способностью идентифицировать и обезвреживать разнообразные патогены по наиболее консервативным, общим для них признакам, дальности эволюционного родства, до первой встречи с ними. В 2011 году была вручена Нобелевская премия в области медицины и физиологии за изучение новых механизмов работы врождённого иммунитета (Ральф Стайнман, Жюль Хоффман и Брюс Бётлер).
Осуществляется большей частью клетками миелоидного ряда, не имеет строгой специфичности к антигенам, не имеет клонального ответа, не обладает памятью о первичном контакте с чужеродным агентом.
Адаптивный (устар. приобретённый, специфический) иммунитет имеет способность распознавать и реагировать на индивидуальные антигены, характеризуется клональным ответом, в реакцию вовлекаются лимфоидные клетки, имеется иммунологическая память, возможна аутоагрессия.
Классифицируют на активный и пассивный.
- Приобретённый активный иммунитет возникает после перенесённого заболевания или после введения вакцины.
- Приобретённый пассивный иммунитет развивается при введении в организм готовых антител в виде сыворотки или передаче их новорождённому с молозивом матери или внутриутробным способом.
Другая классификация разделяет иммунитет на естественный и искусственный.
- Естественный иммунитет включает врождённый иммунитет и приобретённый активный (после перенесённого заболевания), а также пассивный иммунитет при передаче антител ребёнку от матери.
- Искусственный иммунитет включает приобретённый активный после прививки (введение вакцины) и приобретённый пассивный (введение сыворотки).
Выделяют центральные и периферические органы иммунной системы. К центральным органам относят красный костный мозг и тимус, а к периферическим — селезёнку, лимфатические узлы, а также местноассоциированную лимфоидную ткань: бронхассоциированную (БАЛТ), кожноассоциированную (КАЛТ), кишечноассоциированную (КиЛТ, пейеровы бляшки).
Красный костный мозг — центральный орган кроветворения и иммуногенеза. Содержит самоподдерживающуюся популяцию стволовых клеток. Красный костный мозг находится в ячейках губчатого вещества плоских костей и в эпифизах трубчатых костей. Здесь происходит дифференцировка В-лимфоцитов из предшественников. Содержит также Т-лимфоциты.
Тимус — центральный орган иммунной системы. В нём происходит дифференцировка Т-лимфоцитов из предшественников, поступающих из красного костного мозга.
Лимфатические узлы — периферические органы иммунной системы. Они располагаются по ходу лимфатических сосудов. В каждом узле выделяют корковое и мозговое вещество. В корковом веществе есть В-зависимые зоны и Т-зависимые зоны. В мозговом есть только Т-зависимые зоны.
Селезёнка — паренхиматозный зональный орган. Является самым крупным органом иммунной системы, кроме того, выполняет депонирующую функцию по отношению к крови. Селезёнка покрыта капсулой из плотной соединительной ткани, которая содержит гладкомышечные клетки, позволяющие ей при необходимости сокращаться. Паренхима представлена двумя функционально различными зонами: белой и красной пульпой. Белая пульпа составляет 20 %, представлена лимфоидной тканью. Здесь имеются В-зависимые и Т-зависимые зоны. И также здесь есть макрофаги. Красная пульпа составляет 80 %. Она выполняет следующие функции:
- Депонирование зрелых форменных элементов крови.
- Контроль состояния и разрушения старых и повреждённых эритроцитов и тромбоцитов.
- Фагоцитоз инородных частиц.
- Обеспечение дозревания лимфоидных клеток и превращение моноцитов в макрофаги.
К иммунокомпетентным клеткам относят макрофаги и лимфоциты. Эти клетки совместно участвуют в инициации и развитии всех звеньев адаптивного иммунного ответа (система трёхклеточной кооперации).
Клетки, участвующие в иммунном ответе[править | править код]
T-Лимфоциты[править | править код]
Субпопуляция лимфоцитов, отвечающая главным образом за клеточный иммунный ответ. Включает в себя субпопуляции Т-хелперов (дополнительно разделяются на Th2, Th3, а также выделяют Th4, Th9, Th27, Th32, Treg), цитотоксических Т-лимфоцитов,NKT. Включает в себя эффектор, регуляторы и долгоживущие клетки-памяти. Функции разнообразны: как регуляторы и администраторы иммунного ответа (Т-хелперы), так и киллеры (цитотоксические Т-лимфоциты).
B-Лимфоциты[править | править код]
Субпопуляция лимфоцитов синтезирующая антитела и отвечающая за гуморальный иммунный ответ.
Натуральные киллеры[править | править код]
Натуральные киллеры (NK-клетки) — субпопуляция лимфоцитов, обладающая цитотоксичной активностью, то есть они способны: контактировать с клетками-мишенями, секретировать токсичные для них белки, убивать их или отправлять в апоптоз. Натуральные киллеры распознают клетки, поражённые вирусами и опухолевые клетки.
Нейтрофилы[править | править код]
Нейтрофилы — это неделящиеся и короткоживущие клетки. Они составляют 65-70 % от гранулоцитов. Нейтрофилы содержат огромное количество антибиотических белков, которые содержатся в различных гранулах. К этим белкам относятся лизоцим (мурамидаза), липопероксидаза и другие антибиотические белки. Нейтрофилы способны самостоятельно мигрировать к месту нахождения антигена, так как у них есть рецепторы хемотаксиса (двигательная реакция на химическое вещество). Нейтрофилы способны «прилипать» к эндотелию сосудов и далее мигрировать через стенку к месту нахождения антигенов. Далее проходит фагический цикл, и нейтрофилы постепенно заполняются продуктами обмена. Далее они погибают и превращаются в клетки гноя.
Эозинофилы[править | править код]
Эозинофилы составляют 2—5 % от гранулоцитов. Способны фагоцитировать микробы и уничтожать их. Но это не является их главной функцией. Главным объектом эозинофилов являются гельминты. Эозинофилы узнают гельминтов и экзоцитируют в зону контакта вещества — перфорины. Эти белки встраиваются в билипидный слой клеток гельминта. В них образуются поры, внутрь клеток устремляется вода, и гельминт погибает от осмотического шока.
Базофилы[править | править код]
Базофилы составляют 0,5-1 % от гранулоцитов. Существуют две формы базофилов: собственно базофилы, циркулирующие в крови, и тучные клетки, находящиеся в ткани. Тучные клетки располагаются в различных тканях, лёгких, слизистых и вдоль сосудов. Они способны вырабатывать вещества, стимулирующие анафилаксию (расширение сосудов, сокращение гладких мышц, сужение бронхов). При этом происходит взаимодействие с иммуноглобулином Е (IgE). Таким образом они участвуют в аллергических реакциях. В частности, в реакциях немедленного типа.
Моноциты[править | править код]
Моноциты превращаются в макрофаги при переходе из кровеносной системы в ткани, существуют несколько видов макрофагов в зависимости от типа ткани, в которой они находятся, в том числе:
- Некоторые антигенпредставляющие клетки, в первую очередь дендритные клетки, роль которых — поглощение микробов и «представление» их Т-лимфоцитам.
- Клетки Купфера — специализированные макрофаги печени, являющиеся частью ретикулоэндотелиальной системы.
- Альвеолярные макрофаги — специализированные макрофаги лёгких.
- Остеокласты — костные макрофаги, гигантские многоядерные клетки позвоночных животных, удаляющие костную ткань посредством растворения минеральной составляющей и разрушения коллагена.
- Микроглия — специализированный класс глиальных клеток центральной нервной системы, которые являются фагоцитами, уничтожающими инфекционные агенты и разрушающими нервные клетки.
- Кишечные макрофаги и т. д.
Функции их разнообразны и включают в себя фагоцитоз, взаимодействие с адаптивной иммунной системой и инициацию и поддержание иммунного ответа, поддержание и регулирование процесса воспаления, взаимодействие с нейтрофилами и привлечение их в очаг воспаления, выделение цитокинов, регуляция репарации, регуляция процессов свертывания крови и проницаемости капилляров в очаге воспаления, синтез компонентов системы комплемента.
Макрофаги, нейтрофилы, эозинофилы, базофилы и натуральные киллеры обеспечивают прохождение врождённого иммунного ответа, который является неспецифичным (в патологии неспецифичный ответ на альтерацию называют воспалением, воспаление является неспецифической фазой последующих специфических иммунных).
В некоторых частях организма млекопитающих и человека появление чужеродных антигенов не вызывает иммунного ответа. К таким областям относятся мозг и глаза, семенники, эмбрион и плацента. Нарушение иммунных привилегий может становиться причиной аутоиммунных заболеваний.
Аутоиммунные заболевания[править | править код]
При нарушении иммунной толерантности или повреждении тканевых барьеров возможно развитие иммунных реакций на собственные клетки организма. Например, патологическая выработка антител к ацетилхолиновым рецепторам собственных мышечных клеток вызывает развитие миастении[7].
Иммунодефицит[править | править код]
- ↑ Bickle T. A., Krüger D. H. Biology of DNA restriction // Microbiological Reviews. — 1993. — Vol. 57, no. 7. — P. 434—450. — PMID 8336674.
- ↑ Travis J. On the Origin of the Immune System // Science. — 2009. — Vol. 324, no. 5927. — P. 580—582. — doi:10.1126/science.324_580. — PMID 19407173.
- ↑ Genetics of the Immune Response / Ed. by E. Möller and G. Möller. — New York: Plenum Press, 2013. — viii + 316 p. — (Nobel Foundation Symposia, vol. 55). — ISBN 978-1-4684-4469-8. — P. 262.
- ↑ Галактионов, 2005, с. 8.
- ↑ Галактионов, 2005, с. 8, 12.
- ↑ Иммунитет // Казахстан. Национальная энциклопедия. — Алматы: Қазақ энциклопедиясы, 2005. — Т. II. — ISBN 9965-9746-3-2.
- ↑ Галактионов, 2005, с. 392.
- Галактионов В. Г. . Эволюционная иммунология. — М.: Академкнига, 2005. — 408 с. — ISBN 5-94628-103-8.
- Хаитов Р. М. . Иммунология. — М.: ГЕОТАР, 2006. — 320 с. — ISBN 978-5-9704-1288-6.
- Ярилин А. А. . Иммунология. — М.: ГЕОТАР, 2010. — 737 с. — ISBN 978-5-9704-1319-7.
Гуморальный иммунитет - Humoral immunity
«Гуморальный» не следует путать с « плечевых ».Гуморальный иммунитет или humoural иммунитета является аспектом иммунитета , который опосредован макромолекулами , обнаруженных в внеклеточных жидкостях , такие как секретируемые антитела , белки комплемента и некоторые антимикробные пептиды . Гуморальный иммунитет назван так потому , что она включает в себя вещество , найденное в юморах , или жидкостях организма . Это контрастирует с клеточно-опосредованного иммунитета . Его аспекты , связанные с антителами, часто называют антитело-опосредованный иммунитет .
Изучение молекулярных и клеточных компонентов , которые формируют иммунную систему , в том числе их функции и взаимодействие, является центральной наукой иммунологии . Иммунная система разделена на более примитивную врожденную иммунную систему , и приобретенная или адаптивная иммунная система из позвоночных , каждый из которых содержит гуморальный , так и клеточный компонент.
Гуморальный иммунитет относится к продукции антител и вспомогательных процессов , которые сопровождают его, в том числе: Th3 , активация и цитокин производства, зародышевый центр формирования и изотипа коммутации, созревание аффинности и ячейка памяти поколения. Оно также относится к эффекторным функциям антител, которые включают в себя возбудитель и токсин нейтрализацию, классический комплемент активацию и опсонин продвижение фагоцитоза и ликвидации патогенных микроорганизмов.
история
Концепция гуморального иммунитета , разработанные на основе анализа антибактериальной активности компонентов сыворотки. Ханс Бюхнер приписывает развитие гуморальной теории. В 1890 г. он описал alexins, или «защитные вещества», которые существуют в сыворотке крови и другой телесной жидкости и способны убивать микроорганизмы . Alexins, впоследствии переопределен «комплемент» от Пола Эрлиха , были показаны, что растворимые компоненты врожденной реакции , которые приводят к комбинации клеточного и гуморального иммунитета, а также мостиковым особенности врожденного и приобретенного иммунитет .
После 1888 года открытия бактерий , которые вызывают дифтерию и столбняк , Эмиль фон Беринг и Китасато Сибасабуро показали , что болезнь не должна быть вызвана самими микроорганизмами. Они обнаружили , что бесклеточные фильтраты были достаточно , чтобы вызвать заболевание. В 1890 году фильтратов дифтерии, позже названные дифтерии токсины , были использованы для вакцинации животных , в попытке продемонстрировать , что иммунизированные сыворотки содержали антитоксина , которые могли бы нейтрализовать активность токсина , и может передавать иммунитет неиммунизированных животных. В 1897 году Пол Эрлих показал , что антитела образуют против растений токсины рицин и абрин , и предположил , что эти антитела отвечают за иммунитет. Эрлих, со своим другом Эмиль фон Беринг, продолжал развивать дифтерии антитоксина, который стал первым крупным успехом современной иммунотерапии . Наличие и специфичность антител совместимости стали основным инструментом для стандартизации состояния иммунитета и идентификации присутствия предыдущих инфекций .
| вещество | Деятельность | открытие |
|---|---|---|
| Алексин (ы) комплемент | Растворимые компоненты в сыворотке крови , которые способны убивать микроорганизмы | Бюхнера (1890), Эрлиха (1892) |
| Антитоксины | Вещества в сыворотке крови , которые могут нейтрализовать активность токсинов, что позволяет пассивной иммунизации | фон Беринг и Китасато (1890) |
| Bacteriolysins | Сыворотка вещества , которые работают с комплемента белков , чтобы вызвать бактериальный лизис | Ричард Пфайфер (1895) |
| Бактериальные агглютинины и преципитинов | Сывороточные вещества , которые агглютинации бактерии и бактериальные токсины выпадают в осадок | фон Грубер и Дарем (1896 г.), Краус (1897) |
| гемолизинов | Сыворотка вещества , которые работают с дополнением лизировать эритроциты | Belfanti и Carbone (1898) Жюль Борде (1899) |
| опсонины | Сывороточные вещества , которые покрывают наружная мембрана посторонних веществ и повышают скорость фагоцитоза макрофагов | Райт и Дуглас (1903) |
| антитело | Образование (1900), антиген-антитело связывания гипотезы (1938), произведенный В - клетки (1948), структура (1972), гены иммуноглобулина (1976) | Учредитель: P Эрлиха |
Механизм
В гуморального иммунного ответа, сначала В - клетки созревают в костном мозге и усиления рецепторов В-клеток (BCR - х) , которые отображаются в большом количестве на поверхности клеток.
Эти связанные с мембранами белковые комплексы имеют антитела , которые являются специфическими для обнаружения антигена. Каждый B клетка имеет уникальное антитело , которое связывается с антигеном . В созревшие В - клетки мигрируют из костного мозга в лимфатические узлы или другие лимфоидные органы, где они начинают сталкиваться с патогенами.
Шаг 1: Фагоцит поглотит патоген. Шаг 2: Макрофаг затем переваривает бактерии и представляет антигены патогена. Шаг 3: AT хелперов связывается с макрофагами и становится активированный Т-хелперов. Шаг 4: Активированный Т-хелперы связывается с клеткой B, чтобы активировать ячейку B. Шаг 5: Когда B-клетки активируются, некоторые В-клетки превращаются в плазматические клетки и освобождаются в крови, в то время как другие В-клетки становятся ячейки памяти B, что Quicken ответа на вторую экспозицию. Шаг 6: Плазмоциты затем секретируют антитела, которые связываются с антигенами бороться вторгшиеся патогены.активации В-клеток
Когда В - клетки обнаруживают антиген, он связан с рецептором и принимает внутрь от эндоцитоза. Антиген обработаны и представлены на ее поверхности снова с молекулой MHC-II .
клеточная пролиферация B
В ждем В - клетки для Т Н клетки для связывания с комплексом. Это связывание активирует Т H клетку и он высвобождает цитокины , которые индуцируют В - клетки быстро делиться, что делает тысячи идентичных клонов В - клеток. Эти дочерние клетки либо становятся плазматические клетки или клетки памяти . В - клетки памяти остаются неактивными здесь; позже , когда эти клетки памяти сталкиваются с тем же антигеном вследствие реинфекции, они делятся и образуют клетки плазмы. С другой стороны, плазменные клетки вырабатывают большое количество антител , которые выделяются свободно в кровеносной системе.
Реакция антиген-антитело
Теперь эти антитела будут сталкиваться с антигенами и связываются с ними. Это будет либо мешать химическому взаимодействию между хостом и чужеродные клетки, или они могут образовывать мостики между их антигенных участков , препятствующих их нормальному функционированию, или их присутствие будет привлекать макрофаги или клетки - киллеры , чтобы атаковать и фагоцитируют их.
Система комплемента
Система комплемента представляет собой биохимический каскад из врожденной иммунной системы , которая помогает очистить патогены из организма . Он является производным от многих небольших плазмы крови белков , которые работают вместе , чтобы разрушить клетки - мишени в плазматической мембране приводит к цитолизу клетки. Система комплемента состоит из более чем 35 растворимых и клеточных связанных белков, 12 из которых непосредственно участвующих в дополнении путях. Система комплемента участвует в деятельности как врожденного иммунитета и приобретенного иммунитета.
Активация этой системы приводит к цитолизу , хемотаксису , опсонизации , иммунному клиренсу и воспалению , а также маркировке патогенов для фагоцитоза . Белки составляют 5% от сыворотки глобулин фракции. Большинство из этих белков циркулировать в зимогенах , которые являются неактивными до протеолитического расщепления .
Три биохимические пути активации системы комплемента: на классический путь комплемента , то альтернативный путь комплемента , и манноза-связывающего лектина пути . Классический путь комплемента обычно требует антител для активации и является специфическим иммунным ответом, в то время как альтернативный путь может быть активирован без присутствия антител и считается неспецифическим иммунным ответом. Антитела, в частности , класса IgG1, также может «исправить» дополнение.
 В - клеточная активация является большой частью гуморального иммунного ответа.
В - клеточная активация является большой частью гуморального иммунного ответа. Антитела
Иммуноглобулины являются гликопротеинами в надсемействе иммуноглобулинов , которые функционируют как антитела. Термины антитела и иммуноглобулины часто используются как взаимозаменяемые. Они находятся в крови и тканевых жидкостях, а также многих секретах. В структуре, они являются крупными Y-образные глобулярные белки. У млекопитающих существует пять типов антител: IgA, IgD, IgE, IgG, IgM и. Каждый класс иммуноглобулина отличается по своим биологическим свойствам и развивался , чтобы иметь дело с различными антигенами. Антитела синтезируются и секретируются плазматическими клетками , которые являются производными от В - клеток иммунной системы.
Антитело используют приобретенную иммунную систему для идентификации и нейтрализации посторонних предметов , таких как бактерии и вирусы. Каждое антитело распознает специфический антиген , уникальный для своей цели. Путем связывания их специфические антигены, антитела могут вызывать агглютинацию и осаждение антиген-антитело продуктов, простое для фагоцитоза макрофагов и других клеток, блокируют вирусные рецепторы, а также стимулировать другие иммунные ответы, такие как пути комплемента.
Несовместимое переливание крови вызывает реакцию трансфузии , которая опосредованная гуморальный иммунный ответ. Этот тип реакции, называемый острую гемолитическая реакция, приводит к быстрому разрушению ( гемолиз ) из донорских эритроцитов принимающих антител. Причина, как правило, опечатка, такие как неправильная единица крови отдаются неверным пациент. Симптомы лихорадка и озноб, иногда с болью в спине и розовой или красной мочой ( гемоглобинурия ). Основное осложнение является то , что гемоглобин освобожден от разрушения красных кровяных клеток может привести к острой почечной недостаточности .
Смотрите также
Рекомендации
дальнейшее чтение
врожденный и приобретенный, клеточный и гуморальный
Общий рейтинг статьи/Оценить статью
[Всего голосов: 7 Общая оценка статьи: 4.3]Слово “иммунитет” часто звучит в повседневной жизни. И на бытовом уровне каждый представляет себе, что это такое. Перевод слова “immunitas” с латыни обозначает –избавление от чего-либо. И в общих чертах мы понимаем, от чего именно. Ежедневно нас атакуют различные микроорганизмы, но при этом мы не так часто болеем. Это трудится наш иммунитет. Но он борется не только с инфекцией – мы кушаем, принимаем лекарства, вдыхаем пыль, повреждаем кожу – и сохраняем при этом здоровье. Это тоже результат работы иммунной системы. Структура и работа иммунитета гораздо сложнее, чем вы думаете, и тот факт, что ученые так и не разобрались до конца во всех его механизмах – вовсе не удивителен.
В этой статье мы расскажем вам о том, что известно современной науке об иммунной системе человека.
Виды иммунитета и его функции
Важнейшей задачей нашего иммунитета является распознавание и уничтожение чужеродных агентов. Чужими для нашего организма являются патогенные микроорганизмы – бактерии, вирусы, грибы и паразиты, инородные тела, разрушенные клетки организма, и по большому счету все то, в чем наш иммунитет увидел угрозу.
Для того, чтобы противостоять опасностям, в арсенале иммунитета есть много различных клеток и биологически активных веществ.
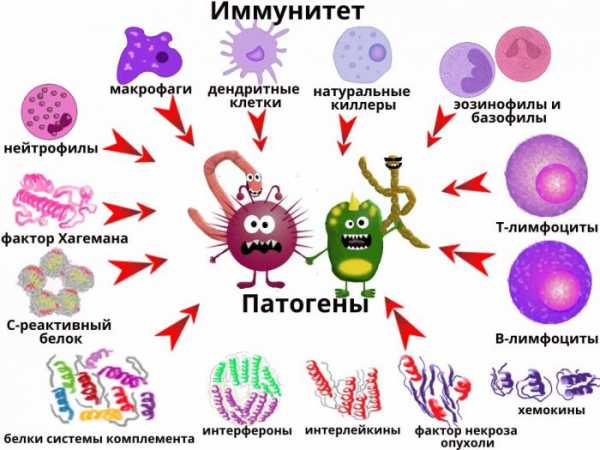
Сам иммунитет делится на врожденный и приобретенный. Разберем подробнее их строение, функции и взаимодействие.
Врожденный (или неспецифический) иммунитет
Неспецифический иммунитет помогает бороться с чужеродными агентами с самого детства. Он закреплен генетически и способен передаваться по наследству от родителей. После попадания в организм вируса или бактерии врожденный иммунитет очень быстро включается в работу, сохраняя свою высокую эффективность в течении 4 суток. Все это время он защищает нас от болезни и не дает ей развиться.
Этот тип иммунитета включает в себя несколько защитных барьеров – кожа и слизистые оболочки, лимфатические узлы и кровь. Таким образом, неспецифический иммунитет работает как в тканях и клетках, так и в жидких средах организма – крови и лимфе, поэтому его делят на клеточный и гуморальный (“гуморос” обозначает жидкость).
Клеточный неспецифический иммунитет
Клеточное звено врожденного иммунитета реализуется за счет различных видов лейкоцитов, или белых кровяных телец, которые формируются в красном костном мозге. Лейкоциты имеют специальные рецепторы, которые распознают “чужаков”. Механизм уничтожения определенных чужеродных агентов выработан эволюционно и не может меняться в процессе жизни. Врожденный иммунитет считается консервативным потому что он узнает только те микроорганизмы, с которыми человечество контактировало много веков подряд.
Лейкоциты бывают нескольких типов – нейтрофилы, макрофаги, гранулоциты (их еще называют натуральные киллеры, или NK клетки), эозинофилы и базофилы.
Наиболее важными для иммунного ответа являются нейтрофилы и макрофаги. Эти клетки относятся к классу так называемых фагоцитов, что в переводе с древнегреческого звучит как “пожиратель клеток”. Основная их функция заключается в захвате, поглощении и переваривании чужеродных микроорганизмов.
Нейтрофилы более мобильные, они первыми реагируют на проникновение бактерий. Внутри этой клетки есть специальные гранулы с ферментом для переваривания микроорганизмов. Нейтрофилы прекрасно работают при остром воспалении. Они представляют собой самый многочисленный тип лейкоцитов – 50-70% от общего их числа.
Макрофаги незаменимы при хронических воспалениях, и в отличие от нейтрофилов уничтожают не только бактерии, но и другие микроорганизмы. Несмотря на то, что макрофагов всего 3-7% от общего числа лейкоцитов, они выполняют очень важную функцию – презентуют другим клеткам иммунитета информацию о чужеродном агенте.
После захвата и разрушения микроорганизма, внутри макрофага остаются его белковые фрагменты, которые соединяются со специальными белками и выводятся на поверхность клетки.
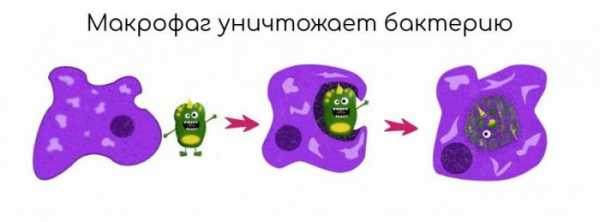
Комплекс, состоящий из белкового фрагмента чужеродного микроорганизма и белка макрофага называется главный комплекс гистосовместимости (ГКГС).
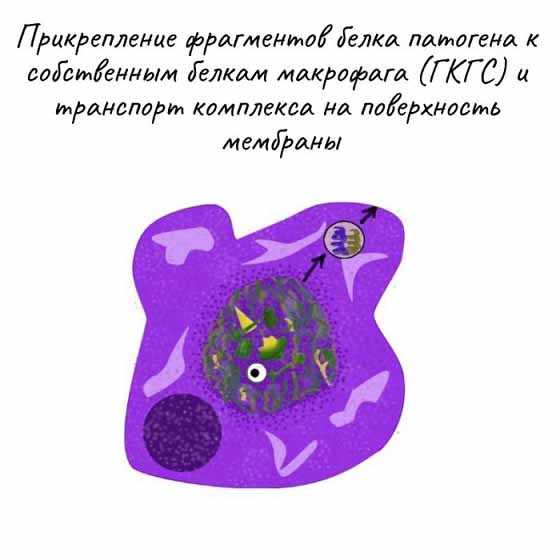
После этого макрофаг презентует этот комплекс другим клеткам иммунной системы, для того, чтобы они запомнили “врага” и сформировали соответствующую защиту. Это важное свойство макрофага позволяет запустить работу специфического иммунитета. О нем мы поговорим немного позже.
Говоря о макрофагах, невозможно обойти стороной их разновидность – дендритные клетки. Назвали их так потому, что они имеют много отростков, или дендритов. Также, как и макрофаги, дендритные клетки способны к фагоцитозу (поеданию чужеродных агентов) и презентации информации о “чужаках” клеткам специфического иммунитета. Дендритные клетки способны распознавать клетки опухоли и “учить” иммунитет бороться с ними, именно поэтому они называются антигенпрезентующими клетками. Проблема заключается в том, что процесс этот не быстрый, а клетки раковой опухоли способны к быстрой трансформации и мутации. Поэтому в научном мире сейчас ведутся исследования методик, которые позволяют ускорить процесс презентации информации дендритными клетками, что позволяет улучшить прогноз лечения рака, вирусного гепатита и туберкулеза.
Натуральные киллеры, они же гранулоциты, они же NK клетки – не зря имеют такое угрожающее название. Они способны быстро уничтожать все чужие клетки, содержащие ядро. Особенно активны они по отношению к опухолевым клеткам и к клеткам, пораженными вирусом. Кроме “убийств”, они регулируют активность иммунитета в целом, выделяя биологически активные вещества – интерфероны, интерлейкины, простогландины, лимфотоксин.
Эозинофилы и базофилы борются в первую очередь с паразитарной инфекцией (например, с глистами) и с вирусами. Выделяют медиаторы воспаления – гистамин, серотонин, мобилизуют другие иммунные клетки.
Гуморальный неспецифический иммунитет
Врожденный иммунитет борется с инфекцией не только в коже и слизистых оболочках, но и в биологических жидкостях организма, к которым относится кровь, лимфа, слюна, мокрота и т.д. К гуморальному неспецифическому иммунитету относятся различные белки. Некоторые из них объединены в системы, которые представляют собой ряд белков, выполняющих важные функции:
Кининовая система – это свертывающая система крови, которая первой реагирует на проникновение чужеродных частиц в кровеносный сосуд. Объясним работу этой системы на простом примере. Предположим, мы загнали в палец занозу. Как правило, любая инородная частица имеет отрицательный заряд, а стартовый компонент свертывающей системы крови, названный по автору фактор Хагемана, заряжен положительно. Он фиксируется на поверхности инородной частицы, запуская ряд реакций, в результате которых вырабатывается мощный медиатор воспаления – брадикинин. Он расширяет кровеносные сосуды, повышает проницаемость сосудистой стенки, вызывает боль и привлекает фагоциты в воспалительный очаг. Все мы видели, что через некоторое время вокруг занозы образуется гной, — это результат слаженной работы иммунной системы. При этом, Фактор Хагемана сворачивает кровь, препятствуя распространению инфекции.
Система комплемента – это группа белков, которые циркулируют в крови и активизируются в ответ на проникновение чужеродного агента. Белки системы комплемента выполняют три функции:
- Привлекают фагоциты в очаг инфекции
- Присоединяются к поверхности бактериальной клетки, делают в ней отверстие и буквально накачивают ее водой, в результате чего бактерия набухает и лопается. Этот процесс называется лизисом бактерий.
- Некоторые белки комплемента могут присоединяться к бактерии, тем самым образуя своего рода метку для клеток, способных “съесть” бактерию. Это значительно ускоряет процесс распознавания и уничтожения чужеродных клеток фагоцитами.
Почему же белки системы комплемента, будучи достаточно агрессивными не разрушают собственные белки организма? Ответ на этот вопрос будет чуть дальше.
Белки острой фазы воспаления – очень чувствительные белки, количество которых увеличивается в ответ на внедрение инфекции или повреждения тканей. Эта группа включает более 10 белков, самым активным из которых является С-реактивный белок. Основной функцией этого белка является активация белков системы комплемента, что приводит к их связыванию с микроорганизмом и подготовка его к уничтожению с помощью фагоцитоза.
Белки теплового шока – активизируются не только при повышении температуры тела, но и при стрессе. Эта группа белков открыта относительно недавно, и поэтому полностью не изучена. Известно, что они могут защищать клетки от повреждений.
Цитокины – белки, которые вырабатывают клетки иммунной системы. Их действие напоминает эффекты гормонов, они регулируют работу других клеток (стимулируют или угнетают). Некоторые из них стимулируют рост клеток, в частности нейтрофилов. К цитокинам относят интерфероны, интерлейкины, фактор некроза опухоли и хемокины.
- Интерфероны – белки, которые синтезируются клетками иммунитета (лейкоцитами, макрофагами и клетками соединительной ткани) в ответ на внедрение в организм вируса. Дополнительным плюсом является то, что интерферон препятствует проникновению вируса в здоровую клетку организма. Возможно, вы знаете о том, что есть медицинские препараты, содержащие интерферон, которые обладают противовирусным действием. Важно понимать, что эти лекарства, равно как и естественный интерферон, не влияют непосредственно на вирус, а только препятствуют его размножению и “сборке”. Поэтому не стоит ждать от интерферона быстрого эффекта, так как на те вирусы, которые уже есть в организме он не влияет. Однако, не все эффекты этого белка однозначно положительны. Он вырабатывает специальное соединение, которое вызывает гибель пораженной клетки, но одновременно с этим погибнуть могут и здоровые клетки организма. В итоге, несмотря на то, что интерферон тормозит развитие болезни и не дает вирусу размножаться, он может быть опасен для организма, уничтожая здоровые клетки.
- Интерлейкины – синтезируются в основном лейкоцитами. Функция интерлейкинов заключается в регуляции работы лейкоцитов.
- Фактор некроза опухоли – цитокины, способные уничтожать и утилизировать клетки опухоли.
- Хемокины – небольшие цитокины, которые регулируют перемещение клеток иммунитета.
Врожденный иммунитет играет очень важную роль, так как именно он первым реагирует на патоген. И если вы простудились и только почувствовали недомогание – знайте, ваш иммунитет трудится уже несколько часов. Если же неспецифический иммунитет не справляется с задачей, к нему подключается специфический или приобретенный иммунитет.
Приобретенный (специфический) иммунитет
В отличие от врожденного, приобретенный иммунитет специфичен, то есть его действие направлено на уничтожение конкретных чужеродных агентов. Процесс формирования специфического иммунитета более длительный, он подключается примерно через сутки- двое после начала заболевания.
Мы уже знаем о том, что некоторые виды лейкоцитов принимают непосредственное участие в работе врожденного иммунитета. Оказывается, есть и другие их разновидности, которые формируют специфический иммунитет – это Т и В – лимфоциты.
Так же, как и врожденный, приобретенный иммунитет можно разделить на гуморальный и клеточный. Давайте подробнее остановимся на этих двух механизмах.
Клеточный специфический иммунитет
В клеточном приобретенном иммунитете принимают участие Т-лимфоциты. Они формируются в тимусе или вилочковой железе человека. Т-лимфоциты созревают в лимфоузлах и органах иммунной системы, где происходит их дифференцировка.
Существует 4 основных типа Т – лимфоцитов, которые выполняют разную функцию.
- Т-киллеры — агрессивный тип лимфоцитов. Они способны уничтожать чужие клетки.
- Т-хелперы, или помощники. Эти лимфоциты берут информацию о чужеродном агенте у фагоцитов и передают ее Т-киллерам, Т-клеткам памяти или В-лимфоцитам.
- Т-клетки памяти – хранят память о чужеродных клетках. Способны циркулировать в крови около 10 лет.
- Т-супрессоры – угнетают иммунитет.
Работа специфического иммунитета запускается благодаря макрофагам и дендритным клеткам. Они презентуют фрагменты вируса или бактерии Т-хелперам и Т-киллерам. Получив эту информацию, Т-хелперы передают ее другим клеткам иммунитета, а Т-киллеры, вооружившись специфическими рецепторами к конкретному возбудителю, отправляются на “войну”. Один Т-киллер способен уничтожить несколько чужеродных агентов. Интересно то, что не всегда для активизации Т-киллеров необходима презентация фрагментов белка антигена. Еще на этапе его формирования в тимусе он приобретает огромное количество рецепторов к различным инфекциям, поэтому вполне может приступить к работе до активизации специфического иммунитета. Именно поэтому Т-киллеры по праву занимают почетное место среди всех клеток иммунной защиты.
При повторном попадании инфекции в организм, в первую очередь, активизируются Т-клетки памяти. Они передают информацию другим иммунным клеткам, и поэтому при повторном заболевании наш организм быстрее и эффективнее защищается.
Т-супрессоры призваны тормозить размножение и деятельность клеток иммунитета. Эти клетки начинают активно работать в тот момент, когда удалось победить возбудителя.
Гуморальный специфический иммунитет
В гуморальном иммунном ответе принимают участие В-лимфоциты. Впервые они были обнаружены и исследованы у птиц, у которых формирование В-лимфоцитов происходит в так называемой Фабрициевой сумке. Поэтому их и назвали В-лифоцитами (bursa – сумка). В организме человека эти клетки формируются в костном мозге, а их дальнейшее созревание происходит в специальных иммунных образованиях — пейеровых бляшках кишечника. Так же как и Т-лимфоциты, зрелые В-лимфоциты постоянно циркулируют в крови и лимфе, попадают в органы иммунной системы (лимфоузлы), и вновь выходят из них в жидкие среды организма. Это позволяет В-лимфоцитам постоянно находиться на страже порядка и взаимодействовать с Т-лимфоцитами.
При попадании в наш организм вируса первыми реагируют фагоциты – нейтрофилы, макрофаги и дендритные клетки. Макрофаг или дендритная клетка поглотили вирус и выработали сигнальные белки – цитокины, которые достигли В-лимфоцита и сообщили ему об опасности, активизируя его. Далее происходит встреча дендритной клетки с Т-хелпером и передача ему информации о чужеродном агенте, после чего Т-хелпер, взаимодействует с В-лимфоцитом. Необходимо пояснить, что “информация” в данном случае – ни что иное, как фрагмент белка бактерии, вируса или другого агента, которые заботливые антигенпрезентующие клетки врожденного иммунитета предоставили Т-хелперу. Таким образом, у В-лимфоцита появляются специфические рецепторы к конкретному типу инфекции. Теперь эта иммунная клетка “вооружена” и готова к встрече с опасным микроорганизмом. Этот сложный процесс получил название презентации антигена.
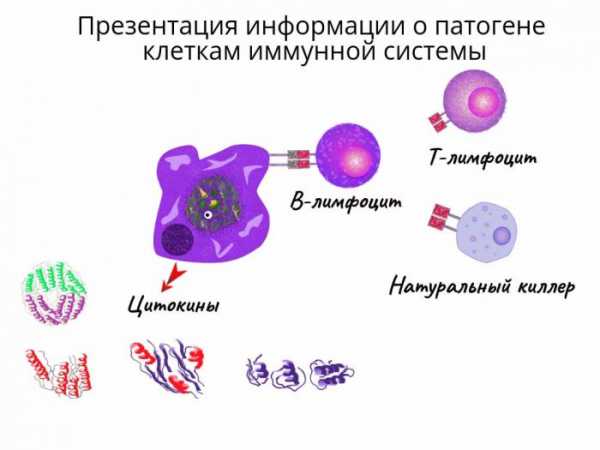
Антиген – любое вещество в организме, которое иммунная система признает “чужой”. Чаще всего антигеном являются чужеродные микроорганизмы, инородные тела или разрушенные клетки организма. Выделяем
В-лимфоцит, имеющий специфические рецепторы к антигену, называется плазматической клеткой. Часть этих клеток вырабатывает в кровь специфические антитела или иммуноглобулины. Антитело – это белок, способный уничтожать и маркировать (помечать) определенные микроорганизмы. Это важное свойство антител, которое значительно ускоряет процесс распознавания и уничтожения патогена клетками иммунной системы.
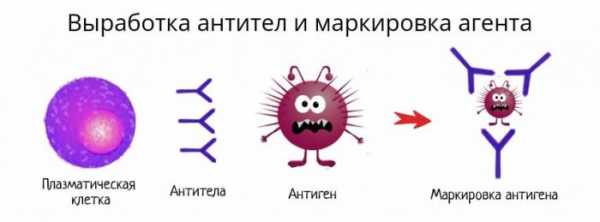
Другая часть плазматических клеток превращается в клетки “иммунологической памяти”, которые способны выделять антитела при повторном введении антигена. Так формируется гуморальный иммунитет к определенным заболеваниям.
Свойство В-лимфоцитов эффективно препятствовать развитию инфекции при повторном ее попадании в организм лежит в основе вакцинации. Вакцина – это ослабленная инфекция, после введения которой формируются клетки ”иммунологической памяти”. Если после вакцинации этот же микроорганизм попал в организм еще раз, то он не вызовет заболевание, либо болезнь будет протекать в более легкой форме.
Но не стоит думать, что иммуноглобулины – это панацея от всех бед. Эти белки нейтрализуют вирус, однако малоэффективны в борьбе с бактериями. Они действуют как наводчики, активизируя систему белков комплемента, фагоцитов и натуральных киллеров к конкретному возбудителю. Вместе с тем, антитела незаменимы для нейтрализации токсинов. Такие заболевания как дифтерия, столбняк или гангрена при наличии специфических антител, не дают интоксикацию. Также иммуноглобулины – мощное средство в борьбе со змеиным ядом.
Разбирая работу системы комплемента в разделе о врожденном иммунитете, мы обещали объяснить причину, по которой белки этой системы не убивают все клетки подряд. Это происходит как раз благодаря маркеру, которым является антитело, соединяясь с антигеном. Система комплемента распознает комплекс антиген-антитело и уничтожает его. Точно так же действуют фагоциты и натуральные киллеры. Конечно же, эти клетки могут убивать непрошеных гостей и без маркера. Но с ним они ведут себя намного быстрее и работают точнее.
Мы разобрали лишь основные процессы, которые происходят в организме при внедрении патогена. На самом деле, все намного сложнее. Иммунный ответ представляет собой целый каскад биохимических реакций, трансформаций и взаимодействий клеток между собой. На основании исследований, полученных за последние 10 лет, ученые пришли к выводу, что как врожденный, так и приобретенный иммунитет нельзя рассматривать отдельно друг от друга. Они представляют собой единый процесс, где при некачественной работе одного звена, происходит сбой всей иммунной системы. Последствия такого сбоя нам хорошо известны. Это аллергия – избыточная реакция иммунной системы на раздражитель, или иммунодефицит – ее недостаточность. Люди, которые страдают хроническими заболеваниями, связанными с нарушением работы иммунитета, хорошо знают насколько тяжело подобрать препарат для лечения. И не удивительно. Ни одно лекарство не может точно повторить сложные процессы, которые происходят незаметно для нас.
Берегите свой иммунитет и не болейте!