Гемотрансфузия это что
Гемотрансфузия — Википедия
Гемотрансфузия (от др.-греч. αἷμα — кровь и от лат. transfusio — переливание) — переливание крови, частный случай трансфузии, при которой переливаемой от донора к реципиенту биологической жидкостью является кровь или её компоненты[1][2]. Этот процесс является одним из видов заместительной терапии. Наряду с замещающим и стимулирующим действием, повышает свёртываемость крови и обезвреживает токсические вещества.
Один из первых аппаратов для переливания кровиПроизводится через вены (в острых случаях — через артерии) (также с использованием препаратов крови[3]) для замещения эритроцитов, лейкоцитов, белков плазмы крови, также для восстановления объёма циркулирующей крови, её осмотического давления при потере крови (для этих целей могут использоваться также заменители крови).
Кроме потери крови, показанием могут быть также аплазии кроветворения, ожоги, инфекции, отравления и другие.
Переливание может быть прямым и с предварительным сбором крови донора для хранения. Современный подход к переливанию крови состоит в компонентном переливании (плазма, эритроцитарная масса, лейкоцитарная масса, тромбоцитарная масса, отмытые эритроциты, тромбовзвесь, криопреципитат и другие более редкие компоненты).
При переливании непроверенной крови в кровь реципиента могут попадать возбудители болезней, имеющиеся у донора. В связи с этим в настоящее время широко используется метод карантинизации компонентов крови.
Кровь донора и реципиента должна быть совместима:
В ряде случаев при переливании учитывают наличие и других антигенов, например, Kell[4] и H.
Кровь переливают строго по совпадению группы крови и резус фактора, до 80-х годов XX века считалось, что первая группа крови с отрицательным резус-фактором является универсальной для всех групп, но с открытием агглютиногенов это мнение было признано неверным. Действительно, переливать можно только эритроциты (а не плазму, содержащую антитела) первой группы. Эритроциты 0 (Rh-) переливают в экстренных случаях всем.
На данный момент «универсальной» крови нет, хотя есть равноценный кровезаменитель[5] — т. н. «голубая кровь»[6][7]. При переливании обязательно соблюдаются группа крови и резус-фактор.
Эритроциты[править | править код]
Биоинженер М. Интаглиетта и др. (2007—2017 гг.) на основе экспериментального моделирования и теоретических расчётов сделали предположение, что положительные эффекты от инфузии аллогенных эритроцитов при таких состояниях, как постгеморрагическая анемия, могут быть обусловлены не предполагаемым увеличением количества доступного для тканей кислорода в крови, а восстановлением реологическихruen свойств крови, благодаря чему поддерживается микроциркуляция и, как следствие, обеспечивается доставка кислорода в ткани оставшимися после кровопотери аутогенными эритроцитами[8][9][10]. К выводу о реологическом действии трансфузий пришли педиатры из Клиники Мюнхенского университета (2016 г.)[11] и другие исследователи[12][13].
К 2007—2017 гг. учёные из «Université libre de Bruxellesruen» и других научных учреждений исследовали влияние инфузий эритроцитов на микроциркуляцию. Была обнаружена обратная корреляция ruen между базовым состоянием микроциркуляции и изменением её состояния после трансфузии[14][11]: у анемичных тяжелобольных, вне зависимости от отличий в уровнях концентрации гемоглобина и других системных параметров, при таких патофизиологиях, как сепсис или травма, трансфузия может улучшить микроциркуляцию, если до трансфузии она была нарушена, но может её ухудшить, если до трансфузии она нарушена не была[15][16][17]. По состоянию на 2016 г. оценка микроциркуляции у пациента в стандартной клинической практике не производится[18][19].
Аналогичная корреляция с базовыми значениями до трансфузии была обнаружена у следующих связанных с кислородом переменных: потребление кислорода при измерении катетером лёгочной артерии (кардиохирургия, 1999 г.)[20]; оксигенация головного мозга при измерении электродами Кларкаruen (ЧМТ, 2006 г.)[21]; потребление кислорода при измерении методом БИК-спектроскопии (анемия, 2009 г.; сепсис, 2011 г.) [22][23]. Ограничением неинвазивных измерений потребления кислорода методом БИК-спектроскопии в условиях клинической практики является отсутствие точной абсолютной шкалы и необходимость временного перекрытия кровотока в месте измерения[24][25].
Распространённым критерием для назначения инфузий эритроцитов является признак анемии — снижение концентрации гемоглобина ниже порогового значения[26][27]; применяются и менее надёжные критерии (например, признак гиповолемии — гипотензия и тахикардия)[28][29][30][31][32]. Вместе с тем такого понятия как «оптимальная» концентрация гемоглобина не существует в отрыве от других показателей[33][34]; уровень концентрации гемоглобина не является точным индикатором того, что трансфузия будет полезна пациенту[35][36][37][38][39]. Рост концентрации гемоглобина благодаря трансфузии может улучшить системные параметры гемодинамики[40], но это не всегда приводит к улучшению состояния организма на уровне капилляров[41][42][43]. Согласно реаниматологу Ж.-Л. Винсентуruen (2015 г.), использование уровня концентрации гемоглобина в качестве критерия для назначения инфузий эритроцитов приводит к ситуации, когда среди пациентов, которым не назначают трансфузию, есть те, которым она могла бы помочь, а среди пациентов, которым трансфузию назначают, есть те, для которых она бесполезна или вредна [44][45]. По оценке академика РАН, д.м.н. Л. А. Бокерии и д.м.н. А. А. Купряшова (2015 г.), результатом сложившейся практики назначения трансфузий без опоры на высокоточные индикаторы является скрытая эпидемия вызванных трансфузиями осложнений[46].
Возникающее при травме кровотечение может осложняться коагулопатией[47]; в таких обстоятельствах жизнь пострадавшего зависит от как можно более раннего восстановления гемодинамики и гемостаза[48]. Эритроциты совместно с остальными компонентами крови участвуют в гемостазе[49][50]; однако, по состоянию на 2016 г. не существует единого выверенного стандарта на трансфузии и в целом медицинскую помощь при травме[51][52]. Распространены два подхода (а также их комбинации). В первом подходе лечение нарушений гемодинамики и гемостаза опирается на массивную инфузию одновременно плазмы, эритроцитов и тромбоцитов в фиксированном соотношении (например, 1:1:1)[53][54][55]; по состоянию на 2015 г. нет высокоточных критериев для назначения пострадавшему массивной трансфузии[56][57]. Второй подход подразумевает ослабление гиповолемии инфузией кристаллоидов (по умолчанию — в режиме пермиссивной гипотензииruen[58]), лечение коагулопатии инфузией содержащих факторы свёртывания крови фармакологических препаратов по показаниям коагулометрии[59][60] и поддержание гематокрита инфузией эритроцитов (по показаниям уровня концентрации[30][31]гемоглобина)[61][62][63]. Вместе с тем, по состоянию на 2017 г. эффективность инфузий эритроцитов при травме, в т.ч. в составе многокомпонентных трансфузий, не была подтверждена или опровергнута методами доказательной медицины[64][65][66][67].
Проведённое на базе больниц Оксфордского университетаruen исследование (2015 г.) показало, что недостаточные трансфузии являются редким явлением[68][69]. Избыточные трансфузии, в свою очередь, бесполезны или вредны для пациента[70][71][72][73][74]; к 2017 г. были опубликованы сообщения о практике избыточных трансфузий в исследованных медицинских учреждениях Европы (2016—2017 гг.)[28][75], Великобритании (2017 г.)[76], США (2016 г.)[77], Китая (2015 г.)[78] и других регионов (2014—2017 гг.)[79][80][81]. Сотрудники Клинического центра Национальных институтов здравоохранения СШАruen Х. Клейн и соавт. (2015 г.) предположили, что нежелание врачей ограничивать инфузии эритроцитов связано с недостатками в имеющихся руководствах: они составлены по исследованиям, в которых, в частности, применялся неточный критерий — концентрация гемоглобина, — из-за чего решение, проводить трансфузию или нет, было в этих исследованиях неверным для некоторых пациентов. По мнению Клейна и соавт., ригидные протоколы из руководств, опирающиеся на концентрацию гемоглобина и разработанные для «среднего» пациента, могут помочь большинству, но являются при этом на практике субоптимальными или опасными для существенного меньшинства. Повысить информированность решения о проведении трансфузии могут подходы точной медицины, чувствительные индикаторы гипоксии тканей и прикладная биоинформатика, полагают исследователи Клинического центра[82].
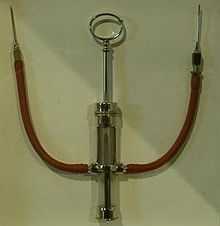
- 1628 г. — Английский врач Уильям Гарвей делает открытие о кровообращении в человеческом организме. Почти сразу после этого была предпринята первая попытка переливания крови.
- 1665 г. — Проведены первые официально зарегистрированные переливания крови: английский врач Ричард Лоуэр (англ. Richard Lower) успешно спасает жизни больных собак, переливая им кровь других собак.
- 1667 г. — Жан-Батист Дени (фр. Jean-Baptiste Denis) во Франции и Ричард Лоуэр в Англии независимо друг от друга делают записи об удачных переливаниях крови от овцы человеку. Но в последующие десять лет переливания от животных к людям были запрещены законом из-за тяжёлых отрицательных реакций.
- 1795 г. — В США американский врач Филипп Синг Физик (англ. Philip Syng Physick) проводит первое переливание крови от человека к человеку, хотя информацию об этом нигде не публикует.
- 1818 г. — Джеймс Бланделл (англ. James Blundell), британский акушер, проводит первое удачное переливание человеческой крови пациентке с послеродовым кровотечением. Используя в качестве донора мужа пациентки, Бланделл взял у него почти четыре унции крови из руки и с помощью шприца перелил женщине. С 1825 по 1830 год Бланделл провел 10 переливаний, пять из которых помогли пациентам. Бланделл опубликовал свои результаты, а также изобрёл первые удобные инструменты для взятия и переливания крови.
- 1840 г. — Сэмуэл Армстронг Лэйн, под руководством Дж. Бланделла, проводит полное переливание крови пациенту в одной из больниц Лондона.
Примерно в это же время американский хирург Джордж Вашингтон Крайл проводит первое переливание крови при проведении хирургической операции.
- 1832 г. — петербургский акушер Андрей Мартынович Вольф впервые в России успешно перелил роженице с акушерским кровотечением кровь её мужа и тем самым спас ей жизнь. Для переливания крови Вольф использовал методику, разработанную Бланделлом.
- 1900 г. — Карл Ландштейнер (нем. Karl Landsteiner), австрийский врач, открывает первые три группы крови — A, В и С. Группа С будет потом переименована в О. За свои открытия Ландштейнер получил в 1930 году Нобелевскую премию.
- 1902 г. — Коллеги Ландштейнера Альфред де Кастелло (итал. Alfred Decastello) и Адриано Стурли (итал. Adriano Sturli) добавляют к списку групп крови четвёртую — AB.
- 1907 г. — Гектоэн (Hektoen) делает предположение о том, что безопасность переливаний может быть усовершенствована, если кровь донора и реципиента (получателя) проверять на совместимость, чтобы избежать осложнений. Рубен Оттенберг (англ. Reuben Ottenberg) в Нью-Йорке проводит первое переливание крови с использованием метода перекрёстной совместимости. Оттенберг также заметил, что группа крови передаётся по наследству по принципу Менделя и отметил «универсальную» пригодность крови первой группы.
- 1912 г. — Роджер Ли, врач общественной больницы Массачусетса, вместе с Полом Дадли Вайтом внедряют в лабораторные исследования так называемое «время свёртывания крови Ли-Вайта». Ещё одно важнейшее открытие делает Ли, опытным путём доказывая, что кровь первой группы может быть перелита пациентам с любой группой, а пациентам с четвёртой группой крови подходит любая другая группа крови. Таким образом, введены понятия «универсальный донор» и «универсальный реципиент».
- 1914 г. — В больнице Росон в Буенос-Айресе, Луис Аготе в первый удалось изобрести и введены в действие антикоагулянты (вещества, препятствующие свёртыванию крови) долговременного действия, позволившие консервировать донорскую кровь, и среди них цитрат натрия.
- 1915 г. — В госпитале Маунт Синай в Нью-Йорке, Ричард Левисон впервые использует цитрат для замены прямого переливания крови на непрямое. Несмотря на всю значимость этого изобретения, цитрат ввели в массовое использование только через 10 лет.
- 1916 г. — Фрэнсис Рус и Д. Р. Турнер впервые используют раствор цитрата натрия и глюкозы, позволяющий хранить кровь в течение нескольких дней. Кровь начинают хранить в закрытых контейнерах. В ходе Первой мировой войны Великобритания использует мобильную станцию переливания крови (создателем считается Освальд Робертсон).
- 1930 г. — Сергей Сергеевич Юдин первым в мире применил в клинике переливание фибринолизной крови.[83]
Аутогемотрансфузия (переливание реципиенту его же собственной крови) достаточно распространена в спорте, несмотря на то, что МОК и ВАДА приравнивают её к применению допинга. Она ускоряет доставку кислорода к мышцам, тем самым увеличивая их производительность[84].
- ↑ Гемотрансфузия — статья из Большой советской энциклопедии.
- ↑ статья «Переливание крови» БМЭ
- ↑ статья «Препараты крови» Архивная копия от 25 апреля 2009 на Wayback Machine БМЭ
- ↑ Что такое келл? Нужны ли келл-положительные доноры? (неопр.). Фонд «Подари жизнь», Инициативная группа «Доноры — детям» (2007-2011). Дата обращения 22 января 2012. Архивировано 4 февраля 2012 года.
- ↑ Кровезаменители — статья из Большой советской энциклопедии.
- ↑ ПЕРФТОРАН — ОН ЖЕ «ГОЛУБАЯ КРОВЬ»//Вестник Российской академии наук 1997, том 67, № 11, с. 998—1013
- ↑ Просто добавь воды
- ↑ Cabrales, P. Is resuscitation from hemorrhagic shock limited by blood oxygen-carrying capacity or blood viscosity? : [англ.] / P. Cabrales, A. G. Tsai, M. Intaglietta // Shockruen. — 2007. — Vol. 27, no. 4. — P. 380-389. — doi:10.1097/01.shk.0000239782.71516.ba. — PMID 17414420.
- ↑ Tsai, Hofmann, Cabrales et al., 2010.
- ↑ Zimmerman, R. Posttransfusion Increase of Hematocrit per se Does Not Improve Circulatory Oxygen Delivery due to Increased Blood Viscosity : [англ.] / R. Zimmerman, A. G. Tsai, B. Y. S. Vázquez [et al.] // Anesthesia & Analgesiaruen. — 2017. — Vol. 124, no. 5. — P. 1547-1554. — doi:10.1213/ANE.0000000000002008. — PMID 28328758.
- ↑ 1 2 Schinagl, Mormanova, Puchwein-Schwepcke et al., 2016.
- ↑ Chen, G. Regulation of blood viscosity in disease prevention and treatment : [англ.] / G. Chen, L. Zhao, Y. Liu [et al.] // Chinese Science Bulletinruen. — 2012. — Vol. 57, no. 16. — P. 1946-1952. — doi:10.1007/s11434-012-5165-4.
- ↑ Morel, N. The viscosity target in hemorrhagic shock : [англ.] / N. Morel, M. Moisan, V. Dubuisson // Critical Care Medicineruen. — 2017. — Vol. 45, no. 4. — P. e458-e459. — doi:10.1097/CCM.0000000000002217. — PMID 28291108.
- ↑ Weinberg, Patel, 2016.
- ↑ Sakr, Y. Microvascular response to red blood cell transfusion in patients with severe sepsis : [англ.] / Y. Sakr, M. Chierego, M. Piagnerelli [et al.] // Critical Care Medicineruen. — 2007. — Vol. 35, no. 7. — P. 1639-1644. — doi:10.1097/01.CCM.0000269936.73788.32. — PMID 17522571.
- ↑ Weinberg, J. A. Microvascular response to red blood cell transfusion in trauma patients : [англ.] / J. A. Weinberg, P. A. MacLennan, M. J. Vandromme-Cusick [et al.] // Shockruen. — 2012. — Vol. 37, no. 3. — P. 276-281. — doi:10.1097/SHK.0b013e318241b739. — PMID 22344313.
- ↑ Tanaka, S. Effect of RBC transfusion on sublingual microcirculation in hemorrhagic shock patients: a pilot study : [англ.] / S. Tanaka, E. Escudier, S. Hamada [et al.] // Critical Care Medicineruen. — 2017. — Vol. 45, no. 2. — P. e154-e160. — doi:10.1097/CCM.0000000000002064. — PMID 27635767.
- ↑ Salgado, D. R. Microcirculatory assessment in daily clinical practice — not yet ready but not too far! : [англ.] / D. R. Salgado, R. Favory, D. De Backer // Einstein (São Paulo). — 2010. — Vol. 8, no. 1. — P. 107-116. — doi:10.1590/S1679-45082010RW1311. — PMID 26761762.
- ↑ Scheeren, T. W. L. Journal of Clinical Monitoring and Computing 2015 end of year summary: tissue oxygenation and microcirculation : [англ.] // Journal of Clinical Monitoring and Computing. — 2016. — Vol. 30, no. 2. — P. 141-146. — doi:10.1007/s10877-016-9846-4. — PMID 26897032.
- ↑ Casutt, M. Factors influencing the individual effects of blood transfusions on oxygen delivery and oxygen consumption : [англ.] / M. Casutt, B. Seifert, T. Pasch [et al.] // Critical Care Medicineruen. — 1999. — Vol. 27, no. 10. — P. 2194-2200. — doi:10.1097/00003246-199910000-00021. — PMID 10548206.
- ↑ Leal-Noval, S. R. Transfusion of erythrocyte concentrates produces a variable increment on cerebral oxygenation in patients with severe traumatic brain injury : [англ.] / S. R. Leal-Noval, M. D. Rincón-Ferrari, A. Marin-Niebla [et al.] // Intensive Care Medicineruen. — 2006. — Vol. 32, no. 11. — P. 1733-1740. — doi:10.1007/s00134-006-0376-2. — PMID 17019549.
- ↑ Creteur, J. Near-infrared spectroscopy technique to evaluate the effects of red blood cell transfusion on tissue oxygenation : [англ.] / J. Creteur, A. P. Neves, J.-L. Vincent // Critical Careruen. — 2009. — Vol. 13, Suppl. 5. — P. S11. — doi:10.1186/cc8009. — PMID 19951383.
- ↑ Sadaka, F. The effect of red blood cell transfusion on tissue oxygenation and microcirculation in severe septic patients : [англ.] / F. Sadaka, R. Aggu-Sher, K. Krause [et al.] // Annals of Intensive Careruen. — 2011. — Vol. 1. — P. 46. — doi:10.1186/2110-5820-1-46. — PMID 22067279.
- ↑ Gerovasili, V. Utilizing the vascular occlusion technique with NIRS technology : [англ.] / V. Gerovasili, S. Dimopoulos, G. Tzanis [et al.] // International Journal of Industrial Ergonomics. — 2010. — Vol. 40, no. 2. — P. 218-222. — doi:10.1016/j.ergon.2009.02.004.
- ↑ Green, M. S. Near-infrared spectroscopy: the new must have tool in the intensive care unit? : [англ.] / M. S. Green, S. Sehgal, R. Tariq // Seminars in Cardiothoracic and Vascular Anesthesiaruen. — 2016. — Vol. 20, no. 3. — P. 213-224. — doi:10.1177/1089253216644346. — PMID 27206637.
- ↑ Goodnough, Levy, Murphy, 2013.
- ↑ Müller, Geisen, Zacharowski et al., 2015.
- ↑ 1 2 Meier, Filipescu, Kozek-Langenecker et al., 2016.
- ↑ Willett, L. R. Management of postoperative complications: anemia : [англ.] / L. R. Willett, J. L. Carson // Clinics in Geriatric Medicine. — 2014. — Vol. 30, no. 2. — P. 279-284. — doi:10.1016/j.cger.2014.01.006. — PMID 24721367.
- ↑ 1 2 Thorson, Ryan, Van Haren et al., 2013.
- ↑ 1 2 Golden, Dossa, Goodhue et al., 2015.
- ↑ Convertino, Wirt, Glenn et al., 2016.
- ↑ Harder, Boshkov, 2010.
- ↑ Reinhart, 2016.
- ↑ Doctor, 2014.
- ↑ Gutsche, J. T. When to transfuse: is it any surprise that we still don’t know? : [англ.] / J. T. Gutsche, B. A. Kohl // Critical Care Medicineruen. — 2014. — Vol. 42, no. 12. — P. 2647-2648. — doi:10.1097/CCM.0000000000000588. — PMID 25402293.
- ↑ Calcaterra, D. Navigating the fine line between the bad and worse: the issue is not the number, and the message is not “all or nothing” : [англ.] / D. Calcaterra, L. A. Renfro, A. Shander // Journal of Cardiothoracic and Vascular Anesthesia. — 2016. — Vol. 30, no. 5. — P. 1159-1162. — doi:10.1053/j.jvca.2016.06.029. — PMID 27640892.
- ↑ Faraoni, Schaefer, 2016.
- ↑ Goubran, Elemary, Radosevich et al., 2016.
- ↑ Saugel, B. Effects of red blood cell transfusion on hemodynamic parameters: a prospective study in intensive care unit patients : [англ.] / B. Saugel, M. Klein, A. Hapfelmeier [et al.] // Scandinavian Journal of Trauma, Resuscitation and Emergency Medicine. — 2013. — Vol. 21, no. 1. — P. 21. — doi:10.1186/1757-7241-21-21. — PMID 23531382.
- ↑ Szopinski, Kusza, Semionow, 2011.
- ↑ Ince, Guerci, 2016.
- ↑ Vincent, Taccone, 2016.
- ↑ Vincent, 2012.
- ↑ Vincent, 2015.
- ↑ Bockeria, Kupryashov, 2015.
- ↑ Chang, R. Advances in the understanding of trauma-induced coagulopathy : [англ.] / R. Chang, J. C. Cardenas, C. E. Wade [et al.] // Bloodruen. — 2016. — Vol. 128, no. 8. — P. 1043-1049. — doi:10.1182/blood-2016-01-636423. — PMID 27381903.
- ↑ Tonglet, M. L. Massive bleeding following severe blunt trauma: the first minutes that can change everything : [англ.] / M. L. Tonglet, P. Greiffenstein, F. Pitance [et al.] // Acta Chirurgica Belgica. — 2016. — Vol. 116, no. 1. — P. 11-15. — doi:10.1080/00015458.2015.1136488. — PMID 27385134.
- ↑ Dubovoy, Engoren, 2016.
- ↑ Litvinov, R. I. Role of red blood cells in haemostasis and thrombosis : [англ.] / R. I. Litvinov, J. W. Weisel // ISBT Science Series. — 2017. — Vol. 12, no. 1. — P. 176-183. — doi:10.1111/voxs.12331.
- ↑ López, E. A. Are the paradigms in trauma disease changing? : [англ.] // Medicina Intensiva. — 2015. — Vol. 39, no. 6. — P. 382-389. — doi:10.1016/j.medin.2015.03.010. — PMID 26068224.
- ↑ Poole, D. Coagulopathy and transfusion strategies in trauma. Overwhelmed by literature, supported by weak evidence : [англ.] // Blood Transfusion. — 2016. — Vol. 14, no. 1. — P. 3-7. — doi:10.2450/2015.0244-15. — PMID 26674832.
- ↑ Harris, T. Early fluid resuscitation in severe trauma : [англ.] / T. Harris, G. O. R. Thomas, K. Brohi // BMJ. — 2012. — Vol. 345, no. 7874. — P. 38-42. — doi:10.1136/bmj.e5752. — PMID 22968721.
- ↑ Janelle, G. M. What is the PROPPR transfusion strategy in trauma resuscitation? : [англ.] / G. M. Janelle, L. Shore-Lesserson, C. E. Smith [et al.] // Anesthesia & Analgesiaruen. — 2016. — Vol. 122, no. 4. — P. 1216-1219. — doi:10.1213/ANE.0000000000001105. — PMID 26991624.
- ↑ Schöchl, Maegele, Voelckel, 2016.
- ↑ Mitra, B. Effectiveness of massive transfusion protocols on mortality in trauma: a systematic review and meta‐analysis : [англ.] / B. Mitra, G. O’Reilly, P. A. Cameron [et al.] // ANZ Journal of Surgery. — 2013. — Vol. 83, no. 12. — P. 918-923. — doi:10.1111/ans.12417. — PMID 24147731.
- ↑ Pommerening, M. J. Clinical gestalt and the prediction of massive transfusion after trauma : [англ.] / M. J. Pommerening, M. D. Goodman, J. B. Holcomb [et al.] // Injuryruen. — 2015. — Vol. 46, no. 5. — P. 807-813. — doi:10.1016/j.injury.2014.12.026. — PMID 25682314.
- ↑ Воробьёв, 1999.
- ↑ Schött, U. Prehospital coagulation monitoring of resuscitation with point-of-care devices : [англ.] // Shockruen. — 2014. — Vol. 41, Suppl. 1. — P. 26-29. — doi:10.1097/SHK.0000000000000108. — PMID 24365883.
- ↑ Stein, P. Point-of-care coagulation monitoring in trauma patients : [англ.] / P. Stein, A. Kaserer, G. H. Spahn [et al.] // Seminars in Thrombosis and Hemostasis. — 2017. — Vol. 43, no. 4. — P. 367-374. — doi:10.1055/s-0037-1598062. — PMID 28297730.
- ↑ Gruen, Brohi, Schreiber et al., 2012.
- ↑ Maegele, Nardi, Schöchl, 2017.
- ↑ Grottke, Rossaint, 2017.
- ↑ Spinella, P. C. Role of transfused red blood cells for shock and coagulopathy within remote damage control resuscitation : [англ.] / P. C. Spinella, A. Doctor // Shockruen. — 2014. — Vol. 41, Suppl. 1. — P. 30-34. — doi:10.1097/SHK.0000000000000089. — PMID 24296434.
- ↑ Poole, Cortegiani, Chieregato et al., 2016.
- ↑ Smith, I. M. Prehospital blood product resuscitation for trauma: a systematic review : [англ.] / I. M. Smith, R. H. James, J. Dretzke [et al.] // Shockruen. — 2016. — Vol. 46, no. 1. — P. 3-16. — doi:10.1097/SHK.0000000000000569. — PMID 26825635.
- ↑ Huang, G. S. Mortality outcomes in trauma patients undergoing prehospital red blood cell transfusion: a systematic literature review : [англ.] / G. S. Huang, C. M. Dunham // International Journal of Burns and Trauma. — 2017. — Vol. 7, no. 2. — P. 17-26. — PMID 28533934.
- ↑ Hibbs, Miles, Staves et al., 2015.
- ↑ Waters, J. H. Patient blood management: where’s the bottom? : [англ.] / J. H. Waters, M. H. Yazer // Transfusionruen. — 2015. — Vol. 55, no. 4. — P. 700-702. — doi:10.1111/trf.13063. — PMID 26840786.
- ↑ Carson, J. L. Outcomes using lower vs higher hemoglobin thresholds for red blood cell transfusion : [англ.] / J. L. Carson, P. A. Carless, P. C. Hébert // JAMA. — 2013. — Vol. 309, no. 1. — P. 83-84. — doi:10.1001/jama.2012.50429. — PMID 23280228.
- ↑ Goodnough, L. T. Do liberal blood transfusions cause more harm than good? : [англ.] / L. T. Goodnough, M. F. Murphy // BMJ. — 2015. — Vol. 350, no. 7989. — P. 13-15. — doi:10.1136/bmj.g6897. — PMID 25501327.
- ↑ Spahn, D. R. Evidence base for restrictive transfusion triggers in high-risk patients : [англ.] / D. R. Spahn, G. H. Spahn, P. Stein // Transfusion Medicine and Hemotherapy. — 2015. — Vol. 42, no. 2. — P. 110-114. — doi:10.1159/000381509. — PMID 26019706.
- ↑ Shander, A. More or less? The Goldilocks Principle as it applies to red cell transfusions : [англ.] / A. Shander, V. A. Ferraris // British Journal of Anaesthesiaruen. — 2017. — Vol. 118, no. 6. — P. 816-819. — doi:10.1093/bja/aex135. — PMID 28575336.
- ↑ Seghatchian, Goubran, 2017.
- ↑ Díaz, M. Q. Appropriate use of red blood cell transfusion in emergency departments: a study in five emergency departments : [англ.] / M. Q. Díaz, A. M. Borobia, J. A. G. Erce [et al.] // Blood Transfusion. — 2017. — Vol. 15, no. 3. — P. 199-206. — doi:10.2450/2016.0324-15. — PMID 27416566.
- ↑ Plumb, J. O. M. Transfusion in critical care — a UK regional audit
Гемотрансфузия (переливание крови): виды и проведение процедуры
Гемотрансфузия приравнивается к операции по пересадке органов со всеми вытекающими последствиями. Несмотря на все меры предосторожности, иногда возникают осложнения, где человеческий фактор играет не последнюю роль.
Существует довольно много состояний и заболеваний, где без переливания крови не обойтись. Это онкология и хирургия, гинекология и неонатология. Операция гемотрансфузии – сложная процедура с множеством нюансов и требующая серьезной профессиональной подготовки.

Трансфузия – это внутривенное введение донорской крови или ее составляющих (плазмы, тромбоцитов, эритроцитов и др.) реципиенту. Цельная кровь переливается редко, в основном используют только ее компоненты.
Виды гемотрансфузии
Различают 4 вида переливания крови:
Прямое
Переливание цельной крови непосредственно от донора к реципиенту. Перед процедурой донор проходит стандартное обследование. Проводится как с помощью аппарата, так и с использованием шприца.
Непрямое
Кровь предварительно заготавливается, делится на компоненты, консервируется и хранится в соответствующих условиях до применения. Это наиболее распространенный вид трансфузий, выполняется с помощью стерильной системы для внутривенного введения. Таким способом вводят свежезамороженную плазму, эритроцитарную, тромбоцитарную и лейкоцитарную массы.
Обменное
Замещение собственной крови реципиента на донорскую в достаточном объеме. Кровь реципиента одновременно удаляется из сосудов частично или полностью.
Аутогемотрансфузия
Для переливания используется кровь самого реципиента, заготовленная заранее. При таком методе исключена несовместимость крови, а также введение инфицированного материала.
Пути введения в сосудистое русло:
- Внутривенно – основной способ переливания, когда препарат вводится непосредственно в вену — венепункция, либо через центральный венозный катетер в подключичную вену — венесекция. Центральный венозный катетер устанавливается на длительное время и требует тщательного ухода. Поставить ЦВК может только врач.
- Внутриартериальная и внутриаортальная гемотрансфузия – их используют в исключительных случаях: клиническая смерть, вызванная массивной кровопотерей. При таком способе рефлекторно стимулируется сердечно-сосудистая система и восстанавливается кровоток.
- Внутрикостное переливание – введение крови осуществляют в кости с большим количеством губчатого вещества: грудина, пяточные кости, крылья подвздошных костей. Способ применяют при невозможности найти доступные вены, часто используют в педиатрии.
- Внутрисердечное переливание – введение крови в левый желудочек сердца. Применяется крайне редко.
Показания к гемотрансфузии
Абсолютные показания – когда переливание является единственным методом лечения. К ним относятся: острая кровопотеря 20% и более объема циркулирующей крови, шоковое состояние и операции с использованием аппарата искусственного кровообращения.
Существуют также относительные показания, когда гемотрансфузия становится вспомогательным способом лечения:
- кровопотеря менее 20% ОЦК;
- все виды анемии при снижении уровня гемоглобина до 80 г/л;
- тяжелые формы гнойно-септических заболеваний;
- продолжительные кровотечения из-за нарушения свертываемости крови;
- глубокие ожоги большой площади тела;
- гематологические болезни;
- тяжелый токсикоз.
Противопоказания к переливанию крови
При гемотрансфузии в организм человека вводятся чужеродные клетки, а это увеличивает нагрузку на сердце, почки и печень. После переливания активизируются все метаболические процессы, что приводит к обострению хронических заболеваний.
Поэтому перед процедурой требуется тщательно собрать анамнез жизни и болезни пациента.
Особенно важны сведения об аллергии и ранее проводимых трансфузиях. По результатам выясненных обстоятельств выделяют реципиентов группы риска.
К ним относятся:
- женщины с отягощенным акушерским анамнезом – выкидыши, рождение детей с гемолитической болезнью;
- пациенты, страдающие заболеваниями системы кроветворения или с онкологией в стадии распада опухоли;
- реципиенты, которым уже проводилась трансфузия.
Абсолютные противопоказания:
- острая сердечная недостаточность, которая сопровождается отеком легких;
- инфаркт миокарда.
При состояниях, угрожающих жизни пациента, кровь переливают, несмотря на противопоказания.
Относительные противопоказания:
- острое нарушение мозгового кровообращения;
- пороки сердца;
- септический эндокардит;
- туберкулез;
- печеночная и почечная недостаточность;
- тяжелые формы аллергии.
Возможно вам будет интересно прочитать — Как проводится операция по пересадке сердца.
Проведение процедуры
Перед проведением процедуры реципиент проходит тщательное обследование в ходе которого исключаются возможные противопоказания. Одним из обязательных условий является определение группы крови и резус-фактора реципиента.
Даже если данные уже известны.
Обязательно перепроверяется группа крови и резус-фактор донора, несмотря на то, что сведения есть на этикетке емкости. Следующий этап – проведение проб на групповую и индивидуальную совместимость. Он называется биологической пробой.
Период подготовки – самый ответственный пункт операции. Все этапы процедуры проводятся только врачом, медсестра лишь помогает.
Перед манипуляцией компоненты крови необходимо согреть до комнатной температуры. Свежезамороженную плазму размораживают при температуре 37 градусов в оборудовании специального назначения.
Компоненты крови донора хранятся в гемаконе – полимерном контейнере. К нему присоединяют одноразовую систему для внутривенных вливаний и закрепляют вертикально.
Затем систему заполняют, берут необходимое количество крови для проведения проб.
Далее систему подключают к реципиенту через периферическую вену или ЦВК. Сначала капельно вводят 10–15 мл препарата, затем приостанавливают процедуру на несколько минут и оценивают реакцию пациента.
Этот этап повторяют трижды.
Скорость гемотрансфузии индивидуальна. Это может быть и капельное и струйное введение. Через каждые 10–15 минут измеряют пульс и давление, наблюдают за пациентом.
После переливания необходимо сдать мочу на общий анализ для исключения гематурии.
По окончании операции в гемаконе оставляют небольшое количество препарата и хранят двое суток при температуре 4–6 градусов.
Это необходимо для изучения причин осложнений, если таковые возникнут после трансфузии. Все сведения об гематрансфузии заносятся в специальные документы.
После процедуры рекомендуют соблюдать постельный режим 2–4 часа.
В это время следят за самочувствием пациента, его пульсом и АД, температурой тела и цветом кожных покровов.
Если за несколько часов не возникло каких-либо реакций, то операция прошла успешно.
Гемотрансфузия — возможные осложнения
Осложнения могут начаться в ходе процедуры или через некоторое время после нее.
Любое изменение состояния реципиента говорит о возникшей посттрансфузионной реакции, что требует оказания незамедлительной помощи.
Нежелательные реакции возникают по следующим причинам:
- Нарушена техника проведения гемотрансфузии:
- тромбоэмболия – из-за образования сгустков в переливаемой жидкости или образование тромбов в месте введения;
- воздушная эмболия – из-за наличия пузырьков воздуха в системе для внутривенных вливаний.
- Реакция организма на введение чужеродных клеток:
- гемотрансфузионный шок – при групповой несовместимости донора и реципиента;
- аллергическая реакция – крапивница, отек Квинке;
- синдром массивной гемотрансфузии – переливание более 2-х литров крови за короткое время;
- бактериально-токсический шок – при введении некачественного препарата;
- заражение инфекциями, передающимися через кровь – очень редко, благодаря карантинному хранению.
Симптомы возникшей реакции:
- повышение температуры тела;
- озноб;
- учащение пульса;
- снижение артериального давления;
- боли в грудной клетке и пояснице;
- одышка.
Осложнения бывают и более серьезными:
- внутрисосудистый гемолиз;
- острая почечная недостаточность;
- тромбоэмболия легочной артерии.
Любое изменение состояния реципиента требует срочного оказания помощи. Если реакция возникла в ходе переливания – его немедленно прекращают.
В тяжелых случаях помощь оказывают в отделениях реанимации.
Почти все осложнения возникают из-за человеческого фактора. Чтобы этого избежать, необходимо тщательно соблюдать весь алгоритм проведения операции.
Отношение медицины к операции гемотрансфузии менялось неоднократно. И сегодня есть специалисты, которые категорически против введения в организм чужой крови.
Но стоит признать, что в некоторых случаях гемотрансфузия – жизненно важная операция, без которой не обойтись.
Соглашаясь на процедуру переливания крови нужно быть уверенным в качестве препаратов и квалификации персонала.
Гемотрансфузия (переливание крови): показания и противопоказания, подготовка, алгоритм
Своевременное переливание крови сохраняет жизнь людям с серьезными болезнями, в числе которых онкологические заболевания, анемия, тромбогеморрагический синдром, а экстренные трансфузии позволяют спасти даже тех, кто потерял почти всю собственную кровь.
Попытки перелить кровь предпринимались в разные эпохи, но это приводило к негативным последствиям из-за процессов отторжения, и только после открытия групп крови и резус-фактора этот метод стал относительно безопасным.
Что такое гемотрансфузия?
Гемотрансфузия — это переливание крови и ее составляющих (плазма, кровяные клетки), применяется при обширных кровопотерях, дефиците кровяных компонентов.
Существует ряд строгих правил относительно проведения этой медицинской процедуры. Их соблюдение снижает риски развития осложнений, которые способны привести к летальному исходу.
Какие существуют виды гемотрансфузий?
Выделяют пять основных разновидностей гемотрансфузии, в зависимости от метода переливания.
Прямое переливание
У предварительно обследованного донора с использованием шприца берут кровь и вводят ее напрямую пациенту. Чтобы жидкость не сворачивалась во время процедуры, могут применяться вещества, которые предотвращают этот процесс.
Показано, если:
- Непрямое вливание не показало результативности, а состояние пациента критическое (шок, 30-50% потерянной крови),
- У пациента с гемофилией обширное кровоизлияние,
- Обнаружены нарушения в гемостатических механизмах.
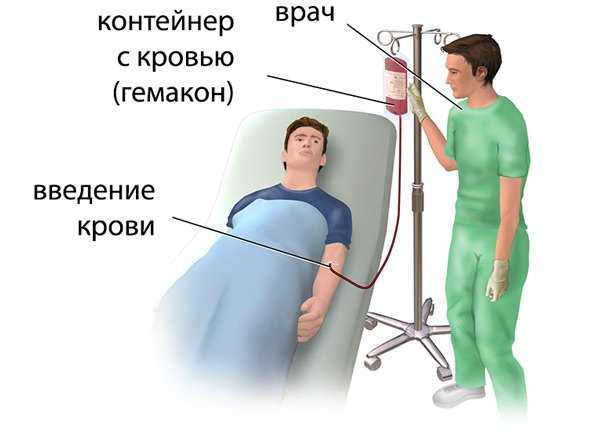
Процедура переливания крови
Обменное переливание
В процессе этой процедуры у пациента изымается кровь и одновременно вводится донорская. Этот метод дает возможность быстро удалить ядовитые вещества из кровотока и восстановить нехватку кровяных элементов. В ряде случаев с применением этого метода проводится полное переливание крови.
Проводится при:
- Гемолитической желтухе у новорожденных,
- Шоковом состоянии, которое развилось после неудачного переливания крови,
- Острой почечной недостаточности,
- Отравлении токсическими веществами.
Переливание пациенту его собственную кровь (аутогемотрансфузия).
Перед оперативным вмешательством у больного изымается определенное количество крови, которое потом возвращается ему, если открылось кровотечение. Этот метод, связанный с введением своей себе крови, обладает преимуществом перед прочими, связанным с отсутствием негативных эффектов, которые возникают при введении донорского материала.
Показания к переливанию:
- Проблемы в подборе подходящего донора,
- Повышенные риски при переливании донорского материала,
- Индивидуальные особенности (редкая группа, бомбейский феномен).
Совместимость крови
Аутогемотрансфузия нашла применение в спорте и называется кровяным допингом: спортсмену вводят его ранее изъятый материал за 4-7 дней до соревнования. Обладает рядом неблагоприятных эффектов и запрещен к применению.
Противопоказания:
- Низкая концентрация белка,
- Сердечная недостаточность 2 степени и выше,
- Выраженный дефицит веса,
- Систолическое давление ниже 100 мм,
- Психические заболевания, которые сопровождаются нарушениями сознания,
- Сбои в процессах мозгового кровоснабжения,
- Онкологические заболевания в терминальной стадии,
- Нарушения в работе печени или почек,
- Воспалительные реакции.
Непрямое переливание
Наиболее распространенный способ переливать кровь. Материал заранее заготовлен с применением специальных веществ, которые продлевают сроки его хранения. Когда возникает необходимость, подходящую по характеристикам кровь переливают пациенту.
Реинфузия
Эта методика проведения считается частью аутогемотрансфузии, так как пациенту вводят его собственную кровь. Если при оперативном вмешательстве открылось кровотечение и жидкость попала в одну из полостей организма, ее собирают и вводят обратно. Также эта методика практикуется при травматических повреждениях внутренних органов и сосудов.
Реинфузионное переливание крови не практикуется, если:
- Кровь была в брюшной полости дольше суток,
- У пациента есть онкологическое заболевание,
- Повреждение затронуло полые органы грудной и брюшной зоны (кишечник, желудок, мочевой пузырь, бронхи, пищевод, желчный пузырь).
Перед введением собранная кровь проходит фильтрацию через восемь слоев марли. Могут применяться другие методы очищения.
Также гемотрансфузия подразделяется по способам введения:
Внутривенное. Осуществляется либо с помощью шприца (венепункция), либо с помощью катетера (венесекция). Катетер подключается в подключичную вену, и через него поступает донорский материал. Может устанавливаться на продолжительное время.
Для катетеризации подключичная вена хорошо подходит, так как она удобно расположена, ее легко найти при любых обстоятельствах, а скорость тока крови в ней высокая.
Внутриартериальное. Осуществляется в следующих случаях: при остановке сердцебиения и дыхания, которые были вызваны обширной потерей крови, при низкой эффективности классических вливаний в вену, при остром шоковом состоянии, во время которого наблюдается выраженное снижение кровяного давления.
В процессе переливания крови используют артерии в бедре и в плече. В отдельных случаях введение осуществляется внутриаортально — кровь направляют в аорту, самую большую артерию организма.
Переливание показано при клинической смерти, которая возникла из-за объемной кровопотери в процессе выполнения оперативных вмешательств в грудной клетке, и для спасения жизни при прочих критических ситуациях, когда вероятность летального исхода из-за сильного кровотечения очень высока.
Внутрисердечное. Эта процедура делается в крайне редких случаях, когда альтернативных вариантов нет. Донорский материал вливают в левый желудочек сердца.
Внутрикостное. Применяется только в тех случаях, когда другие способы переливания крови недоступны: при лечении ожогов, которые покрывают обширную часть тела. Для введения материала подходят кости, которые содержат трабекулярное вещество. Наиболее удобны для этой цели следующие зоны: грудная, пяточная, бедренная кости, подвздошный гребень.
Внутрикостное вливание происходит медленно из-за особенностей структуры, и для ускорения процесса создается повышенное давление в емкости с кровью.
В каких случаях необходимо переливание крови?
Из-за рисков при переливании крови, которые связаны с той или иной степенью чувствительности организма к компонентам чужеродного материала, определен жесткий список абсолютных и относительных показаний и противопоказаний к процедуре.
В список абсолютных показаний включены ситуации, когда переливание крови необходимо, в противном случае вероятность летального исхода близка к 100%.
Абсолютные показания
Выраженная кровопотеря (свыше 15% от общего количества крови). При значительной потере крови нарушается сознание, наблюдается компенсаторное учащение сердцебиения, существует риск развития сопорозных состояний, комы.
Донорский материал восстанавливает потерянный объем крови и ускоряет восстановление.
Тяжелое шоковое состояние, вызванное избыточной кровопотерей либо другими факторами, которые можно устранить переливанием крови.
Любой шок требует срочного начала лечебных мероприятий, иначе велика вероятность смертельного исхода.
При купировании подавляющего большинства шоковых состояний часто нужно применение донорского материала (не всегда это цельная кровь).
При выявленном кардиогенном шоке трансфузия проводится с осторожностью.
Анемия, при которой концентрация гемоглобина ниже 70 г/л. Тяжелые разновидности анемии редко развиваются на фоне неполноценного питания, обычно их развитие обусловлено наличием в организме серьезных заболеваний, в числе которых злокачественные новообразования, туберкулез, язва желудка, болезни, которые связаны с нарушениями процессов свертывания.
Также тяжелая анемия постгеморрагического типа развивается на фоне выраженной кровопотери. Переливание крови, сделанное вовремя, позволяет восстановить потерянный объем гемоглобина и ценных элементов.
Травматические повреждения и сложные хирургические операции, при которых возникло массивное кровоизлияние. Любые хирургические вмешательства требуют наличия заранее заготовленных запасов донорской крови, которую перельют, если при проведении операции будет нарушена целостность стенок крупных сосудов. Особенно это касается сложных вмешательств, к которым относятся те, что проводятся в зонах расположения крупных сосудов.
В список относительных показаний включены ситуации, при которых переливание крови является дополнительной мерой наряду с прочими терапевтическими процедурами.
Относительные показания
Анемия. При лечении анемии разной степени выраженности применяется переливание крови.
Эта процедура проводится при наличии особых показаний, в числе которых:
- Нарушения механизмов транспорта кислорода в венозную кровь,
- Пороки сердца,
- Интенсивные кровоизлияния,
- Сердечная недостаточность,
- Атеросклеротические изменения в сосудах головного мозга,
- Сбои в работе легких.
Если одно показание (или более одного) присутствует, рекомендована трансфузия.
Кровоизлияния, которые вызваны сбоями в механизмах гомеостаза. Гомеостаз — система, которая обеспечивает сохранение крови в жидком виде, управляет процессами свертывания и удаляет остатки свернувшейся крови.
Тяжелая интоксикация. В этих ситуациях применяется обменное переливание крови, которое показано для быстрого выведения ядов из организма. Эффективно при выведении ядовитых веществ, которые продолжительное время сохраняются в крови (акрихин, тетрахлорметан), и восстановлении после попадания в организм веществ, приводящих к распаду эритроцитов (свинец, нитрофенол, анилин, нитробензол, нитрит натрия).
Низкий иммунный статус. При нехватке лейкоцитов организм уязвим перед инфекциями, и в ряде случаев их можно восполнить с помощью донорского материала.
Нарушения в работе почек. Одним из симптомов тяжелой почечной недостаточности является анемия. Ее лечение начинается не во всех случаях и показано, если низкая концентрация гемоглобина может привести к развитию сердечной недостаточности.
Переливание крови при этой патологии дает кратковременную пользу, и процедуру нужно периодически повторять. Распространено переливание эритроцитарной массы.
Печеночная недостаточность. Переливание крови и ее элементов показано для коррекции нарушений в механизмах гомеостаза. Проводится при наличии показаний.
Онкологические заболевания, которые сопровождаются внутренними кровотечениями, нарушениями гомеостаза, анемиями. Трансфузия снижает риски развития осложнений, облегчает состояние пациента, помогает восстановиться после лучевой терапии и химиотерапии. Но цельная кровь не переливается, так как это ускоряет распространение метастазов.
Септическое поражение. При сепсисе переливание крови усиливает иммунную защиту, снижает выраженность интоксикации и применяется на всех этапах лечения. Эта процедура не проводится, если наблюдаются серьезные нарушения в работе сердца, печени, селезенки, почек и других органов, так как это приведет к ухудшению состояния.
Гемолитическая болезнь у новорожденных. Гемотрансфузия — ключевой метод лечения этой патологии и до рождения ребенка, и после.
Также лечение переливанием крови проводится при тяжелом токсикозе и гнойно-септических заболеваниях.
41% онкологических больных сообщают, что желают избавиться от сильной усталости из-за анемии, которая лечится переливанием компонентов крови.
Когда трансфузия противопоказана?
Наличие противопоказаний к переливанию крови обусловлено:
- Повышенными рисками возникновения реакции отторжения,
- Усилением нагрузки на сердце и сосуды из-за увеличенного кровяного объема после переливания,
- Обострением воспалительных и злокачественных процессов из-за ускорения метаболизма,
- Увеличением количества продуктов белкового распада, что повышает нагрузку на органы, в функции которых входит выведение из организма токсических и отработанных веществ.
К абсолютным противопоказаниям относятся:
- Инфекционный эндокардит в острой либо подострой форме,
- Отек легких,
- Выраженные нарушения в механизмах мозгового кровоснабжения,
- Тромбозы,
- Миокардиосклероз,
- Склеротические изменения в почках (нефросклероз),
- Миокардиты различной этиологии,
- Третья-четвертая стадия гипертонии,
- Тяжелые пороки сердца,
- Ретинальное кровоизлияние,
- Тяжелые атеросклеротические изменения в сосудистых структурах головного мозга,
- Болезнь Сокольского-Буйо,
- Печеночная недостаточность,
- Почечная недостаточность.
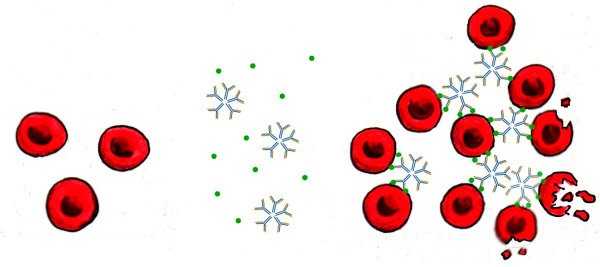
Гемолиз чужеродных эритроцитов
При переливании кровяных компонентов многие абсолютные противопоказания переходят в относительные. Также большинством абсолютных противопоказаний пренебрегают, если высок риск летального исхода при отказе от переливания крови.
Относительные противопоказания:
- Амилоидная дистрофия,
- Высокая чувствительность к белку, аллергии,
- Диссеминированный легочный туберкулез.
Представители некоторых религий (например, свидетели Иеговы) могут отказаться от переливания по религиозным причинам: их учение определяет эту процедуру как недопустимую.
Лечащий врач взвешивает все за и против, которые связаны с показаниями и противопоказаниями, и принимает решение относительно целесообразности проведения процедуры.
Как называют людей, которым делают переливание крови?
Человек, получающий материал, взятый у донора, называется реципиентом. Также так называют не только тех, кто получает кровь и кровяные компоненты, но и тех, кому пересаживают донорские органы.
Донорский материал проходит тщательную проверку перед использованием, чтобы вероятность неблагоприятного исхода была снижена до минимума.
Какие анализы проводятся перед переливанием крови?
Прежде чем сделать переливание крови, доктору нужно провести следующие мероприятия:
- Анализ, который позволяет определить, к какой группе относится кровь реципиента и какой у нее резус-фактор. Эта процедура проводится всегда, даже если пациент утверждает, что точно знает характеристики собственной крови.
- Проверка, позволяющая выяснить, подходит ли донорский материал конкретному реципиенту: биологическая проба при переливании. Когда в вену введена игла, вводится 10-25 мл донорского материала (крови, плазмы или иных компонентов). После этого подача крови останавливается или замедляется, а потом, спустя 3 минуты, вводится еще 10-25 мл. Если после трехразового введения крови самочувствие пациента не изменилось, материал подходит.
- Проба Бакстера: пациенту вливают 30-45 мл донорского материала, а через 5-10 минут берут кровь из вены. Ее помещают в центрифугу, а после оценивают ее окраску. Если цвет не изменился, кровь совместима, если жидкость стала бледнее, донорский материал не подходит.
Также в ряде случаев проводятся и другие пробы на совместимость:
- Проба с применением желатина,
- Проба Кумбса,
- Проба на плоскости,
- Двухэтапная проверка с использованием антиглобулина,
- Проба с полиглюкином.
Какой врач выполняет переливание крови?
Гематолог — доктор, который специализируется на патологиях крови, кроветворной системы.
Основные функции гематолога:
- Лечение и профилактика заболеваний кровеносной системы и органов кроветворения (включая анемии, лейкемии, патологии гемостаза),
- Участие в проведении анализов костного мозга и крови,
- Выявление характеристик крови в сложных случаях,
- Проведение узкоспециализированных проб,
- Контроль процессов гемотрансфузии.
Также существует отдельное направление в медицине, которое напрямую связано с процессами переливания крови, — трансфузиология. Трансфузиологи проверяют доноров, контролируют трансфузионное лечение, заготавливают кровь.
Какие существуют правила переливания крови?
К общим правилам проведения процедуры относятся следующие:
 Процесс переливания крови нужно делать в полной дезинфекции,
Процесс переливания крови нужно делать в полной дезинфекции,- Подготовка к трансфузии должна включать проведение всех необходимых проб и анализов,
- Использование донорской крови, которая не прошла проверку на инфекции, недопустимо,
- Объем крови, взятой за одну процедуру, не должен превышать 500 мл. Этот материал хранится не более 21 дня с момента изъятия при специальных температурных условиях,
- При проведении гемотрансфузии у новорожденного следует соблюдать строгую дозировку, определенную индивидуально.
Несоблюдение этих правил опасно, так как приводит к развитию у пациента тяжелых осложнений.
Алгоритм переливания крови
Информация о том, как правильно выполнять переливание крови, чтобы не допустить возникновение осложнений, давно известна медикам: существует специальный алгоритм, согласно которому проводится процедура:
- Определяется, есть ли противопоказания и показания к проведению переливания. Также проводится опрос пациента, в процессе которого выясняют, проводили ли ему переливание крови ранее, и если у него был такой опыт, то возникали ли осложнения. Если пациент женского пола, при опросе важно узнать, был ли опыт патологических беременностей.
- Проводятся исследования, которые позволяют узнать характеристики крови пациента.
- Подбирается подходящий по характеристикам донорский материал. После проводится макроскопическая оценка для определения его годности. Если присутствуют признаки инфицирования во флаконе (наличие сгустков, хлопьев, помутнений и других изменений в плазме), этот материал недопустимо применять.
- Анализ донорского материала по системе групп крови.
- Проведение проб, которые позволяют узнать, подходит ли реципиенту материал донора.
- Переливание осуществляется капельно, а перед началом процедуры донорский материал либо нагревают до 37 градусов, либо оставляют при комнатной температуре на 40-45 минут. Капать нужно со скоростью 40-60 капель в минуту.
- Во время проведения гемотрансфузии пациент находится под непрерывным наблюдением. Когда процедура завершена, небольшое количество донорского материала сохраняется, чтобы его можно было исследовать при возникших у реципиента нарушениях.
- Доктор заполняет историю болезни, в которую попадает следующая информация: характеристика крови (группа, резус), информация о материале донора, дата проведения процедуры, результаты проб на совместимость. Если после проведения гемотрансфузии возникли осложнения, эта информация записывается.
- После переливания крови за реципиентом наблюдают в течение суток, также проводятся исследования мочи, измеряется кровяное давление, температура, пульс. На следующий день реципиент сдает кровь и мочу.
Почему нельзя переливать другую группу крови?
Если человеку введут кровь, которая ему не подходит, начнется реакция отторжения, связанная с реакцией иммунной системы, воспринимающей эту кровь как чужеродную. Если будет перелито большое количество неподходящего донорского материала, это приводит к смерти пациента. Но ошибки такого рода в медицинской практике крайне редки.
Антитела, влияющие на совместимость крови
Сколько длится переливание крови?
Скорость вливания и общая продолжительность процедуры зависит от разных факторов:
- Выбранного метода введения,
- Количества крови, которую нужно перелить,
- Особенностей и тяжести заболевания.
В среднем переливание крови длится от двух до четырех часов.
Как делают переливание крови новорожденным?
Дозировка крови для новорожденного определяется в индивидуальном порядке.
Чаще всего переливание крови проводится для лечения гемолитической болезни и имеет следующие особенности:
- Применяется метод обменного переливания крови,
- Переливают материал либо первой группы, либо той, которая выявлена у ребенка,
- Применяется для переливания эритроцитарная масса,
- Также капают плазму и растворы, замещающие ее,
- Перед процедурой и после вводится альбумин в индивидуальной дозировке.
Если ребенку перелили I группу крови, его кровь временно приобретает эту группу.
Где берут кровь?
К основным источникам материала относятся:
- Донорство. Центральный источник крови. Если диагностика подтвердила, что человек, который хочет сдать кровь, здоров, ему можно быть донором.
 Утильная кровь. Ее изымают из плаценты, консервируют и применяют для изготовления препаратов, в числе которых фибриноген, тромбин. Из одной плаценты получают порядка 200 мл материала.
Утильная кровь. Ее изымают из плаценты, консервируют и применяют для изготовления препаратов, в числе которых фибриноген, тромбин. Из одной плаценты получают порядка 200 мл материала.- Трупный материал. Изымается у погибших людей, у которых отсутствовали серьезные заболевания. Изъятие осуществляется в первые шесть часов после гибели. Из одного тела можно получить порядка 4-5 литров материала, который тщательно проверяют на соответствие нормам.
- Аутокровь. Пациент сдает собственную кровь перед сложным оперативным вмешательством, и ее применяют, если открылось кровотечение. Также используется материал, который излился в полости организма.
Где можно сдать кровь?
Человеку, который хочет сдать материал, нужно прийти в один из пунктов приема донорской крови. Там ему расскажут, какие анализы нужно пройти и в каких случаях быть донором нельзя.
Какие есть гемотрансфузионные среды?
Трансфузионные среды включают все компоненты и препараты, которые были созданы на кровяной основе и вводятся в кровеносные сосуды.
- Консервированная кровь. Чтобы сохранить кровь, в нее добавляют консервирующие, стабилизирующие вещества и антибиотики. Длительность хранения связана с типом консервирующего вещества. Максимальный срок — 36 суток.
- Гепаринизированная. Содержит гепарин, хлорид натрия и глюкозу, которые ее стабилизируют. Используется в первые 24 часа, применяется в аппаратах, обеспечивающих кровообращение.
- Свежецитратная. В материал добавляют только стабилизирующее вещество, которое предотвращает свертываемость, — цитрат натрия. Эту кровь используют в первые 5-7 часов.
Цельная кровь применяется намного реже, чем компоненты и препараты на ее основе, и связано это с большим количеством рисков, побочных эффектов и противопоказаний. Переливание кровяных компонентов и препаратов действеннее, так как есть возможность воздействовать направленно.
- Эритроцитарная взвесь. Состоит из эритроцитарной массы и консерванта.
- Замороженные эритроциты. Из крови с помощью центрифуги и растворов удаляют плазму и кровяные тельца, кроме эритроцитов.
- Эритроцитарная масса. С помощью центрифуги кровь разделяют на слои, а после удаляют 65% плазмы.
- Тромбоцитарная масса. Получают с применением центрифуги.
- Лейкоцитарная масса. Применение лейкоцитарной массы показано при септическом поражении, которое не удается вылечить другими методами, при низкой концентрации лейкоцитов и для уменьшения лейкопоэза после химиотерапевтического лечения.
- Жидкая плазма. Используется в первые 2-3 часа. Содержит полезные элементы и белок.
- Сухая плазма. Изготавливается при помощи вакуума из предварительно замороженной.
- Протеин. Используется в спорте, источник аминокислот.
- Альбумин. Применяют при асцитах, тяжелых ожогах и при выведении из шоковых состояний.
Эритроциты и гемоглобин
Трансфузионный материал хранится в специальных контейнерах.
Какие существуют риски при переливании крови?
Нарушения и болезни после переливания крови обычно связаны с врачебными ошибками на любом из этапов подготовки к процедуре.
Основные причины развития осложнений:
- Несовпадение характеристик крови реципиента и донора. Развивается гемотрансфузионный шок.
- Повышенная чувствительность к антителам. Возникают аллергические реакции, вплоть до анафилактического шока.
- Некачественный материал. Отравление калием, фебрильные реакции, инфекционно-токсический шок.
- Ошибки при проведении переливания крови. Перекрытие просвета в сосуде тромбом или пузырьком воздуха.
- Переливание массивного кровяного объема. Отравление цитратом натрия, синдром массивных трансфузий, легочное сердце.
- Инфицированная кровь. Если донорский материал не был проверен должным образом, в нем могут находиться патогенные микроорганизмы. Через переливание передаются опасные заболевания, к которым относятся ВИЧ, гепатит, сифилис.
Чем полезно переливание крови?
Чтобы понять, зачем переливают кровь, стоит рассмотреть положительные эффекты от процедуры.
Донорский материал, введенный в кровеносную систему, выполняет следующие функции:
- Заместительная. Объем крови восстанавливается, что положительно влияет на работу сердца. Восстанавливаются системы газотранспорта, а свежие кровяные тельца выполняют функции утерянных.
- Гемодинамическая. Функционирование организма улучшается. Усиливается кровоток, сердце работает активнее, кровообращение в мелких сосудах восстанавливается.
- Гемостатическая. Улучшается гомеостаз, усиливается свертывающая способность крови.
- Дезинтоксикационная. Перелитая кровь ускоряет очищение организма от токсических веществ и повышает сопротивляемость.
- Стимулирующая. Трансфузия вызывает выработку кортикостероидов, что положительно влияет и на иммунную систему, и на общее состояние пациента.
В большинстве случаев положительные эффекты от процедуры перевешивают негативные, особенно когда речь идет о спасении жизни и восстановлении после серьезных заболеваний. Перед выпиской после переливания крови лечащий врач даст рекомендации относительно питания, физических нагрузок и выпишет лекарственные средства.
Видео: Переливание крови
Загрузка...Переливание крови
Переливание крови (гемотрансфузия) — лечебный метод, заключающийся во введении в кровеносное русло больного (реципиента) цельной крови или ее компонентов, заготовленных от донора или от самого реципиента (аутогемотрансфузия), а также крови, излившейся в полости тела при травмах и операциях (реинфузия).
В лечебной практике наиболее широкое распространение имеет переливание эритроцитной массы (взвеси эритроцитов), свежезамороженной плазмы, концентрата тромбоцитов, лейкоцитной массы. Трансфузии эритроцитной массы показаны при различных анемических состояниях. Эритроцитная масса может применяться в комплексе с плазмозаменителями и препаратами плазмы. При переливании эритроцитной массы практически не бывает осложнений.
Трансфузии плазмы показаны при необходимости коррекции объема циркулирующей крови при массивных кровотечениях (особенно в акушерской практике), ожоговой болезни, гнойно-септических процессах, гемофилии и т. д. С целью максимального сохранения структуры плазменных белков и их биологической активности полученную после фракционирования плазму подвергают быстрому замораживанию при температуре -45°С). В то же время объем-замещающий эффект от введения плазмы непродолжителен и уступает действию альбумина и плазмозаменителей.
Переливание тромбоцитной массы показано при тромбоцитопенической кровоточивости. Лейкоцитную массу переливают больным при снижении способности к выработке собственных лейкоцитов. Наиболее распространенным методом переливания цельной крови или ее компонентов является внутривенное введение с помощью системы одноразового пользования с фильтром. Используются и другие пути введения крови и ее компонентов: внутриартериальный, внутриаортальный, внутрикостный.
Метод переливания цельной крови непосредственно от донора больному без стадии консервации крови называется прямым. Так как технологией этого метода не предусмотрено использование фильтров во время переливания, существенно повышается риск попадания в кровеносное русло реципиента мелких тромбов, неизбежно образующихся в системе для переливания, что чревато развитием тромбоэмболии мелких ветвей легочной артерии. Обменное переливание крови — частичное или полное удаление крови из кровеносного русла реципиента с одновременным замещением ее адекватным или превышающим объемом донорской крови — применяется для удаления различных ядов (при отравлениях, эндогенных интоксикациях), продуктов распада, гемолиза и антител (при гемолитической болезни новорожденных, гемотрансфузионном шоке, тяжелых токсикозах, острой почечной недостаточности). Лечебный плазмаферез является одной из основных трансфузиологических операций, при этом одновременно с изъятием плазмы проводится восполнение забираемого объема переливанием эритроцитов, свежезамороженной плазмы, реологических плазмозаменителей. Лечебное действие плазмафереза основано как на механическом удалении с плазмой токсических метаболитов, так и на возмещении недостающих жизненно важных компонентов внутренней среды организма, а также на деблокировании органов («очищение» печени, селезенки, почек).
Правила переливания крови
Правила переливания крови
Правила переливания крови
Показания к назначению переливания любой трансфузионной среды, а также ее дозировка и выбор метода трансфузии определяются лечащим врачом на основании клинических и лабораторных данных. Врач, производящий трансфузию, обязан независимо от проведенных ранее исследований и имеющихся записей лично провести следующие контрольные исследования: 1) определить групповую принадлежность крови реципиента по системе AB0 и сверить результат с данными истории болезни; 2) определить групповую принадлежность эритроцитов донора и сопоставить результат с данными на этикетке контейнера или бутылки; 3) провести пробы на совместимость в отношении групп крови донора и реципиента по системе AB0 и резус-фактору; 4) провести биологическую пробу.
Подбор крови и ее компонентов для переливания. Перед переливанием необходимо проведение следующих трансфузиологических мероприятий:
1) Получить предварительное добровольное согласие гражданина на переливание крови и ее компонентов. В случае если пациент находится в бессознательном состоянии, то необходимость трансфузии для спасения жизни пациента обосновывает показания врачей. Переливание крови детям проводят с письменного разрешения родителей.
2) Проверить группу крови пациента по системе АВ0, сверить полученный результат с данными истории болезни.
3) Перепроверить группу крови по системе АВ0 донорского контейнера с данными на этикетке контейнера.
4) Сравнить группу крови и резус-принадлежность, обозначенные на контейнере, с результатами исследования ранее внесенными в историю болезни и только что полученными.
5) Провести пробы на индивидуальную совместимость по системе АВО и резус эритроцитов доноров и сыворотки реципиента.
6) Уточнить у пациента фамилию, имя, отчество, год рождения и сверить их с указанными на титульном листе истории болезни. Данные должны совпадать и пациент должен их по возможности подтвердить (за исключением случаев, когда переливание проводят под наркозом или в бессознательном состоянии).
7) Провести биологическую пробу.
Визуально врач, осуществляющий трансфузию, проверяет герметичность упаковки, правильность паспортизации, оценивает качество трансфузионной среды. Определять годность гемотрансфузионной среды необходимо при достаточном освещении непосредственно на месте хранения, не допускается взбалтывание. Критериями годности для переливания являются: для цельной крови – прозрачность плазмы, равномерность верхнего слоя эритроцитов, наличие четкой границы между эритроцитами и плазмой, а для свежезамороженной плазмы – прозрачность при комнатной температуре. Запрещается переливание крови и ее компонентов, предварительно не обследованного на ВИЧ, гепатиты В и С, сифилис.
Проба на индивидуальную совместимость донора и реципиента по системе АВО.
На пластинку наносят 2-3 капли сыворотки реципиента и добавляют небольшое количество эритроцитов с таким расчетом, чтобы соотношение эритроцитов и сыворотки было 1:10 (для удобства рекомендуется сначала выпустить через иглу несколько капель эритроцитов из контейнера на край пластинки, затем оттуда стеклянной палочкой перенести маленькую каплю эритроцитов в сыворотку). Далее эритроциты перемешивают с сывороткой, пластинку слегка покачивают в течение 5 мин, наблюдая за ходом реакции. По истечении указанного времени в реагирующую смесь можно добавить 1-2 капли физиологического раствора для снятия возможной неспецифической агрегации эритроцитов. Учет результатов. Наличие агглютинации эритроцитов означает, что кровь донора несовместима с кровью реципиента и не должна быть ему перелита. Если по истечению 5 мин агглютинация эритроцитов отсутствует, то это означает, что кровь донора совместима с кровью реципиента по групповым агглютиногенам.
Непрямая проба Кумбса. В пробирку вносят 1 каплю (0,02 мл) осадка трижды отмытых эритроцитов донора, для чего выдавливают из пипетки небольшую каплю эритроцитов и касаются ею дна пробирки и добавляют 4 капли (0,2 мл) сыворотки реципиента. Содержимое пробирок перемешивают встряхиванием, после чего их помещают на 45 мин в термостат при температуре +37ºС. По истечению указанного времени эритроциты вновь трижды отмывают и готовят 5% взвесь в физиологическом растворе. Далее 1 каплю (0,05 мл) взвеси эритроцитов на фарфоровую пластинку, добавляют 1 каплю (0,05 мл) антиглобулиновой сыворотки, перемешивают стеклянной палочкой. Пластинку периодически покачивают в течении 5 минут. Учет результатов проводят невооруженным глазом или через лупу. Агглютинация эритроцитов свидетельствует о том, что кровь реципиента и донора несовместимы, отсутствие агглютинации является показателем совместимости крови донора и реципиента.
Для определения индивидуальной совместимости крови по системе Резус используется проба с применением 10% желатина и 33% полиглюкина.
Проба на совместимость с применением 10% желатина. В пробирку вносят одну небольшую каплю (0,02 мл) эритроцитов донора, для чего выдавливают из пипетки небольшую каплю эритроцитов и касаются ею дна пробирки. Добавляют 2 капли (0,1 мл) желатина и 2 капли (0,1 мл) сыворотки реципиента. Содержимое пробирок перемешивают встряхиванием, после чего их помещают в водяную баню на 15 минут или термостат на 30 мин при температуре +46-48ºС. По истечению указанного времени в пробирки добавляют 5-8 мл физиологического раствора и перемешивают содержимое путем 1-2 кратного переворачивания пробирок. Результат учитывают рассматривая пробирки на свет. Агглютинация эритроцитов свидетельствует о том, что кровь реципиента и донора не совместимы, отсутствие агрегации является показателем совместимости крови донора и реципиента.
Проба на совместимость с применение 33% полиглюкина. В пробирку вносят 2 капли (0,1 мл) сыворотки реципиента, 1 каплю (0,05 мл) эритроцитов донора и добавляют 1 каплю (0,1 мл) 33% полиглюкина. Пробирку наклоняют до горизонтального положения слегка потряхивая, затем медленно вращают таким образом, чтобы содержимое ее растеклось по стенкам тонким слоем. Такое растекание содержимого делает реакцию более выраженной. Контакт эритроцитов с сывороткой больного при вращении пробирки следует продолжать не менее 3 минут. Через 3-5 минут в пробирку добавляют 2-3 мл физиологического раствора и перемешивают содержимое путем 2-3 кратного перевертывание пробирки не взбалтывания. Учет результатов проводят невооруженным глазом или через лупу. Агглютинация эритроцитов свидетельствует о том, что кровь реципиента и донора несовместимы, отсутствие агглютинации является показателем совместимости крови донора и реципиента.
Биологическая проба. Перед применением контейнер с трансфузионной средой (эритроцитарная масса или взвесь, свежезамороженная плазма, цельная кровь) извлекают из холодильника и выдерживают при комнатной температуре в течение 30 мин, а в экстренных случаях согревают в водяной бане при температуре 37ºС под контролем термометра. Техника проведения пробы заключается в следующем: одновременно переливают 10 мл трансфузионной среды со скоростью 2-3 мл (40-60 капель в минуту), затем переливание прекращают и в течение 3 минут наблюдают за реципиентом, контролируя у него пульс, артериальное давление, общее состояние, цвет кожи, измеряют температуру тела. Такую процедуру повторяют еще дважды. Появление озноба, боли в пояснице, чувства жара, стеснения в груди, головной боли, тошноты или рвоты свидетельствует о биологической несовместимости, требует немедленного прекращения трансфузии и отказа от переливания данной трансфузионной среды. При переливании крови или ее компонентов у пациентов, находящихся под наркозом о реакции или начинающихся осложнениях судят по немотивированному усилению кровоточивости в операционной ране, снижению артериального давления, учащению пульса, изменению цвета мочи при катетеризации мочевого пузыря, а также по результатам пробы на выявление раннего гемолиза. В таких случаях переливание трансфузионной среды прекращают, хирург и анестезиолог совместно с трансфузиологом обязаны выяснить причину гемодинамических нарушений. Если их причиной явилась трансфузия, то данная среда не переливается, а лечение пациента проводится в зависимости от имеющихся клинических и лабораторных данных.
Гемотрансфузионные (посттрансфузионные) реакции и осложнения. У некоторых больных вскоре после П. к. отмечаются гемотрансфузионные реакции, не сопровождающиеся серьезными длительными нарушениями функции органов и систем и не представляющие непосредственной опасности для жизни больного. В зависимости от выраженности клинических проявлений различают гемотрансфузионные реакции трех степеней: легкие, средней тяжести и тяжелые. Легкие гемотрансфузионные реакции характеризуются повышением температуры тела в пределах 1°, болями в мышцах конечностей, головной болью, познабливанием и недомоганием. Эти явления кратковременны; обычно для их купирования не требуется каких-либо специальных лечебных мероприятий. Реакции средней тяжести проявляются повышением температуры тела на 1,5—2°, нарастающим ознобом, учащением пульса и дыхания, иногда крапивницей. При тяжелых реакциях температура тела повышается более чем на 2°, наблюдаются сильный озноб, цианоз губ, рвота, сильная головная боль, боль в пояснице и костях, одышка, крапивница и отек Квинке.
В зависимости от причины возникновения и клинического течения выделяют пирогенные, аллергические, анафилактические реакции. Они появляются через 20—30 мин после трансфузии (иногда во время нее) и продолжаются от нескольких минут до нескольких часов. Пирогенные реакции могут быть следствием внесения пирогенов вместе с консервированной кровью и эритроцитной массой в кровяное русло реципиента. Они проявляются общим недомоганием, лихорадкой, ознобом, головной болью; в ряде случаев возможны циркуляторные нарушения. Аллергические реакции возникают в результате сенсибилизации реципиента к антигенам плазменных белков, различным иммуноглобулинам, а также к антигенам лейкоцитов, тромбоцитов при переливании цельной крови, плазмы. Они проявляются лихорадкой, одышкой, удушьем, тошнотой, рвотой. Анафилактические реакции обусловлены изосенсибилизацией, чаще к иммуноглобулинам класса А. Основную роль в их патогенезе играет реакция антиген — антитело. Эти реакции сопровождаются выделением биологически активных веществ, вызывающих повреждение сосудистой стенки с образованием отека, спазм мышц бронхов и резкое снижение АД. Клинически они характеризуются острыми вазомоторными расстройствами.
Для лечения пирогенных реакций применяют жаропонижающие, десенсибилизирующие и симптоматические средства; для ликвидации аллергических реакций назначают антигистаминные и десенсибилизирующие средства (димедрол, супрастин, хлорид кальция, кортикостероиды), сердечно-сосудистые препараты, промедол. Лечение анафилактических реакций комплексное и включает методы реанимации (при показаниях), поскольку исход зависит от быстроты и эффективности экстренной помощи. Внутривенно медленно вводят 60—90 мг преднизолона или 16—32 мг дексаметазона в 20 мл 40% раствора глюкозы. При отсутствии эффекта в течение 15—20 мин введение глюкокортикоидов повторяют. При тяжелом коллапсе показана трансфузия реополиглюкина. В случае необходимости применяют сердечные гликозиды: вводят в вену медленно (в течение 5 мин) 0,5—1 мл 0,05% раствора строфантина или 1 мл 0,06% раствора коргликона в 20 мл 5, 20 или 40% раствора глюкозы или изотонического раствора хлорида натрия, а также антигистаминные средства (2—3 мл 1% раствора димедрола, 1—2 мл 2% раствора супрастина или 2 мл 2,5% раствора дипразина).
Профилактика гемотрансфузионных реакций включает строгое выполнение всех условий и требований, предъявляемых к заготовке и переливанию консервированной крови и ее компонентов; правильную подготовку и обработку систем и аппаратуры для трансфузий, применение систем для П. к. одноразового пользования; учет состояния реципиента до гемотрансфузии, характер его заболевания, индивидуальные особенности и реактивность организма, выявление повышенной чувствительности к вводимым белкам, сенсибилизацию беременностями, повторными трансфузиями с образованием антилейкоцитарных, антитромбоцитарных антител, антител к плазменным белкам и др.
Клинически осложнение, вызванное переливанием крови или эритроцитной массы, несовместимой по групповым факторам системы АВ0, проявляется гемотрансфузионным шоком, который возникает в момент трансфузии или чаще в ближайшее время после нее. Характерны кратковременное возбуждение больного, боли в груди, животе, пояснице. В дальнейшем отмечаются тахикардия, артериальная гипотензия, развивается картина массивного внутрисосудистого гемолиза (гемоглобинемия, гемоглобинурия, билирубинемия, желтуха) и острого нарушения функции почек и печени. Если шок развивается во время оперативного вмешательства, происходящего под наркозом, появляется выраженная кровоточивость.
Клинические проявления осложнений, вызванных переливанием крови или эритроцитной массы, несовместимой по резус-фактору, в большинстве случаев такие же, как и после переливания цельной крови или эритроцитной массы, несовместимой по групповым факторам АВ0, но они, как правило, возникают несколько позднее, протекают менее выражение.
При развитии гемотрансфузионного шока следует прежде всего немедленно прекратить П. к. и приступить к проведению интенсивной терапии. Основные лечебные мероприятия должны быть направлены на восстановление и поддержание функции жизненно важных органов, купирование геморрагического синдрома, предупреждение острой почечной недостаточности.
Для купирования нарушений гемодинамики и микроциркуляции необходимо вводить плазмозамещающие растворы реологического действия (реополиглюкин), гепарин, свежезамороженную плазму, 10—20% раствор сывороточного альбумина, изотонический раствор хлорида натрия или раствор Рингера — Локка. При проведении указанных мероприятий в пределах 2—6 ч после переливания несовместимой крови обычно удается вывести больных из состояния гемотрансфузионного шока и предупредить развитие острой почечной недостаточности.
Лечебные мероприятия осуществляют в следующем порядке. Производят инъекции сердечно-сосудистых (0,5—1 мл коргликона в 20 мл 40% раствора глюкозы), спазмолитических (2 мл 2% раствора папаверина), антигистаминных (2—3 мл 1% раствора димедрола, 1—2 мл 2% раствора супрастина или 2 мл 2,5% раствора дипразина) средств и кортикостероидных препаратов (внутривенно 50—150 мг преднизолона гемисукцината). При необходимости введение кортикостероидных препаратов повторяют, в последующие 2—3 дня их дозу постепенно снижают. Помимо этого, осуществляют вливание реополиглюкина (400—800 мл), гемодеза (400 мл), 10—20% раствора сывороточного альбумина (200—300 мл), щелочных растворов (200—250 мл 5% раствора гидрокарбоната натрия, лактосол), а также изотонического раствора хлорида натрия или раствора Рингера — Локка (1000 мл). Кроме того, вводят фуросемид (лазикс) внутривенно (80—100 мг), затем внутримышечно через 2—4 ч по 40 мг (фуросемид рекомендуется сочетать с 2,4% раствором эуфиллина, который вводят по 10 мл 2 раза через 1 ч, затем по 5 мл через 2 ч), маннит в виде 15% раствора внутривенно по 200 мл, через 2 ч — еще 200 мл. При отсутствии эффекта и развитии анурии дальнейшее введение маннита и лазикса прекращают, т.к. оно опасно ввиду угрозы развития гипергидратации внеклеточного пространства в результате гиперволемии, отека легких. Поэтому чрезвычайно важно раннее проведение гемодиализа (показания к нему возникают через 12 ч после зафиксированного ошибочного П. к. при отсутствии эффекта от проводимой интенсивной терапии).
Профилактика гемотрансфузионного шока основывается на тщательном выполнении врачом, переливающим кровь или эритроцитную массу, правил инструкции по П. к. Непосредственно перед П. к. или эритроцитной массы врач обязан: определить групповую принадлежность крови больного и сверить результат с записью в истории болезни и с обозначением группы крови на флаконе; определить групповую принадлежность крови донора, взятой из флакона, и сверить результат с записью на этом флаконе; провести пробы на совместимость по группам крови АВ0 и резус-фактору
Гемотрансфузия Википедия
Гемотрансфузия (от др.-греч. αἷμα — кровь и от лат. transfusio — переливание) — переливание крови, частный случай трансфузии, при которой переливаемой от донора к реципиенту биологической жидкостью является кровь или её компоненты[1][2]. Этот процесс является одним из видов заместительной терапии. Наряду с замещающим и стимулирующим действием, повышает свёртываемость крови и обезвреживает токсические вещества.
Технология[ | ]
Один из первых аппаратов для переливания кровиПроизводится через вены (в острых случаях — через артерии) (также с использованием препаратов крови[3]) для замещения эритроцитов, лейкоцитов, белков плазмы крови, также для восстановления объёма циркулирующей крови, её осмотического давления при потере крови (для этих целей могут использоваться также заменители крови).
Кроме потери крови, показанием могут быть также аплазии кроветворения, ожоги, инфекции, отравления и другие.
Переливание может быть прямым и с предварительным сбором крови донора для хранения. Современный подход к переливанию крови состоит в компонентном переливании (плазма, эритроцитарная масса, лейкоцитарная масса, тромбоцитарная масса, отмытые эритроциты, тромбовзвесь, криопреципитат и другие более редкие компоненты).
При переливании непроверенной крови в кровь реципиента могут попадать возбудители болезней, имеющиеся у донора. В связи с этим в настоящее время широко используется метод карантинизации компонентов крови.
Кровь донора и реципиента должна быть совместима:
В ряде случаев при переливании учитывают наличие и других антигенов, например, Kell[4] и H.
Кровь переливают строго по совпадению группы крови и резус фактора, до 80-х годов XX века считалось, что первая группа крови с отрицательным резус-фактором является универсальной для всех групп, но с открытием агглютиногенов это мнение было признано неверным. Действительно, переливать можно только эритроциты (а не плазму, содержащую антитела) первой группы. Эритроциты 0 (Rh-) переливают в экстренных случаях всем.
На данный момент «универсальной» крови нет, хотя есть равноценный кровезаменитель[5] — т. н. «голубая кровь»[6][7]. При переливании обязательно соблюдаются группа крови и резус-фактор.
Эффективность[ | ]
Эритроциты[ | ]
Биоинженер М. Интаглиетта и др. (2007—2017 гг.) на основе экспериментального моделирования и теоретических расчётов сделали предположение, что положительные эффекты от инф
Гемотрансфузия - это... Что такое Гемотрансфузия?
Гемотрансфузия (от др.-греч. αἷμα — кровь и от лат. trasfusio — переливание) — переливание крови, частный случай трансфузии, при которой переливаемой от донора к реципиенту биологической жидкостью является кровь или её компоненты. [1][2] Переливание цельной крови можно обозначить как трансплантацию, так как кровь является соединительной тканью.[источник не указан 50 дней]
Технология
Аппарат для переливания кровиПроизводится через вены (в острых случаях — через артерии) (также с использованием препаратов крови[3]) для замещения эритроцитов, лейкоцитов, белков плазмы крови, также для остановки восстановления объёма циркулирующей крови, её осмотического давления при потере крови (для этих целей могут использоваться также заменители крови).
Кроме потери крови показанием могут быть также аплазии кроветворения, ожоги, инфекции, отравления и другие.
Переливание может быть прямым и с предварительным сбором крови донора для хранения. Современный подход к переливанию крови состоит в компонентном переливании (плазма, эритроцитарная масса, лейкоцитарная масса, тромбоцитарная масса, отмытые эритроциты, тромбовзвесь, криопреципитат и другие более редкие компоненты).
При переливании непроверенной крови в кровь реципиента могут попадать возбудители болезней, имеющиеся у донора. В связи с этим в настоящее время широко используется метод карантинизации компонентов крови.
Кровь донора и реципиента должна быть совместима:
В ряде случаев при переливании учитывают наличие и других антигенов, например, Kell[4].
Кровь переливают строго по совпадению группы крови и резус фактора, лет 30 назад считалось, что первая группа крови с отрицательным резус-фактором является универсальной для всех групп, но с открытием агглютиногенов это мнение было признано неверным.
На данный момент «универсальной» крови нет, хотя есть равноценный кровезаменитель[5] — т. н. «голубая кровь.»[6][7] При переливании обязательно соблюдаются группа крови и резус-фактор.
История
- 1628 г. — Английский врач Уильям Гарвей делает открытие о кровообращении в человеческом организме. Почти сразу после этого была предпринята первая попытка переливания крови.
- 1665 г. — Проведены первые официально зарегистрированные переливания крови: английский врач Ричард Лоуэр (англ. Richard Lower) успешно спасает жизни больных собак, переливая им кровь других собак.
- 1667 г. — Жан-Батист Дени (фр. Jean-Baptiste Denis) во Франции и Ричард Лоуэр в Англии независимо друг от друга делают записи об удачных переливаниях крови от овцы человеку. Но в последующие десять лет переливания от животных к людям были запрещены законом из-за тяжёлых отрицательных реакций.
- 1795 г. — В США американский врач Филипп Синг Физик (англ. Philip Syng Physick) проводит первую трансфузию крови от человека к человеку, хотя информацию об этом нигде не публикует.
- 1818 г. — Джеймс Бланделл (англ. James Blundell), британский акушер, проводит первое удачное переливание человеческой крови пациентке с послеродовым кровотечением. Используя в качестве донора мужа пациентки, Бланделл взял у него почти четыре унции крови из руки и с помощью шприца перелил женщине. С 1825 по 1830 год Бланделл провел 10 трансфузий, пять из которых помогли пациентам. Бланделл опубликовал свои результаты, а также изобрёл первые удобные инструменты для взятия и переливания крови.
- 1832 г. — петербургский акушер Андрей Мартынович Вольф впервые в России успешно перелил роженице с акушерским кровотечением кровь её мужа и тем самым спас ей жизнь. Для переливания крови Вольф использовал методику, разработанную Бланделлом.
- 1900 г. — Карл Ландштейнер (нем. Karl Landsteiner), австрийский врач, открывает первые три группы крови — A, В и С. Группа С будет потом заменена на О. За свои открытия Ландштейнер получил в 1930 году Нобелевскую премию.
- 1902 г. — Коллеги Ландштейнера Альфред де Кастелло (итал. Alfred Decastello) и Адриано Стурли (итал. Adriano Sturli) добавляют к списку групп крови четвертую — AB.
- 1907 г. — Гектоэн (Hektoen) делает предположение о том, что безопасность трансфузий может быть усовершенствована, если кровь донора и реципиента проверять на совместимость, чтобы избежать осложнений. Рубен Оттенберг (англ. Reuben Ottenberg) в Нью-Йорке проводит первое переливание крови с использованием метода перекрёстной совместимости. Оттенберг также заметил, что группа крови передаётся по наследству по принципу Менделя и отметил «универсальную» пригодность крови первой группы.
- 1912 г. — Роджер Ли, врач общественной больницы Массачусетса, вместе с Полом Дадли Вайтом внедряют в лабораторные исследования так называемое «время свертывания крови Ли-Вайта». Ещё одно важнейшее открытие делает Ли, опытным путём доказывая, что кровь первой группы может быть перелита пациентам с любой группой, а пациентам с четвёртой группой крови подходит любая другая группа крови. Таким образом, введены понятия «универсальный донор» и «универсальный реципиент».
- 1914 г. — Изобретены и введены в действие антикоагулянты долговременного действия, позволившие консервировать донорскую кровь, и среди них цитрат натрия.
- 1915 г. — В госпитале Маунт Синай в Нью-Йорке, Ричард Левисон впервые использует цитрат для замены прямого переливания крови на непрямое. Несмотря на всю значимость этого изобретения, цитрат ввели в массовое использование только через 10 лет.
- 1916 г. — Фрэнсис Рус и Д. Р. Турнер впервые используют раствор цитрата натрия и глюкозы, позволяющий хранить кровь в течение нескольких дней после донации. Кровь начинают хранить в закрытых контейнерах. В ходе Первой мировой войны Великобритания использует мобильную станцию переливания крови (создателем считается Освальд Робертсон).
Кровяной допинг
Аутогемотрансфузия (переливание реципиенту его же собственной крови) достаточно распространена в спорте, несмотря на то, что МОК и ВАДА приравнивают её к применению допинга. Она ускоряет доставку кислорода к мышцам, тем самым увеличивая их производительность[8].
Видео
- Голубая кровь Документальный фильм о разработках кровезаменителя Группы профессора Ф. Ф. Белоярцева
Литература
- Монографии
- Справочник фельдшера/Под редакцией профессора А. Н. Шабанова. — М.:"Медицина", 1976 год
- Аграненко В. А. и Скачилова Н. Н. Гемотрансфузионные реакции и осложнения, М., 1986;
- Гаврилов О. К., Очерки истории развития и применения переливания крови, Л., 1968;
- Островский А. Г., Карашуров Е. С. .Переливание крови, препаратов крови и кровезаменителей: Учебное пособие. — Петрозаводск.:Изд-во ПетрГУ, 2000. — 136 с: ил.(Табл. 5. Ил. 37. Библиогр.:19 назв.)
- Петров И. Р., Бондина В. А., Сенчило Е. А., Плазмозамещающие растворы при лечении кровопотери и шока, Л., 1969;
- Репина М. А. Кровотечения в акушерской практике, М., 1986;
- Руководство по общей и клинической трансфузиологии, под ред. Б. В. Петровского, М., 1979;
- Руководство по переливанию крови и кровезаменителей, М.,1965
- Свирко Ю. С. «ПАТОФИЗИОЛОГИЧЕСКИЕ АСПЕКТЫ ПРИМЕНЕНИЯ КРОВЕСБЕРЕГАЮЩИХ МЕТОДИК У КАРДИОХИРУРГИЧЕСКИХ ПАЦИЕНТОВ С ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА»: Автореф. … д-ра мед. наук. — Томск, 2008. — 44 с.
- Серов В. Н. и Макацария А. Д. Тромботические и геморрагические осложнения в акушерстве, М., 1987;
- Справочник «Домашний Доктор» Глава IV. Хирургические болезниПереливание крови и кровезаменителей
- Справочник по кровезаменителям и препаратам крови, под ред. А. И. Бурназяна, М., 1969.
- Справочник по переливанию крови и кровезаменителей, под ред. О. К. Гаврилова,М., 1982.
- Тихонов В. И., Попов О. С., Шпилевой П. К. Кровотечение. Переливание крови: Учебно-методическое пособие. — Томск.:Изд-во ТГУ, 2005. — 148 с.
- Филатов А. Н., Чаплыгина 3. А., Депп М. Е., Белковые гидролизаты, [Л.], 1968
- Чернуха Е. А. и Комиссарова Л. М. Ведение больных с кровотечением во время и после операции кесарева сечения, Акуш. и гинек., № 10, с. 18,1986.
- Специализированные печатные издания
- Публицистика
- Евгения Рябцева, Александр Чубенко. Кровное дело // интернет-журнал «Коммерческая биотехнология» «Популярная механика» № 6, 2007
- Ольга Скрипник. Кровный интерес или Проблемы переливания донорской крови.
- Законодательство
Примечания
См. также
Обменное переливание крови — Википедия
Обме́нное перелива́ние кро́ви — синхронная инфузия донорской крови при заборе крови реципиента.
Обменное переливание крови подразумевает удаление крови из кровеносного русла пациента с одновременным замещением её на кровь донора. Объём переливаемой донорской крови равен или же превышает количество эксфузируемой крови.
Обменное переливание крови выполняют через две вены реципиента: через одну из крупных вен или артерий (для предупреждения свертывания крови при длительной процедуре) кровь реципиента эксфузируется, а через другую вливается донорская. При этом скорость обменного переливания крови — в диапазоне 50—100 мл/мин.
Создатель метода А. Богданов был убеждён, что когда идеология переживает свою социально-трудовую основу, то становится реакционной, превращаясь в «мертвеца, который хватает живого». Абсолютный марксизм по Богданову проникает в ряды борцов, подобно вампиру и превращает вчерашних активистов в неоврагов развития пролетарской мысли. Он писал[1]:
Наше отечество — страна молодого рабочего движения, не укрепившейся культуры, страна мучительно-изнуряющей борьбы — дала этому призраку едва ли не лучшие его жертвы: Г. Плеханова ещё недавно, В. Ильина теперь, не считая иных, менее крупных сил, но в своё время также полезных для общего дела. Товарищей, попавших во власть злого призрака, мы пожалеем и постараемся вылечить, хотя бы суровыми средствами, если нельзя иначе. А с вампиром поступим так, как со всякими вампирами поступать полагается: голову долой, и осиновый кол в сердце!
Врач посвятил себя Пролеткульту, а Ленин относился к пролеткультовцам настороженно — Пролеткульт был реформирован. Но врач пошёл дальше, теоретически обосновал обменное переливание крови, опираясь на тектологию («всеобщую организационную науку»).
Методика Александра Богданова[править | править код]
В конце 1925 году Сталин предложил медику создать Институт переливания крови. Для этих целей отведён особняк купца Игумнова на Большой Якиманке (в котором позднее размещена резиденция французскому посла).
Перед медиками на самом деле ставилась идеологическая задача — связать узами прямого (кровного) родства всё прогрессивное человечество. Врачи ограничились экспериментами и решением конкретных медицинских задач (среди исцеленных — сын самого Богданова). Но основатели тектологии не смирился с отказом от пролетарских идей. Была сформирована спецгруппа пациентов, в которую входила и Мария Ульянова. Богдановская методика операция в идеале требовала участия пожилых и юных партнёров: опытные партийцы передавали бы революционную кровь подрастающему поколению, связывая поколения «кровными узами».
Оперируя тектологическими приёмами, Богданов предложил способ одолеть старость. В этом суть метода «обменное переливание крови»[2]:
Есть все основания полагать, что молодая кровь, с её материалами, взятыми из молодых тканей, способна помочь стареющему организму в его борьбе по тем линиям, по которым он уже терпит поражения, то есть по которым он именно «стареется»; в какой мере помочь, это, конечно, может выяснить только опыт. Оптимальная пара при переливании крови — старик и юноша. С одной стороны, старик вместе с молодой кровью получит «иммунитеты» — способность противостоять разным заражениям". С другой стороны, молодой организм тоже не должен пострадать: молодость будет справляться и с материалом ослабленной, ухудшенной крови, кроме, разве, случаев заражения; притом и в более старой или, вообще, худшей крови должны находиться все же и такие элементы для развития, которых в этой лучшей не было.
Ревизия учения[править | править код]
Ветераны партии при обменном переливании крови выполняли миссию идейно-кровяного донорства и, в свою очередь, «причащались» массам. Большевики тем самым получали шанс на победу в борьбе со старостью. Идея магического вампиризма, преобразилась у Богданова в эзотерическую доктрину, предполагающую укоренение общества будущего в «физиологическом коллективизме», где индивиды соединены цепью «кровавых» взаимообменов.
Богданов умер от очередного (одиннадцатого) обменного переливания крови. На его похоронах Бухарин отметил, что медик «был коллективистом и по чувству, и по разуму одновременно. Даже его идеи о переливании крови покоились на необходимости своеобразного физиологического коллективизма, где отдельные сочеловеки смыкаются в общую физиологическую цепь и повышают тем жизнеспособность всех вместе и каждого в отдельности»[3].
В 1930-х годах идеи Богданова объявлены антиленинскими. Оказалось, что «теория т. н. физиологического коллективизма и теория борьбы со старостью являются методологически ошибочными, чуждыми марксизму установками»[источник не указан 2588 дней].
Тем не менее, с медицинской точки обменное переливание крови оказалось небесполезным[4][неавторитетный источник?]. В современной практике для обменного переливания используют консервированную кровь. Для полноценного замещения крови требуется 10—15 л донорской крови[5]. Обменное переливание крови применяется:
- для лечения гемолитической болезни новорожденных[6],
- при интоксикациях,
- гемотрансфузионном шоке,
- острой почечной недостаточности.
Эффект основан на механическом удалении токсических метаболитов и на возмещении недостающих жизненно важных компонентов внутренней среды организма. Помимо этого производится т. н. деблокирование внутренних органов реципиента.
Синдром массивной гемотрансфузии - причины, симптомы, диагностика и лечение
Синдром массивной гемотрансфузии – это комплекс осложнений, возникающий вследствие переливания большого объема донорской крови. Клинические проявления включают затруднение дыхания, мышечные судороги, замедление сердцебиения, а также повышенную кровоточивость. Диагноз выставляется на основании симптоматики, лабораторных показателей (снижение pH крови и концентрации ионизированного кальция, изменения в коагулограмме), инструментальных данных (электрокардиографии, рентгенографии, КТ). Лечение осуществляется с помощью внутривенного введения глюконата кальция, ингибиторов протеолиза, переливания плазмы, тромбоконцентрата и криопреципитата.
Общие сведения
Синдром массивной гемотрансфузии (СМГ, синдром массивного кровевозмещения) – осложнение, развивающееся при переливании больному в течение 24 часов крови, количество которой превышает 50% ОЦК (2,5-3,5 литров). По сути, синдром обусловлен перегрузкой сердечно-сосудистой системы, реакцией организма реципиента на растворы, использующиеся при консервировании крови, и метаболиты, образующиеся в результате несоблюдения правил техники хранения крови. Также возможны гемолитические реакции. Развитие СМГ не зависит от возраста и половой принадлежности больного. Патология тяжелее протекает у детей и пожилых. Точные статистические данные о частоте синдрома отсутствуют.
Синдром массивной гемотрансфузии
Причины
Основной причиной синдрома массивной гемотрансфузии являются переливания больших объемов крови, потребность в которых возникает при геморрагическом шоке. Подобные лечебные мероприятия показаны при обильных кровотечениях после полученной травмы, при тяжелых гематологических патологиях (гемолитический криз, выраженная тромбоцитопения), требующих постоянной гемотрансфузии, когда для спасения жизни пациента необходимо быстро восполнить ОЦК.
К развитию синдрома предрасполагает множество факторов. К ним относится прием некоторых лекарственных препаратов (антикоагулянтов, калийсберегающих диуретиков, ингибиторов АПФ), глубокий и продолжительный дефицит витамина Д, сопровождающийся гипокальциемией. Усугублению тяжести синдрома способствуют имеющиеся хронические заболевания – сердечная, почечная и печеночная недостаточность, сахарный диабет.
Патогенез
Спектр патологических реакций при данном синдроме широк и многогранен. Переливание большого количества крови в течение короткого времени перегружает сердечно-сосудистую систему (ССС), что ведет к повышению гидростатического давления в сосудах, особенно в сосудах легких, пропотеванию жидкой части крови (плазмы) в просвет альвеол. В донорской крови, которая хранилась слишком долго, эритроциты начинают разрушаться. Из них высвобождается калий.
В результате переливания «старой» крови, особенно в большом объеме, у реципиента развивается гиперкалиемия. Высокий уровень калия ухудшает процессы автоматизма и проводимости в сердечной мышце, что приводит к брадикардии, атриовентрикулярным блокадам и даже остановке сердца. Использующийся при заготовлении донорской крови в качестве антикоагулянта цитрат натрия (соль лимонной кислоты) связывает ионы кальция.
Низкая концентрация кальция в плазме повышает возбудимость скелетных мышц. Развивается судорожный синдром. Гипокальциемия путем изменения мембранного потенциала клеток миокарда удлиняет интервал Q-T, что увеличивает риск пароксизмальной желудочковой тахикардии (ПЖТ). Сильно изменяется кислотно-щелочное равновесие. Из-за образования бикарбонатов из цитрата КЩР сдвигается в сторону метаболического алкалоза. Алкалоз значительно ослабляет тонус сосудов, снижает сердечный выброс, тем самым приводя к артериальной гипотензии, шоку.
Алкалоз также усугубляет гипокальциемию. Значительно страдает и система гемостаза. С одной стороны, алкалоз вызывает агрегацию тромбоцитов, и как следствие, микротромбообразование и нарушение микроциркуляции. С другой стороны, консервированная кровь обеднена факторами свертывания. Возникает коагулопатия разведения и потребления. Гипокальциемия вносит дополнительный вклад в ухудшение способности крови к свертыванию.
Классификация
Существует несколько разновидностей и форм синдрома массивной гемотрансфузии, однако они развиваются не по отдельности, а совместно друг с другом. Зачастую у одного больного могут обнаруживаться все формы синдрома МГ. В клинической практике различают следующие виды патологии:
- Цитратная интоксикация. Содержащийся в консервированной крови цитрат натрия связывается с ионами кальция.
- Калиевая интоксикация. При слишком длительном хранении донорской крови эритроциты постепенно разрушаются, высвобождая большое количество калия.
- ДВС-синдром. Отмечается сочетание микротромбозов с геморрагическим синдромом вследствие сложных метаболических сдвигов при массивных переливаниях.
- Респираторный дистресс-синдром. Определяется повреждение легочной ткани как результат микротромбообразования, перегрузки сосудистого русла легочной артерии.
- Гипотермия. Использование замороженной крови ведет к снижению температуры тела пациента с замедлением всех обменных процессов организма.
Симптомы
Клиническая картина крайне разнообразна. Кожа приобретает бледно-синюшный оттенок. Больной испытывает признаки артериальной гипотонии – головокружение, шум в ушах, предобморочное состояние. Сердцебиение обычно замедленное, нерегулярное, возможны приступы тахикардии с неприятными ощущениями в области сердца. Объемная перегрузка ССС приводит к появлению влажного кашля, затруднению дыхания, особенно в лежачем положении, ощущению тяжести в правом подреберье и отекам на ногах. Характерны запоры вследствие атонии кишечника.
Наблюдается кровоточивость мест инъекций и установки катетеров, носовые, десневые кровотечения. Кожа покрывается геморрагическими элементами. Из-за гипокальциемии мышцы по всему телу начинают непроизвольно болезненно сокращаться. Наиболее сильно спазму подвержены икроножные, жевательные мышцы, мышцы сгибателей кисти. Для тяжелой гипокальциемии типичны такие симптомы как «руки акушера», «сардоническая улыбка».
Может возникнуть спазм коронарных артерий, вызывающий ишемию миокарда, о чем свидетельствует сжимающая или жгучая боль за грудиной. Дети более чувствительны к низкому содержанию кальция в крови, у них нередко встречается опистотонус – спина резко выгнута, голова запрокинута назад, ноги вытянуты, руки согнуты в локтях и запястьях. Иногда у больных с синдромом массивной гемотрансфузии развивается припадок как при эпилепсии.
Осложнения
Для СМГ типично большое количество неблагоприятных последствий. Наиболее частыми тяжелыми осложнениями считаются отек легких, массивные внутренние кровотечения (желудочно-кишечные, внутричерепные). Глубокие электролитные сдвиги становятся причиной жизнеугрожающих нарушений ритма сердца. Гипокальциемия нередко приводит к желудочковой тахикардии, переходящей в фибрилляцию желудочков, а гиперкалиемия – к полной атриовентрикулярной блокаде, асистолии (остановке сердца).
При гипокальциемии может наступить смерть от асфиксии вследствие ларингоспазма, перекрывающего просвет верхних дыхательных путей. Выраженный алкалоз вызывает резкое падение артериального давления (коллапс). Переливания крови от разных доноров неизбежно повышают вероятность несовместимости по различным антигенам, при которой возникает гемолиз, гемотрансфузионный шок, острая почечная недостаточность.
Диагностика
Ведение пациентов с СМГ осуществляют анестезиологи-реаниматологи, врачи-трансфузиологи. Обычно постановка диагноза не вызывает затруднений, однако необходимы дополнительные лабораторные и инструментальные обследования для подтверждения метаболических нарушений, а также с целью дифференциальной диагностики. Назначаются следующие диагностические методики:
- Анализы крови. В общем анализе крови обнаруживается низкий уровень эритроцитов, гемоглобина, тромбоцитов. В биохимическом анализе крови выявляется высокая концентрация калия, уменьшение содержания ионизированного кальция, в коагулограмме – признаки гипокоагуляции (удлинение протромбинового времени, гипофибриногенемия). Исследование КЩС показывает высокий pH.
- Инструментальные исследования. На электрокардиограмме отмечается брадикардия, удлиненный интервал QT, иногда ПЖТ, АВ-блокады. На рентгенограммах ОГК визуализируется усиление сосудистого рисунка, диффузные двусторонние затемнения по типу матового стекла. При подозрении на внутреннее кровотечение проводится ФЭГДС, КТ головного мозга, органов брюшной полости.
Дифференциальный диагноз СМГ осуществляется с геморрагическими диатезами (иммунной тромбоцитопенией, тромботической тромбоцитопенической пурпурой). Развитие отека легких при гемотрансфузии требует исключения TRALI-синдрома (острого посттрансфузионного повреждения легких иммунной природы). При возникновении выраженной гипокальциемии необходима дифференциальная диагностика со столбняком, эпилепсией.
Лечение синдрома массивной гемотрансфузии
Поскольку переливания крови обычно осуществляются в отделении реанимации и интенсивной терапии, лечение СМГ проходит там же. Терапия синдрома многокомпонентная, проводится в основном с помощью консервативных методов. Все нарушения достаточно легко поддаются коррекции. Первым и обязательным звеном патогенетической терапии является прекращение переливания цельной крови. Это позволяет предотвратить дальнейшее ухудшение состояния больного. Далее в зависимости от конкретной формы СМГ применяются следующие способы воздействия:
- Борьба с артериальной гипотензией и шоком. Чтобы поднять давление до нормальных цифр, назначают коллоидные плазмозамещающие растворы (сывороточный альбумин) и кристаллоидные растворы без содержания калия (физиологический раствор NaCl, «дисоль»). Для усиления сократительной способности миокарда и повышения тонуса сосудов эффективны допамин, норадреналин.
- Коррекция алкалоза и электролитных нарушений. Гиперкалиемию и гипокальциемию можно купировать внутривенным введением глюконата или хлорида кальция. Для снижения концентрации калия путем перемещения его в клетки вводят глюкозу с инсулином. При крайне высокой гиперкалиемии необходим срочный гемодиализ. Чтобы сместить pH к физиологическим значениям, используют ацетазоламид.
- Нормализация системы гемостаза. Для восстановления свертывающей функции крови применяют компоненты крови гемостатического действия, а именно тромботический концентрат, а также плазму и криопреципитат, содержащие факторы свертывания. С целью подавления фибринолитической активности крови назначают ингибиторы протеолитических ферментов (апротинин). Для улучшения микроциркуляции используют пентоксифиллин.
Профилактика и прогноз
СМГ является тяжелой патологией с большим числом опасных осложнений, однако при своевременной диагностике и адекватном лечении можно добиться быстрой нормализации состояния больного. Наиболее частыми причинами летального исхода являются отек легких, обильные кровотечения при ДВС-синдроме. Для первичной профилактики СМГ рекомендуется низкая скорость гемотрансфузии. С целью предупреждения гипотермии донорскую кровь необходимо полностью размораживать и подогревать до 36-37° С. Непосредственно перед гемотрансфузией обязательно нужно определять концентрацию калия и кальция.
Гемотрансфузиология - это... Что такое Гемотрансфузиология?
раздел гематологии (См. Гематология), изучающий Переливание крови и её составных частей (компонентов). Использование крови с лечебной целью началось с попыток в древности и в средние века переливать кровь животных людям. В 1667 французский учёный Ж. Дени успешно перелил кровь ягнёнка анемизированному (малокровному) больному. Дальнейшие попытки переливания крови животных больным людям кончались смертельно, что повлекло за собой его запрещение в ряде стран. В 1819 английский акушёр Дж. Бланделл впервые перелил кровь человека человеку. В 1832 в России акушёр Г. С. Вольф, перелив человеческую кровь, спас жизнь больной, умиравшей от маточного кровотечения. «Трактат о переливании крови (как единственном средстве во многих случаях спасти угасающую жизнь), составленный в историческом, физиологическом и хирургическом отношении» (1848) А. М. Филомафитского был первым фундаментальным трудом по переливанию крови в России. Лишь с установлением групп крови (См. Группы крови) в 1901 австрийским учёным К. Ландштейнером и в 1907 чешским врачом Я. Янским, с введением в 1914 для консервирования крови лимоннокислого натрия переливание крови стало безопасным и началось его широкое применение. Открытие американским учёным А. Винером Резус-фактора сделало переливание крови ещё более безопасным. В Советской России в 1919 В. Н. Шамов первым провёл переливание крови с учётом групповой совместимости, а в 1921 Н. Н. Еланский приготовил стандартные сыворотки для определения группы крови. В 1926 в Москве А. А. Богдановым был создан первый в мире научный институт переливания крови. Разработку учения о переливании крови начали А. А. Богомолец, И. Р. Петров, С. И. Спасокукоцкий, М. П. Кончаловский, Х. Х. Владос и др. К 1932 было организовано три крупных научно-методических и организационных центра переливания крови — в Москве, Ленинграде и Харькове. В последующем сеть научных учреждений, разрабатывающих наиболее актуальные направления по проблемам переливания крови и гематологии, расширилась. Кроме специализированных институтов, вопросами Г. занимаются многочисленные станции переливания крови. Исследования по одному из основных вопросов — консервированию крови и её компонентов (эритроцитной, лейкоцитной массы, плазмы и др.) — проводили С. Д. Балаховский, Д. Н. Беленький, А. Д. Беляков, П. С. Васильев, ф. Р. Виноград-Финкель, С. Е. Северин, А. Е. Киселев, А. Н. Филатов и др. В результате этих исследований стало возможным удлинять сроки хранения биологически полноценной консервированной крови и её препаратов, применяя замораживание и ультрабыстрое замораживание. Значительные успехи достигнуты в области консервирования костного мозга (А. Г. Федотенков, С. С. Лаврик, Н. Г. Карташевский и др.). Важная проблема Г. — фракционирование (разделение белков крови). Полученные фракционированием белковые препараты (протеин, альбумин, фибриноген, фибринолизин, тромбин, гамма-глобулин и др.) используются в лечебной практике. Применение метода плазмофореза, заключающегося в разделении полученной от донора крови на плазму и форменные элементы и возвращении донору эритроцитов, позволяет получить за год 6—7 л плазмы от одного донора без вреда для его здоровья. Вопросам трансфузионной тактики в хирургии посвящены работы С. И. Спасокукоцкого, П. Л. Сельцовского, В. И. Казанского, А. В. Гуляева, Б. В. Петровского, Д. М. Гроздова и др. Гемотерапия получила применение в клинике внутренних и инфекционных болезней, в акушерстве и гинекологии и др. благодаря исследованиям А. А. Багдасарова, П. М. Альперина, М. С. Дульцина и др. Большое место в Г. занимают серологические исследования Н. И. Блинова, Н. В. Попова, М. А. Умновой и др. по изучению групп крови, формированию групповых факторов и способности организма больных к образованию антител.Актуальные в Г. проблемы заготовки и консервирования трупной (кадаверной) крови разработаны В. Н. Шамовым и С. С. Юдиным. Первый Международный конгресс по переливанию крови был созван в 1935 в Риме. Было основано Международное общество трансфузиологов, в работе которого активное участие принимают советские учёные, также объединённые в научное общество.
Лит.: Гаврилов О. К., Очерки истории развития и применения переливания крови, Л., 1968; Руководство по переливанию крови и кровезаменителей, [Л.], 1965.
А. М. Полянская.
Трансфузиология - это... Что такое Трансфузиология?
Трансфузиология (от лат. transfusio «переливание» и -логия от др.-греч. λέγω «говорю, сообщаю, рассказываю») — раздел медицины, изучающий вопросы трансфузии (смешения) биологических и заменяющих их жидкостей организмов, в частности крови и её компонентов, групп крови и групповых антигенов (изучается в гемотрансфузиология), лимфы, а также проблемы совместимости и несовместимости, пост-трансфузионных реакций, их профилактики и лечения.
История
- 1628 г. — Английский врач Уильям Гарвей делает открытие о кровообращении в человеческом организме. Почти сразу после этого была предпринята первая попытка переливания крови.
- 1665 г. — Проведены первые официально зарегистрированные переливания крови: английский врач Ричард Лоуэр (англ. Richard Lower) успешно спасает жизни больных собак, переливая им кровь других собак.
- 1667 г. — Жан-Батист Дени (фр. Jean-Baptiste Denis) во Франции и Ричард Лоуэр в Англии независимо друг от друга делают записи об удачных переливаниях крови от овцы человеку. Но в последующие десять лет переливания от животных к людям были запрещены законом из-за тяжёлых отрицательных реакций.
- 1795 г. — В США американский врач Филипп Синг Физик (англ. Philip Syng Physick) проводит первую трансфузию крови от человека к человеку, хотя информацию об этом нигде не публикует.
- 1818 г. — Джеймс Бланделл (англ. James Blundell), британский акушер, проводит первое удачное переливание человеческой крови пациентке с послеродовым кровотечением. Используя в качестве донора мужа пациентки, Бланделл взял у него почти четыре унции крови из руки и с помощью шприца перелил женщине. С 1825 по 1830 год Бланделл провел 10 трансфузий, пять из которых помогли пациентам. Бланделл опубликовал свои результаты, а также изобрёл первые удобные инструменты для взятия и переливания крови.
- 1832 г. — петербургский акушер Андрей Мартынович Вольф впервые в России успешно перелил роженице с акушерским кровотечением кровь её мужа и тем самым спас ей жизнь. Вольф использовал для переливания аппарат и методику, полученную им от пионера мировой трансфузиологии Джеймса Бланделла.
- 1840 г. — В колледже Святого Георгия (англ. St. George’s School) в Лондоне Самуэль Армстронг Лэйн (англ. Samuel Armstrong Lane) под руководством Бланделла проводит первое удачное переливание крови для лечения гемофилии.
- 1867 г. — английский хирург Джозеф Листер впервые использует антисептики для предотвращения инфицирования во время переливаний крови.
- 1873—1880 гг. — американские трансфузиологи пытаются использовать для переливаний молоко — коровье, козье и человеческое.
- 1884 г. — солевые растворы заменяют молоко при переливаниях, поскольку на молоко возникает слишком много реакций отторжения.
- 1900 г. — Карл Ландштейнер (нем. Karl Landsteiner), австрийский врач, открывает первые три группы крови — A, В и С. Группа С будет потом заменена на О. За свои открытия Ландштейнер получил в 1930 году Нобелевскую премию.
- 1902 г. — Коллеги Ландштейнера Альфред де Кастелло (итал. Alfred Decastello) и Адриано Стурли (итал. Adriano Sturli) добавляют к списку групп крови четвертую — AB.
- 1907 г. — Гектоэн (Hektoen) делает предположение о том, что безопасность трансфузий может быть усовершенствована, если кровь донора и реципиента проверять на совместимость, чтобы избежать осложнений. Рубен Оттенберг (англ. Reuben Ottenberg) в Нью-Йорке проводит первое переливание крови с использованием метода перекрёстной совместимости. Оттенберг также заметил, что группа крови передаётся по наследству по принципу Менделя и отметил «универсальную» пригодность крови первой группы.
- 1908 г. — Французский хирург Алексис Каррель (фр. Alexis Carrel) разработал способ предотвращения свёртываемости, пришивая вену реципиента прямо к артерии донора. Этот метод, известный как прямой метод, или анастомоз, до сих пор практикуется некоторыми врачами при пересадках, среди них Д. Б. Мерфи (англ. J.B. Murphy) в Чикаго и Джордж Криле (англ. George Crile) в Кливленде. Эта процедура показала свою непригодность при переливаниях крови, но развилась как способ трансплантации органов, и именно за неё Каррель получил Нобелевскую премию в 1912 году.
- 1908 г. — Мореши (Moreschi) описывает реакцию антиглобулина. Обычно, когда происходит реакция антиген-антитело, её нельзя увидеть. Антиглобулин — это прямой способ визуализации реакции антигена-антитела. Антиген и антитело реагируют друг с другом, затем, после удаления антител, не участвовавших в реакции, реагент антиглобулина добавляется и присоединяется между антителами, которые присоединены к антигену. Сформированный химический комплекс становится достаточно большим, чтобы его рассмотреть.
- 1912 г. — Роджер Ли, врач общественной больницы Массачусетса, вместе с Полом Дадли Вайтом внедряют в лабораторные исследования так называемое «время свертывания крови Ли-Вайта». Ещё одно важнейшее открытие делает Ли, опытным путём доказывая, что кровь первой группы может быть перелита пациентам с любой группой, а пациентам с четвёртой группой крови подходит любая другая группа крови. Таким образом, введены понятия «универсальный донор» и «универсальный реципиент».
- 1914 г. — Изобретены и введены в действие антикоагулянты долговременного действия, позволившие консервировать донорскую кровь, и среди них цитрат натрия.
- 1915 г. — В госпитале Маунт Синай в Нью-Йорке, Ричард Левисон впервые использует цитрат для замены прямого переливания крови на непрямое. Несмотря на всю значимость этого изобретения, цитрат ввели в массовое использование только через 10 лет.
- 1916 г. — Фрэнсис Рус и Д. Р. Турнер впервые используют раствор цитрата натрия и глюкозы, позволяющий хранить кровь в течение нескольких дней после донации. Кровь начинают хранить в закрытых контейнерах. В ходе Первой мировой войны Великобритания использует мобильную станцию переливания крови (создателем считается Освальд Робертсон).
Виды гемотрансфузии
Интраоперационная реинфузия
Интраоперационная реинфузия — метод, основанный на заборе крови, излившейся в полость (брюшную, грудную, полость малого таза) во время проведения оперативного вмешательства, и последующем отмывании эритроцитов и возвращении их в кровяное русло.
Аутогемотрансфузия
Аутогемотрансфузия — это метод, при котором пациент является для себя одновременно и донором, и реципиентом крови и её компонентов.
Гомологическая гемотрансфузия
Прямое переливание крови
Прямое переливание крови — это непосредственное переливание крови от донора к реципиенту без стабилизации и консервирования.
Непрямое переливание крови
Непрямое переливание крови — это основной метод гемотрансфузии. При таком методе используются стабилизаторы и консерванты (цитратный, цитратно-глюкозный, цитратно-глюкозофосфатный консерванты, аденин, инозин, пируват, гепарин, ионобменные смолы и др.), что дает возможность осуществлять заготовку компонентов крови в большом количестве, а также хранить её длительное время.
Обменное переливание крови
При обменном переливании крови выполняют одномоментно инфузию донорской крови с забором крови реципиента. Чаще всего такой метод применяется при гемолитической желтухе новорожденных, при массивном внутрисосудистом гемолизе и при тяжелых отравлениях.
Препараты крови
Компоненты крови
- Эритроцитная масса — компонент крови, состоящий из эритроцитов (70-80 %) и плазмы (20-30 %) с примесью лейкоцитов и тромбоцитов.
- Эритроцитная взвесь — фильтрированная эритроцитная масса (примесь лейкоцитов и тромбоцитов ниже, чем в эритроцитной массе) в ресуспензирующем растворе.
- Эритроцитная масса, отмытая от лейкоцитов и тромбоцитов (ЭМОЛТ) — трёх- и более кратно отмытые эритроциты. Срок годности не более 1 суток.
- Размороженные отмытые эритроциты — эритроциты, подвергшиеся криоконсервации в глицерине при температуре -195°С. В замороженном состоянии срок годности не ограничен, после разморозки — не более 1 суток (повторная криоконсервация не допускается).
- Лейкоцитная масса (ЛМ) представляет собой трансфузионную среду с большим содержанием лейкоцитов.
- Тромбоцитарная масса — суспензия (взвесь) жизнеспособных и гемостатически активных тромбоцитов в плазме. Её получают из свежей крови методом тромбоцитофереза. Срок хранения — 24 часа, а в тромбомиксере — 5 суток.[источник не указан 654 дня]
- Плазма — жидкая составляющая крови, получаемая путем её центрифугирования и отстаивания. Применяют нативную (жидкую), сухую и свежезамороженную плазму. При переливании плазмы не учитывается резус-фактор (Rh).
Препараты крови комплексного действия
К препаратам комплексного действия относят плазму и растворы альбумина; они оказывают одновременно гемодинамическое, противошоковое действие. Наибольший эффект вызывает свежезамороженная плазма ввиду практически полной сохранности ее функций. Другие виды плазмы — нативная (жидкая), лиофилизированная (сухая) — в значительной мере теряют лечебные свойства в процессе изготовления, и их клиническое использование менее эффективно. Свежезамороженную плазму получают методом плазмафареза (см. Плазмаферез, цитаферез) или центрифугирования цельной крови с быстрым последующим замораживанием (в первые 1—2 ч с момента взятия крови у донора). Она может храниться до 1 года при 1°—25° и ниже. В течение этого времени в ней сохраняются все факторы свертывания крови, антикоагулянты, компоненты системы фибринолиза. Непосредственно перед переливанием свежезамороженную оттаивают в воде при t° 35—37° (для ускорения оттаивания плазмы пластикатный мешок, в котором она заморожена, можно разминать в теплой воде руками). Переливать плазму следует сразу после согревания в течение первого часа в соответствии с прилагаемой инструкцией по применению. В оттаявшей плазме могут появиться хлопья фибрина, что не препятствует переливанию ее через стандартные пластикатные системы, имеющие фильтры. Значительное помутнение, наличие массивных сгустков свидетельствуют о недоброкачественности плазмы: в этом случае переливать ее нельзя.
Корректоры системы гемостаза
Препараты иммунологического действия
Кровезамещающие растворы
Препараты гемодинамического действия
Данные препараты служат для восполнения объёма циркулирующей крови (ОЦК), обладают стойким волемическим эффектом, удерживают воду в сосудистом русле за счёт осмотического давления. Объёмный эффект 100—140 % (1000 мл введённого раствора восполняет ОЦК на 1000—1400 мл), объёмное действие от трёх часов до двух суток. Выделяют 4 группы:
- альбумин (5 %, 10 %, 20 %)
- препараты на основе желатина (Желатиноль, Гелофузин)
- декстраны (Полиглюкин, Реополиглюкин)
- гидроксиэтилкрахмалы (Стабизол, Гемохес, Рефортан, Инфукол, Волювен)
Кристаллоиды
Различаются по содержанию электролитов. Объёмный эффект 20-30 % (1000 мл введённого раствора восполняет ОЦК на 200—300 мл), объёмное действие 20-30 минут. Наиболее известные кристаллоиды — физиологический раствор, раствор Рингера, раствор Рингера-Локка, Трисоль, Ацесоль, Хлосоль, Ионостерил.
Кровезаменители дезинтоксикационного действия
Препараты на основе поливинилпиралидона (Гемодез, Неогемодез, Перистон, Неокомпенсан).
Переносчики кислорода
Осложнения при переливании крови
Синдром тканевой несовместимости
Синдром тканевой несовместимости развивается при несовместимости крови донора и реципиента по одной из иммунных систем в результате реакции организма реципиента на вводимый чужеродный белок.
Синдром гомологической крови
Синдром гомологической крови характеризуется нарушением микроциркуляции и транскапиллярного обмена в результате повышения вязкости крови и закупорки капиллярного русла микроагрегатами тромбоцитов и эритроцитов.
Синдром массивных переливаний крови
Синдром массивных переливаний крови возникает при объёме переливаемой крови, превышающем 50 % ОЦК.
Трансмиссионный синдром
Трансмиссионный синдром характеризуется переносом болезнетворных факторов от донора к реципиенту.
Интересные факты
Ричард Лоуэр является одним из главных героев книги Йена Пирса «Перст указующий».