Антифосфолипидный синдром диагностика
Антифосфолипидный синдром: диагностика и лечение
Антифосфолипидный синдром, имеющий также сокращенное название АФС, впервые был описан всего лишь около сорока лет назад лондонским врачом Грэмом Хьюзом. Иногда АФС называют синдром Хьюза (или Хьюджа – в зависимости от перевода фамилии).
Патология связана с аутоиммунными процессами, которые не всегда поддаются адекватной регулировке. В чем же опасность антифосфолипидного синдрома? В повышении тромбообразования в сосудах (как в венозных, так и в артериальных). Сами понимаете, чем грозят тромбы.
Еще одна особенность синдрома – чаще всего этой патологии подвержены женщины. И особенно это касается репродуктивного возраста (20 – 40 лет). Повышенное тромбообразование негативным образом влияет на процесс беременности, в состоянии спровоцировать его преждевременное прекращение с гибелью плода в итоге.
Содержание статьи
Антифосфолипидный синдром. Что это?
Антифосфолипидный синдром – это аутоиммунный патологический процесс, при котором отмечается синтез антител к фосфолипидам. При этом аутоиммунные реакции ведут к следующим явлениям:- Нарушение системы гемостаза.
- Агрегация (склеивание) тромбоцитов.
- Изменения стенок сосудов.
- Закупорка сосудов различного калибра.
Считается, что АФС – это ведущая причина иммунной тромбофилии и основа тяжелой акушерской патологии.
Главной мишенью при антифосфолипидном синдроме являются фосфолипиды – одни из основных компонентов мембран клеток крови, сосудов, нервной ткани. Также они отвечают за транспорт жирных кислот, жиров, холестерина.
Те фосфолипиды, которые локализованы в клеточных мембранах занимают важное место в процессе свертывания крови. Такие фосфолипиды выступают как антигены. Они отличны по своему строению и способности формировать иммунный ответ, что разделяет их на две основные, наиболее часто встречающиеся, группы:
- Нейтральные.
- Анионные (отрицательно заряженные).
К таким клеточным и тканевым компонентам при сбое иммунного ответа вырабатываются антифосфолипидные антитела (АФЛА) – это серологические маркеры антифосфолипидного синдрома, которые являются гетерогенной группой антител, которые между собой различаются по специфичности.
Исходя из методов определения, выделяют два основных вида антител:
- Волчаночный антикоагулянт, который идентифицируется фосфолипидзависимыми коагуляционными тестами. Представлен иммуноглобулинами G или М.
- Антитела, которые вырабатываются к:
- Кардиолипину – представлены иммуноглобулинами классов G, M, А.
- Фосфатидилсерину.
- Фосфатидилхолину.
- Фосфатидилэтаноламину.
- Фосфатидиловой кислоте.
- Бета-2 гликопротеину – 1.
- Аннексину V.
- Протромбину.
Такой диагноз, как АФС и его выявление, характеризуются постепенным ростом среди населения, что указывает, несмотря на современные методы лечения, на тяжесть патологии.
Насколько часто встречается
Истинный АФС не является распространенным явлением. Точные данные о эпидемиологии указанного заболевания предоставить не представляется возможным, так как основные антитела – волчаночный антикоагулянт и антитела к кардиолипину встречаются у здорового населения, при воздействии различных причин.
Ориентировочно оценить количество случаев антифосфолипидного синдрома можно по таким показателям:
- Кардиолипиновые антитела у здоровых людей обнаруживаются до 4% населения.
- Волчаночный антикоагулянт также может находиться в сыворотке крови у абсолютно здорового человека.
- В таких ситуациях, как, прием психотропных препаратов, оральных контрацептивов, наличие ВИЧ – инфекции, гепатитов, онкологической патологии, АФЛА могут присутствовать в крови, но это не говорит о наличии антифосфолипидного синдрома.
- Среди всех пациентов, у которых диагностирован АФС, до 50% случаев составляет первичный антифосфолипидный синдром.
- У женщин с акушерской патологией, которая сопровождается спонтанными абортами, невынашиванием АФС диагностируется до 42% случаев.
- При установленном антифосфолипидном синдроме у женщин репродуктивного возраста частота патологии зачатия, беременности, мертворождения достигает 90%.
- У женщин до 50 лет, у которых развился инсульт, в 40% подтверждается связь с наличием антифосфолипидных антител.
- При наличии венозных тромбозов антифосфолипидные антитела выявляются в 10% случаев.
В целом, вторичный антифосфолипидный синдром до 9 раз чаще диагностируется у женщин, так как они более подвержены развитию болезней соединительной ткани.
Важно! К сожалению, последние эпидемиологические данные не радуют, так как еще несколько лет назад по приблизительным подсчетам частота АФС не превышала 5%. Сейчас этот показатель уверенно приближается к 10%.
Одним из факторов успеха в лечении указанного заболевания является правильное классифицирование найденной патологии, что в дальнейшем позволит подобрать правильную тактику ведения пациента.
Классификация
По причине возникновения АФС бывает:- Первичный антифосфолипидный синдром.
- Вторичный, который возникает в следующих случаях:
- Аутоиммунная патология.
- Ревматические заболевания.
- Злокачественные опухоли.
- Инфекционные факторы.
- Прочие причины.
Среди прочих форм различают:
- Катастрофический – отличается внезапным началом, стремительной недостаточностью органов и систем вследствие массивных тромбозов.
- Микроангиопатии типа тромбоцитопенической, тромботической пурпуры, гемолитико – уремического синдрома (характеризуется тремя ведущими признаками – тромбоцитопения, гемолитическая анемия, острая недостаточность функции почек), HELLP – синдром (осложнение при нормальной беременности во 2 и 3 триместрах с развитием тяжелых гемолиза, поражения печени, тромбоцитопении, тромбозов).
- Гипотромбинемия.
- ДВС – синдром.
- Комбинации антифосфолипидного синдрома с васкулитами.
- Синдром Снеддона – сосудистая патология невоспалительного генеза, при которой отмечаются рецидивирующие тромбозы сосудов головы, сетчатое ливедо, артериальная гипертензия.
В зависимости от серологических данных выделяют разновидности АФС:
- Серопозитивный – определяются антикардиолипиновые антитела с/без волчаночного антикоагулянта.
- Серонегативный:
- Антитела к фосфолипидам, которые взаимодействуют с фосфатидилхолином, определяются.
- Анитела к фосфолипидам, которые взаимодействуют с фосфатидилэтаноламином.
Все указанные выше патологические состояния имеют свои причины, определение которых крайне важно для понимания возникшей ситуации и того, что врачу и пациенту предпринимать далее.
Причины развития
Этиологические факторы АФС до сих пор изучены недостаточно. Основными предположительными причинами развития антифосфолипидного синдрома в настоящее время считаются:
- Аутоиммунные процессы.
- Бактериальные инфекции.
- Вирусные возбудители.
- Генетическая предрасположенность.
- Онкологические болезни.
- Поражения центральной нервной системы.
- Длительное лечение интерферонами, препаратами ряда изониазида, гидралазина, оральными контрацептивами, различными психотропными средствами.
Любая из указанных причин запускает в организме ряд патологических изменений, которые неизбежно ведут к тромбозам и мультиорганному поражению.
Механизмы развития
Как и причины, так и механизмы развития АФС изучены недостаточно. Но, согласно заключениям многих исследователей, один синтез анитифосфолипидных антител не может приводить к значимой патологии системы гемостаза.
Поэтому в настоящее время существует теория «двойного удара», суть которой заключается в:
- Повышенные уровни антифосфолипидных антител создают условия для развития патологических процессов свертывания – это, так называемый, первый удар.
- Под воздействием медиаторов запускается формирование тромба и тромбозов, что еще более усугубляет активацию реакций свертывания крови, которая предварительно была вызвана АФЛА, что является вторым ударом.
При этом антифосфолипидные антитела образуют комплексы с белками системы свертывания, которые высокочувствительны к расположенным на клеточных мембранах фосфолипидам.
Это приводит к не только нарушению функций фосфолипидов, но и также к потере способности указанных белков обеспечить нормальный процесс коагуляции. Это, в свою очередь, ведет к дальнейшим «сбоям» – АФЛА способны вызывать внутриклеточный сигнал, который ведет к трансформации функций клеток-мишеней.
Важно! Антифосфолипидные антитела поражают не только фосфолипиды, а также белки, принимающие участие в процессах свертывания крови. Это влечет за собой сбой в процессах свертывания крови. Более того, АФЛА «подают» сигнал внутрь клеток, который приводит к поражению органов-мишеней.
Именно так запускается процесс образования тромбозов сосудов артериального и венозного русла – патогенетической основы антифосфолипидного синдрома, при котором ведущие механизмы следующие:
- Для обеспечения нормальных антикоагуляционных процессов необходимо полноценное функционирование белка С и S. АФЛА обладают способностью подавлять функции этих белков, что обеспечивает беспрепятственное образование тромбов.
- При уже развившихся тромбозах сосудов наблюдается нарушение между факторами, которые обеспечивают сужение и расширение сосудов.
- Усиленная выработка и повышение концентрации основного вазоконстриктора ТхА2 приводит к активации других сосудосуживающих компонентов и веществ, которые вызывают свертывание крови. Одним из ведущих таких компонентов является эндотелин – 1.
Таким образом, от начала развития заболевания и до появления первых клинических признаков антифосфолипидного синдрома появляются следующие патологические реакции:
- Антифосфолипидные антитела повреждают клетки эндотелия сосудов. При этом снижается выработка простациклина, который расширяет сосуды и не позволяет тромбоцитам склеиваться.
- Происходит ингибирование деятельности тромбомодулина – белка, который оказывает антитромботическое действие.
- Происходит торможение синтеза факторов свертывания, начало выработки, высвобождение веществ, которые приводят к тромбоцитарному склеиванию.
- Взаимодейтствие антител с тромбоцитами еще больше стимулирует образование веществ, которые также приводят к их агрегации и последующей гибели тромбоцитов с развитием тромбоцитопении.
- В крови постепенно понижается уровень антикоагулянтных агентов и ослабляется действие гепарина.
- Результатом этого становится появление высокой вязкости крови, в сосудах любого калибра и любой локализации образуются тромбы, развивается органная гипоксия, развиваются клинические симптомы.
Такие реакции на разных этапах ведут к клиническим проявлениям антифосфолипидного синдрома.
Симптомы АФС
Широта симптоматики при АФС очень разнообразна, так как поражаются абсолютно все виды сосудов – артерии и вены.Наиболее частыми, присущими только антифосфолипидному синдрому признаками, являются:
- Тромбозы сосудов.
- Акушерская патология.
В зависимости от вида тромбозов и развиваются симптомы заболевания:
- Венозные – наиболее частый вид АФС, особенно патология нижних конечностей. С такого признака очень часто начинается заболевание. Практически у 50% пациентов диагностируется тромбоэмболии легочных артерий. Реже регистрируются патологические процессы в портальных, поверхностных, почечных сосудах. Важно, что антифосфолипидный синдром занимает второе место в причинах развития синдрома Бадда-Киари, при котором происходит обструкция вен печени, ведущая к нарушению оттока крови и венозному застою.
- Артериальные – диагностируются реже венозных. Основное проявление такого процесса – это развитие нарушений периферического кровообращения, ишемии, инфарктов. Самой частой локализацией такой патологии являются мозговые, немного реже – коронарные.
Одной из особенностей антифософлипидного синдрома является высокий риск рецидивов всех видов тромбозов.
Так как симптоматика АФС многообразна, легче будет представить ее в виде поражений отдельных систем:
- Поражение ЦНС – наиболее частое и опасное проявление анифосфолипидного синдрома. Проявляется развитием следующих патологий:
- Транизиторные ишемические атаки и энцефалопатии.
- Ишемические инсульты.
- Эпилептический синдром.
- Хорея.
- Рассеянный склероз.
- Мигрень.
- Миелиты.
- Внутричерепная гипертензия.
- Транзиторная амнезия.
- Тугоухость.
- Гипертонус по типу паркинсонического.
- Нарушения зрения вплоть до полной потери.
- Психозы.
- Деменция.
- Депрессия.
- Поражения сердечно – сосудистой системы, которые проявляются в виде:
- Тромбозы крупных коронарных артерий.
- Инфаркт миокарда.
- Внутрисердечные тромбозы.
- Повторное стенозирование после аорто-коронарного шунтирования и чрескожной ангиопластики.
- Недостаточность/стеноз любого из клапанов сердца.
- Фиброз, утолщение, кальциноз створок клапанов.
- Ишемическая кардиомиопатия.
- Артериальная гипертензия.
- Легочная гипертензия.
- Синдром дуги аорты.
- Атеросклероз.
- Поражение почек:
- Бессимптомная протеинурия.
- Нефротический синдром.
- Острая почечная недостаточность.
- Ренальная гипертензия.
- Почечная недостаточность.
- Гематурия.
- Инфаркт почки.
- Легочные поражения:
- Эмболии.
- Инфаркт легких.
- Легочная гипертензия.
- Острый респираторный дистресс – синдром взрослых.
- Кровоизлияния внутри альвеол.
- Тромбозы сосудов различного уровня.
- Фиброзирующий альвеолит.
- Послеродовый кардиопульмональный синдром, основными признаками которого являются плеврит, одышка, повышение температуры тела, развитие инфильтратов в легких.
- Устойчивое поражение легочных сосудов невоспалительного генеза.
- Поражение пищеварительного тракта:
- Ишемические, некротические поражения любых отделов органов пищеварения, которые приводят к развитию кровотечений.
- Боли в животе.
- Некроз, перфорация пищевода.
- Нехарактерные, большие язвенные очаги желудка и 12-перстной кишки.
- Острый холецистит.
- Окклюзионные процессы селезенки с преимущественным поражением вен.
- Поражение надпочечников:
- Двусторонний геморрагический инфаркт.
- Тромбоэмболия сосудов.
- Поражения печени:
- Синдром Бадда–Киари.
- Портальная гипертензия.
- Печеночная вено–окклюзионная болезнь.
- Узловая гиперплазия печени.
- Инфаркты печени, преимущественно во время беременности.
- Гепатит.
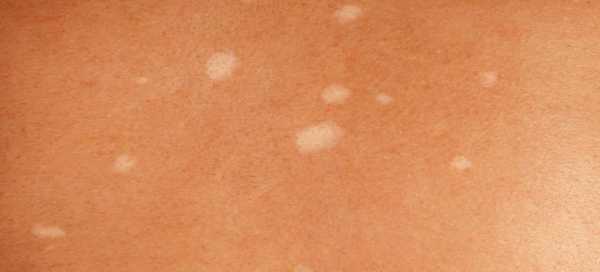
- Поражение кожи:
- Сетчатое ливедо.
- Язвы различного размера.
- Пурпура.
- Пустулы.
- Ладонная, подошвенная эритема.
- Узелки.
- Гангрена пальцев рук, ног.
- Поверхностные некрозы кожи.
- Кровоизлияния в ногтевое ложе.
- Тромбофлебиты подкожных вен.
- Атрофические папулоподобные поражения.
- Поражение костей:
- Асептические некрозы.
- Нарушения со стороны крови:
- Тромбоцитопения.
- Катастрофический АФС:
- Стремительное развитие смертельной полиорганной недостаточности.
- Массивные тромбозы как вен, так и артерий.
- Быстрое развитие дистресс – синдрома.
- Нарушения мозгового кровообращения.
- Ступор.
- Нарушение ориентации во времени и пространстве.
Указанные признаки антифосфолипидного синдрома могут развиваться на любом этапе, часто без каких-либо видимых причин, когда пациент еще не знает о своей болезни.
Важно. Особую категорию составляют беременные женщины, для которых антифосфолипидный синдром и развитие тромбозов, к сожалению, оставляет мало шансов на материнство.
АФС синдром и беременность
Усиленная выработка антифосфолипидных антител во время беременности приводит к развитию нескольких видов патологии:
- Внутриутробная гибель плода на сроках после 10й недели беременности, что приводит к привычному невынашиванию.
- Ранняя преэклампсия и эклампсия тяжелой степени.
- Плацентарная ишемия.
- Фетоплацентарная недостаточность.
- Задержка роста плода, аритмия у плода.
- Развитие трех и более необъяснимых спонтанных выкидыша до 10й недели беременности.
- Тромбозы вен и артерий у матери.
- Внутриутробная гибель плода.
- Артериальная гипертензия.
- Хорея.
- Hellp – синдром.
- Ранняя отслойка плаценты.
- Мертворождение.
- Неудачное проведение ЭКО.
Очень важно! У ребенка, который родился у матери, страдающей АФС, уже с первых дней жизни возможно развитие тромбозов различной локализции, что подтверждает генетическую предрасположенность антифосфолипидного синдрома. Такие дети больше подвержены риску развитию аутизма, дисциркуляторных расстройств.
Антифосфолипидный синдром у детей
Дети также подвержены риску развития у них АФС. В педиатрии частота заболеваемости реже, чем у взрослого населения, но опасность состоит в том, что в детском возрасте АФС протекает более стремительно и агрессивно.Справочно. Клинические проявления, диагностика и тактика лечения у детей такие же, как и у взрослых.
Антифосфолипидный синдром у мужчин
Такое заболевание менее характерно для мужчин. Основные различия при этом возникают при системной красной волчанке, так как в патогенезе указанной патологии одно из мест занимают половые гормоны. При этом практически у половины мужчин достаточно быстро развиваются гематологические нарушения.
Справочно. Более чем в 65% случаев у лиц мужского пола наблюдаются нервно – психические расстройства.
Такое тяжелое заболевание требует своевременной, качественной диагностики, так как любое промедление может привести к летальному исходу.
Диагностика АФС
Для того, чтобы определить АФС у пациента необходим полный спектр обследований, так как, только обнаружение АФЛА не говорит о наличии заболевания:
- Сбор анамнеза.
- Физикальное обследование.
- Лабораторная диагностика, основой которой является определение волчаночного антикоагулянта, титров антифосфолипидных антител, антикардиолипиновых антител. Также проводится скрининговая диагностика с исследованием АЧТВ, тест Рассела, время свертывания плазмы, протромбиновое время. Важное место в диагностике занимают определение гомоцистеина, антител к бета2-гликопротеину-1, МНО.
- Инструментальная диагностика состоит в проведении ультразвукового допплеровского исследования сосудов, Эхо-КГ, радиоизотопная сцинтиграфия легких, ЭКГ, катетеризация сердца, коронарная ангиография, МРТ, КТ.
Важно, что у каждой женщины во время беременности должен быть исключен АФС. При подозрении на него требуется провести:
- Исследование свертывающей системы крови.
- Эхо-КГ.
- Исследование сосудов головы, шеи, почек, нижних конечностей, глаз.
- УЗИ плода.
- Допплерография маточно-плацентарного кровотока.
Для определения антифосфолипипдного синдрома определены специальные критерии, благодаря подтверждению или исключению которых решается окончательный вопрос о диагнозе.
Клинические критерии АФС:
- Тромбоз сосудов – один или более эпизодов тромбоза любого сосуда, локализации. Такое состояние должно быть зафиксировано инструментально или морфологически.
- Патология при беременности:
- Один или более случаев внутриутробной гибели нормального здорового плода после 10й недели.
- Один или более случаев преждевременных родов здорового плода до 34 недели по причине тяжелой преэклампсии/эклампсии/плацентарной недостаточности.
- Три и более случаев спонтанного выкидыша до 10 недели при отсутствии видимых причин.
Лабораторные критерии АФС:
- Определение в сыворотке крови как минимум дважды в течение 12 недель антикардиолипиновых антител IgG или IgM, бета-2 гликопротеина-1 в средних или высоких концентрациях.
- Определение волчаночного антикоагулянта в двух или более анализах в течение 12 недель.
- Удлиненное время свертывания плазмы в фосфолипид-зависимых тестах: АЧТВ, протромбиновое время, тесты Рассела, КВС.
- Отсутствие коррекции удлинения свертывающего времени в тестах с донорской плазмой.
- Укорочение или коррекция при добавлении фосфолипидов.
Для постановки диагноза требуется один клинический признак и один лабораторный.
Справочно. Исключается антифосфолипидный синдром, если до 12 недель или более 5 лет определяются различные уровни антифосфолипидных антител без проявления клинической симптоматики или есть клинические проявления, но без наличия антифосфолипидных антител.
И только после этого необходимо переходить к определению тактики ведения пациентов.
Лечение АФС
Общими подходами к лечению АФС считаются:- Взрослые и дети:
- Антикоагулянты – гепарин с последующим переводом на варфарин при контроле МНО.
- Антиагреганты – аспирин.
- Иммунодепрессанты – гидроксихлорохин.
- Симптоматическое лечение.
- Женщины при беременности:
- Антикоагулянты.
- Антиагреганты.
- Глюкокортикосетроиды (если АФС сочетается с системной красной волчанкой).
- Плазмаферез.
- Иммуноглобулины.
- Иммунодепрессанты.
В настоящее время начинают применять новые лекарственные препараты, которые являются антикоагулянтами с селективной точкой приложения на факторы свертывания крови. Такие средства более эффективны в лечении и предупреждении тромбозов, чем гепарины и варфарин, а также более безопасными.
Справочно. Основной целью лечения антифосфолипидного синдрома является профилактика и препятствие тромбозов и их осложнений.
Признаками антифосфолипидного синдрома являются спонтанность, непредсказуемость. На сегодня, к сожалению, универсальные методы лечения не представлены, нет четкого понимания этиологических факторов заболевания и его патогенеза. На данном этапе все «ориентировочно, предположительно, может быть».
Надежду на успех в лечении вселяют появление новых лекарственных средств, постоянные исследования о причинах заболевания с возможностью синтезировать препараты для этиологического лечения антифосфолипидного синдрома.
Видео: Лекции по АФС
Антифосфолипидный синдром: клинические аспекты | Клюквина Н.Г.
ММА имени И.М. Сеченова
Антитела к фосфолипидам (аФЛ) – гетерогенная популяция аутоантител, реагирующих с отрицательно заряженными, реже нейтральными фосфолипидами и (или) фосфолипидсвязывающими сывороточными белками. Внедрение радиоиммунологического, а затем и иммуноферментного метода определения антител к кардиолипинам (аКЛ) способствовало более глубокому пониманию роли аФЛ при заболеваниях человека. Оказалось, что аФЛ являются серологическим маркером своеобразного симптомокомплекса, включающего венозные и/или артериальные тромбозы, различные формы акушерской патологии (в первую очередь привычное невынашивание беременности), тромбоцитопению, а также разнообразные неврологические, кожные, сердечно–сосудистые и гематологические нарушения [1]. Начиная с 1986 года, этот симптомокомплекс стали обозначать, как антифосфолипидный синдром (АФС) [2], а в 1994 году на международном симпозиуме по аФЛ было предложено называть АФС синдромом Hughes – по имени английского ревматолога, впервые описавшего его и внесшего наибольший вклад в изучение этой проблемы [3]. Несмотря на достаточной большой период времени, прошедший с момента описания АФС, до сих пор у практических врачей нередко возникают трудности при постановке диагноза, дифференциальной диагностике и лечении данного синдрома.
АФС вначале был описан, как вариант системной красной волчанки (СКВ). Однако очень скоро было показано, что АФС может развиваться при других аутоиммунных ревматических и неревматических заболеваниях, злокачественных новообразованиях, на фоне инфекций и приема ряда лекарственных препаратов [4]. Более того, оказалось, что связь между гиперпродукцией аФЛ и тромботическими нарушениями имеет более универсальный характер и может наблюдаться в отсутствие достоверных клинических и серологических признаков СКВ или какого–либо другого заболевания. Это послужило основанием для введения термина первичный АФС [5]. Полагают, что примерно половина больных АФС страдают первичной формой заболевания. Однако является ли первичный АФС самостоятельной нозологической формой, до конца не ясно. Имеются данные о том, что первичный АФС иногда может быть вариантом начала СКВ [6], и наоборот, у некоторых больных с «классической» СКВ в дальнейшем на первый план могут выходить признаки АФС, которые и определяют прогноз болезни.
Сведений об истинной распространенности АФС в популяции на сегодня нет. Заболевание чаще развивается в молодом возрасте и нередко встречается у детей, даже у новорожденных [7]. В общей популяции АФС чаще выявляется у женщин, однако при первичном АФС половые различия нивелируются [8].
При АФС могут поражаться сосуды любого калибра и локализации – от капилляров до крупных венозных и артериальных стволов. Поэтому спектр клинических проявлений этой патологии чрезвычайно разнообразен и зависит от локализации тромбоза. По современным представлениям, основу АФС составляет своеобразная васкулопатия, обусловленная невоспалительным и/или тромботическим поражением сосудов и заканчивающаяся их окклюзией [9]. В рамках АФС описаны патология ЦНС, сердечно–сосудистой системы, нарушение функции почек, печени, эндокринных органов, желудочно–кишечного тракта. С тромбозом сосудов плаценты склонны связывать развитие привычного невынашивания беременности. Наиболее часто встречающиеся клинико–лабораторные признаки АФС представлены в таблице [10].
Необходимо иметь в виду, что если первым проявлением АФС был артериальный тромбоз, то в последующем в подавляющем большинстве случаев наблюдается тромбирование артерий и наоборот [21].
Лабораторная диагностика АФС основана в первую очередь на определении волчаночного антикоагулянта (ВА) с помощью функциональных тестов и аКЛ иммуноферментным методом с использованием иммобилизованного на твердой фазе кардиолипина. АКЛ могут относиться к различным изотипам иммуноглобулинов (IgG, IgM, IgA).
Клиническое значение аФЛ зависит от того, связано ли их присутствие в сыворотке крови с развитием проявлений, характерных для АФС. Так, клинические проявления АФС наблюдаются у 30% больных с положительным ВА и у 30–50% больных, имеющих умеренный или высокий уровень IgG–аКЛ [11]. Необходимо отметить, что нередко выявляемое на фоне широкого спектра бактериальных и вирусных инфекций повышение уровня аФЛ (как правило, транзиторное) редко сопровождается развитием тромботических осложнений. Это связывают с различиями в иммуннологических свойствах аФЛ при АФС и инфекционных заболеваниях [12]. Следует также иметь в виду, что при ряде ревматических заболеваний гиперпродукция аФЛ может быть не связана с тромбозами. Например, было показано, что увеличение уровня аКЛ у больных ревматической полимиалгией ассоциируется не с тромботическими осложнениями, а с наличием гигантоклеточного артериита [13]. Cходные результаты были получены и при изучении аФЛ при других формах системных васкулитов. Несмотря на нередкое обнаружение аКЛ при ревматоидном васкулите и таких заболеваниях, как неспецифический аортоартериит (болезнь Такаясу), узелковый полиартериит, облитерирующий тромбангиит, четкой связи с развитием клинических проявлений АФС не прослеживается. Это позволяет предположить, что патогенетические механизмы тромботических осложнений при васкулитах отличны от таковых, которые лежат в основе АФС. Они обусловлены воспалительными изменениями в сосудистой стенке, приводящими к стенозированию и/или окклюзии просвета сосуда, что само по себе сопровождается повышенным риском тромбообразования [12].
Повышение уровня аКЛ было отмечено у больных с активной СКВ без АФС (при этом титры антител и их динамика хорошо коррелировали с показателями активности заболевания), а также при других системных ревматических заболеваниях, острой ревматической лихорадке и даже при остеоартрозе [12,14]. Кроме того, частота обнаружения IgG–аКЛ в сыворотках здоровых людей варьирует от 0 до 14%, составляя в среднем 2–4%. Таким образом, однократное обнаружение аФЛ не может служить основанием для постановки диагноза АФС.
Немаловажное значение имеют и титры аФЛ. С развитием клинических проявлений АФС лучше всего коррелируют умеренные и высокие уровни IgG–аКЛ (>40 GPL), тогда как диагностическое значение более низких уровней аКЛ представляется сомнительным [11,15].
В настоящее время интенсивно изучается клиническое значение антител к фосфолипидсвязывающим белкам, в первую очередь антител к b2–гликопротеину–1 (b2–ГП–1). Установлено, что синтез именно антител к b2–ГП–1 ассоциируется с развитием тромботических нарушений в рамках АФС и лучше коррелирует с развитием тромбозов, чем обнаружение аКЛ [16] . Как предполагается, при определении аКЛ с использованием иммобилизованного на твердой фазе кардиолипина выявляются как b2–ГП–1–зависимые, так и b2–ГП–1–независимые антитела, что снижает и специфичность результатов. Таким образом, методы определения аФЛ для диагностики АФС требуют дальнейшего совершенствования. Несмотря на более высокую специфичность ВА для АФС, этот метод пока не стандартизован на международном уровне [17]. Недостаточно корректная постановка лабораторных тестов и трактовка получаемых результатов приводит к гипердиагностике АФС и назначению необоснованного лечения.
Характерной особенностью АФС является рецидивирование тромбозов. К сожалению, достоверные предикторы развития этого осложнения отсутствуют [19,20]. Возможно, что более специфичным маркером рецидивирования тромботических осложнений могут оказаться антитела к b2–ГП–1.
Венозный тромбоз является основным проявлением АФС и встречается в 2 раза чаще, чем артериальный [22]. Тромбы обычно локализуются в глубоких венах нижних конечностей, но могут встречаться и в печеночных, аксиллярных, подключичных, почечных, поверхностных и других. Характерны повторные эмболии из глубоких вен нижних конечностей в легкие, иногда вызывающие развитие легочной гипертензии. Полагают, что АФС (чаще первичный, чем вторичный) – вторая по частоте причина синдрома Бадда–Киари [23]. Тромбоз внутримозговых артерий, приводящий к инсульту и транзиторным ишемическим атакам, – наиболее частая локализация артериального тромбоза при АФС. Полагают, что у женщин моложе 50 лет частота инсультов, ассоциирующихся с аФЛ, достигает 40% [24].
С точки зрения дифференциальной диагностики наличие тромботических осложнений нельзя связывать только с АФС. В целом в популяции только у 10% больных с венозными тромбозами обнаруживаются аФЛ [25]. Известно, что рецидивирующие тромбозы (главным образом венозные) могут быть обусловлены наследственным дефицитом белков С, S и антитромбина III. По данным эпидемиологических исследований, у 12,9% пациентов (из 2132 обследованных) с венозными тромбозами имелись различные наследственные дефекты естественных антикоагулянтов (в первую очередь белка S), и только у 4,1% были обнаружены аФЛ [26]. Хорошо известно о связи рецидивирующих тромбозов с наличием мутаций Leiden в гене Y фактора свертывания крови и в гене протромбина [27]. Нередко в развитии тромботических осложнений у одного и того же пациента могут играть роль несколько факторов. Например, у больных с наследственными тромбофилиями в половине случаев тромботические осложнения ассоциируются с такими факторами риска, как ожирение, хирургические вмешательства, длительная иммобилизация, беременность или прием оральных контрацептивов. Ряд патологических состояний (нефротический синдром, злокачественные новообразования, миелопролиферативные заболевания, гипергомоцистеинемия, серповидно–клеточная анемия и др.) тесно связывают с повышенным риском тромбоза глубоких и поверхностных вен.
Проведение дифференциальной диагностики тромбоза коронарных и мозговых артерий (с одной стороны, наиболее частого артериального тромбоза при АФС, а с другой стороны – характерная локализация атеросклеротического поражения сосудов) усложняет тот факт, что в настоящее время обсуждается взаимосвязь между продукцией аФЛ и ускоренным развитием атеросклероза. Однако даже при тяжелом атеросклерозе, приводящем к полной окклюзии просвета сосуда, как правило, отсутствуют другие клинические проявления, характерные для АФС.
Тщательный сбор анамнеза, с уточнением семейной предрасположенности к тромбофилии, анализ спектра клинических проявлений и факторов риска развития тромбоза (как наследственных, так и приобретенных) наряду с определением уровня аФЛ являются основными компонентами постановки диагноза.
Наиболее характерным проявлением АФС является акушерская патология (привычное невынашивание беременности, повторные эпизоды антенатальной гибели плода), частота которой может достигать 80%. Потеря плода может наступить в любые сроки беременности, но несколько чаще во II и III триместре [28]. Риск выкидышей коррелирует с увеличением концентрации IgG–аКЛ [29]. Кроме того, синтез аФЛ ассоциируется и с другими формами акушерской патологии, в том числе с поздним гестозом, преэклапмсией и эклампсией, задержкой внутриутробного развития плода, преждевременными родами [30]. Неблагоприятные исходы нередко регистрируются и при беременности, наступившей на фоне тяжелой экстрагенитальной патологии и/или сопровождающейся развитием специфических осложнений гестационного процесса. Таким образом, при анализе взаимосвязи между акушерской патологией и наличием АФС, как и в случае с тромботическими осложнениями, следует обязательно исключать факторы, которые могут быть потенциальной причиной предыдущих выкидышей (невынашивание эндокринного или воспалительного генеза; невынашивание, связанное с аномалиями развития половых органов, с наличием миомы матки, истмико–цервикальной недостаточности) или приводить к неблагоприятным исходам гестационного процесса (так называемая группа беременности высокого риска) [31].
В 1999 году были предложены предварительные классификационные критерии [32], в соответствии с которыми диагноз АФС считается достоверным при сочетании хотя бы одного клинического с, по меньшей мере, одним лабораторным признаком.
Клинические:
- Сосудистый тромбоз: 1 и более эпизодов тромбоза (артериального, венозного, тромбоза мелких сосудов). Тромбоз должен быть подтвержден при помощи инструментальных методов или морфологически (морфология – без значительного воспаления сосудистой стенки).
- Патология беременности:
– один и более случаев внутриутробной гибели морфологически нормального плода после 10 недель беременности, или
– один и более случаев преждевременных родов морфологически нормального плода до 34 недель беременности из–за выраженной преэклампсии или эклампсии, или выраженной плацентарной недостаточности, или
– три и более последовательных случаев спонтанных абортов до 10 недели беременности (при исключении анатомических дефектов матки, гормональных нарушений, материнских и отцовских хромосомных нарушений).
Лабораторные:
– положительные акЛ класса IgG и/или IgM (определяемые при помощи стандартизированного ИФМ для b2–ГП–1 зависимых аКЛ) и /или
– положительный волчаночный антикоагулянт (определяемый стандартизированным методом).
При этом положительные результаты лабораторных тестов должны быть зарегистрированы не менее 2 раз, с интервалом не менее 6 недель.
Таким образом, исходя из вышеприведенных критериев, у пациентки с СКВ, с рецидивирующими венозными тромбозами и 2 абортами на ранних сроках, с дважды положительными результатами определения аКЛ, диагноз АФС не вызывает сомнения. У молодого мужчины с тромбозом поверхностных вен нижних конечностей и минимальным повышением (при однократном исследовании) уровня аКЛ, следует, наряду с повторным определением аФЛ, исключить и другие причины развития данного осложнения. Совершенно неправомочен диагноз АФС у молодой женщины с первой беременностью с однократными положительными результатами определения аФЛ.
Дифференциальная диагностика АФС, как уже отмечалось, проводится с широким кругом заболеваний, протекающих с сосудистыми нарушениями. С другой стороны, при АФС наблюдается очень большое количество клинических проявлений, которые могут имитировать различные заболевания: васкулит, инфекционный эндокардит, опухоли сердца, рассеянный склероз, гепатит, нефрит и др. Полагают, что АФС должен быть заподозрен при развитии тромботических нарушений (особенно множественных, рецидивирующих, с необычной локализацией), тромбоцитопении, акушерской патологии у лиц молодого и среднего возраста. Его следует исключать при необъяснимом тромбозе у новорожденных, в случаях некроза кожи на фоне лечения непрямыми антикоагулянтами и у больных с удлиненным АЧТВ при скрининговом исследовании [33].
Ведение больных АФС представляет сложную проблему. Это обусловлено неоднородностью патогенетических механизмов, лежащих в основе АФС, полиморфизмом клинических проявлений, отсутствием достоверных клинических и лабораторных показателей, позволяющих прогнозировать рецидивирование тромботических нарушений. Полагают, что риск рецидивирования тромбозов особенно высок в следующих случаях: у больных молодого возраста с персистирующим высоким уровнем аФЛ, при наличии рецидивирующих тромбозов и акушерской патологии в анамнезе, при других факторах риска тромботических нарушений (наследственных, приобретенных, их сочетания), при быстрой отмене непрямых антикоагулянтов.
Ведение больных АФС основывается на назначении антикоагулянтов непрямого действия и антиагрегантов (в первую очередь низких доз ацетилсалициловой кислоты), которые широко применяются для профилактики тромбозов. Однако использование этих препаратов имеет при АФС свои особенности, что прежде всего связано с более высоким риском рецидивирования тромбозов, чем в общей популяции больных тромбофилией, а также с необходимостью лечения ведущего заболевания (при вторичном АФС) [34].
Полагают, что у больных с высоким уровнем аФЛ в сыворотке, но без клинических признаков АФС (в том числе у беременных женщин без акушерской патологии в анамнезе) следует ограничиться назначением небольших доз ацетилсалициловой кислоты (80 мг в сутки). Однако эти лица нуждаются в тщательном динамическом наблюдении, так как риск тромботических осложнений у них весьма высок.
Что касается больных с клиническими признаками АФС (в первую очередь с тромбозами), то им показана более агрессивная антикоагулянтная терапия. Данные проспективных исследований свидетельствуют о том, что у больных с достоверным вторичным и первичным АФС при лечении высокими дозами непрямого антикоагулянта варфарина, позволяющими поддерживать состояние гипокоагуляции на уровне более 3–4 по международному нормализационному индексу (INR), отмечается достоверное снижение частоты рецидивирования тромбозов [35]. В то же время терапия антикоагулянтами сопряжена с рядом трудностей. Во–первых, это связано с увеличением риска кровоточивости, и данное осложнение может по своей тяжести превосходить пользу от профилактики тромбоза. Во–вторых, у части больных рецидивирование тромбоза отмечается после прекращения терапии антикоагулянтами. В–третьих, у больных АФС могут наблюдаться выраженные спонтанные колебания INR, что существенно затрудняет использование этого показателя для мониторинга лечения варфарином [36]. Однако все вышеперечисленное не должно являться препятствием для проведения активной антикоагулянтной терапии у тех больных, кому она жизненно необходима. В настоящее время большинство исследователей рекомендуют в случае наличия так называемых «больших» тромбозов (тромбозы глубоких вен, ТЭЛА, артериальные тромбозы), с частым рецидивированием, пожизненно назначать терапию антикоагулянтами под контролем INR [37]. Недавно было установлено, что лечение варфарином в относительно низкой дозе (INR в пределах 2,0–2,9) столь же эффективно для профилактики рецидивирования венозных тромбозов, как и более высокие дозы препарата [38]. Необходимо иметь в виду, что варфарин может взаимодействовать с рядом лекарственных препаратов, которые при сочетанном назначении как снижают (барбитураты, эстрогены, антациды, противогрибковые и противотуберкулезные препараты), так усиливают его антикоагулятное действие (НПВП, антибиотики, пропранолол, ранитидин и пр.). Следует дать определенные рекомендации и по поводу диеты, так как богатая витамином К пища (печень, зеленый чай, листовые овощи – брокколи, шпинат, брюссельская и кочанная капуста, репа, салат–латук) способствует развитию резистентности к варфарину.
Само по себе лечение глюкокортикоидами и цитотоксическими препаратами при АФС, как правило, неэффективно, за исключением ситуаций, когда их назначение продиктовано активностью основного заболевания (например, при СКВ). Кроме того, длительная глюкокортикоидная терапия потенциально может увеличивать риск развития тромбозов [4].
Умеренная тромбоцитопения, нередко наблюдаемая при АФС, не требует лечения или контролируется небольшими дозами глюкокортикоидами. У больных с тромбоцитопений в пределах 50–100 х 109 /л можно использовать небольшие дозы варфарина (INR 2,0–3,0), а более существенное снижение уровня тромбоцитов диктует необходимость назначения внутривенного иммуноглобулина или высоких доз глюкокортикоидов [39].
Лечение больных с акушерской патологией глюкокортикоидами в настоящее время не показано в связи с отсутствием данных о преимуществах такого вида терапии и из–за большой частоты побочных эффектов у матери (синдром Кушинга, диабет, артериальная гипертензия) и плода. Стандартом профилактики рецидивирующих потерь плода являются малые дозы ацетилсалициловой кислоты, которые рекомендуется принимать до, в течение беременности и после рождения ребенка. Во время беременности малые дозы ацетилсалициловой кислоты желательно комбинировать с подкожным введением гепарина. Назначение низкомолекулярных гепаринов снижает риск развития гепарин–индуцированного остеопороза у матери [40]. И только при неэффективности данных схем обсуждается назначение внутривенного иммуноглобулина, экстракорпоральных методов лечения и в крайне редких случаях – глюкокортикоидов [41].
Течение АФС, тяжесть и распространенность тромботических осложнений непредсказуемы, а универсальные схемы ведения больных, к сожалению, отсутствуют. Спектр клинических проявлений требует проведения широкого дифференциального поиска, внедрения новых высокочувствительных лабораторных методов обследования. Именно поэтому, несмотря на достигнутый за почти 20 лет прогресс в изучении механизмов развития, клинических особенностей и подходов к лечению, АФС продолжает оставаться одной из наиболее актуальных мультидисциплинарных проблем современной медицины. Для решения этой проблемы в первую очередь необходимо объединение усилий специалистов различных областей медицины – ревматологов, кардиологов, невропатологов, акушеров–гинекологов, иммунологов.
Литература:
1. Harris E.N., Charavi A.E., Boey M.L. et al. – «Anticardiolipin antibodies: detection by radioimmunoassay and association with thrombosis in systemic lupus erythematosus»– Ibid., 1983, vol.2, pp. 1211–1214.
2. Hughes G.R.V. – «Thrombosis, abortion, cerebral disease and lupus anticoagulant» – Brit. Med.J., 1983, vol. 187, p. 1088–1089.
3. Khamashta M.A., Asherson R.A. – «Hughes syndrome: antiphospholipid antibodies move to thrombosis in 1994» – Br. J.Rheumatol., 1995, vol. 34, pp. 493–494.
4. Asherson R.A., Cervera R., Piette J.C., Shoenfeld Y. «The antiphospholipid syndrome: history, definition, classification, and differencial diagnosis».– In: The antiphospholipid syndrome. Asherson R.A., Cervera R., Piette J.C., Shoenfeld Y (eds). – CRC Press: Boca Raton, 1996, pp. 3–12.
5. Asherson R.A., Cervera R., Ordi–Ros J. et al. «The primary antiphospholipid syndrome: major clinical and serological features» – Medicine (Baltimore), 1989, vol. 68, pp. 366–374.
6. Alarcon–Segovia D., Sanchez–Guerrero J. «Primary antiphospholipid syndrome» – J.Rheum., 1989, vol. 16, p. 482–488.
7. Насонов Е.Л., Рябова Т.В., Шпитонкова О.В., Александрова Е.Н. «Антифосфолипидный синдром в педиатрии» – Детская ревматология, 1995, 1, стр. 75–62.
8. Asherson R.A. « The primary antiphospholipid syndrome» –J.Rheumatol., 1988, vol. 15, pp.1742–1746.
9. Алекберова З.С., Решетняк Т.М., Роденска–Лоповок С.Г. «Васкулопатия у больных системной красной волчанкой с антифосфолипидным синдромом» – Тер. Архив, 1995, 5, стр. 41–44.
10. Hughes G.R.V. «The antiphospholipid syndrome: ten years on» – Lancet, 1993, vol. 324, pp. 314–344.
11. McNeil H.P., Chesterman C.N., Kliris S.A. «Immunology and clinical importance of antiphospholipid antibodies» – Adv. Immunol., 1991, vol. 49, p. 193–280.
12. Насонов Е.Л., Баранов А.А., Шилкина Н.П., Алекберова З.С. «Патология сосудов при антифосфолипидном синдроме», Москва–Ярославль, 1995.
13. Duhaut P., Berruyer M., Pinede L. et al. «Anticardiolipin antibodies and giant cell arteritis. A prospective, multicenter case–control study» – Arthritis and Rheum., 1998, 41, 701.
14. Джузенова Б.С., Насонов Е.Л., Ковалев В.Ю. и др. «Антитела к кардиолипину при острой ревматической лихорадке» – Клин. Медицина, 1992, 2, 66–71.
15. Насонов Е.Л., Алекберова З.С., Калашникова Л.А., Решетняк Т.М., Александрова Е.Н. «Антифосфолипидный синдром (синдром Hughes): 10 лет изучения в России. – Клиническая медицина, 1998, 2, стр. 4–11.
16. Решетняк Т.М., Дерксен Р.В., Алекберова З.С. и др. «Антитела к (2–гликопротеину–1 при СКВ» – Клиническая медицина, 1998, 3, 36–40.
17. Brandt J.T., Barna L.K., Triplett D.A. «Laboratory identification of lupus anticoagulants: results of the Second Intarnational Workshop for Identification of Lupus Anticoagulants. On behalf of the Subcommittee on Lupus Anticoagulants/Antiphospholipid Antibodies of the ISTH» Thromb Haemost, 1995, 74, 1597.
18. Finazzi G., Brancaccio V., Moia M. et al/ Natural history and rick factors for thrombosis in 360 patients with antiphospholipid antibodies: a four–year prospective study from the Italian registry/ Am.J.Med, 1996, 100, 530.
19. Levine S.R., Brey R.L. Neurological aspects of antiphospholipid antibody syndrome/ Lupus, 1996, 5, 347.
20. Shulman S., Svenungsson E., Grandqvist S. et al./ Anticardiolipin antibodies predict early recurrence of thromboembolism and death among patients with venous thromboembolism following anticoagulant therapy/Am J Med, 1998, 104, 332/
21. Rosove M.H., Brewer P.M.C./ Antiphospholipid thrombosis. Clinical course after first thrombotic events in 70 patients/ Ann. Intern.Ved., 1992, 117, 303–308.
22. Алекберова З.С., Решетняк Т.М., Кошелева Н.М. и др./ «Антифосфолипидный синдром при системной красной волчанке: оценка диагностических и классификационных критериев»/ Клин. Медицина, 1996, 6, 39–42.
23. Pelletier S., Landi B., Piette J.C. et al./ Antiphospholipid syndrome as the second cause of non–tumor Budd–Chiary syndrome/ J.Hepat., 1994, vol.2, 76–80.
24. Munts A.G., vanGenderen P.J., Dippel D.W. et al./ Coagulation disorders in young adults with acute cerebral ischaemia//J Neurol., 1998, 245, 21.
25. Gromnica–Ihle E., Schossler M./Antiphospholipid cyndrome// Int Arch Allergy Immunol., 2000, 123, 67.
26. Mateo J., Oliver A., Borell M. et al./ Laboratory evaluation and clinical characteristics of 2132 consecutive unselected patients with venous thromboembolism – results of the Spanish Multicentric Study on Thrombophilia/ Thromb Haemost, 1997, 77, 444.
27. Price D.T., Ridker P.M/ Factor Y Leiden mutation and the risks for thromboembolic disease. A clinical perspective/ Ann Intern Med, 1997, 127, 895.
28. Cervera R., Asherson R.A., Lie J.T./Clinicopathologic correlations of the antiphospholipid syndrome/ Sem. Arthr. Rheum., 1995, 24, 4, 262–272/
29. Out H.J., Bruinse H.W., Christiaens G.C.M.L. et al./ A prospective, controlled multicenter study of thr obstetric risks of pregnant women with antiphospholipid antibodies//Clin. Exp. Rheum., 1992, 10, 6, 648.
30. Branch D.W., Andres R., Digre K.B./ The association of antiphospholipid antibodies with severe pre–eclampsia//Obstet. And Gynec., 1989, 73, 541–545/
31. Карпов Н.Ю., Баранов А.А., Шилкина Н.П. и соавт. «Антитела к кардиолипину при беременности высокого риска», Клин. Медицина, 1999Б 4, 19–22.
32. Wilson W.A., Charavi A.E., Koike T. et al./ International consensus statement on preliminary classification criteria for definite antiphospholipid syndrome: report of an international workshop./ Arthr/Rheum., 1999, 42, 1309–1312.
33. Насонов Е.Л., Алекберова З.С., Калашникова Л.Н., Клюквина Н.Г. «Антифосфолипидный синдром», в кн. Васкулиты и васкулопатии, Ярославль, 1999.
34. McCrae K.B. /Antiphospholipid antibody associated thrombosis: a consensus for treatment?//Lupus, 1996, 5, 560–570.
35. Hamsten A., Norberg R., Bjorkholm M. et al./ Antibodies to cardiolipin in young survivors of myocardial infarction^ an association with recurrent cardiovascylar events//Lancet, 1986, 2, 113–115.
36. Moll S., Ortel T.L./ The INR is invalid in monitoring warfarin anticoagulant therapy in patients with lupus anticoagulant//Lupus, 1996, 5, 522.
37. Mc Crae K.R. / Antiphospholipid antibody associated thromboses: a consensus for treatment//Lupus, 1996, 5, 560.
38. Lockshin M.D./ Answers to the Antiphospholipid antibody syndrome? (editorial)/ N Engl. J.Med., 1995, 332, 1025.
39. Hunt B.I, Khamaahta M.A./ Management of the Hughes syndrome// Clin. Exp. Rheum., 1996, 14, 115–117.
40. Lockshin M.D., Druzin M.L., Qamar T./ Prednisone does not prevent recurrent fetal death in women with Antiphospholipid antibody//Am J Obstet Gynec., 1989, 160,439.
41. Spinnato J.A., Clark A.L., Harris E.N./ Intravenous immunoglobulin therapy for the antiphospholipid syndrome in pregnancy// Am J Obstet Gynec., 1995, 172, 690
Антифосфолипидный синдром: диагностика и лечение
Антифосфолипидный синдром (АФС) является аутоиммунной патологией. В ее основе лежит формирование антител к фосфолипидам, которые являются главными компонентами мембран клеток. Такое заболевание проявляется проблемами с сосудами, сердцем, другими органами, а также с беременностью.
В статье рассмотрим причины возникновения, симптомы, методы диагностики антифосфолипидного синдрома. Клинические рекомендации по лечению АФС прошли общественную экспертизу и были утверждены в декабре 2013 года. В рекомендациях также дается подробное описание, что представляет собой антифосфолипидный синдром. Информация, предоставляемая в этом документе, является практическим руководством для медперсонала, работающего с пациентами, у которых диагностирован АФС.
Общие сведения
АФС можно назвать симптомокомплексом, включающим рецидивирующие артериальные и венозные тромбозы, а также акушерскую патологию. Различают два вида заболевания:
- Первичный антифосфолипидный синдром.
- Вторичный АФС.
Первичный диагностируется тогда, когда у пациента на протяжении 5 лет не проявляются другие заболевания, кроме АФС.
Вторичный представляет собой патологию, развившуюся на фоне другой патологии (красной волчанки, склеродермии, ревматоидного артрита и других).
В первом варианте у пациента отсутствуют эритема на лице, кожные высыпания, стоматит, воспаление брюшины, синдром Рейно, а в анализе крови нет антинуклеарного фактора, антител к нативной ДНК и антител к Sm-антигену.
Диагностика заболевания
Диагноз антифосфолипидный синдром выставляют в тех случаях, когда у людей существует хотя бы по одному клиническому и лабораторному критерию его проявления. Если существуют только клинические критерии, а лабораторные показатели отсутствует, то диагноз данного заболевания не выставляется. Также не ставят диагноз АФС при наличии только лабораторных критериев. Диагноз АФС исключают в том случае, если у человека больше пяти лет подряд в крови выявляют антифосфолипидные антитела, но при этом не наблюдаются клинические симптомы.
Диагностика антифосфолипидного синдрома имеет свои нюансы.
Учитывая то, что для определения лабораторных показателей АФС требуется минимум два раза исследовать в крови концентрацию антифосфолипидных антител, выставить точный диагноз в рамках однократного обследования невозможно. Только тогда, когда будут два раза сданы соответствующие тесты, можно оценивать лабораторные критерии.
Положительным результат теста будет считаться лишь в том случае, если количество антител к фосфолипидам при анализе крови на антифосфолипидный синдром окажется повышенным два раза подряд. В том случае если всего раз антифосфолипидные антитела наблюдались в повышенном количестве, а при повторном исследовании были в норме, это считается отрицательным критерием и не служит признаком данного заболевания. Диагностику антифосфолипидного синдрома должен проводить высококвалифицированный специалист.
Дело в том, что временное увеличение антифосфолипидных антител в крови может встречаться очень часто. Фактически оно фиксируется после каждого инфекционного заболевания, даже на фоне банальных отоларингологических недугов. Подобное временное увеличение уровня антител не требует лечения и самостоятельно проходит в течение всего нескольких недель.
Когда диагноз данного синдрома будет подтвержден или опровергнут, не следует сразу же считать его окончательным, так как их уровень способен колебаться в зависимости от самых разных причин, например таких, как недавно перенесенная простуда или стресс.
Дифференциация с другими заболеваниями
Антифосфолипидный синдром по МКБ 10 имеет код D 68.6. Десятый пересмотр был проведен в 1989 году в Женеве. Его нововведением стало использование в кодах болезней и цифр, и букв. До этого антифосфолипидный синдром по МКБ 9 имел код 289.81 в классе «Болезни крови и кроветворных органов». АФС нередко можно перепутать с другими патологиями. Таким образом, недуг нужно уметь отличить от следующих заболеваний, имеющих сходную с ним клиническую симптоматику:
- Наличие у пациента приобретенной или генетической тромбофилии.
- Присутствие дефектов фибринолиза.
- Развитие злокачественных опухолей абсолютно любой локализации.
- Наличие атеросклероза или эмболии.
- Развитие инфаркта миокарда с тромбозом сердечных желудочков.
- Развитие кессонной болезни.
- Наличие у пациента тромботической тромбоцитопенической пурпуры или гемолитико-уремического синдрома.
Какие анализы следует сдавать для диагностики АФС
В рамках диагностики такого заболевания, как антифосфолипидный синдром, необходимо сдать кровь из вены. Делается это натощак в утренние часы. При этом человек не должен быть простывшим.
В том случае если пациент плохо себя чувствует, сдавать анализ на антифосфолипидный синдром нельзя. Требуется дождаться полной нормализации состояния, и только после этого сделать необходимые пробы.

Непосредственно перед сдачей таких анализов нет необходимости в соблюдении какой-то специальной диеты, но очень важно ограничить алкоголь, курение и употребление вредной пищи. Анализы можно сдать абсолютно в любой день менструации, если дело касается женщины. Итак, в рамках диагностики антифосфолипидного синдрома необходимо выполнить следующие исследования:
- Антитела к фосфолипидам типа «IgG» и «IgM».
- Антитела к кардиолипину типа «IgG» и «IgM».
- Антитела к гликопротеину типа «IgG» и «IgM».
- Исследование волчаночного антикоагулянта. Оптимальным считается определение данного параметра в лаборатории по тесту Рассела с применением яда гадюки.
- Общий анализ крови с определением количества тромбоцитов.
- Выполнение коагулограммы.
Указанные анализы вполне достаточны для постановки либо для опровержения соответствующего диагноза. По рекомендации врача можно сдать и другие дополнительные анализы на показатели, которые характеризуют состояние системы кровяного свертывания. К примеру, дополнительно можно сдать Д-димер, тромбоэластограмму и так далее. Однако подобные дополнительные тесты не позволят уточнить диагноз, зато на их основании удастся наиболее точно оценить риск тромбозов и систему свертывания в целом.
Антифосфолипидный синдром и беременность
У женщин АФС может спровоцировать выкидыш (если срок небольшой) или преждевременные роды.
Недуг может приводить к задержке развития или внутриутробной гибели плода. Прерывание беременности происходит чаще всего во 2-м и 3-м триместрах. Если терапия отсутствует, то такой печальный исход будет у 90–95 % пациенток. При своевременном правильном лечении неблагоприятное развитие беременности вероятно в 30 % случаев.
Варианты патологии беременности:
- Гибель здорового плода без видимой причины.
- Преэклампсия, эклампсия или плацентарная недостаточность в срок до 34 недель.
- Спонтанные аборты в срок до 10 недель, при этом хромосомные нарушения у родителей отсутствуют, как и гормональные или анатомические нарушения половых органов у матери.
При антифосфолипидном синдроме беременность может протекать нормально.
Клинические проявления могут отсутствовать. В таких случаях заболевание обнаруживается лишь при выполнении лабораторных исследований. Назначается в качестве лечения ацетилсалициловая кислота до 100 мг в сутки, однако пользу такой терапии окончательно не установили.

Бессимптомный антифосфолипидный синдром лечат «Гидроксихлорохином». Особенно часто его назначают при сопутствующих болезнях соединительной ткани, например системной красной волчанке. При возникновении риска тромбоза назначается «Гепарин» в профилактической дозе.
Далее выясним, каким образом в настоящее время проводится лечение данной патологии.
Лечение
В настоящее время, к сожалению, лечение антифосфолипидного синдрома является весьма сложной задачей, так как сегодня еще отсутствуют точные и достоверные данные о механизме и причине развития этой патологии.
Терапия в настоящее время направляется на устранение и профилактику тромбозов. Таким образом, лечение по сути своей является симптоматическим и не позволяет достигать абсолютного излечения от этого заболевания. Это значит, что такую терапию проводят пожизненно, так как она дает возможность минимизировать риски тромбозов, но одновременно не устраняет заболевание. То есть получается, что по состоянию медицины и знаниям науки на сегодняшний день больные должны пожизненно устранять симптомы АФС. В терапии этого заболевания выделяется два основных направления, коими являются купирование уже резвившегося тромбоза, а также проведение профилактики повторных эпизодов тромбообразования.
Проведение срочного лечения
На фоне катастрофического антифосфолипидного синдрома для пациентов проводят срочное лечение, которое осуществляется в условиях реанимации. Для этого используют все доступные методики противовоспалительной и интенсивной терапии, например:
- Проведение антибактериальной терапии, которая устраняет очаги инфекции.
- Использование «Гепарина». Помимо этого применяются такие низкомолекулярные препараты, как «Фраксипарин» наряду с «Фрагмином» и «Клексаном». Эти лекарства помогают уменьшить образование тромбов.
- Лечение глюкокортикоидами в виде «Преднизолона», «Дексаметазона» и так далее. Эти медикаменты позволяют купировать системные воспалительные процессы.
- Одновременное применение глюкокортикоидов с «Циклофосфамидом» для купирования тяжелых системных воспалительных процессов.
- Внутривенный ввод иммуноглобулина на фоне тромбоцитопении. Такая мера целесообразна при наличии низкого количества тромбоцитов в крови.
- В случае отсутствия эффекта от применения глюкокортикоидов, иммуноглобулина и «Гепарина» вводятся экспериментальные генно-инженерные медикаменты наподобие «Ритуксимаба» и «Экулизумаба».
- Плазмаферез проводится лишь при крайне высоком титре антифосфолипидных антител.
Некоторые исследования доказали эффективность «Фибринолизина» наряду с «Урокиназой», «Альтеплазой» и «Антистреплазой» в рамках купирования катастрофической формы синдрома. Но надо сказать, что данные препараты не назначаются постоянно, так как их применение связано с высокими рисками кровотечения.

Медикаментозное лечение тромбозов
В рамках профилактики тромбозов людям, страдающим данным синдромом, необходимо пожизненно применять лекарственные средства, которые уменьшают свертываемость крови. Непосредственно выбор препаратов определяют особенности клинического течения этого заболевания. На сегодняшний день врачами рекомендуется придерживаться следующей тактики во время профилактики тромбозов у пациентов, страдающих антифосфолипидным синдромом:
- При АФС с антителами к фосфолипидам, на фоне чего отсутствуют клинические эпизоды тромбозов, можно ограничиться ацетилсалициловой кислотой в низких дозах по 75 миллиграмм в сутки. «Аспирин» в данном случае принимается пожизненно или до изменения тактики лечения. В том случае если данный синдром является вторичным (к примеру, протекает на фоне красной волчанки), пациентам рекомендуют одновременно с «Аспирином» применять «Гидроксихлорохин».
- При АФС с наличием эпизодов венозных тромбозов рекомендуют применять «Варфарин». В дополнение к «Варфарину» могут назначить «Гидроксихлорохин».
- При синдроме антифосфолипидных антител с наличием эпизодов артериального тромбоза также рекомендуют применять «Варфарин» и «Гидроксихлорохин». А в дополнение к «Варфарину» и «Гидроксихлорохину» в случае высокого риска тромбозов назначают еще и «Аспирин» в низкой дозировке.
Дополнительные лекарства для лечения
Дополнительно к любым вышеуказанным схемам терапии могут назначаться те или иные препараты в целях коррекции имеющихся нарушений. К примеру, на фоне умеренной тромбоцитопении применяются низкие дозировки глюкокортикоидов – «Метипред», «Дексаметазон», «Преднизолон» и так далее. При наличии клинически значимой тромбоцитопении применяются глюкокортикоиды, а также «Ритуксимаб». Может быть использован и «Иммуноглобулин».
В том случае, если проводимое лечение не позволяет повысить тромбоциты в крови, то проводится хирургическое удаление селезенки. При наличии патологий почек на фоне данного синдрома применяются препараты из категории ингибиторов, например «Каптоприл» или «Лизиноприл».
Новые препараты
В последнее время активно осуществляются разработки новых препаратов, профилактирующих тромбозы, к которым относятся гепариноиды, а кроме того, ингибиторы рецепторов, например «Тиклопидин» наряду с «Тагреном», «Клопидогрелем» и «Плавиксом».
По предварительным сведениям сообщается, что данные препараты весьма эффективны при антифосфолипидном синдроме. Вполне вероятно их скорое введение в стандарты лечения, рекомендованные международными сообществами. На сегодняшний день эти препараты применяются в рамках лечения антифосфолипидного синдрома, но каждый врач старается назначать их согласно собственной схеме.
При наличии необходимости операционного вмешательства при данном синдроме следует как можно дольше осуществлять прием антикоагулянтов в виде «Варфарина» и «Гепарина». Отменять их нужно за минимально возможный промежуток времени перед операцией. Возобновить прием «Варфарина» необходимо после хирургического вмешательства.
Помимо этого, людям, которые страдают антифосфолипидным синдромом, в кратчайшие сроки после операции необходимо встать с постели и начать двигаться. Не лишним будет носить чулки из специального компрессионного трикотажа, что позволит провести дополнительную профилактику риска тромбозов. Вместо специального компрессионного белья подойдет простое обертывание ног эластичными бинтами.
Клинические рекомендации при антифосфолипидном синдроме должны строго соблюдаться.
Какие еще препараты применяются
В лечении этого заболевания используются препараты из следующих групп:
- Лечение антиагрегантами и антикоагулянтами непрямого действия. В данном случае (помимо «Аспирина» и «Варфарина») нередко применяется «Пентоксифиллин».
- Применение глюкокортикоидов. При этом может быть использован препарат «Преднизолон». В данном случае возможна также его комбинация с иммуносупрессорами в виде «Циклофосфамида» и «Азатиопринома».
- Применение аминохинолиновых препаратов, к примеру, «Делагила» или «Плаквенила».
- Использование селективных нестероидных противовоспалительных препаратов в виде «Нимесулида», «Мелоксикама» или «Целекоксиба».
- В рамках акушерских патологий внутривенно применяется «Иммуноглобулин».
- Лечение витаминами группы «В».
- Применение препаратов полиненасыщенных жирных кислот, к примеру, «Омакора».
- Использование антиоксидантов, например «Мексикора».
Широкого применения в настоящее время еще не получили, но являются весьма перспективными в терапии антифосфолипидного синдрома лекарства следующих категорий:
- Применение моноклональных антител к тромбоцитам.
- Лечение антикоагулянтными пептидами.
- Использование ингибиторов апоптоза.
- Применение препаратов системной энзимотерапии, к примеру, «Вобэнзима» или «Флогэнзима».
- Лечение цитокинами (в основном сегодня применяется «Интерлейкин-3»).
В рамках предотвращения повторного тромбообразования используют преимущественно непрямые антикоагулянты. В случаях вторичного характера антифосфолипидного синдрома лечение проводится на фоне адекватной терапии основного заболевания.
Прогноз на фоне патологии
Прогноз при этом диагнозе является неоднозначным и прежде всего зависит от своевременности лечения, а также от адекватности терапевтических методик. Не менее важна дисциплинированность больного, соблюдение им всех необходимых предписаний лечащего врача.
Какие еще имеются рекомендации при антифосфолипидном синдроме? Врачи советуют не проводить лечение по собственному усмотрению или по советам «бывалых», а только под контролем врача. Помните, подбор медикаментов для каждого больного индивидуален. Препараты, которые помогли одному пациенту, могут значительно усугубить положение другого. Также врачи советуют людям с АФС регулярно проводить контроль своих лабораторных показателей. Особенно это актуально для беременных и для тех женщин, которые планируют стать мамами.
К какому врачу следует обращаться?
Лечение такого заболевания проводится врачом-ревматологом. Учитывая то, что большинство случаев этого заболевания связано с патологиями при беременности, в лечении также нередко принимает участие акушер-гинеколог. Так как это заболевание поражает различные органы, может потребоваться консультация соответствующих специалистов, к примеру, возможно участие таких врачей, как невролог, нефролог, офтальмолог, дерматолог, сосудистый хирург, флеболог, кардиолог.
Антифосфолипидный синдром Текст научной статьи по специальности «Клиническая медицина»
ЛЕКЦИИ
© ДЕНИСОВА А.А., МАРТЫНОВИЧ Н.Н. — 2009
АНТИФОСФОЛИПИДНЫЙ СИНДРОМ
А.А. Денисова, Н.Н. Мартынович (Иркутская государственная областная детская больница, глав. врач — В.М. Селиверстов, Иркутский государственный медицинский университет, ректор — д.м.н., проф. И.В. Малов, кафедра педиатрии №1, зав. — д.м.н., проф. Н.Н. Мартынович)
Резюме. В лекции представлены современные данные о патогенезе и диагностике антифосфолипидного синдрома.
Ключевые слова: антифосфолипидный синдром, антифосфолипидные антитела, волчаночный антикоагулянт.
ANTIPHOSPHOLIPID SYNDROME
А.А. Denisova, N.N. Martynovich (Irkutsk State Regional Children's Hospital, Irkutsk State Medical University, Irkutsk)
Summary. The modern data about pathogeneses and diagnostic antiphospholipid syndrome is presented in the lecture. Key words: Antiphospholipid syndrome, antiphospholipid antibodies, lupus anticoagulants.
Среди гематогенных тромбофилий особое место занимают приобретенные формы этой патологии, в основе патогенеза которых лежат сложные изменения в иммунной системе, приводящие к нарушению нормальных взаимодействий в системе гемостаза. Подобные тромбофилии составляют группу, которая согласно классификации З.С. Баркагана обозначается как «иммунные тромбофилии». Наиболее изученный вид этой патологии — иммунная тромбофилия, обусловленная антифосфолипидным синдромом (АФС).
Антифосфолипидный синдром — это симптомоком-плекс, включающий в себя венозные и артериальные тромбозы, различные формы акушерской патологии, тромбоцитопению, разнообразные неврологические, сердечно-сосудистые, кожные, гематологические и другие нарушения, серологическим маркером которых являются антитела к фосфолипидам (антитела к кар-диолипину (АКА), волчаночный антикоагулянт (ВА), в2-гликопротеин-1-кофакторзависимые антитела, антитела к аннексину V, протромбину.
К проблеме АФС в последние годы существенно возрос интерес, т.к. накопились данные о высокой частоте этого патологического процесса и возможности его возникновения не только при системной красной волчанке и других иммунных заболеваниях, но и в качестве самостоятельной формы патологии, приводящей к возникновению тромбозов и акушерской патологии.
Следует отметить, что данные о частоте АФС в общей популяции весьма разноречивы. Во многом это связано с существующей путаницей в лабораторной диагностик и отсутствием четких критериев верификации антифосфолипидных антител (АФА). Большинство опубликованных исследований показывает, что циркуляция АФА наблюдается у 2-4% здоровых людей, причем следует отметить, что у женщин АФА обнаруживаются в 2-5 раз чаще, чем у мужчин.
Согласно современным представлениям АФС — это широко распространенный невоспалительный иммунный процесс, в основе которого лежит образование в организме в высоком титре бимодальных аутоантител, взаимодействующих с отрицательно заряженными плазменными фосфолипидными мембранами и связанными с ними белками — гликопротеинами. Основными мишенями АФА являются несущие отрицательный заряд кар-диолипин, фосфатидилсерин, фосфатидилэтаноламин, фосфатидиловая кислота, а из белковых компонентов — Р2гликопротеин I, аннексин V и протромбин.
АФА, к которым относятся так называемые анти-кардиолипиновые антитела (АКА) и волчаночный ан-
тикоагулянт (ВА) представляют собой семейство гетерогенных ауто— и аллоиммунных иммуноглобулинов IgG, IgA, IgM, связывающих фосфолипид-белковые комплексы. В ряде случаев происходит и прямое взаимодействие АФА с фосфолипидами, что имеет место при инфекционных заболеваниях. Такое связывание проявляется, с одной стороны, снижением тромборе-зистентности эндотелия и активацией тромбоцитар-ного гемостаза, а с другой — дисбалансом в системе коагуляционного гемостаза. Последний приводит к развитию тромбофилического статуса, при котором активация факторов Va, Xa и протромбина сочетается с депрессией пртивосвертывающих механизмов, в частности, в системе протеина С, тромб омодулина и фибринолиза. имеющиеся нарушения характеризуются in vitro развитием гипокоагуляции в так называемых «фосфолипид-зависимых» коагуляционных тестах. Эта гипокоагуляция выявляется комплексом специальных лабораторных методик и обозначается как эффекты АФА, обладающих свойствами ВА. На долю этих антител приходится около 70% всех АФА. В силу этого АФС в современных классификациях включается в число аутоиммунных гематогенных тромбофилий и обозначается как одна из гипокоагуляционных форм этой патологии.
Антифосфолипидные антитела оказывают следующие патогенетические влияния:
— эндотелиальная клетка: снижение синтеза про-стациклина — простагландина, обладающего антиагре-гационным и вазодилатирующим эффектом; нарушение функциональной активности тромбомодулина — белка, содержащегося на поверхности эндотелия, прямо тормозящего прокоагулянтную активность тромбина и ускоряющего активацию протеина С тромбином; снижение активности гепаран-сульфата; индуцирование образования фактора активации тромбоцитов; нарушение фибринолитической активности; снижение высвобождения тканевого активатора плазминогена; увеличение высвобождения ингибитора активатора плаз-миногена 1; увеличение синтеза фактора Виллебранда, необходимого для нормальной агрегации тромбоцитов и обладающего способностью удлинять период полувы-ведения фактора VIII;
— тромбоциты: антифосфолипидные антитела взаимодействуют с тромбоцитами, вызывают увеличение продукции тромбоксана А, концентрации цитозольного кальция, что ведет к увеличению агрегации тромбоцитов; кроме того, антифосфолипидные антитела связываются с мембраной активированных тромбоцитов,
Таблица 1
Клинические и лабораторные критерии диагностики АФС
Критерии Клинические и лабораторные признаки
Клинические 1. Сосудистые тромбозы:
Один или более клинических эпизодов артериального, венозного тромбоза, или тромбоза сосудов малого диаметра, в любой ткани или органе. Тромбоз должен быть подтвержден картиной ультразвукового доплеровского сканирования или данными гистологического исследования, за исключением поверхностных венозных тромбозов. При гистологическом исследовании тромбоз должен быть представлен значительными изменениями сосудистой стенки воспалительного характера.
2. Заболевания беременных:
a) один или более необъяснимых случаев смерти морфологически нормального плода на 10-й или позже неделе нормальной беременности, причем нормальная морфология плода должна быть документирована данными ультразвукового сканирования или непосредственным исследованием плода; b) один или более случаев преждевременных родов морфологически нормального плода к 34-й или ранее неделе беременности вследствие тяжелой преэклампсии или экслампсии, или тяжелой плацентарной недостаточности; c) три или более необъяснимых последовательных аборта до 10 недельного срока беременности с патологическими или анатомическими аномалиями у матери, или гормональными нарушениями, причем хромосомные причины должны быть исключены у отца и матери
Лабораторные 1. Умеренный или высокий уровень антитела к кардиолипину класса IgG и/или ^М в крови, в 2-х или более исследованиях, полученных с интервалом не менее 6 недель, измеренных путем стандартного метода ИФА для Ы2-гликопротеин 1-зависимых антител к кардиолипину
2. Позитивный тест на наличие волчаночного антикоагулянта в плазме в 2-х или более исследованиях, полученных с интервалом не менее 6 недель, причем этот антикоагулянт должен определяться согласно указаниям Международного общества тромбоза и гемостаза по следующим этапам:
a) установление факта удлинения фосфолипидзависимой фазы свертывания плазмы по результатам скрининговых тестов, таких как АЧТВ, каолиновое время, лебетоксовое время с разведением, протромбиновое время с разведением b) невозможность откорректировать удлиненное время скрининговых тестов путем смешивания с нормальной безтромбоцитарной плазмой c) укорочение времени скрининговых тестов или его нормализация после добавления в исследуемую плазму избытка фосфолипидов, и исключение других коагулопатий, например, наличие ингибитора VIII фактора или гепарина
Условия постановки диагноза Пациенты с АФС должны иметь не менее одного клинического и одного лабораторного критерия
что вызывает более быстрое разрушение их фагоцитирующими мононуклеарами, в результате чего развивается тромбоцитопения;
— гуморальные компоненты коагуляции: снижение активации протеина С и уровня свободного белка 8 — в норме активированный протеин С в присутствии своего кофактора белка 8 избирательно разрушает факторы Уа и УШа, что способствует угнетению свертывания крови; ослабление активности гепарина и гепарино-посредованного образования комплекса антитромбин Ш-гепарин; снижение синтеза и функциональной активности плацентарного антикоагулянта; нарушение функциональной активности естественного антикоагулянта Р2-ГП1.
Главной патогенетической особенностью АФС является высокая ангиотропность и тромбогенность. В дебюте этого синдрома чаще доминируют цереброваскулярные поражения — от нарушения памяти, упорных головных болей, мигреней, ослабления интеллекта, преходящих нарушений мозгового кровообращения и зрения до тромбозов мозговых синусов и сосудов, тромботических инсультов с парезами и параличами, эпилепсии и синдрома Снеддона. Реже наблюдаются тромбозы сосудов легких, почечная гипертензия, окклюзия сосудов печени и почек, в том числе с портальной гипертензией и синдромом Бадда-Киари, почечная гипертензия. Дебютными могут быть флеботромбозы конечностей (с ТЭЛА или без неё), сетчатое ливедо, синдром Рейно.
АФС может сопутствовать аутоиммунным, аллергическим, инфекционным заболеваниям (особенно лимфопролиферативным). В некоторых случаях он может возникать при различных видах лекарственной непереносимости.
Клиническая классификация и основные виды АФС Ascherson и соавт., 1996)
Первичный АФС:
1. Политромботический синдром, тромбозы разной локализации, нарушения мозгового кровообращения, особенно у лиц молодого возраста.
2. Привычное невынашивание беременности и внутриутробная гибель плода (упорно повторяющиеся вы-кидышы при отсутствии акушерско-гинекологической патологии).
Вторичный АФС:
1. На фоне аутоиммунных заболеваний (СКВ, узелковый периартериит, ревмотоидный артрит, системная склеродермия, иммунный тиреоидит).
2. На фоне злокачественных новообразований (солидные опухоли, тимомы, карциномы, гематологические опухоли — лимфопролиферативные заболевания).
3. На фоне инфекционных и инфекционноиммунологических заболеваний (клещевой боррелиоз, хронический гломерулонефрит, бронхиальная астма, ВИЧ, носительство стрептококковой и стафилококковой инфекции)
4. В связи с другими видами патологии (терминальная стадия хронической почечной и печеночной недостаточности).
Варианты АФС
1. Катастрофический.
2. Гипопротромбинемический.
3. Микроангиопатический.
4.На фоне ДВС-синдрома.
Трудности диагностики АФС, с которыми сталкиваются врачи различных специальностей, предопределили необходимость создания соответствующих классификационных критериев. Основные из них предложены в 1999 году на Международной конференции в г. Саппоро (Япония) (табл. 1).
Вместе с тем необходимо отметить, что саппо-ровские классификационные критерии не полностью охватывают факторы риска, способствующие возникновению тромбозов при АФС. Многолетние исследования Алтайского гематологического центра и ведение 1012 больных с тромбофилиями различного генеза, из которых у 354 (35%) пациентов был верифицирован диагноз АФС, позволили внести следующие клиниколабораторные дополнения к диагностике этого синдрома [7].
Рис.1. Алгоритм лабораторной диагностики ВА
Первичный АФС
1. Сосудистые тромбозы — один или более клинических эпизодов артериального, венозного тромбоза, или тромбоза сосудов малого диаметра, в любой ткани или органе. Тромбоз должен быть подтвержден картиной ультразвукового допплеровского сканирования или данными гистологического исследования, за исключением поверхностных венозных тромбозов.
Гистологическая картина — значительные изменения сосудистой стенки невоспалительного характера.
2. Неврологические: хорея, судороги, мигренеподобные головные боли, снижение памяти, транзиторные ишемические атаки, тромботические и ишемические инсульты.
3.Сосудистые и кожные проявления: сетчатое ливе-до, язвы голени, синдром Рейно, кровоизлияния в под-ногтевое ложе («симптом занозы»), поверхностная сыпь в виде точечных геморрагий, напоминающая васкулит.
4. Поражение сердца: тромбоз коронарных артерий и развитие инфаркта миокарда,острый или хронический тромбоз мелких интрамуральных ветвей коронарных артерий, что приводит к нарушению сократительной способности миокарда, поражение клапанов, развитие тромботических вегетаций, формирование внутри-предсердных тромбов, лабильная или стабильная АГ.
5. Поражение почек: тромбоз почечной артерии, инфаркт почки, внутриклубочковый микротромбоз с последующим развитием гломерулосклероза и ХПН.
4. Полиаллергический синдром.
5. Вирусинфицированность (ЦМВ, ВПГ, вирус Эпштейн-Барра, гепатипов и др.).
6. Наличие сопутствующих признаков иммунологических процессов, не позволяющих отнести выявленную совокупность симптомов к четко очерченной нозологической форме.
7. Акушерская патология.
Вторичный АФС
Развитие АФС на фоне уже имеющегося иммунного или опухолевого заболевания. Разделение АФС на первичный и вторичный варианты целесообразно, т.к. это определяет необходимость назначения глюкокортикостероидов и иммунодепрессантов.
Катастрофический АФС (КАФС)
КАФС выделяют в особую форму. Данный синдром является редкой, но наиболее тяжелой формой АФС и проявляется на фоне высоких титров АФА\ВА, характеризуется множественными тромбозами жизненно важных органов и развитием полиорганной недостаточности. КАФС — это острое, угрожающее жизни состояние, требующее неотложной терапии. Клиническая картина КАФС во многом напоминает ДВС-синдром и тромботическую тромбоцитопеническую пурпуру.
Патологические состояния способные привести к КАФС: септический шок; НЕКЬР-синдром; гемолитико-уремический синдром; тромботическая тромбоцитопе-ническая пурпура; синдром системного воспалительного ответа; острые инфекционные процессы; аллергические реакции; прием лекарственных (антиаритмиче-ских, пртивозачаточных) препаратов.
Важно отметить, что в связи с разнообразием клинических и серологических проявлений определены предварительные критерии его диагностики (по данным X
Международного конгресса по антифосфолипидному синдрому, Таормине, Италия, 2002):
Клинические проявления окклюзии сосудов двух или более органов с полиорганной недостаточностью.
Гистологическое подтверждение окклюзии сосудов мелкого калибра, по меньшей мере, в одном органе. Серологическое подтвержденное наличие АФА. Диагноз КАФС ставится при наличии одного или более критериев из трех групп. Вероятный КАФС диагностируется при наличии вышеперечисленных признаков в тех случаях, когда окклюзия мелких сосудов не подтверждена гистологически или если вторичные клинические проявления (органная недостаточность и др.) появляются в течение 2-4 недель с момента возникновения патологических состояний или воздействий, способных привести к КАФС, несмотря на антикоагу-лянтную терапию.
Лабораторная диагностика АФС При выявлении АФА используют два взаимодополняющих подхода:
Функциональные методы — определение АФА, обладающих свойствами волчаночного актикоагулянта с помощью коагуляционных тестов, основанных на удлинении in vitro времени свертывания в фосфолипид — чувствительных тестах.
Иммунологические методы — основанные на определении антител к кардиолипину, фосфатидилсерину и некоторым мембранным белкам — в2гликопротеину I, аннексину V и протромбину. 2
Следует подчеркнуть, что диагноз АФС устанавливается только при наличии положительных лабораторных тестов (обнаружение волчаночных антикоагулятов и\или высокого титра АФА и антител к мембран-связанным белкам — в2гликопротеину I, аннексину V, протромбину. 2
При поиске ВА необходимо соблюдать ряд условий и рекомендаций
В случае лечения непрямыми антикоагулянтами (варфарин, варфарекс и др.) необходимо перевести пациента на прием гепаринов в профилактических дозах в течение 7-10 дней (во избежание ошибок в интерпретации результатов исследований).
Кровь должна стабилизироваться с учетом гемато-критного показателя пациента.
Тесты необходимо выполнять на бедной тромбоцитами плазме, полученной в строгом соответствии с правилами. Не подлежат исследованию лиофилизиро-ванные или ранее замороженные образцы плазмы больных, а также с гемолизом.
Обязательно при определении эффектов ВА является выполнение полного комплекса диагностических тестов.
Учитывая вышеизложенное, важно отметить, что, несмотря на междисциплинарное значение гематогенных тромбофилий, эта группа патологических состояний до нашего времени мало знакома широкому кругу врачей разных специальностей, поэтому, в ряде случаев не диагностируется и не лечится. Это приводит к инва-лидизации, а иногда и к гибели детей и больных трудоспособного возраста, повторным неудачам при попытке родить здоровых детей, увеличивает финансовые расходы в здравоохранении.
ЛИТЕРАТУРА
1.Баркаган З.С. Клинико-диагностические варианты, номенклатура и основы диагностики гематогенных тромбофи-лий // Проблемы гематологии и переливания крови. — 1996. — №3. — С.5-15.
2. Баркаган З.С., Момот А.П., ЦывкинаЛ.П. и др. Основы лабораторной диагностики АФС // Тромбоз, гемостаз и реология. — 2000. — №3. — С.13-16.
3. Биденко М.А., Калягин А.Н., Новохатько О.И. Антифосфолипидный синдром как причина возникновения инсульта // Сибирский медицинский журнал (Иркутск). — 2007. — №6. — С.87-91.
4. Калашникова Л.А., Насонов Е.Л., Александрова Е.Н. и
др. Ишемические нарушения мозгового кровообращения и поражение клапанов сердца при первичном АФС // Клин. мед. — 1996. — №6. — С. 46-49.
5. Насонов Е.Л. Антифосфолипидный синдром: клиническая и иммунологическая характеристика // Клин. мед. — 1989. — №1. — С. 5-13.
6. Сердюк Г.В. Новые аспекты диагностики и терапии первичного АФС и его осложнений: Автореф. дис. ... докт. мед. наук. — Барнаул, 2005. — 44 с.
7. Сердюк Г.В., Момот А.П., Цывкина Л.П., Момот О.А. Традиции и новации в диагностике антифосфолипидного синдрома // СПб, 2008. — 92 с.
Адрес для переписки: 664056, г. Иркутск, б. Гагарина, 4, Иркутская государственная областная детская клиническая больница, отделение клинической лабораторной диагностики — Денисова Анна Алексеевна, врач.
Тел. (3925) 243605, эл. адрес: [email protected] 664003, г. Иркутск, ул. Красного Восстания, 1, Иркутский государственный медицинский университет, кафедра педиатрии № 1 — Мартынович Наталья Николаевна, заведующая кафедрой, доктор медицинских наук
© ГОВОРУШКО С.М. — 2009
МЕДИЦИНСКОЕ И ВЕТЕРИНАРНОЕ ЗНАЧЕНИЕ ПАУКОВ: ГЛОБАЛЬНАЯ СИТУАЦИЯ
С.М. Говорушко
(Тихоокеанский институт географии ДВО РАН, Владивосток, директор — д.г.н., акад. РАН П.Я. Бакланов, лаборатория устойчивого природопользования и экспертизы, зав. — к.г.н. В.П. Каракин)
Резюме. Цель исследования — выявление значимости пауков с точки зрения их влияния на человеческую смертность в глобальном масштабе. Анализировались литературные источники, содержащие подобные данные. Полученная информация позволяет сделать вывод, что современная смертность от их укусов не превышает первых десятков человек в год, однако социально-экономические последствия остаются значительными.
Ключевые слова: опасные виды, пауки, токсичность яда, укусы, человеческая смертность, ядопродуктивность.
MEDICAL AND VETERINARY IMPORTANCE OF SPIDERS: GLOBAL SITUATION
S.M. Govorushko (Pacific-Ocean Geographical Institute FEB RAS, Vladivostok)
Summary. The aim of my research is to discover importance of spiders in the view of their impact on human mortality on global scale. Different literature publications were analyzed. The data which were considered helped me to arrive at the conclusion that nowadays mortality from spiders’ bites does not exceed several tens of victims per year. However their socioeconomic consequences are still significant.
Key words: bites, human mortality, species of medical concern, spiders, toxicity of venom, venom amount.
Распространение опасных пауков. По разным данным отряд пауков насчитывает 20 тыс. видов [3], 30 тыс. [12], 35 тыс. [15], 40 тыс. [24], 50 тыс. видов [9]. Это самый большой по количеству видов и наиболее широко распространенный отряд паукообразных. В свою очередь, он делится на три подотряда: ЫрЫ$иототркае (членистобрюхие пауки), Му4а1ототрНав (пауки — птицееды) и ЛтапвототрНав (аранеоморфные пауки).
Опасными для человека и теплокровных животных считаются виды, способные прокусить кожу. К ним относится примерно 0,5% видов, которые встречаются во всех частях земного шара кроме наиболее холодных районов. Все они принадлежат ко второму и третьему подотрядам. Среди мигаломорфных пауков это виды родов ЛсапШо$ситпа, РНоттгйорш, Лугеи1атга, встречающиеся в Южной Америке, рода Pteтгnoеhгlus, обитающие в Восточной Африке, а также рода Л^ак, живущие в Австралии.
Из аранеоморфных пауков очень ядовиты виды родов ^епш (Ctenгdae), широко распространенные в тропических и субтропических зонах Земли. Опасны также виды семейств Лтапе'йае (пауки-кругопряды), обитающие в тропиках, 8рата$$'йае, населяющие тропики и субтропики, Пет'йПйае (пауки-тенетники), живущие во всех частях света, Ьуео$'йае (пауки-волки), распространенные в Азии и Европе, 8аШег4ае (пауки-скакуны), обитающие во всех частях света, 8геатгг4ае, обитающие в тропиках и субтропиках [3].
В фауне России опасными для человека видами являются каракурт (Latrodectus mactans tredecimguttatus) из семейства пауков-тенетников (Theridiidae), южнорусский тарантул (Lycosa singoriensis Lazm.) из семейства пауков-волков (Lycosidae), обыкновенный крестовик (Araneus diadematus Cl.) и аргиопа (Argiope lobata Pall.) из семейства пауков-кругопрядов (Araneidae), эрезус (Eresus niger Pet.) из семейства Eresidae и погребной паук — Segestria florentina Ross из одноименного семейства Segestriidae. В основном они распространены на юге Европейской части, однако южнорусский тарантул (Lycosa singoriensis) встречается до широты городов Ельца и Казани, а обыкновенный крестовик (Araneus diadematus Cl.) распространен вплоть до Крайнего Севера [34].
Некоторые особенности биологии. В природе пауки очень многочисленны. Например, в Великобритании на лугу было насчитано 130,8 пауков на квадратный метр. В среднем, паук потребляет 0,089 грамма насекомых в день. Есть данные, что в Нидерландах площадью 36150 квадратных километров и с 15-миллионным населением обитают 5000 миллиардов пауков [32]. Продолжительность жизни пауков очень различна. Большинство видов, обитающих вне помещений, заканчивают жизненный цикл в течение года. Некоторые домовые формы в умеренном климате (например, Tegenaria из сем. Agelenidae) живут по нескольку лет.
Некоторые аспекты диагностики, клинической картины и лечения антифосфолипидного синдрома
Неврологические проявления антифосфолипидного синдрома (АФС) на сегодняшний день являются малоизученными и не имеют такого широкого распространения, как инсульты или рассеянный склероз. В то же время данным нозологическим заболеванием интересуются врачи многих специальностей: ревматологи, акушер-гинекологи, кардиологи, терапевты, педиатры. Наиболее частыми неврологическими проявлениями АФС являются инсульты, реже встречаются головные боли, эпилептические припадки, деменция, хорея, периферическая нейропатия, миелопатии и энцефалопатии, феноменологически по своим клиническим проявлениям напоминающие рассеянный склероз (РС).
Ключевые слова: антифосфолипидный синдром, кардиолипин, клиническая картина, лечение, неврологические проявления
Антифосфолипидный синдром (АФС) — диффузное заболевание соединительной ткани, характеризующееся повреждением интимы сосудов микроциркуляторного русла вследствие формирования аутоиммунных антител к фосфолипидам (ФЛ) мембран клеток, которые включают в себя волчаночный антикоагулянт, антитела к кардиолипину (КЛ) и антитела к бета-2- гликопротеину 1 (β2-ГП 1) [1, 7, 9].
Первичный АФСразвивается у лиц без аутоиммунных заболеваний. Выделяют следующие группы:
- больные с тромбоэмболиями, прежде всего – в системе легочной артерии (ЛА), приводящими к развитию легочной гипертензии;
- пациенты молодого возраста (до 45 лет) с инсультами, транзиторными ишемическими атаками, окклюзией артерий, в том числе коронарных; наиболее яркий пример – синдром Снеддона;
- женщины с акушерской патологией (привычное невынашивание беременности) и внутриутробная гибель плода при отсутствии акушерско-гинекологической патологии;
- больные с аллергией к лекарственным препаратам (хинидин, гидролазин, фенотиазин,прокаинамид) [1, 2, 3, 4, 7, 8, 9].
ВторичныйАФС имеет признаки как основного заболевания, так и АФС. Развивается на фоне аутоиммунных заболеваний (чаще всего — системной красной волчанки (СКВ), инфекционных заболеваний и лимфопролиферативных болезней, изменяющих иммунный статус организма [1, 2, 7, 9, 14, 15]. Вторичный АФС может быть проявлением следующих заболеваний: инсулинозависимый сахарный диабет, злокачественные опухоли (солидные опухоли, тимома, карциномы), лейкемии, инфекционно-иммунные заболевания, заболевания почек и печени [1, 3, 7, 8, 9, 10, 15].
Также выделяют другие варианты АФС, характеризующиеся острым началом и тяжелым клиническим течением:
- катастрофический АФС (КАФС) (острая диссеминированная коагулопатия и вазопатия), проявляющийся острым мультиорганным тромбозом и имитирующий синдром ДВС или гемолитикоуремический синдром;
- серонегативный АФС — без антител к ФЛ, когда отсутствуют серологические маркеры — антитела к КЛ и волчаночному антикоагулянту (ВА), а также феномен тромботического шторма (ФТШ) (множественные тромбозы, развивающиеся в течение короткого периода времени) [1, 3, 6, 7, 9, 10, 14, 15]. Но известные в настоящее время формы тромбофилии выявляются не всегда. Критерии диагностики феномена ФТШ включают два или более эпизода венозных или артериальных тромбоза/микроангиопатии; атипичную локализацию тромбозов; рефрактерность тромбозов к стандартной терапии. Наиболее частым этиологическим фактором ФТШ является беременность. Причиной возникновения данного состояния гомеостаза человека служат тяжелые формы мультигенной тромбофилии (две и более гомозиготные формы высокотромбогенных мутаций) одновременно с повышенными уровнями кофакторов. Для своевременной диагностики необходимо исследовать уровень антифосфолипидных антител у всех пациентов с ДВС-синдромом, особенно у пациентов, у которых развиваются тромбозы при отсутствии явного провоцирующего фактора, при рецидивирующих тромбозах, при тромботических осложнениях во время беременности, включая тяжелую акушерскую патологию, в том числе – при преэклампсии, антенатальной гибели плода, подозрении на эмболию околоплодными водами [6]. К другим формам АФС относят и полиорганную недостаточность, а также:
- тромботическую тромбоцитопеническую пурпуру;
- гемолитико-уремический синдром,
- HELLP-синдром;
- ДВС-синдром;
- синдром волчаночный антикоагулянт-опосредованной гипопротромбинемии [6, 10].
По данным различных авторов, частота выявления антител к кардиолипину (КЛ) в популяции варьирует от 0 до 14 %, в среднем составляя 2–4 % [1, 6, 7, 8, 15]. При этом высокие титры обнаруживаются достаточно редко — у 0,2 % пациентов, причем чаще пожилого, чем молодого возраста. Заболевание чаще развивается в молодом, чем в пожилом возрасте, оно также описано у детей и даже новорожденных. АФС чаще встречается у женщин, чем у мужчин, но тяжелее протекает у мужчин [1, 3, 7, 9].
В развитии АФС играют важную роль следующие этиологические факторы: наследственный, инфекционный и гендерный [1, 7, 8, 9]. Клиническим подтверждением значения наследственной предрасположенности к развитию иммунопатологического процесса при АФС служит наличие семей, несколько членов которых страдают этим заболеванием или имеют его отдельные клинические или иммунологические проявления [1, 6, 7]. P. Ford и соавт. [1, 7] описали семью с первичным АФС, в которой мать и дочь в молодом возрасте перенесли ишемические НМК. У матери еще имелись и другие проявления первичного АФС: повторные выкидыши, тромбоз периферических вен, транзиторная тромбоцитопения. Иммунологические маркеры АФС включали положительный ВА, антитела к КЛ и ФС [6].
Вирусные и бактериальные токсины, повреждая ткани, приводят к экспозиции белков, которые могутбыть антигенным стимулом, и с другой стороны, сами инфекционные агенты (вирусы, бактерии, риккетсии, спирохеты) могут вызывать продукцию антител к ФЛ, так как их оболочка содержит большое количество ФЛ. По данным Калашниковой Л. А. [1], существенное значение имеет стрептококковая инфекция. У 63 % больных с синдромом Снеддона в анамнезе имелось указание на частые ангины, у 30 % из них проводилась тонзилэктомия. Установлено, что антитела к ФЛ вырабатываются при различных острых инфекциях и по мере стихания последних уровень антител к КЛ нормализуется. Но при стрептококковой инфекции, количество антител к КЛ остается повышенным, что предположительно отражает развитие аутоиммунного процесса [5]. Еще одним фактором, предрасполагающим к развитию АФС, является дисбаланс половых гормонов. Известно, что аутоиммунные заболевания чаще развиваются у женщин, нередко имеющих признаки гиперэстрогенемии, чем у мужчин [1, 7]. Эстрогены усиливают иммунный ответ за счет ингибирования Т-супрессоров и активации В-лимфоцитов, тогда как андрогены и прогестерон обладают иммуносупрессивным действием [1, 7]. Эстрогены не только влияют на иммунную систему, но и дополнительно создают прокоагулянтное состояние, повышая уровень фибриногена, протромбина, коагуляционных факторов VII, X, XII свертывающей системы [1, 7].
В рамках данного заболевания описаны патология центральной нервной системы (ЦНС), патология сердечно-сосудистой системы (ССС), нарушение функции почек, печени, эндокринных органов, желудочно-кишечного тракта (ЖКТ). С тромбозом сосудов плаценты связывают развитие некоторых форм акушерской патологии. Характерной особенностью АФС является частое рецидивирование тромбозов. Замечено, если первым проявлением АФС был артериальный тромбоз, то и в последующим у большинства больных будут наблюдаться артериальные тромбозы, а у больных с первично возникшим венозным тромбозом рецидивируют венозные тромбозы [3, 4, 9, 14].
Основными неврологическими проявлениями АФС являются артериальные и венозные тромбозы различной локализации, чаще тромбозы локализуются в сосудах головного мозга, приводя к ишемическим нарушениям мозгового кровообращения (НМК). Следовательно наиболее частыми проявлениями АФС будут нарушения мозгового кровообращения (ишемические и венозные тромбозы) Другими неврологическими проявлениями АФС могут быть эпилептические припадки, деменция, головные боли, хорея, синдром имитирующий течение рассеянного склероза (СИРС).
По частоте встречаемости цереброваскулярные нарушения (ЦВН) при АФС находятся на первом месте и в 75 % случаев дебютируют с ишемического инсульта (ИИ). Как и преходящие НМК, они развиваются в бассейне различных мозговых артерий, чаще ˗ в системе сонных артерий, реже ˗ в системе вертебробазилярных артерий. Очаговая неврологическая симптоматика в остром периоде инсульта разнообразна и определяется локализацией очаговых изменений в веществе головного мозга. Темп развития очаговых неврологических симптомов достаточно быстрый. ИИ, как правило, развивается в период бодрствования, очень редко неврологические симптомы развиваются после ночного сна. Сознание в остром периоде обычно не нарушено, очевидно из-за характерного для АФС малого или среднего инфаркта мозга. У пациенток с АФС инсульты могут возникать во время беременности, после родов или медицинских абортов. Характерной особенностью ИИ при АФС является хорошее восстановление очаговых неврологических симптомов. Значительное обратное развитие парезов обусловлено небольшими или средними размерами инфарктов мозга и их локализацией вне зоны, функционально значимой для двигательных функций. Хороший регресс очаговой неврологической симптоматики при ИИ у больных с антителами к ФЛ отмечают и зарубежные авторы. У 50 % больных к моменту выписки из стационара отсутствовал остаточный неврологический дефицит, у 30 % он был незначительным, у 10 % был умеренным. ИИ при АФС склонны к рецидивированию, при отсутствии патогенетического лечения они, как правило, рецидивируют [1, 4, 5, 9, 10, 13].
Синдром Снеддона характеризуется сочетанием двух основных проявлений: цереброваскулярных нарушений ишемического характера и изменениями кожи в виде распространенного ливедо. У некоторых больных еще имеется артериальная гипертония, кардиологическая патология, тромбозы периферических вен, тромбоцитопения, легкий почечный синдром, у женщин спонтанные аборты или внутриутробная гибель плода, а также другие неврологические нарушения: головная боль, эпилептические припадки, когнитивные нарушения, достигающие иногда степени деменции, хорея, зрительная и периферическая нейропатия. Ливедо — представляет собой достаточно стойкие синеватые пятна на коже, имеющие ветвящуюся форму и различную интенсивность. Пятна могут сливаться друг с другом, образуя на коже сетевидный, неправильной формы рисунок, или располагаться на некотором расстоянии друг от друга. Из двух основных признаков синдрома Снеддона ливедо обычно проявляется первым, является генерализованным и вовлекает в процесс кожу рук, ног, ягодичной области и туловища. Расположение его на лице нетипично. Цереброваскулярные нарушения являются вторым признаком, обязательным для синдрома Снеддона. Они характеризуются ИИ, преходящими НМК; чаще проявляются через несколько лет (в среднем 8 лет) после появления ливедо. До возникновения ЦВН у большинства больных (около 80 %) уже есть некоторые основные признаки заболевания, как спонтанные аборты, периферические венозные тромбозы, ишемическая болезнь сердца (ИБС), тромбоцитопения. У некоторых пациентов наряду с острыми НМК имеются симптомы хронической недостаточности кровоснабжения головного мозга в виде головокружения, пошатывания, постепенно нарастающих когнитивных нарушений. ИИ являются основным проявлением цереброваскулярных нарушений при синдроме Снеддона и наблюдаются у 85 % больных [1, 4, 5, 9, 13, 15].
Эпилептические припадки являются вторым по частоте неврологическим проявлением АФС. Их частота по данным различных авторов варьирует от 4 до 29 % [3]. Эпилептические припадки у женщин чаще возникают, чем у мужчин. Сопряженные с полом факторы могут оказывать стабилизирующие влияние на мембрану нейронов и глии. Очевидно, при этом имеют значения и гормональные нарушения, а именно — относительное преобладание эстрогенов над прогестероном, что приводит к повышению судорожной готовности мозга. Чаще эпилептические припадки при АФС возникают после 20–30 лет, в связи с чем их относят к эпилепсии позднего возраста. Проявление судорожного синдрома может быть разнообразным, они могут быть генерализованными, тонико-клоническими и комплексными парциальными припадками, причем как со вторичной генерализацией, так и без генерализации. У некоторых больных различные виды эпилептических припадков могут сочетаться. Частота развития эпиприпадков у разных больных может варьировать от единичных генерализованных, возникающих 1‒2 раза в год, до ежедневных комплексных парциальных эпиприпадков [1, 2, 7, 12].
Клиническому выявлению связи эпилептических припадков с антителами к кардиолипину помогают другие неврологические и системные проявления АФС. Как правило, к моменту развития первого эпилептического припадка такие клинические проявления АФС, как цереброваскулярные нарушение, ИБС, тромбозы периферических вен, тромбоцитопении и осложненный акушерский анамнез, имеются у 80 % больных. Для верификации взаимосвязи эпилептических припадков с выработкой антител к ФЛ необходимо обнаружить эти антитела [1, 2, 12].
Синдром, имитирующий рассеянный склероз (СИРС), встречается, как при первичном (4 %), так и при вторичном АФС. Отличием АФС от РС является наличие антител к ФЛ. Данный синдром чаще встречается у женщин молодого возраста. СИРС у больных с АФС представлен различными неврологическими симптомами, указывающими на многоочаговое поражение головного и спинного мозга: парапарезы, нарушение функции тазовых органов, гемипарезы, атаксия, головокружение, двоение в глазах при восприятии зрительных образов, а также симптомы поражения зрительных нервов. У большинства больных имеются постепенно прогрессирующая миелопатия и/или зрительная нейропатия, спиноцеребеллярный синдром. К моменту появления СИРС у больных с первичным и вторичным АФС уже имеются системные и неврологические проявления: инфаркт миокарда, периферические и церебральные венозные тромбозы, мигренозные головные боли. Данные симптомы предшествуют проявлению СИРС от нескольких месяцев до нескольких лет. При исследовании антител к ФЛ необходимо учитывать, что их титры могут колебаться вплоть до отрицательных значений. Поэтому при наличии клинических данных о развитии СИРС на фоне АФС необходимо повторное исследование этих антител. У большинства больных наряду с антителами к КЛ обнаруживают и антитела к (β2-ГП 1). При исследовании спинномозговой жидкости характерные для РС олигоклональные IgG ‒ полоски у больных с АФС и СИРС отсутствуют или обнаруживаются редко. При МРТ головного мозга у большинства пациентов с СИРС выявляют мелкоочаговые изменения в белом веществе полушарий, реже — в зрительном бугре, мозжечке и стволе мозга, сходные с таковыми при РС (3). Однако в единичных случаях патологические изменения при МРТ не определяются. Необходимо помнить, что мелкоочаговые изменения в белом веществе мозга находят при различных неврологических заболеваниях, в связи с чем диагноз в каждом конкретном случае должен обязательно основываться на комплексной оценке клинических и лабораторных данных. При дифференциальной диагностике между СИРС при АФС и РС как самостоятельной нозологией в первую очередь учитывают наличие других системных и неврологических проявлений АФС (тромбозы, спонтанные аборты, мигренеподобные головные боли, нарушение мозгового кровообращенияидр.), а также признаки ревматических заболеваний (у больных с вторичным АФС), наследственной отягощенностью по АФС и ревматическим заболеванием, наличие антинуклеарного фактора и пониженного уровня комплемента [1, 3, 11, 14].
Головная боль является одним из наиболее распространенных неврологических проявлений первичного и вторичного АФС. Ее частота по данным различных авторов, в разных группах больных с различными неврологическими проявлениями составляет 23–78 %. Головные боли при АФС очень вариабельны по своим клиническим проявлением и чаще описываются, как мигренозные. Около 80 % всех головных болей при АФС по своим клиническим характеристикам соответствуют мигрени (чаще всего мигрени без ауры), в остальных случаях — головной боли напряжения, редко идиопатической прокалывающей головной боли. Головная боль начинается в молодом или даже детском возрасте. К моменту ее дебюта у больных уже часто имеются другие системные проявления первичного АФС. НМК, как правило развивается через несколько месяцев, а иногда даже лет после начала головных болей. Общим патогенетическим звеном головной боли и НМК при первичном АФС, очевидно, является нарушение функции эндотелия [1, 7, 8]. В некоторых случаях первичного АФС отмечают усиление головных болей перед развитием инсульта.
Диагноз головной боли, как одного из проявлений первичного АФС основывается на наличие двух системных и неврологических признаков этого синдрома (периферические тромбозы, невынашивание беременности, тромбоцитопения, ливедо, НМК, эпилептические припадки, хорея в анамнезе). Для иммунологического подтверждения ассоциации головной боли с выработкой антител к ФЛ необходимо обнаружение последних в крови. При проведении дифференциального диагноза необходимо знать, что головные боли при первичном АФС могут быть обусловлены повышением АД (артериальное давление), вертеброгенными и другими причинами. Появление стойкой головной боли в сочетании с признаками внутричерепной гипертензии служит основанием для исключения тромбоза венозных синусов головного мозга.
Деменции ‒ одно из проявлений АФС, которое может развиться как при его первичном, так и при вторичном варианте. Деменция обычно связана со множественными микроинфарктами в коре и прилежащем белом веществе головного мозга, обусловленном окклюзирующим процессом в артериях поверхности мозга. В этих случаях деменцию классифицируют, как мультинфарктную. Деменция при АФС возникает постепенно. Наряду со множественными инфарктами в генезе деменции при первичном АФС может иметь значение первичное иммунное повреждение вещества мозга вследствие его прямого взаимодействия с антителами к ФЛ. Мультиинфарктную деменцию при АФС очень сложно дифференцировать от болезни Альцгеймера, сенильной деменции, метаболического или токсического поражения мозга. Деменция характеризуется снижением, а в последствие и потерей когнитивных функций, снижение памяти и интеллекта, которые приводят к снижению способности выполнять повседневную работу. В первую очередь происходит нарушение мышления и снижение памяти [1, 7, 9].
Лечение и профилактика цереброваскулярных нарушений при АФС связаны с коррекцией коагуляционных нарушений, индуцированных антителами к ФЛ. Больным с цереброваскулярными нарушениями и тромбозами назначают антикоагулянты и антиагреганты.
Лечение СИРС при АФС зависит от характера патологических изменений мозга, неврологических симптомов и от стадии заболевания. Показано проведение пульс-терапии метилпреднизолоном в дозе 0,5–1,0 г внутривенно капельно через день, 3-4 раза. Затем его принимают внутрь (0,5–1,0 мг/кг), постепенно снижая дозу. Учитывая склонность больных к гиперкоагуляции, одновременно необходимо назначение небольших доз аспирина и антикоагулянтов. При неэффективности лечения кортикостероидами проводят плазмаферез [1, 3, 11]. Неспецифическое лечение включает назначение ноотропных препаратов и витаминов.
Больным с первичным АФС при мигренозных головных болях профилактически назначают небольшие дозы аспирина, блокаторы кальциевых каналов (верапамил, нифедипин, норваск), которые часто являются препаратами выбора, учитывая сопутствующую артериальную гипертензию и нарушение периферического кровообращения. Назначают также препараты содержащие эрготамин (вазобрал). У некоторых больных с упорными головными болями интенсивность последних снижалась после приема даназола.
Первичная профилактика АФС заключается в обнаружение высоких титров антител к КЛ, высокоактивного ВА, антител к β2-ГП 1, которые являются лабораторными маркерами высокого риска развития тромбозов [1, 4, 5]. Наличие у больных с антителами к ФЛ системных (нецеребральных тромбозов), невынашивания беременности, ливедо на коже, мигренеподобных головных болей является показанием для первичной профилактики. Для первичной профилактики тромбозов (не только церебральных) рекомендуют назначение небольших доз аспирина (75-100 мг) [1, 4, 7, 9, 14]. В качестве альтернативы рекомендуют небольшие дозы антикоагулянтов непрямого действия и антималярийных препаратов (плаквенил) [4, 7, 9]. Важным компонентом в первичной профилактике цереброваскулярных нарушений при АФС является устранение факторов повреждающих эндотелий: курения, гиперлипидемии, артериальной гипертонии. Противопоказан прием оральных эстрогенсодержащих контрацептивов, также назначение эстрогенсодержащих препаратов с лечебной целью при нарушении менструального цикла [1, 9, 10].
Вторичная профилактика — профилактика повторных цереброваскулярных нарушений у больных перенесших НМК. Используют антикоагулянты непрямого действия (варфарин). Применение только низких доз аспирина не предотвращает рецидива тромбоза у данных пациентов. По литературным данным, на фоне приема аспирина (50–100 мг) повторные НМК развивались у 17 % больных, у 47 % больных урежались, у 41 % прекращались преходящие НМК. Однако иногда через несколько месяцев или лет лечение одним аспирином становилось неэффективным (возобновлялись преходящие НМК), что требовало назначения антикоагулянтов непрямого действия. Временная отмена аспирина может приводить к возобновлению или учащению преходящих или повторных НМК [1, 4, 6, 9, 14].
Комбинированную терапию антикоагулянтами непрямого действия и аспирина назначают в тех случаях, когда монотерапия неэффективна и не позволяет добиться урежения или прекращения НМК [1, 4, 9]. Патогенетическим лечением ишемического инсульта при АФС является назначение антикоагулянтов прямого действия: гепарина и низкомолекулярных гепаринов (клексан, фрагмин, фраксипарин). Необходимо подчеркнуть, что прерывание приема непрямых антикоагулянтов, приводит к рецидиву тромбозов, причем риск развития повторных тромбозов особенно высок в первые 6 месяцев после отмены непрямых коагулянтов.
Антималярийные препараты, производные гидроксихлорохина (плаквенил) обладают иммуносупрессивным, противовоспалительным, противотромботическим, гиполипидемическим свойствами. Антималярийные препараты предотвращают развитие тромбозов вследствие их влияния на гемореологические свойства крови: уменьшение агрегации и адгезии тромбоцитов. Под влиянием антималярийных препаратов происходит снижение продукции цитокинов, происходит снижение синтеза интерлейкина — I, фактора некроза опухоли, который повреждают эпителий и способствуют тромбообразованию. Частично протекторное действие может быть обусловлено снижением титров антител к ФЛ [1]. Использование препаратов иммуноглобулинов при иммунных нарушениях обусловлено их способностью блокировать связывание антител с рецепторами макрофагов, повышать уровень Т-супрессоров, снижать синтез антител [1]. Введение иммуноглобулина применяют в комплексе с антикоагулянтами и антиагрегантами при повторных НМК, тромбоцитопении и системных тромбозах [1, 9].
Среди специфических эффектов плазмафереза выделяют детоксикацию, коррекцию реологических свойств крови, иммунокоррекцию, повышение чувствительности к эндогенным веществам и медикаментозным препаратам. Детоксикационный эффект достигается не только путем элиминации экзогенных и эндогенных токсичных субстанций, но и посредством антиоксидантного действия вследствие активации процессов биотрансформации промежуточных метаболитов, эндотоксинов бактерий до конечных продуктов. Действие плазмафереза, корригирующее реологические свойства крови, реализуется путем влияния на все звенья системы гемостаза. Особое значение в терапии больных с АФС приобретает удаление в процессе процедурыиммунных комплексов, аутоантигенов, что позволяет снизить активность aутоиммунного процесса. Под действием плазмафереза изменяются функциональные свойства мембран клеток, в частности повышается деформируемость и снижаются агрегационные свойства эритроцитов и тромбоцитов, что особенно важно у больших с АФС, ввиду наличия у большинства из них выраженной гиперкоагуляции. Плазмаферез может быть использован как в качестве подготовки к беременности, так и во время нее. Плазмаферез можно проводить в дискретном или непрерывном режиме с использованием в качестве плазмозамещающих растворов кристаллоидных, коллоидных и белковых препаратов. Описаны случаи успешного лечения резистентного АФС ритуксимабом, использование которого приводит к нормализации уровня тромбоцитов, снижению антител к КЛ [1, 9].
Таким образом, знакомство неврологов с уже известными в литературе неврологическими проявлениями АФС [1, 2, 3, 4, 6, 7, 9, 10, 11, 12, 14, 15] позволит во многих случаях избежать диагностических ошибок, назначить своевременное этиопатогенетическое лечение данного контингента больных, предупредив тяжелую инвалидизацию или даже смерть пациентов. Все больные с АФС должны находиться под длительным диспансерным наблюдением, первоочередной задачей которого является оценка степени риска рецидивирования тромбозов и их эффективная профилактика.
Литература:
- Калашникова Л. А. Неврология антифосфолипидного синдрома. / Л. А. Калашникова. ‒ М.: Медицина, 2003. ‒ 256 с.
- Калашникова Л. А. Эпилептические припадки при антифосфолипидном синдроме. / Л. А. Калашникова, Л. А. Добрынина, В. В. Гнездицкий // Неврологический журнал. ‒ 1999. ‒ № 5. ‒ С. 12–17.
- Калашникова Л. А. Неврологические проявления антифосфолипидного синдрома, имитирующие рассеянный склероз. / Л. А. Калашникова, Б. Д. Джамантаева // Нейрохирургия и неврология Казахстана. ‒ 2015. ‒ № 1 (38). ‒ С. 15-23.
- Калашникова Л. А. Цереброваскулярные нарушения при антифосфолипидном синдроме / Л. А. Калашникова // Анналы клинической и экспериментальной неврологии. ‒ 2011. ‒ Т. 5, № 1. ‒ С. 39-43.
- Куташов В. А., Ульянова О. В. Наиболее значимые предикторы кардиоэмболического инсульта, определяющие клиническую картину и исход заболевания. / В. А. Куташов, О. В. Ульянова // Вестник неврологии, психиатрии и нейрохирургии. ‒ 2016. ‒ № 6. ‒ С. 51-55.
- Макацария А. Д Катастрофический антифосфолипидный синдром и тромботический «шторм» / А. Д. Макацария, В. О. Бицадзе, С. В. Акиньшина // Сибирский медицинский журнал. ‒ 2010. ‒ Том 25, № 4 ‒ С. 118–123.
- Насонов Е. Л. Антифосфолипидный синдром. / Е. Л. Насонов. — М.: Литтерра, 2004. — 440 с.
- Насонова В. И. Избранные лекции по клинической ревматологии. / В. И. Насонова. — М.: Медицина, 2001. — 200 с.
- Неврологические проявления у больных с антифосфолипидным синдромом:учебно–методические рекомендации / В. А. Куташов, А. В. Чернов, О. В. Ульянова, Л. А. Куташова. — Воронеж: ВГМУ, 2016. — 92 с.
- Особенности диагностики и неврологических проявлений катастрофического антифосфолипидного синдрома / В. А. Куташов [и др.] // Научно-медицинский вестник Центрального Черноземья. ‒ 2016. ‒ № 65. ‒ С. 116-123.
- Синдром, имитирующий рассеянный склероз / В. А. Куташов, А. П. Скороходов,О. В. Ульянова, А. А. Дудина // Нейроиммунология — 2016. — Т. XIII, № 1–2. — С. 47.
- Ульянова О. В. Симптоматическая эпилепсия, как одно из проявлений антифосфолипидного синдрома / О. В. Ульянова, А. П. Скороходов, В. В. Белинская // Научно-медицинский вестник Центрального Черноземья. ‒ 2015. ‒ № 59. ‒ С. 134-138.
- Ульянова О. В. К вопросу о кардиогенных факторах риска возникновения ишемического инсульта у лиц молодого возраста / О. В. Ульянова, В. А. Куташов // Кардиоваскулярная терапия и профилактика. — 2015. — Т.1, спец. вып. ‒ № 15. — С. 62-63.
- Ульянова О. В., Скороходов А. П. Антифосфолипидный синдром в неврологии / О. В. Ульянова, А. П. Скороходов // матер. науч. практ. конф. «Актуальные проблемы неврологии», Воронеж. ‒ 2015. ‒ С. 304-310.
- Hughes G. R. V. The antiphospholipid syndrome: ten years on / G. R. V. Hughes // Lancet — 1993 — Vol. 324. — P. 341–344.
Основные термины (генерируются автоматически): тромбоз, проявление, больной, нарушение, антитело, головной, боль, головной мозг, синдром, молодой возраст.
Особенности неврологических проявлений у пациентов с антифосфолипидным синдромом Текст научной статьи по специальности «Клиническая медицина»
Т.И.ТУЛЕЕВА, Г.А.ДИХАНБАЕВА
OH.TYCTIK КАЗАХСТАН ОБЛЫСЫНДА БАЛАЛАР ЭПИЛЕПСИЯСЫНЫН, ЗЕРТТЕУ МЭСЕЛЕС1
ТYЙiн: Кептеген дамыган елдерде эпилепсиянын, таралуы женшде ресми деректер бар, бiрак; Казахстан бойынша балалар эпилепсиясы бойынша эпидемиологиялык; деректер жок;. Гылыми-зерттеу барысында ОКО калалык; жэне ауылдык; балалар популяциясынын, арасында облыс бойынша эпилепсиянын, таралу мэселеа бойынша осы патология женшде алдын-ала деректер алынды. ТYЙiн сездер: эпидемиология, таралуы, балалардагы эпилепсия.
T.I.TULEYEVA, G.A.DIHANBAEVA
THE STUDY OF THE PROBLEM OF EPILEPSY IN CHILDREN OF SOUTH KAZAKHSTAN REGION
Resume: There are official data of epilepsy prevalence in developed countries , but there are practically no epidemiological data on epilepsy in children in Kazakhstan. In the course of scientific studies on the problem of epilepsy in children in South Kazakhstan obtained preliminary data on the prevalence of this disease among the urban and rural children's population in the area.
Keywords: epidemiology, prevalence, epilepsy in children.
ОСОБЕННОСТИ НЕВРОЛОГИЧЕСКИХ ПРОЯВЛЕНИЙ У ПАЦИЕНТОВ С АНТИФОСФОЛИПИДНЫМ СИНДРОМОМ
О.В. УЛЬЯНОВА, В.А. КУТАШОВ, Т.Ю. ХАБАРОВА
ГБОУВПО ВГМУ им. Н.Н. Бурденко, Кафедра психиатрии и неврологии ИДПО
УДК 616-008.9-07:618.8.
Антифосфолипидный синдром (АФС) относится к одной из актуальных мультидисциплинарных проблем современной медицины. В связи с разнообразием клинических проявлений АФС является сферой интереса ревматологов, кардиологов, акушеров-гинекологов, гематологов, педиатров, но наибольшую актуальность представляет для неврологов, так как наиболее часто тромбозы локализуются в сосудах головного мозга, приводя к ишемическим нарушениям мозгового кровообращения (НМК). Другими неврологическими проявлениями АФС могут быть эпилептические припадки, деменция, головные боли, хорея, феноменологически напоминающие рассеянный склероз (РС).
Ключевые слова: антифосфолипидный синдром, неврологические проявления, нарушения мозгового кровообращения.
Антифосфолипидный синдром (АФС) - диффузное заболевание соединительной ткани,
характеризующееся повреждением интимы сосудов микроциркуляторного русла вследствие
формирования аутоиммунных антител к фосфолипидам (ФЛ) мембран клеток, которые включают в себя волчаночный антикоагулянт, антитела к кардиолипину (КЛ) и антитела к бета-2-гликопротеину 1 (Р2-ГП 1). Первичный АФС развивается у лиц без аутоиммунных заболеваний. Выделяют следующие группы: а) больные с тромбоэмболиями, прежде всего - в системе легочной артерии (ЛА), приводящими к развитию легочной гипертензии; б) пациенты молодого возраста (до 45 лет) с инсультами, транзиторными ишемическими атаками, окклюзией артерий, в том числе коронарных; наиболее яркий пример - синдром Снеддона; в) женщины с акушерской патологией (привычное невынашивание беременности) и внутриутробная гибель плода при отсутствии акушерско-гинекологической патологии; г) больные с аллергией к лекарственным препаратам (хинидин, гидролазин, фенотиазин, прокаинамид) [1, 2, 3, 4, 5, 6,
7, 8, 9, 10]. Разработан ряд критериев, присутствие любого из которых исключает первичный АФС [5, 6, 7,
8, 9]: наличие эритемы лица («бабочка»), дискоидная эритема, изъязвление слизистой рта или глотки (исключая изъязвление слизистой носовой перегородки и ее перфорацию, которые могут встречаться при первичном АФС), артриты, плевриты (без тромбоэмболии легочной артерии (ТЭЛА) или левожелудочковой недостаточности), перикардит (при исключении инфаркта миокарда или уремии), персистирующая протеинурия более чем 0,5 г/сут (наличие гломерулонефрита), лимфоцитопения (менее 1000 клеток в 1 мкл), антитела к нативной ДНК (радиоимунный метод), антитела к экстрагированным ядерным антигенам, антинуклеарные антитела в высоком титре (более 1:320), прием препаратов, индуцирующих выработку антител к ФЛ [5, 6]. Вторичный АФС имеет признаки как основного заболевания, так и АФС. Развивается на фоне аутоиммунных заболеваний (чаще всего -системной красной волчанки (СКВ), инфекционных заболеваний и лимфопролиферативных болезней, изменяющих иммунный статус организма [5, 6, 8].
КазНМУ
№2-2016
Вторичный АФС может быть проявлением следующих заболеваний: болезнь шегрена, полихондрит, ревматическая лихорадка, системные васкулиты (узелковый периартериит, болезнь Хортона, болезнь Такаясу, болезнь Шенлейн-Геноха), неспецифический язвенный колит, болезнь Крона, саркоидоз, аутоиммунная тромбоцитопения, иммунный тиреоидит, миастения,
инсулинозависимый сахарный диабет,
злокачественные опухоли (солидные опухоли, тимома, карциномы), лейкемии, инфекционно-иммунные заболевания (болезнь Лайма, бронхиальная астма, ВИЧ-инфекция,
стафилококковая и стрептококковая инфекции), заболевания почек и печени; инфекционные заболевания, вызванные туберкулезной палочкой, спирохетами, малярийным плазмодием [1, 5, 6, 7, 8]. Также следует выделить другие варианты АФС, характеризующиеся внезапным и острым развитием данного заболевания. К ним относятся: а) Катастрофический АФС (КАФС) (острая диссеминированная коагулопатия и вазопатия), проявляющийся острым мультиорганным тромбозом и имитирующий синдром ДВС или гемолитикоуремический синдром; б)
Серонегативный АФС - без антител к ФЛ, когда отсутствуют серологические маркеры - антитела к КЛ и волчаночному антикоагулянту (ВА), а также феномен тромботического шторма (ФТШ) (множественные тромбозы, развивающиеся в течение короткого периода времени) [1, 2, 5, 6, 8]. Но известные в настоящее время формы тромбофилии выявляются не всегда. Критерии диагностики феномена ФТШ включают два или более эпизода венозных или артериальных
тромбоза/микроангиопатии; атипичную
локализацию тромбозов; рефрактерность тромбозов к стандартной терапии. Наиболее частым этиологическим фактором ФТШ является беременность. Причиной возникновения данного состояния гомеостаза человека служат тяжелые формы мультигенной тромбофилии (две и более гомозиготные формы высокотромбогенных мутаций) одновременно с повышенными уровнями кофакторов. Для своевременной диагностики необходимо исследовать уровень
антифосфолипидных антител у всех пациентов с ДВС-синдромом, особенно у пациентов, у которых развиваются тромбозы при отсутствии явного провоцирующего фактора, при рецидивирующих тромбозах, при тромботических осложнениях во время беременности, включая тяжелую акушерскую патологию, в том числе - при преэклампсии, антенатальной гибели плода, подозрении на эмболию околоплодными водами [2]. К другим формам АФС относят и полиорганную недостаточность, а также: а) тромботическую тромбоцитопеническую пурпуру; б) гемолитико-уремический синдром, в) HELLP-синдром; г) ДВС-синдром; е) синдром волчаночный антикоагулянт-опосредованной гипопротромбинемии [5, 6, 8]. В развитии АФС играют важную роль следующие этиологические факторы: наследственный, инфекционный и гендерный [5, 6]. Клиническим подтверждением значения наследственной предрасположенности к развитию
иммунопатологического процесса при АФС служит наличие семей, несколько членов которых страдают
этим заболеванием или имеют его отдельные клинические или иммунологические проявления [5, 8]. P. Ford и соавт. [5, 8] описали семью с первичным АФС, в которой мать и дочь в молодом возрасте перенесли ишемические НМК. У матери еще имелись и другие проявления первичного АФС: повторные выкидыши, тромбоз периферических вен, транзиторная тромбоцитопения. Иммунологические маркеры АФС включали положительный ВА, антитела к КЛ и ФС [1, 2, 5, 6, 7, 8, 9]. Вирусные и бактериальные токсины, повреждая ткани, приводят к экспозиции белков, которые могут быть антигенным стимулом, и с другой стороны, сами инфекционные агенты (вирусы, бактерии, риккетсии, спирохеты) могут вызывать продукцию антител к ФЛ, так как их оболочка содержит большое количество ФЛ. По данным Калашниковой Л.А. [5], существенное значение имеет стрептококковая инфекция. У 63% больных с синдромом Снеддона в анамнезе имелось указание на частые ангины, у 30% из них проводилась тонзилэктомия. Установлено, что антитела к ФЛ вырабатываются при различных острых инфекциях и по мере стихания последних уровень антител к КЛ нормализуется. Но при стрептококковой инфекции, количество антител к КЛ остается повышенным, что предположительно отражает развитие аутоиммунного процесса [5]. Еще одним фактором, предрасполагающим к развитию АФС, является дисбаланс половых гормонов. Известно, что аутоиммунные заболевания чаще развиваются у женщин, нередко имеющих признаки гиперэстрогенемии, чем у мужчин [5, 8]. Эстрогены усиливают иммунный ответ за счет ингибирования Т-супрессоров и активации В-лимфоцитов, тогда как андрогены и прогестерон обладают иммуносупрессивным действием [5, 8]. Эстрогены не только влияют на иммунную систему, но и дополнительно создают прокоагулянтное состояние, повышая уровень фибриногена, протромбина, коагуляционных факторов VII, X, XII свертывающей системы [5, 8].
Истинная распространенность АФС в популяции до сих пор неизвестна. Учитывая, что синтез антител к ФЛ может быть и в норме, низкий уровень антител нередко встречается в крови здоровых людей. По данным различных авторов, частота выявления антител к КЛ в популяции варьирует от 0 до 14%, составляя в среднем 2-4%, при этом высокие титры обнаруживаются достаточно редко - у 0,2% пациентов, чаще пожилого, чем молодого возраста. При этом клиническое значение антител к ФЛ у «здоровых» лиц (т.е. не имеющих явных симптомов заболевания) уровень повышенных не вполне ясно. Часто при повторных анализах уровень повышенных в предшествующих определениях антител нормализуется. Нарастание частоты встречаемости антител к ФЛ отмечено при некоторых воспалительных, аутоиммунных, инфекционных заболеваниях, злокачественных новообразованиях, на фоне приема лекарственных препаратов (оральные контрацептивы, психотропные средства и др.). Имеются данные об иммуногенетической предрасположенности к повышенному синтезу антител к ФЛ и более частом их выявлении у родственников больных АФС. Чаще заболевание развивается в молодом, чем в пожилом возрасте, описано у детей и даже новорожденных. В общей
популяции АФС встречается чаще у женщин [1, 5, 6, 8,
9].
Поскольку в основе АФС лежит невоспалительная тромботическая васкулопатия, затрагивающая сосуды любого калибра и локализации, от капилляров до крупных сосудов, включая аорту, спектр клинических проявлений чрезвычайно разнообразен. В рамках данного заболевания описаны патология центральной нервной системы (ЦНС), патология сердечно-сосудистой системы (ССС), нарушение функции почек, печени, эндокринных органов, желудочно-кишечного тракта (ЖКТ). С тромбозом сосудов плаценты связывают развитие некоторых форм акушерской патологии. Характерной особенностью АФС является частое рецидивирование тромбозов. Замечено, если первым проявлением АФС был артериальный тромбоз, то и в последующим у большинства больных будут наблюдаться артериальные тромбозы, а у больных с первично возникшим венозным тромбозом рецидивируют венозные тромбозы [2 ,5, 6, 8].
Цереброваскулярные нарушения (ЦВН) при АФС в 75% случаев дебютируют с ишемическим инсультом. Также, как преходящие НМК, они развиваются в бассейне различных мозговых артерий, чаще - в системе сонных артерий, реже - в системе вертебробазилярных артерий. Очаговая
неврологическая симптоматика в остром периоде инсульта разнообразна и определяется локализацией очаговых изменений в веществе головного мозга. Темп развития очаговых неврологических симптомов достаточно быстрый. Инсульт, как правило, развивается в период бодрствования, очень редко неврологические симптомы развиваются после ночного сна. Сознание в остром периоде обычно не нарушено, очевидно из-за характерного для АФС малого или среднего инфаркта мозга. У пациенток с АФС инсульты могут возникать во время беременности, после родов или медицинских абортов.
Характерной особенностью ишемических НМК при АФС является хорошее восстановление очаговых неврологических симптомов. Значительное обратное развитие парезов обусловлено небольшими или средними размерами инфарктов мозга и их локализацией вне зоны, функционально значимой для двигательных функций. Хороший регресс очаговой неврологической симптоматики при ишемическом инсульте у больных с антителами к ФЛ отмечают и зарубежные авторы. У 50% больных к моменту выписки из стационара отсутствовал остаточный неврологический дефицит, у 30% он был незначительным, у 10% был умеренным [5]. Ишемические НМК при АФС склонны к рецидивированию. Среди обследованных больных по данным российских исследователей повторные инсульты развивались у 30% больных [5], по наблюдениям зарубежных исследователей - в 31-38% случаев [5, 8, 9]. Повторные инсульты развиваются со средней частотой 9,4-18,7% в год, что значительно выше, чем в общей популяции больных с ЦВН [5, 8, 9]. Риск повторного инсульта у молодых больных с антителами к ФЛ в 8 раз выше, чем у пациентов, не имеющих этих антител [5]. В среднем инсульты рецидивируют через 8-12 месяцев после предшествующего НМК. Повторные инсульты развиваются в разных сосудистых бассейнах, а не только в том, где произошло первое НМК. Это служит
клиническим указанием на то, что они связаны не с локальным, органическим поражением церебральных артерий, а вызваны общими причинами, а именно -гиперкоагуляционным состоянием. Синдрома Снеддона характеризуется сочетанием двух основных проявлений: цереброваскулярных нарушений ишемического характера и изменениями кожи в виде распространенного ливедо. У некоторых больных еще имеется артериальная гипертония, кардиологическая патология, тромбозы
периферических вен, тромбоцитопения, легкий почечный синдром, у женщин спонтанные аборты или внутриутробная гибель плода, а также другие неврологические нарушения: головная боль, эпилептические припадки, когнитивные нарушения, достигающие иногда степени деменции, хорея, зрительная и периферическая нейропатия. Ливедо -представляет собой достаточно стойкие синеватые пятна на коже, имеющие ветвящуюся форму и различную интенсивность. Пятна могут сливаться друг с другом, образуя на коже сетевидный неправильной формы рисунок, или располагаться на некотором расстоянии друг от друга. Из двух основных признаков синдрома Снеддона ливедо обычно проявляется первым, является генерализованным и вовлекает в процесс кожу рук, ног, ягодичной области и туловища. Его расположение на лице нетипично.
Цереброваскулярные нарушения являются вторым признаком, обязательным для синдрома Снеддона. Они характеризуются ишемическими инсультами, преходящими НМК. Чаще они проявляются через несколько лет (в среднем 8 лет) после появления ливедо. До возникновения ЦВН у большинства больных (около 80%) уже есть некоторые основные признаки заболевания, как спонтанные аборты, периферические венозные тромбозы, ишемическая болезнь сердца (ИБС), тромбоцитопения. У некоторых пациентов наряду с острыми НМК имеются симптомы хронической недостаточности кровоснабжения головного мозга в виде головокружения, пошатывания, постепенно нарастающих
когнитивных нарушений. Ишемические инсульты являются основным проявлением
цереброваскулярных нарушений при синдроме Снеддона и наблюдаются у 85% больных. При отсутствии патогенетического лечения они, как правило, рецидивируют [5, 8].
Эпилептические припадки являются вторым по частоте неврологическим проявлением АФС. Их частота варьирует от 4 до 29%. Эпилептические припадки у женщин чаще возникают, чем у мужчин. Сопряженные с полом факторы могут оказывать стабилизирующие влияние на мембрану нейронов и глии. Очевидно, имеют значения и гормональные нарушения, а именно относительное преобладание эстрогенов над прогестероном, что приводит к повышению судорожной готовности мозга. Чаще эпилептические припадки при АФС возникают после 20-30 лет, в связи с чем их относят к эпилепсии позднего возраста. Структура эпилептических припадков разнообразна. Обычно наблюдаются генерализованные тонико-клонические припадки и комплексные парциальные припадки без генерализации или с вторичной генерализацией. Значительно реже встречаются простые парциальные припадки. У некоторых больных с АФС отмечают сочетание припадков разных типов,
КазНМУ
№2-2016
обычно генерализованных и комплексных, причем в ходе заболевания они могут возникать почти одновременно или с интервалом 3-15 лет. Частота эпиприпадков у разных больных различна: от единичных генерализованных, возникающих реже 1 раза в год, до почти ежедневных комплексных парциальных припадков. В некоторых случаях наблюдают спонтанное, не связанное с лечением исчезновение приступов. Во времени это может быть связано с присоединением цереброваскулярных нарушений (преходящие НМК, ишемические инсульты). Вероятно это обусловлено спектром продуцируемым антител к ФЛ и как следствие изменения их направленности (против эндотелия и тромбоцитов, а не нейронов). Альтернативным объяснением является снижение интратекальной продукции указанных антител [5, 8]. ЭЭГ у больных с АФС и эпилептическими припадками в основном характеризуется сниженным или средним амплитудным уровнем, отчетливой дезорганизацией альфа-ритма, признаками дисфункции медиально-базальных структур мозга. В большинстве случаев выявляются локальные знаки, представленные разрядной активностью в височных или лобно-височных отделах мозга с неустойчивым преобладанием по амплитуде в билатеральном разряде то в одном, то в другом полушарии, или же в одном из них. Клиническому распознаванию ассоциации эпилептических припадков с продукцией антител к ФЛ помогают другие системные и неврологические проявления АФС [10]. К моменту развития первого эпилептического приступа, такие клинические проявления АФС, как
цереброваскулярные нарушение, ИБС, тромбозы периферических вен, тромбоцитопении и осложненный акушерский анамнез, имеются у 80% больных. Для подтверждения взаимосвязи эпилептических припадков с продукцией антител к ФЛ необходимо обнаружить эти антитела. КАФС (синдром Ашерсона) является наиболее тяжелой формой АФС. Он проявляется множественными тромбозами жизненно важных органов и развитием синдрома полиорганной недостаточности (СПОН) на фоне высокого титра антител к ФЛ. Этот синдром носит имя Ашерсона, который в 1992 г. впервые ввел в клиническую практику термин КАФС. Хотя КАФС развивается менее чем у 1% из всех пациентов с АФС, он является угрожающим жизни состоянием и требует неотложной терапии. Летальность при КАФС достигает 50%. Несмотря на то, что изучению КАФС в последние годы уделяется пристальное внимание, часто КАФС не диагностируется и, следовательно, не применяются рекомендуемые методы терапии. КАФС развивается как у женщин, так и мужчин: у женщин он наблюдается в 2 раза чаще, а течение и исходы хуже у мужчин. Средний возраст пациентов составляет 37 лет (от 7 до 76 лет). В 45% случаев КАФС является первым проявлением заболевания. Различные провоцирующие факторы выявлены более чем у 45% пациентов с КАФС [2, 5]. В качестве такого фактора в большинстве случаев (40%) выступает инфекция. Кроме того, провоцирующим фактором для развития КАФС могут стать хирургические вмешательства (например, гистерэктомия, кесарево сечение, холецистэктомия), в том числе даже небольшие (экстракция зуба, РХПГ, кюретаж матки, биопсия), отмена антикоагулянтов,
использование некоторых лекарственных препаратов (чаще всего оральных контрацептивов), онкологические заболевания. При КАФС за короткий промежуток времени (в течение 1 недели) происходит развитие множественных тромбозов различных органов. В противоположность некатастрофическому АФС наблюдается
множественная окклюзия сосудов мелкого калибра (хотя могут вовлекаться и более крупные сосуды). Для КАФС наиболее характерны почечные, легочные, церебральные и гастроинтестинальные тромбозы. Часто встречаются атипичные для АФС тромбозы: надпочечниковые, селезеночные, тестикулярные, яичниковые, кожные, тромбозы поджелудочной железы, предстательной железы; тромбозы могут лежать в основе развития бескаменного холецистита, язв ЖКТ. Некроз костного мозга является редким осложнением, которое описано у пациентов с метастатическими опухолями, ДВС-синдромом, развившимся после радио- или химиотерапии, у пациентов с септическим шоком. Теперь этот список пополнен еще и сообщениями о развитии некроза костного мозга при КАФС. У небольшого числа пациентов с КАФС развиваются тромбозы крупных сосудов (вен нижних конечностей, тромбозы коронарных и церебральных артерий), то есть проявления, характерные для классического АФС. Характерен рецидив тромбозов несмотря на проводимую адекватную антикоагулянтную терапию.
В результате тромботической микроваскулопатии развивается СПОН. Клинически это может проявляться нарушениями ЦНС, включая ступор, дезориентацию, параличи, развитием
надпочечниковой недостаточности (у 13%), дыхательной недостаточности, развитием инфарктов миокарда (у 25%). Характерным симптомом КАФС является развитие острого респираторного дистресс-синдрома (ОРДС) (в 25% случаев). Обнаружение антител к ФЛ в бронхоальвеолярной жидкости подтверждает его аутоиммунную природу. Практически у 80% пациентов поражаются почки с развитием почечной микроангиопатии и окклюзией мелких сосудов. Часто (в 60% случаев) выявляются и симптомы поражения головного мозга (инсульт, транзиторные ишемические атаки, судороги, кома), однако микротромбозы сосудов головного мозга могут развиваться и гораздо чаще, чем это диагностируется, и могут быть причиной развития энцефалопатии при КАФС. Более чем у половины пациентов с КАФС наблюдается поражение сердца. В большинстве случаев оно проявляется развитием аортальной и митральной недостаточности, которые могли сформироваться ранее на фоне СКВ или АФС [2].
Ранняя диагностика и начало адекватной терапии являются критическими для исхода КАФС. При подозрении на КАФС незамедлительно должна быть начата агрессивная терапия. Следует отметить, что серологическое выявление маркеров АФС или обнаружение ВА требует времени, что часто невозможно, а порой на фоне прогрессирующих тромбозов или вследствие длительной иммуносупрессивной терапии результаты лабораторных исследований могут быть отрицательными. Таким образом, установление диагноза КАФС в соответствии с имеющимися на
сегодня международными критериями в клинике часто является очень сложной задачей [2, 5]. Лечение КАФС проводят комплексно: используют антикоагулянты в сочетании с высокими дозами кортикостероидов, вводимых внутривенно. Применяют плазмаферез, внутривенно вводимый иммуноглобулин. Исходы лечения зависят от тяжести коагуляционных нарушений.
Лечение и профилактика цереброваскулярных нарушений при АФС связаны с коррекцией коагуляционных нарушений, индуцированных антителами к ФЛ. Больным с цереброваскулярными нарушениями и тромбозами назначают антикоагулянты и антиагреганты. Первичная профилактика АФС заключается в обнаружение высоких титров антител к КЛ, высокоактивного ВА, антител к Р2-ГП 1, которые являются лабораторными маркерами высокого риска развития тромбозов [5, 8]. Наличие у больных с антителами к ФЛ системных (нецеребральных тромбозов), невынашивания беременности, ливедо на коже, мигренеподобных головных болей является показанием для первичной профилактики. Для первичной профилактики тромбозов (не только церебральных) рекомендуют назначение небольших доз аспирина (75-100мг) [5, 8]. В качестве альтернативы рекомендуют небольшие дозы антикоагулянтов непрямого действия и антималярийных препаратов (плаквенил) [5, 8]. Важным компонентом в первичной профилактике цереброваскулярных нарушений при АФС является устранение факторов повреждающих эндотелий: курения, гиперлипидемии, артериальной гипертонии. Противопоказан прием оральных эстрогенсодержащих контрацептивов, также назначение эстрогенсодержищих препаратов с лечебной целью при нарушении менструального цикла [5].
Вторичная профилактика - профилактика повторных цереброваскулярных нарушений у больных перенесших НМК. Используют антикоагулянты непрямого действия (варфарин). Применение только низких доз аспирина не предотвращает рецидива тромбоза у данных пациентов. По литературным данным, на фоне приема аспирина (50-100 мг) повторные НМК развивались у 17% больных, у 47% больных урежались, у 41% прекращались преходящие НМК. Однако иногда через несколько месяцев или лет лечение одним аспирином становилось неэффективным (возобновлялись преходящие НМК), что требовало назначения антикоагулянтов непрямого действия. Временная отмена аспирина может приводить к возобновлению или учащению преходящих или повторных НМК [5, 6, 7, 8].
Комбинированную терапию антикоагулянтами непрямого действия и аспирина назначают в тех случаях, когда монотерапия неэффективна и не позволяет добиться урежения или прекращения НМК [5, 6, 8]. Патогенетическим лечением ишемического инсульта при АФС является назначение антикоагулянтов прямого действия: гепарина и низкомолекулярных гепаринов (клексан, фрагмин, фраксипарин). Необходимо подчеркнуть, что прерывание приема непрямых антикоагулянтов, приводит к рецидиву тромбозов (иногда развитию КАФС), причем риск развития повторных тромбозов особенно высок в первые 6 месяцев после отмены
непрямых коагулянтов. Антималярийные препараты, производные гидроксихлорохина (плаквенил) обладают иммуносупрессивным,
противовоспалительным, противотрмботическим, гиполипидемическим свойствами. Антималярийные препараты предотвращают развитие тромбозов вследствие их влияния на гемореологические свойства крови: уменьшение агрегации и адгезии тромбоцитов. Под влиянием антималярийных препаратов происходит снижение продукции цитокинов, происходит снижение синтеза интерлейкина -I, фактора некроза опухоли, который повреждают эпителий и способствуют тромбоомбразованию. Частично протекторное действие может быть обусловлено снижением титров антител к ФЛ [5]. Использование препаратов иммуноглобулинов при иммунных нарушениях обусловлено их способностью блокировать связывание антител с рецепторами макрофагов, повышать уровень Т-супрессоров, снижать синтез антител [5]. Введение иммуноглобулина применяют в комплексе с антикоагулянтами и антиагрегантами при повторных НМК, тромбоцтопении и системных тромбозах [4, 5, 9].
Среди специфических эффектов плазмафереза выделяют детоксикацию, коррекцию реологических свойств крови, иммунокоррекцию, повышение чувствительности к эндогенным веществам и медикаментозным препаратам. Детоксикационный эффект достигается не только путем элиминации экзогенных и эндогенных токсичных субстанций, но и посредством антиоксидантного действия вследствие активации процессов биотрансформации промежуточных метаболитов, эндотоксинов бактерий до конечных продуктов. Действие плазмафереза, корригирующее реологические свойства крови, реализуется путем влияния на все звенья системы гемостаза. Особое значение в терапии больных с АФС приобретает удаление в процессе процедуры иммунных комплексов, аутоантигенов, что позволяет снизить активность аутоиммунного процесса. Под действием плазмафереза изменяются функциональные свойства мембран клеток, в частности повышается деформируемость и снижаются агрегационные свойства эритроцитов и тромбоцитов, что особенно важно у больших с АФС, ввиду наличия у большинства из них выраженной гиперкоагуляции. Плазмаферез может быть использован как в качестве подготовки к беременности, так и во время нее. Плазмаферез можно проводить в дискретном или непрерывном режиме с использованием в качестве плазмозамещающих растворов кристаллоидных, коллоидных и белковых препаратов. Описаны случаи успешного лечения резистентного АФС ритуксимабом, использование которого приводит к нормализации уровня тромбоцитов, снижению антител к КЛ [5, 6, 8].
Таким образом, знакомство неврологов с уже известными в литературе неврологическими проявлениями АФС [1, 2, 3, 4, 5, 6, 7, 8, 9, 10] позволит во многих случаях избежать диагностических ошибок, назначить своевременное
этиопатогенетическое лечение, предупредив тяжелую инвалидизацию или даже смерть пациентов. Все больные с АФС должны находиться под длительным диспансерным наблюдением, первоочередной задачей которого является оценка
СПИСОК ЛИТЕРАТУРЫ
1 Е.Л. Насонов, З.С. Алекберова, Л.А. Калашникова и др. Антифосфолипидный синдром (синдром Hughes): 10 лет изучения в России // Клин. мед. - 1998. - №2. - С. 4 - 11.
2 В.О. Бицадзе, Д.Х. Хизроева, Н.А. Макацария и др. Антифосфолипидные антитела, их патогенетическое и диагностическое значение при акушерской патологии / // Акушерство, гинекология и репродукция. - 2014. - N2. - С. 39 - 60.
3 .Н. Спирина, А.Н. Бойко, И.О. Степанова, Т.Е. Шмидт Ведение больных с рассеянным склерозом: Метод. Рекомендации. - М.: 2015. - 68 с.
4 Гусев Е.И. Рассеянный склероз и другие демиелинизирующие заболевания. - М.: 2004. - 540 с.
5 Калашникова Л.А. Неврология антифосфолипидного синдрома. - М.: Медицина, 2003 - 256 с.
6 Насонов Е.Л. Антифосфолипидный синдром. - М.: Литтерра, 2004. - 440 с.
7 Насонова В.И. Избранные лекции по клинической ревматологии. - М.: Медицина, 2001. - 200 с.
8 В.А. Куташов, А.В. Чернов, О.В. Ульянова, Л.А. Куташова Неврологические проявления у больных с антифосфолипидным синдромом: Учебно-метод. пособие для врачей неврологов, терапевтов, врачей общей практики, клинических ординаторов и интернов. - Воронеж: 2015. - 90 с.
9 Ульянова О.В. Антифосфолипидный синдром в неврологии // Материалы научно-практической конференции неврологов ЦФО РФ, посвященной 125-летию со дня рождения Н.М. Иценко «Актуальные проблемы неврологии». - Воронеж: 2015. - С. 304 - 310.
10 Ульянова О.В. Симптоматическая эпилепсия, как одно из проявлений антифосфолипидного синдрома // Научно-медицинский вестник Центрального Черноземья. - 2015. - № 59. - С. 134 - 138.
O.V. ULYANOVA, V.A. KUTASHOV, T.YU. KHABAROVA
FEATURES NEUROLOGICAL MANIFESTATIONS IN PATIENTS WITH ANTIPHOSPHOLIPID SYNDROME
Resume: Antiphospholipid syndrome (APS) refers to one of the actual multi-disciplinary problems of modern medicine. Due to the variety of clinical manifestations of APS is a sphere of interest of rheumatologists, cardiologists, obstetricians, hematologists, pediatricians, but the greatest urgency is to neurologists as thromboses localized most frequently in the cerebral blood vessels, leading to ischemic cerebrovascular disorder (CVD). Other neurological manifestations of APS can be seizures, dementia, headache, chorea, phenomenologically reminiscent of multiple sclerosis (MS). Keywords: antiphospholipid syndrome, neurological symptoms, disorders of cerebral circulation.
О.В. УЛЬЯНОВА, В.А. КУТАШОВ, Т.Ю. ХАБАРОВА
ANTIPHOSPHOLIPID СИНДРОМЫ БАР НАУКАСТАРДА НЕВРОЛОГИЯЛЫК КОР1Н1СТЕРДЩ ЕРЕКШЕЛ1КТЕР1
Тушн: Антифосфолипидтж синдромы (APS) к;аз1рп замангы медицинанын, езект пэнаралы; мэселердщ бiрiне жатады. Клиникалы; кершютердщ эртурлшгше байланысты АЭС ревматологтар, кардиолог, акушер-гинекологтар, гематолог, педиатрлардын, мудделер саласы болып табылады, бiрак; неврологтарга ен, улкен езектшж ишемиялы; цереброваскулярлы; бузылуы (CVD) экелетш мидагы ;ан тамырларынын, жш жерсiндiрiлген Тромбоз болып табылады. Бас;а да АЭС неврологиялы; керiнiстерi феноменологиялы; еске алу склерозы (КП), деменция, бас ауруы, хорее болуы мумкш.
ТYЙiндi сездер: антифосфолипидтж синдромы, неврологиялы; симптомдар, цереброваскулярлык о;игасы.