Получение диэтилового эфира
Диэтиловый эфир — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 29 января 2019; проверки требуют 9 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 29 января 2019; проверки требуют 9 правок.| Диэтиловый эфир | |||
|---|---|---|---|
| |||
| Систематическое наименование | Этоксиэтан | ||
| Хим. формула | C4H10 O | ||
| Состояние | жидкость | ||
| Молярная масса | 74,12 г/моль | ||
| Плотность | 0,714 г/см³ | ||
| Энергия ионизации | 9,53 ± 0,01 эВ[1] | ||
| Температура | |||
| • плавления | -116,3 °C | ||
| • кипения | 34,65 °C | ||
| • разложения | 193,4 °C | ||
| • вспышки | −49 ± 1 °F[1] | ||
| Пределы взрываемости | 1,9 ± 0,1 об.%[1] | ||
| Давление пара | 440 ± 1 мм рт.ст.[1] | ||
| Растворимость | |||
| • в воде | (для 20 °С) 6,5 г/100 мл | ||
| Рег. номер CAS | 60-29-7 | ||
| PubChem | 3283 | ||
| Рег. номер EINECS | 200-467-2 | ||
| SMILES | |||
| InChI | |||
| RTECS | KI5775000 | ||
| ChEBI | 35702 | ||
| Номер ООН | 1155 | ||
| ChemSpider | 3168 | ||
| Пиктограммы ECB | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
Диэтиловый эфир (этиловый эфир, серный эфир, этоксиэтан). По химическим свойствам — типичный алифатический простой эфир. Широко используется в качестве растворителя. Впервые получен в Средние века.
Возможно, что впервые диэтиловый эфир был получен в IX веке алхимиком Джабир ибн Хайяном[2] либо алхимиком Раймундом Луллием в 1275 году[2][3]. Достоверно известно, что он был синтезирован в 1540 году Валерием Кордусом, который назвал его «сладким купоросным маслом» (лат. oleum dulce vitrioli), поскольку получил его перегонкой смеси этилового спирта и серной кислоты, которая тогда называлась «купоросным маслом»[2]. Кордус также отметил его анестезирующие свойства. В 1680 году Роберт Бойль вторично синтезировал эфир. Затем в 1704 году Исаак Ньютон открыл эфир в третий раз, в поисках синтеза искусственного золота.[4]
Название «эфир» было дано этому веществу в 1729 году Фробениусом[en][5].
В 1794 году эфир был испытан для вдыханий с целью уменьшения болей, а в 1795 году Томас Беддоус создал Медицинский пневматический институт для лечения различных легочных заболеваний газами. Такие газы тогда называли "искусственным воздухом". [4]
Получают действием на этиловый спирт кислотных катализаторов при нагревании, например, перегонкой смеси этилового спирта и серной кислоты при температуре порядка 140—150 °C. Также получается как побочный продукт в производстве этилового спирта гидратацией этилена в присутствии фосфорной кислоты или 96—98 % серной кислоты при 65—75 °С и давлении 2,5 МПа. Основная часть диэтилового эфира образуется на стадии гидролиза этилсульфатов (95—100 °C, 0,2 МПа).
- Бесцветная, прозрачная, очень подвижная, летучая жидкость со своеобразным запахом и жгучим вкусом.
- Растворимость в воде 6,5 % при 20 °C. Образует азеотропную смесь с водой (т. кип. 34,15 °C; 98,74 % диэтилового эфира). Смешивается с этанолом, бензолом, эфирными и жирными маслами во всех соотношениях.
- Легко воспламеняется, в том числе пары; в определённом соотношении с кислородом или воздухом пары эфира для наркоза взрывоопасны.
- Разлагается под действием света, тепла, воздуха и влаги с образованием токсичных альдегидов, пероксидов и кетонов, раздражающих дыхательные пути.
- Образующиеся пероксиды нестойки и взрывоопасны, они могут быть причиной самовоспламенения диэтилового эфира при хранении и взрыве при его перегонке «досуха»
По химическим свойствам диэтиловый эфир обладает всеми свойствами, характерными для простых эфиров, например, образует нестойкие оксониевые соли с сильными кислотами:
- (C2H5)2O+HBr→[(C2H5)2OH]+Br−{\displaystyle {\mathsf {(C_{2}H_{5})_{2}O+HBr\rightarrow [(C_{2}H_{5})_{2}OH]^{+}Br^{-}}}}
Образует сравнительно стабильные комплексные соединения с кислотами Льюиса: (C2H5)2O·BF3
Фармакология[править | править код]
В медицине используется в качестве лекарственного средства общеанестезирующего действия, так как его влияние на нейронные мембраны и свойство «обездвиживать» ЦНС очень специфично и полностью обратимо. Применяется в хирургической практике для ингаляционного наркоза, а в стоматологической практике — местно, для обработки кариозных полостей и корневых каналов зуба при подготовке к пломбированию.
В связи с медленным разложением диэтилового эфира, должны строго выдерживаться установленные сроки хранения. Для наркоза можно применять эфир только из склянок, открытых непосредственно перед операцией. По истечении каждых 6 месяцев хранения эфир для наркоза проверяют на соответствие требованиям. Использование технического эфира в этих целях не допускается.
Выдающийся отечественный хирург Н.И. Пирогов первым в истории медицины начал оперировать раненых с эфирным обезболиванием в полевых условиях и всего провел около десяти тысяч операций под эфирным наркозом.
Техника[править | править код]
Диэтиловый эфир — аэрозоль для быстрого запуска.Инструкция утверждает, что возможен запуск при температуре −55 °F (−48,3 °C)
В СССР выпускалась пусковая жидкость «Арктика», небольшое количество заливалось во впускной коллектор через карбюратор при снятом воздушном фильтре. Для армии выпускался эфир в алюминиевой запечатанной гильзе, перед использованием гильза протыкалась штык-ножом или отвёрткой. За рубежом выпускается «жидкость для запуска в холодные дни» в аэрозольном баллоне. Состав: диэтиловый эфир, индустриальное масло, пропеллент.
Механизм запуска ДВС в этом случае по большей мере компрессионный: смесь эфира с воздухом воспламеняется от сжатия уже при степени сжатия порядка 5-6. Потерявшие компрессию по разным причинам двигатели могут делать несколько оборотов на эфире, но на бензине, тем не менее, не работают.
- ↑ 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0277.html
- ↑ 1 2 3 Toski, A; Bacon, DR; Calverley, RK. The history of Anesthesiology // Clinical Anesthesia / Barash, Paul G; Cullen, Bruce F; Stoelting, Robert K.. — 4th ed. — Lippincott Williams & Wilkins, 2001. — P. 3. — ISBN 978-0-7817-2268-1.
- ↑ Hademenos, George J.; Murphree, Shaun; Zahler, Kathy; Warner, Jennifer M. McGraw-Hill's PCAT. — McGraw-Hill. — P. 39. — ISBN 978-0-07-160045-3.
- ↑ 1 2 П.Ю.Столяренко История обезболивания в стоматологии (часть 1) Архивная копия от 15 июня 2018 на Wayback Machine
- ↑ Dr. Frobenius (1729) "An account of a spiritus vini æthereus, together with several experiments tried therewith, " (недоступная ссылка) Philosophical Transactions of the Royal Society (London), 36 : 283—289.
- Бабаян Э. А., Гаевский А. В., Бардин Е. В. «Правовые аспекты оборота наркотических, психотропных, сильнодействующих, ядовитых веществ и прекурсоров» М.: МЦФЭР, 2000 стр. 148
- Гурвич Я. А. «Справочник молодого аппаратчика-химика» М.: Химия, 1991 стр. 229
- Девяткин В. В., Ляхова Ю. М. «Химия для любознательных, или о чём не узнаешь на уроке» Ярославль: Академия Холдинг, 2000 стр. 48
- Рабинович В. А., Хавин З. Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 148
- Гауптман 3., Органическая химия, пер. с нем., М.: Химия, 1979, с. 332-40;
- Грефе Ю., Общая органическая химия, пер. с англ., т. 2, М., 1982, с. 289—353;
- Ремане X.,Kirk-Othmer encyclopedia, v. 9, N. Y., 1980, p. 381-92.
формула. Диэтиловый эфир: физические и химические свойства :: SYL.ru
Сотни лет назад известному ученому того времени Луллию, которого после смерти стали называть алхимиком, удалось открыть незаменимый в настоящее время диэтиловый эфир. Формула, свойства, температура кипения, способы получения вещества будут подробно описаны в данной статье.
История
В 13 веке известный испанский ученый Раймонд Луллий открыл диэтиловый эфир. Свойства его были описаны в 1540 году не менее известным научным деятелем Парацельсом. В 1846-м эфир впервые попробовали использовать в качестве наркоза. Операция, проведенная американским врачом Д. Уорреном с применением паров этого вещества, прошла успешно. Изобретателями наркоза считают стоматолога У. Мортона и его наставника – врача и химика Ч. Джексона.
Способы получения эфира в 16 столетии описал Валериус Кордус – известный ботаник и фармацевт родом из Касселя. С начала 18 века спиртово-эфирная смесь использовалась в качестве успокаивающего средства – это было предложение Фридриха Гофмана. Петербуржский аптекарь Томас Ловиц в 1796 году получил чистый диэтиловый эфир, формула которого, кстати, имеет два варианта (об этом немного позже). А вот принцип действия упомянутого вещества на организм человека обнародовал английский физик М. Фарадей, после чего в 1818 году была опубликована даже научная статья, посвященная этой теме.
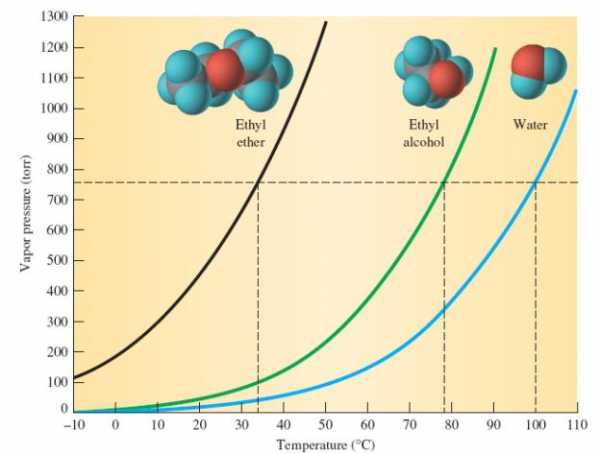
Характеристика
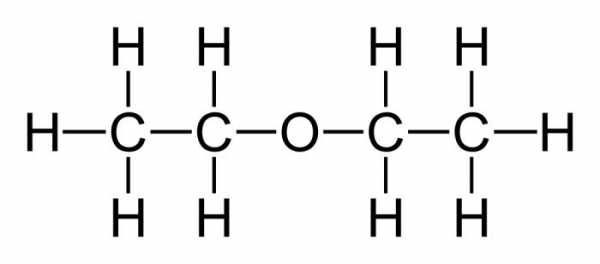
Что же называют простым эфиром? Это органическое соединение, молекулы которого состоят из двух углеводородных радикалов и атома кислорода. Наиболее важен простой, диэтиловый эфир, формула которого имеет следующий вид:
(С2Н5)2О или С4Н10О.
Он представляет собой бесцветную, прозрачную, очень подвижную летучую жидкость, имеющую своеобразный запах и жгучий вкус.
Под воздействием света, воздуха, тепла и влаги эфир способен разлагаться, образовывая при этом токсичные альдегиды, пероксиды и кетоны, которые раздражают дыхательные пути.
При температуре воды в 20 градусов растворяется на 6,5%. Хорошо смешивается с жирными и эфирными маслами, бензолом и спиртом, независимо от соотношения.
Сам эфир, впрочем, как и его пары, легко воспламеняется. В определенной пропорции с кислородом или же воздухом пары диэтилового эфира, используемые для наркоза, взрывоопасны.
Химические свойства
Для диэтилового эфира характерны все химические свойства простых эфиров. Итак, разберемся с этим вопросом подробнее. Это довольно инертное вещество. Основное отличие от сложных эфиров – отсутствие гидролиза, правда, есть и исключения. На холоде не взаимодействует с хлоридом фосфора, металлическим натрием и многими разбавленными минеральными кислотами. Несмотря на это, концентрированные кислоты (серная и йодоводородная) даже при низких температурах разлагают эти эфиры, а нагретый металлический натрий их расщепляет.
Эфир с неподеленными парами электронов взаимодействует с протоном сильной кислоты, в результате чего образуется неустойчивое оксониевое соединение:
- Ацидолиз. Серная и йодоводородная кислоты, а также FeCl3 в ангидриде уксусной кислоты способны расщеплять простые эфиры. Химическая реакция выглядит так: Ch4—Ch3—O—Ch3—Ch4 + HJ → Ch4—Ch3—OH + J—Ch3—Ch4.
- Реакция металлирования, получившая название реакции Шорыгина. Нагретый металлический натрий расщепляет диэтиловый эфир: C2H5–O–C2H5 + 2Na → C2H5ONa + C2H5Na
- Относительная химическая инертность не препятствует эфирам при хранении на воздухе образовывать перекиси, что зачастую приводит к взрывам в конце перегонки.
Диэтиловый эфир: физические свойства
Своеобразный запах, низкая температура кипения простых эфиров – свидетельство слабого межмолекулярного воздействия, а это говорит о низкой полярности и отсутствии предпосылок к образованию водородных связей. В отличие от спиртов эфирам присущи более сильные электронодонорные свойства, что подтверждается значением потенциалов ионизации. Усиление этих особенностей связано с положительным индуктивным эффектом группы атомов, получающихся из алканов при удалении атома водорода.

Температура кипения диэтилового эфира – 35,6 градуса по Цельсию (это гораздо ниже, чем у изомерных спиртов), а замерзания – 117 оС. Простые эфиры почти не смешиваются с водой. Объяснение этому довольно простое: они не способны образовывать водородные связи, поскольку их молекулы не имеют полярных связей. Плохо растворяется в воде и диэтиловый эфир, плотность которого по отношению к оксиду водорода составляет 0,714. Одной из особенностей рассматриваемого вещества является склонность к электризации. Вероятность возникновения разрядов статического электричества особо высока при переливании или сливе химсостава, в результате чего может произойти воспламенение. Пары эфира образуют с воздухом, который в 2,5 раза легче, взрывчатые смеси. Нижний предел взрываемости – 1,7%, а верхний – 49%. Работая с эфиром, не следует забывать, что его пары имеют свойство распространяться на большие расстояния без потерь способности к горению. Так что основная мера предосторожности – отсутствие вблизи открытого огня и прочих источников воспламенения.
Простой эфир – малоактивное соединение, в разы менее реакционноспособное по сравнению со спиртами. Замечательно растворяет большую часть органических веществ, благодаря чему используется в качестве растворителя. Исключением не является и диэтиловый эфир. Физические свойства, равно как и химические, позволяют применять его в медицине и на производстве.
Получение диэтилового эфира
Простые эфиры в природе не встречаются - их получают синтетическим путем. Под воздействием кислотных катализаторов на этиловый спирт при повышенной температуре получается диэтиловый эфир (формула указана выше). Проще всего получить это вещество посредством перегонки смеси, состоящей из серной кислоты и спирта. Для этого ее необходимо разогреть до 140-150 градусов по Цельсию. Нам понадобится этиловый спирт и серная кислота (в равных пропорциях), пипетки, пробирки и газоотводные трубки.
Итак, после того как оборудование и реактивы подготовлены, можно приступать к проведению опыта. В пробирку (она обязательно должна быть сухой) необходимо налить 2-3 мл смеси спирта и кислоты и медленно нагреть. Как только начнется кипение, горелка убирается, а в горячую смесь при помощи пипетки по стенке пробирки добавляется от 5 до 10 капель этилового спирта. Протекающая реакция выглядит следующим образом:
- СН3—СН2—ОН (этилсерная кислота) + h3S04 СН3—СН2—OSO3H + Н2О;
- Ch4—СН2—OSO3H + СН3—СН3—О;
- СН3—СН2—О—СН2—СН3(диэтиловый эфир)+ Н2SO4.
Об образовании диэтилового эфира свидетельствует появившийся запах.
Использование в медицине
В качестве лекарственного средства общеанестезирующего действия медики используют диэтиловый эфир. Свойства этого вещества не позволяют применять его при операциях, где задействуются электроинструменты, поскольку оно легко воспламеняется, а при соединении с воздухом может взорваться. Диэтиловый эфир широко распространен в хирургии, где используется для ингаляционного наркоза. В стоматологии им обрабатывают зубные корневые каналы и кариозные места, подготавливая, таким образом, полость рта к пломбированию.
Диэтиловый эфир как топливо
Вещество обладает высоким цетановым числом (85-96), благодаря чему его можно использовать как стартовую жидкость для бензиновых и дизельных двигателей. Благодаря высокой изменчивости и низким температурам вспышки диэтиловый эфир применяют в качестве составляющей топливной смеси для образцовых дизельных двигателей. Получается, что данное вещество подобно этанолу.
Правильное хранение
Диэтиловый эфир рекомендуется хранить в бутылочках темного цвета (тщательно закупоренных) в прохладном месте, поскольку на свету, в тепле и под воздействием влаги он разлагается, в результате чего выделяются токсические вещества.
Опыт 13. Получение простого диэтилового эфира
Реактивы и оборудование: смесь этилового спирта и концентрированной серной кислоты в объемном соотношении 1:1, этиловый спирт; пипетки, прямые газоотводные трубки с оттянутыми концами, пробирки.
В сухую пробирку наливают 2—3 мл смеси этилового спирта и концентрированной серной кислоты (1:1) и осторожно нагревают до начинающегося кипения. Затем горелку убирают и к горячей смеси по стенке пробирки добавляют пипеткой 5—10 капель этилового спирта.
СН3СН2ОН + H2SO4 СН3СН2OSO3H + Н2О
этилсерная кислота
t
СН3СН2OSO3H + СН3СН2ОН СН3СН2ОСН2СН3 + H2SО4
диэтиловый эфир
Образование диэтилового эфира обнаруживают по запаху. Потом пробирку закрывают пробкой с прямой газоотводной трубкой с оттянутым концом, осторожно ее нагревают и поджигают выделяющийся эфир.
Напишите механизмы реакций образования этилсерной кислоты и диэтилового эфира (SN2).
3.2. Фенолы Осторожно! Фенолы вызывают ожоги кожи Опыт 14. Образование и разложение фенолятов
Реактивы и оборудование: фенол, 10%-ный раствор гидроксида натрия, 10%-ный раствор серной кислоты, пробирки.
К 2 мл смеси фенола с водой прибавляют по каплям при перемешивании 10%-ный раствор гидроксида натрия до полного растворения фенола:
К полученному раствору фенолята натрия по каплям приливают 10%-ный раствор серной кислоты. Наблюдают помутнение раствора в результате разложения фенолята натрия серной кислотой и выделения малорастворимого в воде фенола:
Объясните происходящее. Сравните свойства фенолов с алифатическими спиртами в данной реакции.
Опыт 15. Взаимодействие фенола с бромной водой
Реактивы и оборудование: 5%-ный раствор фенола, бромная вода; пробирки.
В пробирку наливают 1 мл 5%-ного раствора фенола и по каплям приливают бромную воду. Наблюдают образование белого осадка. При добавлении избытка бромной воды осадок становится желтым.
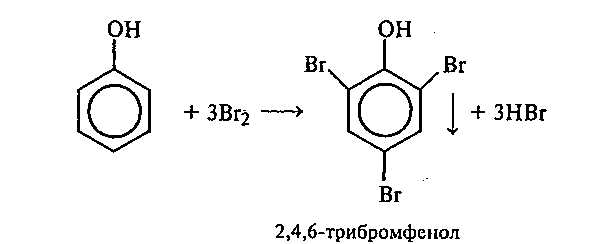
Рассмотрите механизм реакции бромирования фенола (SE). Почему реакция бромирования фенола идет в более мягких условиях по сравнению с толуолом и бензолом? Какой продукт образуется при действии избытка бромной воды на трибромфенол?
Опыт 16. Окисление фенола
Реактивы и оборудование: 5%-ный раствор фенола, 5%-ный раствор карбоната натрия, 1%-ный раствор перманганата калия; пипетки, пробирки.
В пробирке смешивают 1 мл 5%-ного раствора фенола и 1 мл 5%-ного раствора карбоната натрия. По каплям при перемешивании приливают 1%-ный раствор перманганата калия. Наблюдают обесцвечивание раствора и выпадение бурого осадка оксида марганца (IV).
Объясните наблюдаемое изменение окраски. Напишите реакцию окисления фенола.
Опыт 17. Взаимодействие фенолов с хлоридом железа (III)
Реактивы и оборудование: 1%-ный раствор фенола, 1%-ный раствор пирокатехина, 1%-ный раствор резорцина, 1%-ный раствор гидрохинона, 1%-ный раствор пирогаллола, 2%-ный раствор хлорида железа (III), 2М раствор гидроксида натрия; пипетки, фильтровальная бумага.
Реакция с хлоридом железа (III) является качественной на енольные и фенольные гидроксильные группы.
В четыре пробирки наливают по 1 мл 1%-ных растворов: в первую — фенола, во вторую — пирокатехина, в третью — резорцина, в четвертую — гидрохинона. В каждую пробирку добавляют по 3—4 капли 2%-ного раствора хлорида железа (III). В пробирке с фенолом появляется сине-фиолетовая окраска, с пирокатехином — зеленая, с резорцином — фиолетовая, с гидрохиноном — зеленая, очень быстро переходящая в желтую (гидрохинон окисляется в хинон).
Следует помнить, что растворы фенолов должны быть приготовлены не ранее, чем за 1-2 дня до проведения реакции, так как фенолы легко окисляются и их растворы темнеют.
Эфир диэтиловый, получение из него
Напишите уравнение реакции получения диэтилового эфира. Для каких целей он используется в технике и медицине [c.89]Диэтиловый (этиловый) эфир. Имеет очень большое практическое значение его обычно называют просто эфиром. Получается главным образом дегидратацией этилового спирта при действии концентрированной серной кислоты (стр. 109). Этим методом диэтиловый эфир был получен впервые еще в 1540 г. В. Кордусом долгое время диэтиловый эфир неправильно называли серным эфиром, так как предполагали, что он должен содержать серу. В настоящее время диэтиловый эфир получают так же, пропуская пары этилового спирта над окисью алюминия А120д, нагретой до 240—260 С. [c.129]
Вернемся еще раз к свойствам аминогруппы глицина она проявляет более сильные основные свойства (более высокое значение рКа), чем обычный органический амин. Можно ожидать, что единичный отрицательный заряд карбоксильной группы приведет к повышению электронной плотности на аминогруппе и что электростатическое притяжение (эффект ноля) между аммоний-катионом и карбоксилат-апионом затруднит отрыв протона от аммонийной группы. Это действительно так, и оба эффекта играют важную роль. Тем не менее рКа аминогруппы глицина равен 9,60, тогда как у метиламина 10,64 (табл. 2.1). Это происходит потому, что наиболее важным, или определяющим, эффектом является оттягивание электронов карбоксильной (карбонильной) группой. Так, если нейтрализовать весь заряд карбоксильной группы путем превращения ее в амид, то рКа аминогруппы глициламида равен 8,0, а для глицилглицина 8,13. При этом не возможны ни повышение электронной плотности карбоксилат-ани-оном, ни эффект поля (электростатическое влияние) единственным эффектом остается оттягивание электронов амидной карбонильной группой. Отметим, что этерификация аспарагиновой и глутаминовой кислот аналогичным образом влияет на свойства полученных соединений (табл. 2.1). Аминогруппы диэтиловых эфиров обладают кислыми свойствами. [c.40]
Монотерпеноиды (монотерпены) и сесквитерпеноиды (сескви-терпены) представляют собой жидкости. Их молекулы содержат 10 и 5 атомов углерода соответственно. Эти соединения содержатся в разных частях высших растении, в том числе в древесине. Они получаются перегонкой соответствующего растительного материала с водяным паром или экстракцией с диэтиловым эфиром получившиеся смеси называются эфирными маслами и используются прежде всего в производстве духов и медицине. Наиболее известны лимонное, гвоздичное, розовое, лавандовое, эвкалиптовое, мятное, камфарное, санталовое, кедровое и терпентиновое (из сосен) масла. Источник получения этих масел в большинстве случаев ясен из названия. [c.220]
Очистку поликарбоната осуществляют также по следующей схеме выделяют твердый поликарбонат из реакционной смеси, перемешивают полученные твердые частицы в промывной смеси, состоящей из воды и очистного агента, представляющего собой эфир монокарбоновой кислоты (этилацетат, бутилацетат, метилпропионат), ке-тон или простой эфир (диэтиловый, дипропиловый) и отделяют частицы поликарбоната от жидкости. Выбранный агент для очистки характеризуется тем, что он не смешивается с водой, способствует набуханию частичек поликарбоната, но не растворяет их и является растворителем для бисфенола. [c.80]
Он же—простой эфир, диэтиловый эфир, серный эфир. Последнее название он получил еще в ХУП веке, когда думали, судя по получению его с помощью серной кислоты, что в нем содержится сера. [c.70]
Унитарная теория, основанная на явлении замещения, обусловила новые экспериментальные исследования, которые повели к открытию, главным образом синтетическим путем, большого числа новых соединений. Для дальнейшего развития химии особое значение имело исследование простых эфиров (Вильямсон, 1850 г.). Растворяя металлический калий в спирте и обрабатывая этот раствор йодистым этилом, Вильямсон получил обычный (диэтиловый) эфир заменяя затем этиловый спирт метиловым, он получил смешанный метилэтиловый эфир (см. главу Простые эфиры ). При этом он правильно истолковал полученные результаты, считая спирты и простые эфиры производными воды (которой он приписывал формулу HgO вместо эквивалентной формулы НО, применяемой дуалистической теорией) [c.19]
Этиловый спирт — очень важный для нужд народного хозяйства продукт. В больших количествах он расходуется для получения синтетического каучука и в производстве пластмасс. Этанол используется как растворитель при изготовлении одеколонов, духов, лекарств, лаков, а также для консервирования анатомических препаратов. Он применяется для получения многих органических веществ диэтилового эфира, красителей, уксусной кислоты, бездымного пороха и др. Этиловый спирт в смеси с бензином может использоваться в качестве горючего для двигателей внутреннего сгорания. Очень часто его денатурируют, т. е. к спирту прибавляют другие вещества и красители, чтобы сделать его непригодным для употребления внутрь. [c.313]
Первоначально в качестве экстрагента использовался диэтиловый эфир. Однако его летучесть и огнеопасность заставили искать другие реактивы. Из кислородсодержащих органических растворителей (спиртов, сложных эфиров, кетонов) наилучшим оказался бутилаце-тат. Если при экстракции галлия из солянокислого раствора диэтиловым эфиром коэффициент распределения (при кислотности 5,5 н.) равен максимально 75, то при экстракции бутилацетатом (кислотность 6 н.) он превышает 400. Коэффициент разделения галлия и алюминия при экстракции этим реагентом практически не зависит от соотношения их концентраций в растворе и составляет 2-10 [901. Еще больший коэффициент распределения галлия получен при экстракции метилизобутилкетоном ( 2800). Однако этот растворитель недостаточно селективен — экстрагирует не только трехвалентное, но и двухвалентное железо, а также медь, цинк, ванадий и другие металлы [75]. [c.253]
Этот метод синтеза широко применяется для получения моно-и диалкилуксусных кислот с высоким молекулярным весом, алкильные группы в которых не разветвлены. Иногда в качестве алкилирующих агентов используют вторичные галогенпроизводные, а третичные галогенпроизводные для этого не применяют никогда. Для того чтобы расширить область алкилирования, используют гидрид натрия в таком растворителе, как диметилформамид примером такой реакции может служить этилирование диэтилового эфира /ире/и-бутилмалоновой кислоты [70], однако наилучшей средой для осуществляемого с трудом алкилирования малоновых эфиров является, по-видимому, гидрид натрия в тетраметилмочевине [71]. Находящиеся в а-положении малонового эфнра атомы водорода имеют сильно выраженный кислый характер за счет того, что они присоединены к атому углерода, расположенному между двумя карб-этоксигруппами. Этот эффект обычно приписывают резонансной стабилизации карбаниона. Первая стадия реакции приводит к об-+ — [c.233]
Диэтиловый эфир получение - Справочник химика 21
Диэтиловый эфир получен нагреванием диметилового эфира нафталевой кислоты с этиловым спиртом в присутствии небольшого количества этилата натрия [3231. Вислиценус и Понндорф синтезировали этот эфир с почти количественным выходом многочасовым нагреванием серебряной соли нафталевой кислоты с иодистым этилом при 100 "С кристаллизуется из спирта в листочках. Т. пл. 59—60 °С, т. кип. 238—239 "С при 19 мм рт. ст. [451[. Ди-н-бутиловый эфир, т. пл. 52—53 °С [1821. [c.148]Получение метилового эфира бета-нафтола. Получение диэтилового эфира Получение формальдегида. Проведение реакци [c.258]
Для получения гексахлорциклогексана в оптически активной форме была использована способность гексахлорцикло-гексанов под действием оснований отщеплять хлористый водород с переходом в 1,3,5-трихлорбензол. Если использовать в качестве дегидрогалогенирующего агента оптически активное основание бруцин, то при его действии на избыток гексахлорциклогексана дегидрохлорирование антиподов проходит с разной скоростью и остающийся избыточный гексахлорциклогексан приобретает оптическую активность [а]в + 14,6 (в диэтиловом эфире). Полученная оптически активная форма устойчива в кислой среде ее можно, например, перекристал-лизовать из концентрированной азотной кислоты, однако уже в слабощелочной среде идет быстрая рацемизация. [c.403]
Из водных растворов к навеске водного раствора (100 жл) в делительной воронке добавляют 1 мл разбавленной (1 1) серной кислоты химически чистой и встряхивают 5 мин. Выделившуюся 2-ме токси-3,6-дихлорбензойную кислоту экстрагируют 100 жл (5 раз по 20 мл) диэтилового эфира. Полученные экстракты сушат над безводным сульфатом натрия, фильтруют и отгоняют диэтиловый эфир на водяной бане до объема 3—5 мл. [c.186]
Полученные закономерности были проверены на растворах нитрата кобальта в различных органических растворителях (изопропиловом спирте, метиловом спирте, метилизобутилкетоне и диэтиловом эфире). Полученные результаты показали, что выявленная закономерность для чистых растворителей при определении 2п, Си и Mg сохраняется и при определении данных примесей в органическом растворе соли. [c.200]
Ниже приведены все адсорбционные параметры диэтилового эфира, полученные нами из электрокапиллярных измерений и измерений дифференциальной емкости. [c.67]
В 1959 г. Коп и Додж [74] вычислили равновесные концентрации этанола, получаемого гидратацией этилена, с учетом образования диэтилового эфира. Полученные ими результаты приведены в табл. 15. Как видно из данных этой таблицы, учет образования эфира вносит существенные изменения в состав жидкой и паровой фаз. Авторы сообщили, что в отдельных опытах, проведенных с катализатором — серной кислотой — при 221° С и давлении 273 атм, им удалось получить выходы этилового спирта и диэтилового эфира, близкие к равновесным. [c.44]
Полученную кашицу переносят в колбу, снабженную мешалкой с водяным или ртутным затвором, заливают 100 мл 20%-ной НС1 (ч.), вытесняют из колбы воздух водородом и нагревают до 70—90 С при перемешивании до прекращения растворения остатков непрореагировалшего алюминия. После охлаждения реакционной смеси осадок промывают водой докавта-цией до исчезновения кислой реакции промывных вод, затем отсасывают на воронке Бюхнера и промывают этиловым спиртом и диэтиловым эфиром. Полученную смесь сушат сначала на воздухе, а в конце — слабо нагревая в струе водорода. [c.231]
При применении вместо глицерина Р-метилглицерин-а, у-диэтилового эфира получен по реакцин Скраупа с1, /-6,8-диметнлэрголин, который оказался идентичным продукту превращения в него й, /-дигидролизергиновой кислоты (IV) [c.498]
Получение ацетилтиохолинйодида. В круглодонную колбу емкостью 500 мл, снабженную стеклянной притертой пробкой, помещают 56 г (0,29 М 30,7 мл) 2-йодэтилтиолацетата и 150 мл сухого диэтилового эфира. Полученный раствор охлаждают до температуры —20° и прибавляют порциями (примерно по 3 мл) 18 г (0,3 М] 27,5 мл) жидкого триметиламина (см. примечание 5). После прибавления каждой порции триметиламина колбу закрывают притертой пробкой и взбалтывают реакционную смесь. Затем колбу герметизируют пробкой, которую закрепляют к горлышку колбы изоляционной лентой, и оставляют при температуре минус 10—15° на одни сутки. По истечении этого срока начинает выделяться ацетил-. [c.94]
Реактив Гриньяра метилмагнийиодид, синтезированный взаимодействием металлического магния с метилиодидом в среде диэтилового эфира. Полученный реактив Гриньяра разбавляют в два раза по объему сухим бензолом, содержание влаги в котором не превышает 0,005% (масс.). Концентрация метил-магнийиодида в разбавленном реактиве составляет примерно 1 М. [c.92]
Данные ГЖХ-авализа диэтиловых эфиров, полученных из указанных дихяорангцдридов и абс. зтанола. [c.93]
Этиловый эфир, свойства, структура, получение, использование / химия | Thpanorama
этиловый эфир, также известный как диэтиловый эфир, является органическим соединением, химическая формула которого C4H10О. Он характеризуется тем, что является бесцветной и летучей жидкостью, поэтому его бутылки должны быть как можно плотнее закрыты..
Этот эфир классифицируется как член диалкиловых эфиров; то есть они имеют формулу ROR ', где R и R' представляют разные углеродные сегменты. И как он описывает свое второе имя, диэтиловый эфир, это два радикала-этила, которые связываются с атомом кислорода.

Первоначально этиловый эфир использовался в качестве общего анестетика, введенного в 1846 году Уильямом Томасом Грином Мортоном. Однако, из-за его воспламеняемости, его использование было отклонено, заменив его другими менее опасными анестетиками..
Это соединение также использовалось для оценки времени кровообращения, при оценке состояния сердечно-сосудистой системы пациентов..
В организме диэтиловый эфир может превращаться в углекислый газ и метаболиты; последние в конечном итоге выводятся с мочой. Однако большая часть вводимого эфира выдыхается в легких без каких-либо изменений..
С другой стороны, он используется в качестве растворителя для мыла, масел, парфюмерии, алкалоидов и камеди.
индекс
- 1 Структура этилового эфира
- 1.1 Межмолекулярные силы
- 2 Физические и химические свойства
- 2.1 Другие имена
- 2.2 Молекулярная формула
- 2.3 Молекулярный вес
- 2.4 Внешний вид
- 2.5 Запах
- 2.6 Вкус
- 2.7 Точка кипения
- 2.8 Точка плавления
- 2.9 Температура вспышки
- 2.10 Растворимость в воде
- 2.11 Растворимость в других жидкостях
- 2.12 Плотность
- 2.13 Плотность пара
- 2.14 Давление пара
- 2.15 Стабильность
- 2.16 Автоматическое зажигание
- 2.17 Разложение
- 2.18 Вязкость
- 2.19 Теплота сгорания
- 2.20 Тепло испарения
- 2.21 Поверхностное натяжение
- 2.22 Потенциал ионизации
- 2.23 Порог запаха
- 2.24 Показатель преломления
- 3 Получение
- 3.1 Из этилового спирта
- 3.2 Из этилена
- 4 Токсичность
- 5 использует
- 5.1 Органический растворитель
- 5.2 Общая анестезия
- 5.3 Дух эфира
- 5.4 Оценка кровообращения
- 5.5 Учебные лаборатории
- 6 Ссылки
Структура этилового эфира
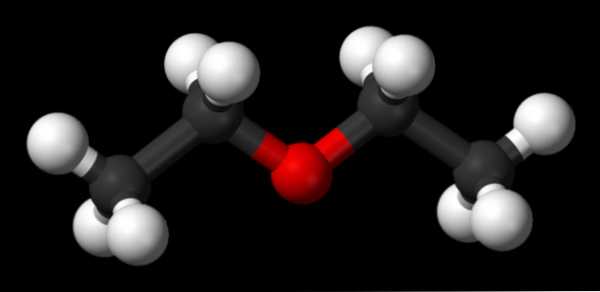
На изображении выше мы имеем представление с моделью сфер и стержней молекулярной структуры этилового эфира.
Как видно, красная сфера, соответствующая атому кислорода, имеет две этильные группы, связанные с обеих сторон. Все звенья простые, гибкие и свободно вращаются вокруг осей σ.
Эти вращения происходят из стереоизомеров, известных как конформеры; что больше, чем изомеры, они являются альтернативными пространственными состояниями. Структура изображения точно соответствует антиконформеру, в котором все его группы атомов расположены в шахматном порядке (отделены друг от друга).
Каким был бы другой конформер? Затмение, и хотя ваше изображение недоступно, просто визуализируйте его с помощью формы U. На верхних концах U будут расположены метильные группы -CH3, которые будут испытывать стерические отталкивания (они сталкиваются в космосе).
Следовательно, ожидается, что молекула СН3СН2ОСН2СН3 принять анти-конформации большую часть времени.
Межмолекулярные силы
Какими межмолекулярными силами управляют молекулы этилового эфира в жидкой фазе? Они поддерживаются в жидкости главным образом благодаря дисперсионным силам, поскольку в их дипольном моменте (1,5D) отсутствует область, достаточно дефицитная по электронной плотности (δ +).
Это потому, что ни один атом углерода в этильных группах не дает слишком много электронной плотности для атома кислорода. Сказанное выше видно на карте электростатического потенциала этилового эфира под рукой (нижнее изображение). Обратите внимание на отсутствие синей области.
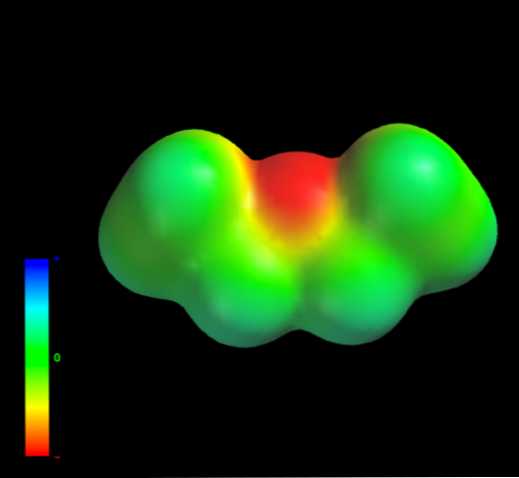
Кислород также не может образовывать водородные связи, опять же, потому что в молекулярной структуре нет доступных О-Н связей. Следовательно, мгновенные диполи и их молекулярная
Получение простых эфиров
Общие методы получения простых эфиров
К общим методам получения простых эфиров относятся:
- реакция А. Вильямсона;
- межмолекулярная дегидратация спиртов;
- алкоксимеркурирование алкенов.
Синтез А. Вильямсона заключается в обработке алкогалятов калия или натрия галоидными соединениями, алкилсульфатами или алкилсульфонатами и имеет вид:
Рисунок 1.
Из двух радикалов один $R$ переходит в эфир из молекулы спирта, а второй $R'$ переходит из молекулы галогеналкана. Наилучший выход эфира можно получить, если $R'$ является первичным радикалом. В этом случае реакция идет по механизму бимолекулярного нуклеофильного замещения $S_N2$, например:
Рисунок 2.
Например, получение метилэтилового эфира из этилята натрия:
Рисунок 3.
Синтез А. Вильямсона пригоден только для первичных $RX$, так как трет-алкоголят-ионы очень объемистые.
Межмолекулярной дегидратацией первичных спиртов в присутствии кислых катализаторов можно получить симметричные простые эфиры, например, получение диметилового эфира из метанола:
Рисунок 4.
Для других спиртов с дегидратацией конкурирует образование алкенов. Но при определенных условиях можно получить простой эфир:
Рисунок 5.
Межмолекулярная дегидратация спиртов не применяется для получения эфиров фенолов, так как гидроксил в этих соединениях прочно связан. Спирты с реакционноспособным гидроксилом, например, бензгидрол $(C_6H_5)_2CHOH$ или бензиловый спирт $C_6H_5CH_2OH$, очень легко этерифицируются.
В зависимости от строения спирта, дегидратация протекает по $S_N1$- или $S_N2$-механизму замещения. Реакция межмолекулярной дегидратации является хорошим методом получения смешанных спиртов, если группа $R$-первичная, а $R'$- третичная.
Специфическим катализатором при получении простых эфиров из аллиловых спиртов является платинохлористоводородная кислота.
Рисунок 6.
Межмолекулярная дегидратация имеет практическое значение для получения эфиров низших спиртов, особенно этилового эфира.
Реакцию этерификации можно осуществить в условиях гетерогенного катализа, пропуская пары спирта над $Al_2O_3$, $ThO_2$, $TiO_2$, $W_2O_5$ или над квасцами при температуре 135-140$^\circ$С. В этой реакции применяют те же реактивы, что и для получения этилена. Однако будет иным соотношение исходных веществ и более низкая температура.
Алкоксимеркурирование алкенов начинается с атаки двойной связи олефина катионом $^+HgOCOCH_3$, в результате образуется интермедиат в виде меркуриониевого катиона, в последствии раскрывающегося в результате нуклеофильной атаки спирта по наиболее замещенному углеродному атому:
Рисунок 7.
При синтезе эфиров, имеющих вторичный или третичный алкил, применяют трифторацетат ртути (I), реакция протекает в спирте:
Рисунок 8.
Простые эфиры можно получить метилированием спиртов с помощью диазометана. Эта реакция дает особенно хорошие результаты в случае незатрудненных первичных и вторичных спиртов. Реакция протекает в присутствии кислого катализатора $HBF_4$ или $BF_3$ (кислоты с нуклеофильными анионами не применяют). Реакция протекает с образованием промежуточного иона метил-диазония ${CH_3N_3}^+$.
Рисунок 9.
Примеры использования метода А. Вильямсона
В основном синтез А. Вильямсона применяют для получения эфиров фенола.
Например: получение анизола (метилового эфира фенола) из фенолята натрия и йодистого метила:
Рисунок 10.
Подобным образом можно получить фенетол $C_6H_5OC_2H_5$ - этиловый эфир фенола.
Йодистые алкилы можно заменить соответствующими сульфатами, которые обладают подобной реакционной способностью.
Рисунок 11.
Методом А. Вильямсона можно получить ароматические эфиры, но реакция при этом будет протекать тяжелее в результате пониженной реакционной способности галоидного атома, связанного с ароматическим ядром.
Окись дифенила - дифениловый эфир можно получить при нагревании сухого фенолята натрия с бромбензолом до 210$^\circ$С в присутствии катализатора порошка меди
Рисунок 12.
Получение замещенных эфиров
Например, необходимо получить дивиниловый эфир $CH_2=CH-O-CH=CH_2$.
Для образования дивинилового эфира нужно получить двойную углерод-углеродную и эфирную связь. Лучшим методом получения ненасыщенного эфира является дегидрогалогенирование галогенэфира.
Пути получения эфира с двумя хлорэтильными группами ($ClCH_2CH_2-$):
-
Хлорирование эфира. Однако хлорирование диэтилового эфира не дает нужного продукта, а полихлорирование эфира ведет к накоплению атомов хлора в одной этильной группе.
-
Превращение хлорсоединения в эфир. Хлорэтиловый эфир можно синтезировать дегидратацией хлорэтилового спирта
Рисунок 13.
Несимметричный эфир можно получить по реакции Вильямсона, например, получение фенил-n-нитробензилового эфира
Рисунок 14.
Эфир получают в результате взаимодействия фенолята натрия с n-нитробензилхлоридом. Фенолят натрия образуется при действии раствора гидроксида натрия на фенол. n-Нитробензилхлорид получают свободнорадикальным хлорированием n-нитротолуола, который образуется при нитровании толуола.
Рисунок 15.
Простые эфиры | Химия онлайн
Простыми эфирами называют органические вещества, в которых два углеводородных радикала связаны атомом кислорода: R'–O–R", где R' и R" — различные или одинаковые радикалы.
Простые эфиры могут быть предельными, непредельными, циклическими, ароматическими.
предельные
непредельные
ароматические
циклические
Простые эфиры рассматриваются как производные спиртов. Названия этих соединений строятся из названий радикалов (в порядке возрастания молекулярной массы) и слова «эфир». Например, CH3-O-CH3 - диметиловый эфир; C2H5-O-CH3 - метилэтиловый эфир.
Физические свойства
Два первых простейших представителя – диметиловый и метилэтиловый эфиры – при обычных условиях газы, все остальные – жидкости.
Диэтиловый эфир (C2H5-O-C2H5)– бесцветная легкокипящая прозрачная жидкость (t кип. 35,5 °С), малорастворимая в воде. С этиловым спиртом смешивается в любых отношениях. Температура воспламенения – 9,4°С, образует с воздухом взрывоопасную смесь. Вызывает набухание резин. Широко применяется в качестве растворителя, в медицине (ингаляционный наркоз), вызывает привыкание человека, ядовит.
Диоксан (т. кип. 101°С) — хороший растворитель, смешивается как с водой, так и с углеводородами. За эти качества его назвали «органической водой». Достаточно токсичен. Значительно более опасны галогенсодержащие дибензопроизводные диоксана: диоксин (2,3,7,8-тетрахлордибензо-п-диоксин).
Простые эфиры имеют более низкие температуры кипения и плавления, чем изомерные им спирты. Эфиры практически не смешиваются с водой. Это объясняется тем, что простые эфиры не образуют водородных связей, т.к. в их молекулах отсутствуют полярные связи О-Н.
Простые эфиры хорошо растворяют многие органические вещества и поэтому часто используются как растворители.
Эфиры имеют приятный запах.
Химические свойства
Простые эфиры — малоактивные соединения, они значительно менее реакционноспособны, чем спирты.
1.Расщепление простых эфиров HJ и HBr
Простые эфиры разлагаются под действием концентрированных иодоводородной или бромоводородной кислот:
2. Образование комплексных соединений
Образование нестойких солей оксония (подобных солям аммония) в результате взаимодействия с сильными кислотами:
3. Окисление эфиров, образование перекисей
Несмотря на относительную химическую инертность, эфиры легко образуют при хранении на воздухе перекиси:
Перекиси являются причиной взрывов в конце перегонки эфиров, поэтому эфиры тщательно очищают от перекисей перед перегонкой и применением.
Получение
1. Межмолекулярная дегидратация спиртов
Симметричные простые эфиры R–O–R получают при межмолекулярной дегидратации спиртов:
При этом в одной молекуле спирта разрывается связь О-Н, а в другой — связь С-О. Реакцию можно рассматривать как нуклеофильное замещение группы HО– (в одной молекуле спирта) на группу RO– (от другой молекулы):
2. Взаимодействие галогенпроизводных с алкоголятами (реакция Вильямсона)
Эфиры несимметричного строения R–O–R' образуются при взаимодействии алкоголята и галогенуглеводорода. Например, метилэтиловый эфир можно получить из этилата натрия и хлорметана:
В этой реакции происходит нуклеофильное замещение галогена (Cl–) на алкоксигруппу (CH3O–):
3. Дегидратация спиртов в присутствии ионов водорода как катализаторов
4. Получение гетероцикических кислородсодержащих соединений (циклические простые эфиры) этиленоксид (эпоксид) диоксан
Применение
Вследствие относительной химической инертности, эфиры часто применяются в качестве органических растворителей (диэтиловый эфир, тетрагидрофуран, диоксан).
Эфиры с разветвленными алкильными радикалами (например, метил-трет-бутиловый эфир) используются в последнее время в качестве антидетонационных добавок в моторные топлива (бензины), заменяя чрезвычайно вредный тетраэтилсвинец (ТЭС) — Pb (CH3CH2)4.
Простые эфиры фенолов и нафтолов имеют своеобразные запахи и применяются в парфюмерии.
Химические свойства фенолов
XuMuK.ru - Способы получения
1. Действие водоотнимающих средствКлассическим способом получения простых эфиров является действие на спирты серной кислоты. При этом, например, из этилового спирта сначала получается этилсерная, или серновинная, кислота (Вильямсон)
которая при нагревании с избытком спирта образует простой эфир, причем выделяется молекула серной кислоты:
Таким образом, серная кислота в конце процесса оказывается неизмененной и может снова войти в реакцию со спиртом, т. е. она играет роль катализатора.
Во второй фазе реакции можно взять другой спирт. Тогда получается смешанный эфир:
Так как образующаяся при реакции вода может отгоняться с эфиром (вместе с небольшим количеством спирта), то теоретически было бы достаточно небольшого количества серной кислоты, чтобы превратить в эфир неограниченные количества спирта. Однако наряду с образованием эфира идет также и окисление спирта серной кислотой с восстановлением последней до сернистого ангидрида. Поэтому на заводах, где процесс ведется непрерывно, серную кислоту приходится периодически добавлять. Добавка к серной кислоте некоторых сернокислых солей (например, сернокислого алюминия) благоприятствует образованию эфира. Диэтиловый эфир образуется также при водоотнимающем действии некоторых других кислот (фосфорная кислота, органические сульфокислоты и пр.) и некоторых безводных солей (хлористый цинк, сернокислая медь и пр.). Было предложено получать его сухим путем, пропуская пары спирта через нагретые до 150—200° С обезвоженные квасцы.
Простые эфиры образуются также как промежуточные продукты при получении олефинов пропусканием паров спирта над глиноземом, окисью тория и т. п.
2. Действие галоидных алкилов на алкоголяты.
Второй способ получения простых эфиров состоит в действии галоидных алкилов на алкоголяты (Вильямсон). И в этом случае можно получать как симметричные простые эфиры, так и смешанные:
При этом наряду с эфирами, а иногда почти исключительно, образуются этиленовые углеводороды.
Органическая химия: Лабораторный практикум, страница 12
3CH3CH2OH + 2KMnO4 ® 3CH3CHO + 2MnO2¯+ 2KOH +2H2O
Опыт № 20. Получение простого (диэтилового) эфира
Реактивы:
Этиловый спирт
Концентрированная серная кислота
Ход работы:
В пробирку наливают ~1 мл этилового спирта и ~1 мл концентрированной серной кислоты, добавляют кипятильные камешки. В пробирку вставляют пробку со стеклянной трубкой длиной 20-25 см (обратный воздушный холодильник) и очень осторожно нагревают на песчаной бане (до кипения!), затем дают остыть и по каплям очень осторожно прибавляют к смеси несколько капель спирта. Ощущается запах эфира. Реакция протекает в две стадии.
Первая стадия:
C2H5OH + HOSO2OH ® C2H5OSO2OH + H2O
этилсерная
кислота
Вторая стадия:
C2H5OH + HOSO2OC2H5 ® C2H5-O-C2H5 + H2SO4
Итоговое уравнение:
H2SO4
C2H5OH + HOC2H5 ® C2H5-O-C2H5 + H2O
Остывшую реакционную смесь выливают в пробирку с небольшим (~2-3 мл) количеством воды. Эфир легче воды и всплывает на ее поверхность.
Эфир легко воспламеняется, пары его очень летучи. Поэтому нельзя работать с эфиром вблизи открытого огня.
Опыт №21. Получение сложного (уксусно-этилового) эфира
Реактивы:
Ледяная уксусная кислота
Этиловый спирт
Концентрированная серная кислота
Насыщенный раствор хлорида натрия
Ход работы:
В пробирке смешивают ~2 мл ледяной уксусной кислоты, ~2 мл этилового спирта и ~0,5 мл концентрированной серной кислоты, Полученную смесь осторожно кипятят несколько минут в пламени спиртовки и после охлаждения выливают в пробирку с насыщенным раствором хлорида натрия. Образовавшийся уксусно-этиловый эфир (малорастворимый в воде) всплывает на поверхность, тогда как не вступившие в реакцию спирт и уксусная кислота переходят в водный нижний слой. Уксусно-этиловый эфир (этилацетат) имеет характерный фруктовый запах.
Опыт № 22. Получение фенолята натрия
Реактивы:
Фенол кристаллический
Вода
Раствор гидроксида натрия
Соляная кислота
Ход работы:
В пробирку помещают ~0,5 г кристаллов фенола (избегать попадания на руки!), приливают ~2 мл воды и встряхивают. К образовавшейся эмульсии прибавляют ~2-3 капли 10%-ного раствора гидроксида натрия и снова встряхивают. Раствор из мутного становится прозрачным, так как образовавшийся фенолят натрия в отличие от самого фенола хорошо растворим в воде:
C6H5OH + NaOH ® C6H5ONa + H2O
фенолят натрия
Фенол имеет слабокислые свойства, поэтому сильные кислоты вытесняют его из его солей. Для этого к раствору фенолята натрия приливают несколько капель соляной кислоты (на стенках пробирки появляются легкоплавкие кристаллы плохо растворимого в воде фенола).