Миелолейкоз что это за заболевание
Хронический миелолейкоз. — Симптомы
Развитие опухолевых процессов с каждым годом набирает обороты. Большинство ученых мира изучают возможные факторы развития состояния и основные методы терапии для излечения пациентов, а профилактическими мероприятиями занимаются все виды лечебных учреждений. Развитие опухолевого процесса может коснуться любого органа или системы организма. Миелолейкоз – что это такое? Основные причины этого заболевания, методы диагностики и терапии рассмотрим далее.
Общие понятия
Система кроветворения основывается на созревании молодых клеток – тромбоцитов, эритроцитов и лейкоцитов в костном мозге. Параллельно с этим процессом происходит уничтожение старых клеток печенью и селезенкой.
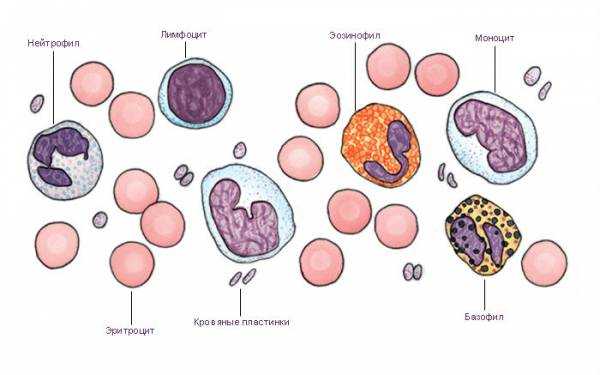
Форменных элементов в крови столько же, сколько и плазмы. При этом самое большое количество приходится на белые кровяные клетки – лейкоциты. Они отвечают за реакцию организма на воздействие чужеродных агентов и соединений и позволяют поддерживать иммунную систему на должном уровне.
Неконтролируемая выработка большого количества лейкоцитов называется миелоидным лейкозом. Это опухолевое заболевание, которое сопровождается критическим увеличением в кровеносном русле незрелых форм. Со временем происходит распространение патологических форм клеток во все органы и системы организма, что вызывает прогрессирование болезни.
Этиология заболевания
На данном этапе однозначные факторы, приводящие к развитию заболевания, не определены. Существует несколько версий возникновения патологического состояния:
- Появление патологических клонов – это процесс развития патологических изменений в структуре стволовых клеток. Происходит мутация, во время которой клетки не только приобретают изменения в себе, но и передают их остальным структурам, создавая свои клоны. Это состояние излечить с помощью цитостатических препаратов невозможно.
- Воздействие химических веществ.
- Действие радиоактивного излучения на организм, которое происходит не только по профессиональной необходимости. Например, использование в анамнезе лучевой терапии для лечения другой опухоли.
- Прием цитостатиков и химиотерапевтических препаратов для терапии опухолей других органов может послужить пусковым механизмом развития миелолейкоза.
- Генетические заболевания, наследственность.
- Болезни, имеющие вирусный генез.

Кроме того, на появление опухолевого процесса влияют пол, возраст пациента и воздействие радиационного облучения в зоне проживания.
Хроническая форма болезни
Проявление симптоматики опухолевого процесса крови зависит от формы болезни. Наиболее распространенная форма – хронический миелоидный лейкоз. Это состояние имеет злокачественный характер.
Хронический миелолейкоз – что это такое? Это состояние, которое возникает вследствие того, что в организме появляется аномальный ген, который поражает кровяные клетки. Место локализации гена – костный мозг. С током крови происходит распространение патологических клеток по всем органам.
Заболевание не имеет острого начала и яркой клинической картины. Для него характерно медленное течение. Опасность состоит в том, что эта форма болезни может перейти в острую фазу в любой период, что может закончиться летальным исходом для пациента.
Миелоидный лейкоз имеет несколько стадий развития:
- хроническая;
- стадия акселерации;
- терминальная стадия.
Первая стадия хронической формы
Большинству пациентов ставят диагноз именно в этой стадии. Начало заболевания точно определить невозможно, поскольку оно имеет бессимптомный характер или легкие проявления. Сначала появляется утомляемость, тяжесть в желудке или в левом подреберье, одышка.
Во время приема пищи пациенты жалуются на чувство переполненности в эпигастрии. Пальпаторно ощущается увеличение селезенки. Осмотр сопровождается болезненными ощущениями со стороны селезенки, иррадиирущими в спину. В анализе крови определяется лейкоцитоз, нарастающий в динамике, а также тромбоцитоз и увеличение количества гранулоцитов.
Часто больные обращаются к врачу при развитии инфаркта селезенки. Появляется резкий болевой синдром в ее проекции, симптомы интоксикации организма, повышается температура тела.
Стадия акселерации
В этой стадии заболевание практически не имеет проявлений. У больного нет жалоб, кроме периодического подъема температуры до субфебрильных показателей и усталости. Продолжает увеличиваться уровень миелоцитов и лейкоцитов в крови.
Уровень базофилов увеличивается на треть. После этого больных начинает беспокоить чувство жара и желание чесаться. Это связано с увеличением выработки гистамина.
Острая стадия (терминальная)
Развитие третьей стадии описывает клиническую картину, схожую с острым течением болезни. Хронический миелоидный лейкоз прогрессирует, и появляется яркая клиническая картина. Пациенты жалуются на такие проявления:
- резкая слабость;
- высокая температура тела;
- боли в суставах;
- резкое уменьшение веса больного.
При обследовании пациента можно обнаружить увеличение различных групп лимфатических узлов, печени, селезенки, развитие геморрагического синдрома. Бластный криз – финальная стадия болезни, которая характеризуется следующими клиническими проявлениями:
- лимфо- или миелобластов становится больше на 20 % в костном мозге или кровеносном русле;
- биопсия костного мозга определяет большие группы бластов;
- развитие миелоидной саркомы – злокачественной опухоли из незрелых белых клеток крови.

На этой стадии заболевания жизнь пациента зависит исключительно от уровня паллиативной терапии.
Острый миелоидный лейкоз
Клиническая картина развивается быстро, имеет яркие признаки заболевания. Без назначения адекватной терапии результат может быть неблагоприятным уже по истечении нескольких недель или месяцев.
Острый миелолейкоз – что это такое? Это злокачественный опухолевый процесс миелоидного ростка крови. Больные клетки не способны противостоять инфекциям, хотя это является их основной функцией. Параллельно с увеличением бластных структур происходит уменьшение остальных форменных элементов крови.
Эритропения и недостаток гемоглобина проявляются бледностью кожных покровов, одышкой, усталостью. Снижение количества тромбоцитов приводит к увеличению склонности кожи к повреждениям, повышенной кровоточивости, появлению петехий и гематом.
Первые симптомы не являются специфичными. Очень легко перепутать их с проявлениями респираторной вирусной инфекции. Кроме того, острый миелолейкоз сопровождается прогрессированием болевых ощущений в костях и суставах.
Диагностические мероприятия
Успешность начала лечения зависит от скорости проведения диагностики и постановки правильного диагноза. Чтобы определить общее состояние и фазу заболевания пациента, у которого подозрение на миелолейкоз, анализы проводятся в следующих направлениях:
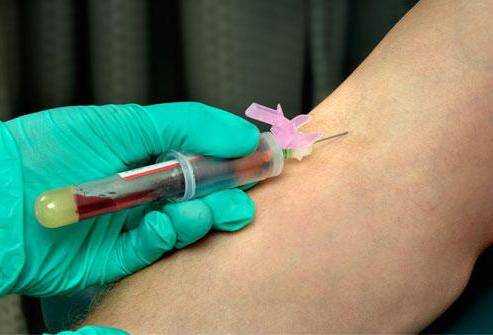
- Анализ периферической крови развернутый – фиксируется уровень всех форменных элементов крови в динамике.
- Биохимия крови показывает нарушения в работе печени и селезенки, которые вызваны развитием болезни.
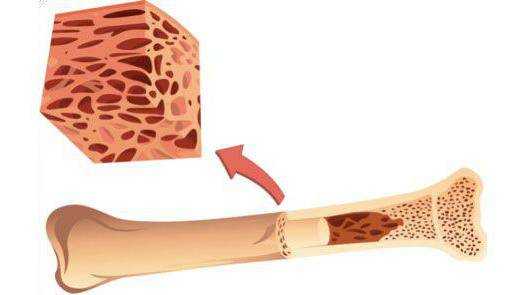
- Биопсия костномозгового аспирата проводится после забора необходимого материала из бедренной кости. Определяется наличие бластных форм.
- Гибридизация позволяет определить мутационную или аномальную хромосому.
- ПЦР направлена на выявление аномального гена.
- Цитогенетические анализы направлены на определение аномальной хромосомы в лейкозной клетке.
- По необходимости проводится компьютерная томография, магнитно-резонансная томография и ультразвуковое исследование.
Принципы терапии заболевания
Миелоидный лейкоз требует безотлагательного начала лечения. Врач-онколог определяет схему терапии, исходя из стадии заболевания, его проявлений. На ранней стадии назначается витаминная диета, общеукрепляющие препараты.
Лечение миелолейкоза основывается на применении препаратов, способных угнетающе действовать на онкоген. Основные средства:
- «Иматиниб» — средство угнетает активность белка, который вырабатывается онкогеном миелолейкоза;
- «Дазатиниб» — препарат используется в случае неэффективности или непереносимости пациентом «Иматиниба»;
- «Нилотиниб» — средство с аналогичным действием, относящееся ко второму поколению онкогенных ингибиторов;
- «Понатиниб» — один из новых препаратов, сильный по своей эффективности против бластных клеток, но способен вызывать тяжелые осложнения со стороны организма больного.
Также для укрепления иммунной системы пациентам назначается прием «Интерферона». Препарат не способен самостоятельно справиться с заболеванием, однако его применяют в комплексной терапии в виде ежедневных подкожных инъекций.
Химиотерапия проводится с использованием цитостатических средств. Эту часть терапии используют как дополнительное лечение при трансплантации клеток костного мозга. Эффективными считаются «Гидроксикарбамид», «Бусульфан», «Винбластин», «Винкристин», «Цитарабин».
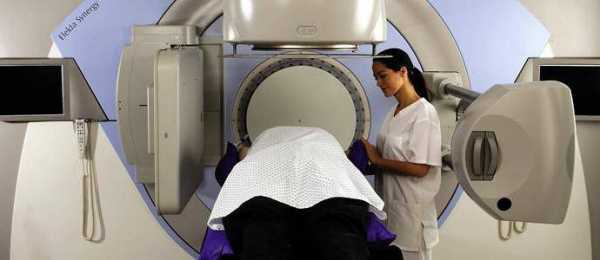
Облучение при онкологии проводится при помощи высокоэнергетических лучей, а также их частиц. Применяется индивидуально, в зависимости от необходимости. При миелолейкозе лучевая терапия используется для уменьшения болевых синдромов в костях и суставах. Также облучение при онкологии кроветворной системы используют перед трансплантацией костного мозга.
Трансплантация клеток костного мозга
Хирургическое вмешательство является довольно распространенным методом лечения, но при этом дорогостоящим. Не каждый пациент в состоянии себе это позволить. Онкоцентр на Каширке – один из знаменитых институтов терапии опухолевых новообразований – проводит подобные оперативные вмешательства, помогая излечиться своим пациентам.
Пересадка самого костного мозга сейчас используется не так часто, как трансплантация стволовых клеток, которые берут из периферической крови. Существуют два варианта проведения процедуры:
- Используют гемопоэтические клетки костного мозга донора. Это может быть кто-то из родственников, поскольку достаточно тяжело найти подходящего донора, который не состоял бы в родственных связях с больным.
- Пересадка собственных периферических клеток. Эта процедура сложна тем, что вместе со здоровыми клетками могут быть изъяты и бластные.
Онкоцентр на Каширке не только проводит хирургические вмешательства, которые позволили снизить смертность пациентов, но и использует современные методы термоаблации, криотермоаблации и радиоволновой хирургии.
Заключение
В статье был рассмотрен термин «миелолейкоз». Что это такое, вам теперь известно. Благоприятный исход возможен при полном курсе лечения начальных стадий заболевания. Терминальная стадия предполагает исключительно паллиативную терапию. Поздние и злокачественные стадии болезни приводят к летальному исходу у пациентов.
Суть заболевания
Если приходится слышать такой диагноз, как «хронический миелолейкоз», то важно понимать, что речь идет о серьезном опухолевом заболевании системы кроветворения, при котором поражаются гемопоэтические стволовые клетки костного мозга. Его можно отнести к группе лейкозов, для которых характерны крупные образования гранулоцитов в крови.
В самом начале своего развития миелолейкоз проявляется посредством увеличения количества лейкоцитов, достигающего почти 20 000/мкл. При этом в прогрессирующей фазе данная цифра изменяется до 400 000/мкл. Стоит отметить и тот факт, что как в гемограмме, так и в миелограмме фиксируется преобладание клеток, имеющих различную степень зрелости. Речь идет о промиелоцитах, метамиелоцитах, палочкоядерных и миелоцитах. В случае развития миелолейкоза выявляются изменения в 21-й и 22-й хромосомах.
Данное заболевание в большинстве случаев приводит к ощутимому увеличению содержания базофилов и эозинофилов в крови. Этот факт является свидетельством того, что приходится иметь дело с тяжелой формой болезни. У больных, которые страдают таким онкологическим недугом, развивается спленомегалия, а в костном мозге и крови фиксируется большое количество миелобластов.
Как происходит зарождение болезни?
Хронический миелолейкоз патогенез имеет достаточно интересный. Изначально в качестве пускового фактора в развитии данного заболевания можно определить соматическую мутацию плюрипотентной гемопоэтической стволовой клетки крови. Основную роль в процессе мутации выполняет перекрестная транслокация хромосомного материала между 22-й и 9-й хромосомами. При этом происходит образование Ph-хромосомы.
Бывают случаи (не более 5 %), когда Ph-хромосому во время стандартного цитогенетического исследования обнаружить не удается. Хотя молекулярно-генетическое исследование выявляет онкоген.
Хронический миелолейкоз может развиваться и по причине воздействия различных химических соединений и радиации. Наиболее часто эта болезнь диагностируется в зрелом возрасте, крайне редко у подростков и детей. Что касается половой принадлежности, то данный вид опухоли с одинаковой частотой фиксируется как у мужчин, так и у женщин в возрасте от 40 до 70 лет.
Несмотря на весь опыт врачей, этиология развития миелолейкоза до сих пор остается не до конца ясной. Специалисты предполагают, что острый и хронический миелолейкоз развивается по причине нарушения хромосомного аппарата, которое, в свою очередь, вызвано влиянием мутагенов или наследственных факторов.
Говоря о воздействии химических мутагенов, стоит обратить внимание на тот факт, что было зафиксировано достаточно случаев, когда у людей, подвергавшихся воздействию бензола или употреблявших цитостатические препараты («Мустарген», «Имуран», «Саркозолин», «Лейкеран» и др.), развивался миелолейкоз.
Хронический миелолейкоз: стадии
При таком диагнозе, как «миелолейкоз», различают три этапа развития данного заболевания:
— Начальная. Характеризуется увеличением селезенки и стабильным нагнетанием лейкоцитов в крови. Состояние пациента рассматривают в динамике, не применяя радикальных мер лечения. Болезнь, как правило, диагностируется уже на этапе тотальной генерализации опухоли в костном мозге. При этом в селезенке, а в некоторых случаях и в печени, наблюдается обширная пролиферация опухолевых клеток, которая свойственна развернутой стадии.
— Развернутая. Клинические признаки на этой стадии начинают доминировать, и пациенту назначается лечение с использованием специфических препаратов. На данном этапе миелоидная ткань в костном мозге, печени и селезенке разрастается, жир в плоских костях фактически полностью вытесняется. Также наблюдается резкое преобладание гранулоцитарного ростка и трехростковая пролиферация. Стоит отметить, что в развернутой стадии лимфатические узлы крайне редко поражаются лейкозным процессом. В некоторых случаях возможно развитие миелофиброза в костном мозге. Есть вероятность развития пневмосклероза. Что касается инфильтрации печени опухолевыми клетками, то в большинстве случаев она выражена достаточно ярко.
— Терминальная. На данном этапе развития болезни прогрессирует тромбоцитопения и анемия. Становятся очевидными проявления различных осложнений (инфекции, кровотечения и др.). Нередко наблюдается развитие второй опухоли из незрелых стволовых клеток.
На какую продолжительность жизни стоит рассчитывать?
Если говорить о людях, которым пришлось столкнуться с хроническим миелолейкозом, то стоит отметить, что современные методики лечения значительно повысили шансы таких больных на относительно долгую жизнь. Благодаря тому факту, что были произведены открытия в области патогенетических механизмов развития болезни, позволившие разработать препараты, способные воздействовать на мутировавший ген, при таком диагнозе, как хронический миелолейкоз, продолжительность жизни пациентов может составлять 30-40 лет с момента выявления заболевания. Но это возможно при условии, что опухоль была доброкачественной (медленное увеличение лимфоузлов).
В случае развития прогрессирующей или классической формы средний показатель составляет от 6 до 8 лет с момента, когда была диагностирована болезнь. Но в каждом индивидуальном случае на количество лет, которыми сможет насладиться больной, ощутимое влияние оказывают меры, которые были предприняты в процессе лечения, равно как и форма заболевания.
В среднем, по статистическим данным, в течение первых двух лет после выявления заболевания умирает до 10 % пациентов и 20 % — в последующие годы. Немало больных миелолейкозом уходят из жизни в течение 4 лет после того, как был поставлен диагноз.
Клиническая картина
Развитие такого заболевания, как хронический миелолейкоз, проходит постепенно. В первое время больной чувствует ухудшение общего состояния здоровья, быструю утомляемость, слабость, а в некоторых случаях умеренную боль в левом подреберье. После проведения исследования нередко фиксируется увеличение селезенки, а при анализе крови обнаруживается значительный нейтрофильный лейкоцитоз, отличающийся наличием сдвига в лейкоцитарной формуле влево по причине действия миелоцитов с повышенным содержанием базофилов, эозинофилов и тромбоцитов. Когда наступает время развернутой картины болезни, то у пациентов наблюдается потеря трудоспособности по причине нарушения сна, потливости, стабильного нарастания общей слабости, значительного повышения температуры, боли в области селезенки и в костях. Также происходит потеря массы и аппетита. На данном этапе болезни селезенка и печень значительно увеличиваются.
При этом хронический миелолейкоз, симптомы которого отличаются в зависимости от этапа развития болезни, уже в начальной стадии ведет к тому, что в костном мозге выявляется преобладание эозинофилов, зернистых лейкоцитов и базофилов. Такой рост происходит за счет уменьшения других лейкоцитов, нормобластов и эритроцитов. Если процесс течения болезни начинает обостряться, то количество незрелых миелобластов и гранулоцитов значительно возрастает, начинают появляться гемоцитобласты.
Бластный криз при хроническом миелолейкозе приводит к тотальной властной метаплазии. При этом наблюдается высокая лихорадка, во время которой отсутствуют признаки инфекции. Развивается геморрагический синдром (кишечные, маточные, слизистые кровотечения и др.), лейкемиды в коже, оссалгии, лимфатические узлы увеличиваются, фиксируется полная резистентность к цитостатической терапии и инфекционные осложнения.
Если на процесс течения болезни не удалось ощутимо повлиять (или такие попытки не были предприняты вовсе), то состояние больных будет прогрессивно ухудшаться, при этом появится тромбоцитопения (дают о себе знать явления геморрагического диатеза) и резкая анемия. По причине того, что размеры печени и селезенки быстро растут, заметно увеличивается объем живота, состояние диафрагмы становится высоким, органы брюшной полости сдавливаются, и, как следствие перечисленных факторов, начинает уменьшаться дыхательная экскурсия легких. Более того, изменяется положение сердца.
Когда хронический миелолейкоз развивается до такого уровня, на фоне ярко выраженной анемии появляется головокружение, одышка, сердцебиение и головная боль.
Моноцитарный криз при миелолейкозе
Касаясь темы моноцитарного криза, нужно отметить, что это достаточно редкое явление, в процессе которого появляются и разрастаются молодые, атипичные и зрелые моноциты в костном мозге и крови. По причине того, что костномозговые барьеры нарушены, на терминальной стадии заболевания в крови появляются осколки ядер мегакариоцитов. Одним из наиболее важных элементов терминальной стадии при моноцитарном кризе является угнетение нормального кроветворения (независимо от морфологической картины). Процесс болезни отягощается по причине развития тромбоцитопении, анемии и гранулоцитопении.
У некоторых больных может фиксироваться быстрое увеличение селезенки.
Диагностика
Факт прогрессирования такого заболевания, как хронический миелолейкоз, прогноз развития которого может быть достаточно нерадужным, определяется посредством целого комплекса клинических данных и конкретных изменений в процессе кроветворения. При этом в обязательном порядке учитываются гистологические исследования, гистограммы и миелограммы. Если клинико-гематологическая картина выглядит недостаточно ясной и данных для того, чтобы уверенно поставить диагноз, не хватает, то врачи делают акцент на обнаружении Ph-хромосомы в моноцитах, мегакариоцитах, эритроцитах и гранулоцитах костного мозга.
В некоторых случаях приходится дифференцировать хронический миелолейкоз. Диагностика, которую можно определить, как дифференциальную, ориентирована на выявление типичной картины болезни с гиперлейкоцитозом и спленомегалией. Если вариант нетипичный, то производится гистологическое исследование пунктата селезенки, а также изучение миелограммы.
Определенные сложности могут наблюдаться при поступлении пациентов в стационар в состоянии бластного криза, симптомы которого очень похожи на миелобластный лейкоз. В такой ситуации ощутимо помогают данные основательно собранного анамнеза, цитохимические и цитогенетические исследования. Нередко хронический миелолейкоз приходится дифференцировать с остеомиелофиброзом, при котором можно наблюдать интенсивную миелоидную метаплазию в лимфоузлах, селезенке, печени, а также значительную спленомегалию.
Бывают ситуации, и они нередки, когда помогает выявить хронический миелолейкоз анализ крови у пациентов, которые проходили обычное обследование (при отсутствии жалоб и бессимптомном течении болезни).
Диффузный миелосклероз можно исключить посредством рентгенологического исследования костей, выявляющего множественные участки склероза в плоских костях. Еще одно заболевание, которое пусть и редко, но все же приходится дифференцировать с миелолейкозом, — это геморрагическая тромбоцитемия. Её можно охарактеризовать лейкоцитозом со сдвигом влево и увеличением селезенки.
Лабораторные исследования при диагностике миелолейкоза
Для того чтобы точно определить состояние пациента при подозрении на хронический миелолейкоз, анализ крови может проводиться в нескольких направлениях:
— Биохимический анализ крови. Его используют для того, чтобы выявить нарушения в работе печени и почек, которые являются следствием применения определенных цитостатических средств или были спровоцированы распространением лейкозных клеток.
— Клинический анализ крови (полный). Необходим для измерения уровня различных клеток: тромбоцитов, лейкоцитов и эритроцитов. У большинства пациентов, которым пришлось столкнуться с такой болезнью, как хронический миелолейкоз, анализ выявляет большое количество незрелых белых клеток. Иногда может наблюдаться низкое количество тромбоцитов или эритроцитов. Подобные результаты не являются основанием для определения лейкоза без дополнительного теста, который направлен на исследование костного мозга.
— Исследование образцов костного мозга и крови под микроскопом, проводимое патологом. В этом случае изучается форма и размер клеток. Незрелые клетки идентифицируются как бласты или миелобласты. Также идет подсчет количества кроветворных клеток в костном мозге. К данному процессу применим термин «клеточность». У тех, кто болен хроническим миелолейкозом, костный мозг, как правило, гиперклеточный (большое скопление кроветворных клеток и высокое содержание злокачественных).
Лечение
При таком заболевании, как хронический миелолейкоз, лечение определяется в зависимости от стадии развития опухолевых клеток. Если речь идет о слабовыраженных клинико-гематологических проявлениях в хронической стадии болезни, то в качестве актуальных лечебных мероприятий стоит рассматривать полноценное питание, обогащенное витаминами, регулярное диспансерное наблюдение и общеукрепляющую терапию. На течение заболевания благоприятно может повлиять «Интерферон».
В случае развития лейкоцитоза врачи назначают «Миелосан» (2-4 мг/сутки). Если приходится иметь дело с более высоким лейкоцитозом, то доза «Миелосана» может подниматься до 6 и даже 8 мг/сут. Ожидать проявления цитопенического эффекта стоит не ранее 10 дней после первого приема препарата. Уменьшение размеров селезенки и цитопенический эффект происходит в среднем во время 3-6-й недели лечения, если общая доза препарата составляла от 200 до 300 мг. Дальнейшая терапия подразумевает прием один раз в неделю 2-4 мг «Миелосана», который на данном этапе оказывает поддерживающий эффект. Если о себе дают знать первые признаки обострения, проводится миелосанотерапия.
Возможно использование такой методики, как лучевая терапия, но только в том случае, когда в качестве основного клинического симптома определяется спленомегалия. Для лечения пациентов, чья болезнь находится в прогрессирующей стадии, актуальна поли- и монохимиотерапия. Если фиксируется значительный лейкоцитоз, при недостаточно эффективном воздействии «Миелосана» назначается «Миелобромол» (125-250 мг в день). При этом осуществляется строгий контроль показателей периферической крови.
В случае развития значительной спленомегалии назначается «Допан» (однократно 6-10 г/сутки). Препарат пациенты принимают один раз в течение 4-10 дней. Интервалы между приемами определяются в зависимости от степени и скорости уменьшения числа лейкоцитов, а также размеров селезенки. Как только снижение лейкоцитов достигает приемлемого уровня, использование «Допана» прекращается.
Если у больного развивается резистентность к «Допану», «Миелосану», лучевой терапии и «Миелобромолу», для лечения назначается «Гексафосфамид». В целях эффективного воздействия на течение заболевания в прогрессирующей стадии используются программы ЦВАМП и АВАМП.
Если развивается резистентность к цитостатической терапии при таком заболевании, как хронический миелолейкоз, лечение в стадии прогрессирования будет ориентировано на использование лейкоцитофареза в сочетании с конкретной схемой полихимиотерапии. В качестве срочных показаний к лейкоцитофарезу можно определить клинические признаки стаза в сосудах головного мозга (чувство тяжести в голове, снижение слуха, головные боли), которые обусловлены гипертромбоцитозом и гиперлейкоцитозом.
В случае выявления бластного криза актуальными можно считать различные программы химиотерапии, используемые при лейкозах. Показаниями к трансфузиям эритроцитарной массы, тромбоконцентрата и антибактериальной терапии служат инфекционные осложнения, развитие анемии и тромбоцитопенической геморрагии.
Касаясь хронической стадии заболевания, стоит отметить, что на данном этапе развития миелолейкоза достаточно эффективной является трансплантация костного мозга. Эта методика способна обеспечить развитие клинико-гематологической ремиссии в 70 % случаев.
Срочным показанием для применения спленэктомии при хроническом миелолейкозе является угроза разрыва или сам разрыв селезенки. К относительным показаниям можно причислить тяжелый абдоминальный дискомфорт.
Тем пациентам, у которых были выявлены экстрамедуллярные опухолевые образования, представляющие угрозу для жизни, показана лучевая терапия.
Хронический миелолейкоз: отзывы
По словам больных, подобный диагноз является слишком серьезным, чтобы его игнорировать. Изучая свидетельства различных пациентов, становится очевидной реальная возможность победить заболевание. Для этого нужно своевременно пройти диагностику и курс последующего лечения. Только при участии высококвалифицированных специалистов есть шанс победить хронический миелолейкоз с минимальными потерями для здоровья.
Причины заболевания
Чаще всего причиной болезни считается генетическая мутация, из-за которой нарушается нормальный процесс кроветворения с появлением юных форм. Несмотря на современные медицинские методики полное излечение недуга практически невозможно, однако, остановив процесс на ранней стадии, человек может еще долго жить без ухудшения качества жизни.
До сих пор не выявлены основные причины, которые провоцируют сбой кроветворения. Существуют лишь предположения, что аномалии в составе хромосомного набора играю немаловажную роль в патологическом процессе.
К предрасполагающим факторам относится:
-
- действие канцерогенов химического происхождения, например, при приеме лекарственных препаратов группы цитостатиков или вследствие воздействия бензола;
- лучевое облучение при другой локализации онкопроцесса;
- некоторые ученые указывают на взаимосвязь вирусных агентов и данной болезни.
Не зависимо от провоцирующего фактора, злокачественный процесс проходит по одному пути, вызывая острый или хронический миелолейкоз.
Как проявляется миелолейкоз?
Поражая кроветворные ростки, прогрессирование болезни протекает развернутой и терминальной стадиями. На начальном этапе могут отсутствовать какие-либо клинические проявления. Лабораторно в крови обнаруживается лишь лейкоцитоз и появление юных форм. Кроме того, выявляется филадельфийская хромосома и дисбаланс между эритроцитами и белыми кровяными клетками (лейкоцитами) в костном мозге.
Данная стадия может продолжаться около 4-х лет. Диагностировав патологию на начальном этапе и начав необходимое лечение, человек долгое время не ощущает симптомов недуга.
Что касается терминальной стадии, то здесь больной жалуется на гипертермию (увеличение температуры), интенсивное снижение массы тела, выраженную слабость и боль в костях. При пальпации обнаруживается увеличение размеров селезенки и печени.
При диагностике выявляется повышенное количество бластов, регистрируется угнетение кроветворных ростков, в связи с чем снижается уровень лейкоцитов, тромбоцитов и эритроцитов.
Миелолейкоз имеет стадийность:
Хроническая фаза – длиться до 3-х лет, на протяжении которых могут отсутствовать симптомы, однако постепенно увеличивается селезенка, лейкоцитарный и тромбоцитарный уровень. По окончании 3-х лет появляется слабость, потливость и дискомфорт в левом подреберье.
Стадия акселерации клинически практически ничем не отличается, однако лабораторно обнаруживается повышение базофилов, регистрируются миелоциты, метамиелоциты, промиелоциты и бластные клетки. Возможно появление зуда, диареи и чувства жара. Если на данном этапе после проведенного курса химиотерапии не снижается количество базофилов, это свидетельствует о неблагоприятном прогнозе и прогрессировании терминальной фазы.
Терминальная – характеризуется резкой слабостью, суставной, костной болью, лихорадкой до 39 градусов, ознобом, снижением массы тела, спленомегалией и гепатомегалией. Из осложнений стоит отметить инфаркт селезенки, проявляющийся острой болью в левом подреберье с распространением на спину и гипертермией до 38 градусов.
Симптомы на последней стадии обусловлены изменениями в крови. Снижение лейкоцитов сопровождается неполноценной работой иммунной системы, обостряется хроническая патология, прогрессируют инфекционные болезни и воспаляются лимфоузлы.
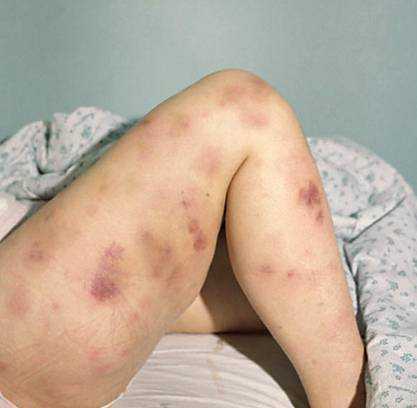
Тромбоцитопения проявляется нарушением работы свертывающей системы и развитием геморрагического синдрома. На коже и слизистых может появляться сыпь, увеличивается время кровоточивости при наличии раны или при менструации. При анемии возможны головокружения, слабость, бледность кожных покровов и потеря сознания, так как органы, в том числе головной мозг не получают достаточное количество питательных веществ и кислорода.
Острый миелолейкоз вначале развития проявляется симптомокомплексом гриппа в виде ломоты в суставах, субфебрилитета, снижения аппетита, слабости и одышки. Данная форма стремительно прогрессирует и, несмотря на применяемое лечение, часто приводит к летальному исходу (15-70%).
Лечение миелолейкоза
Лечебная тактика зависит от стадии злокачественной патологии. Зачастую применяется медикаментозная и химиотерапия. Широко назначается общеукрепляющая терапия, гормональная, иммуностимулирующая, изменяется питательный рацион и ведется диспансерное наблюдение.
Химиотерапевтические препараты (“Гидроксимочевина”) вводятся исключительно в условиях стационара под наблюдением медицинского персонала. Однако следует помнить об их побочных действиях в виде угнетения иммунитета, появления диареи и других диспепсических расстройств. Из цитостатиков назначается “Миелосан”.
Лучевая терапия используется при увеличении селезенки. На терминальной стадии могут применяться “Винкристин”, “Цитозар”, “Рубомицин” и другие химиопрепараты.
Излечение возможно при трансплантации стволовых клеток, однако это не всегда удается.
Миелолейкоз
Миелолейкоз – это злокачественное заболевание крови и костного мозга, при котором образуется избыточное количество гранулоцитов (нейтрофилов, эозинофилов и базофилов) и их предшественников. Гранулоциты являются разновидностью лейкоцитов и отвечают за защиту организма от инфекций. При миелолейкозе они перестают выполнять свои функции и вытесняют из крови и костного мозга нормальные клетки крови, проникают в другие органы, нарушая их работу.
Существует множество разновидностей миелолейкоза, различаемых в зависимости от скорости развития патологического процесса, зрелости лейкозных клеток, изменений в хромосомах. Чаще всего выделяют два основных типа заболевания: острый миелобластный лейкоз и хронический миелоидный лейкоз.
При любом типе миелолейкоза применяется комплексное и достаточно длительное лечение. С каждым годом появляются все более эффективные методы терапии этого вида рака крови. Прогноз заболевания зависит от типа миелолейкоза, стадии болезни, на которой начато лечение, возраста пациента. В целом прогноз при остром миелолейозе благоприятный, особенно у детей. При хроническом миелолейкозе прогноз хуже, однако при своевременном начале лечения современные методы терапии позволяют надолго приостановить прогрессирование патологического процесса.
Синонимы русские
Лейкемия миелоидная, Ph-положительный хронический миелолейкоз, лейкоз гранулоцитарный, миелоидный лейкоз, миелолейкоз, миелоз, миеломная болезнь, острый миелобластный лейкоз, острый нелимфобластный лейкоз, острый нелимфобластный лейкоз у взрослых.
Синонимы английские
Childhoodacutemyeloidleukemia, adultacutemyeloidleukemia, acutemyeloidleukemia, acutemyeloblasticleukemia, acutegranulocyticleukemia, acutenonlymphocyticleukemia, chronicmyeloidleukemia, chronicgranulocyticleukemia.
Симптомы
Острый миелолейкоз обычно развивается стремительно – в течение нескольких недель. Его основными симптомами являются:
- слабость;
- раздражительность;
- головокружение;
- одышка;
- частые инфекционные заболевания;
- лихорадка;
- частые, длительные кровотечения, возможны сильные носовые кровотечения, кровоточивость десен;
- кровоизлияния в кожу и слизистые;
- болезненность, воспаление десен;
- тяжесть в животе;
- увеличение лимфатических узлов;
- головные боли, тошнота, рвота, судороги.
Хронический миелолейкоз развивается постепенно и проходит 3 стадии:
1) хроническая – симптомы обычно отсутствуют;
2) прогрессирующая – появляются слабость, боли в животе;
3) бластный криз – на этом этапе заболевание протекает со всеми симптомами острого миелолейкоза.
Общая информация о заболевании
Все клетки крови развиваются из единой стволовой клетки, которая затем дает начало миелоидным и лимфоидным стволовым клеткам. Из лимфоидных формируются лимфоциты, миелоидные дают начало предшественникам эритроцитов, тромбоцитов и миелобластам. Именно из миелобластов в результате цепочки последовательных делений формируются гранулоциты и моноциты.
Гранулоциты представляют собой разновидность лейкоцитов и называются так из-за своего вида – под микроскопом в них видны характерные темные гранулы, а также ядро, состоящее из нескольких сегментов. Существует несколько видов гранулоцитов – эозинофилы, базофилы и нейтрофилы. Моноциты также имеют сегментированное ядро, но их гранулы светлые. Основная задача гранулоцитов и моноцитов – борьба с вредными для организма чужеродными агентами (вирусами, бактериями).
При миелолейкозе костный мозг вырабатывает избыточное количество патологических гранулоцитов. Постепенно они вытесняют из крови и костного мозга нормальные клетки крови, что приводит к появлению характерных симптомов. При подавлении деления и роста эритроцитов возникают симптомы анемии – бледность, головокружение, слабость, – при подавлении роста тромбоцитов – нарушения свертываемости крови, частые кровотечения. Лейкозные клетки могут проникать в другие органы – печень, селезенку, лимфатические узлы, головной и спинной мозг, – вызывая нарушение их функций и характерные проявления. Патологические миелоидные клетки также могут образовывать скопления в надкостнице, средостении, органах желудочно-кишечного тракта (хлоромы).
Злокачественные нарушения кроветворения происходят из-за повреждения ДНК миелоидных клеток. ДНК клетки содержит информацию о ее росте, делении и гибели и представлена в клетке в виде хромосом. Факторы, повреждающие ДНК миелоидных клеток, до конца не изучены. Доказано вредное воздействие ионизирующей радиации, предшествующей химиотерапии, токсических веществ, например бензола. Выявлены также характерные изменения структуры и количества хромосом при определенных видах миелолейкоза.
При остром миелолейкозе часто наблюдаются повреждения 8-й, 15-й, 16-й, 17-й и 21-й хромосом. Характерным признаком хронического миелолейкоза считается наличие филадельфийской хромосомы. Она встречается в 95 % всех случаев хронического миелолейкоза и образована в результате присоединения к 22-й хромосоме участка 9-й хромосомы. Филадельфийская хромосома активирует синтез специальных белков тирозинкиназ, которые нарушают деление миелоцитов. В результате в крови появляются как зрелые гранулоциты, так и бластные клетки.
Острый миелолейкоз встречается как у взрослых, так и у детей. При нем в крови и костном мозге находят большое количество миелобластов. При хроническом миелолейкозе миелоидные клетки более зрелые и "специализированные". Средний возраст пациентов с хроническим миелолейкозом – 55-60 лет.
Кто в группе риска?
- Мужчины.
- Люди старше 60 лет.
- Курящие.
- Подвергавшиеся радиоактивному облучению.
- Подвергавшиеся химиотерапии или лучевой терапии в связи с другой формой рака.
- Люди с синдромом Дауна и другими генетическими нарушениями.
- Страдающие миелодиспластическими заболеваниями (это группа хронических заболеваний, при которых костный мозг не вырабатывает достаточное количество полноценных клеток крови).
Диагностика
Лабораторные методы обследования
- Общий анализ крови (без лейкоцитарной формулы и СОЭ) с лейкоцитарной формулой. Это исследование дает врачу информацию о количестве, соотношении и степени зрелости элементов крови.
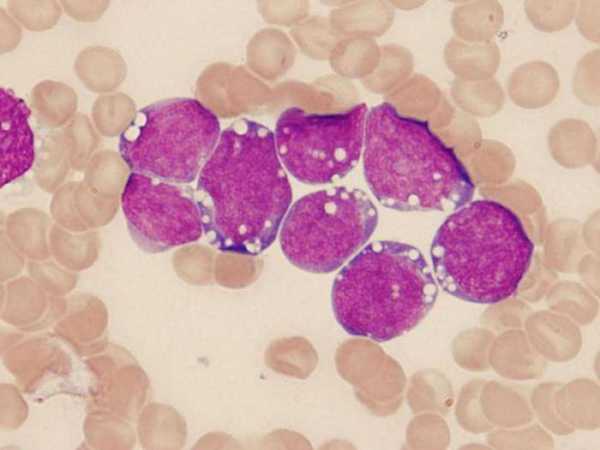
- Лейкоциты. При миелолейкозе лейкоциты могут быть повышены, в норме или понижены. Лейкоцитарную формулу (соотношение отдельных видов лейкоцитов) определяют по мазку крови. Для этого на предметное стекло наносится тонкий мазок крови, окрашивается специальными красителями, а затем исследуется под микроскопом. Таким образом врач может не только определить соотношение лейкоцитов, но и выявить патологические, незрелые клетки, которые внешне отличаются от нормальных. Для острого лейкоза характерно наличие в лейкоцитах специфических включений – азурофильных гранул и палочек Ауэра. Это характерный признак миелобластов. При хроническом миелолейкозе в крови обнаруживают более зрелые лейкоциты.
- Тромбоциты, эритроциты и гемоглобин могут быть снижены.
- Определение уровня щелочной фосфатазы нейтрофилов. Это специальное бактерицидное вещество, которое определяется только в зрелых лейкоцитах. При миелолейкозе она снижена, тогда как при других заболеваниях, например инфекциях, бывает значительно повышена.
- Проточная цитометрия или иммунофенотипирование. При сложных вариантах миелолейкоза эти методики позволяют точно определить тип злокачественных клеток. При проточной цитометрии измеряют параметры клетки с помощью лазерного луча. Иммунофенотипирование заключается в обнаружении специфических для разных типов клеток белков на поверхности мембраны лейкоцита.
- Цитогенетические исследования. Для исследования обычно берут венозную кровь. Клетки крови фиксируют и окрашивают, после чего специалист под микроскопом исследует их кариотип – полный набор хромосом, который идентичен во всех клетках организма человека. Используется для выявления хромосомных нарушений, характерных для миелолейкоза.
Другие методы обследования
- Спинномозговая пункция. Проводится для определения в спинномозговой жидкости, омывающей спинной и головной мозг, лейкозных клеток. Образец спинномозговой жидкости берется с помощью тонкой иглы, которая вводится между 3-м и 4-м поясничными позвонками после местного обезболивания.
- Рентгенография грудной клетки – может показать увеличение лимфатических узлов.
- Ультразвуковое исследование органов брюшной полости. Помогает выявить увеличение печени и селезенки.
Лечение
- Химиотерапия – это использование специальных препаратов, которые разрушают лейкозные клетки или препятствуют их делению.
- Таргетированная терапия – применение препаратов, имеющих направленное действие на некоторые виды злокачественных клеток. Они взаимодействуют с определенными белками на поверхности лейкозных клеток и вызывают их разрушение.
- Иммунотерапия – использование средств, усиливающих ответ иммунной системы организма на злокачественные клетки. При терапии лейкозов чаще всего используют альфа-интерферон – специфический белок, обладающий противовирусной активностью.
- Пересадка костного мозга – пациенту пересаживают нормальные клетки костного мозга от подходящего донора. Предварительно проводят курс химио- или лучевой терапии в высоких дозах, чтобы уничтожить все патологические клетки в организме.
- Лучевая терапия – разрушение лейкозных клеток с помощью ионизирующего излучения. Может быть использована при остром миелолейкозе для полного разрушения лейкозных клеток перед пересадкой костного мозга.
Профилактика
Специфической профилактики миелолейкоза нет. Для своевременной диагностики необходимо регулярно проходить профилактические осмотры, а при возникновении тревожных симптомов сразу обращаться к врачу.
Рекомендуемые анализы
Что такое ХМЛ и как с ним бороться
Врач-онкогематолог Михаил Фоминых про хронический миелоидный лейкоз

Михаил Фоминых — научный сотрудник Российского НИИ гематологии и трансфузиологии, Санкт-Петербург. Практикующий онкогематолог, который посвятил свою научную деятельность хроническому миелолейкозу, и в 2016 году защитил на эту тему диссертацию. В ходе дискуссии он раскрыл основные симптомы ХМЛ, рассказал про зоны риска и ограничения, а также объяснил, можно ли родить здорового ребенка с таким диагнозом.
Каковы основные симптомы ХМЛ?
Зачастую самого человека ничего особо не беспокоит. Очень часто пациент попадает к нам от другого специалиста: терапевта или хирурга. Люди сдают плановые анализы и выясняется, что у них повышенное количество белых кровяных телец. Обнаружив повышенные лейкоциты, терапевт или хирург направляет пациента к гематологу.
Если говорить о симптоматике, то это может быть повышенная усталость, потливость, немотивированные подъемы температуры тела до 38 без явных признаков инфекции, тяжесть в левом подреберье за счет того, что селезенка увеличивается в размере. Если следить за здоровьем и каждый год сдавать анализы, то хронический миелоидный лейкоз можно выявить на ранней стадии. На сегодняшний день 95% случаев ХМЛ диагностируется в хронической фазе и только 5% - в запущенных, продвинутых. Это фазы акселерации и бластного криза, когда начинают проявляться симптомы опухолевой интоксикации.
Самый яркий симптом ранней стадии ХМЛ - немотивированная потеря массы тела в течение полугода. Если вы не сидите на диете и не работаете над снижением веса, но теряете килограммы, а помимо этого наблюдается повышенная потливость и температура выше 38 - это повод насторожиться и пойти сдать анализы.
ХМЛ в "продвинутой" стадии проявляется слабостью и повышенной утомляемостью вследствие анемии, может появляться повышенная кровоточивость из десен или из носа, появление синяков. В принципе, эти симптомы характерны для всех гематологических болезней, которые связаны с поражением костного мозга.
Насколько должны быть повышены лейкоциты, чтобы заподозрить ХМЛ?
На сегодняшний день норма лейкоцитов составляет от 4 до 9 на десять в девятой степени в литре. Но нужно понимать, что эти цифры зависят от многих факторов: перенесенная инфекция, операция. Только по количеству лейкоцитов никто не скажет, что у вас лейкоз - в любом случае необходимо будет провести дополнительное обследование. Если повышенный лейкоцитоз 10-11 проявляется однократно - это еще не повод бежать к гематологу, так как это может быть вполне нормальная реакция организма на перенесенную вирусную или бактериальную инфекцию. Но если в течение трех месяцев наблюдается лейкоцитоз выше 15, то это повод обратиться к гематологу. Мы рекомендуем наблюдать за показателями крови и сдавать анализы хотя бы раз в год, чтобы вовремя выявить сбой и начать лечение, если оно необходимо.
Можно ли говорить о том, что кто-то находится в зоне риска? Есть ли предрасположенность? Влияет ли экология?
Наследственность здесь не играет абсолютно никакой роли. Если у родителей был ХМЛ, то далеко не факт, что он будет у детей: наследственная теория пока не нашла подтверждения. То же самое касается всех остальных существующих теорий: вирусной, бактериальной.
Не так давно произошла ужасная история, когда больных лейкозом детей выселяли из квартир, потому что жители дома считали, будто рак может передаваться воздушно-капельным путем. Это, разумеется, не так: онкологические заболевания не передаются таким способом. Если бы онкологические болезни передавались воздушно-капельным путем, то я и другие врачи-онкологи уже, наверное, поумирали бы: своего первого онкологического пациента я увидел на третьем курсе, за 15 лет практики я повидал их тысячи и пока, к счастью, жив, здоров и не имею никакого онкологического диагноза.
После получения ионизирующего излучения риск действительно повышается: после Чернобыля, Хиросимы и Нагасаки отмечался всплеск развития острых лейкозов. Это подтвержденный факт, но наследственность на возникновение лейкозов никаким образом не влияет. Другие теории пока тоже не нашли подтверждения. Врачи, к сожалению, пока не выявили причину.
Можно сказать, что ХМЛ - это несчастный случай, как кирпич на голову?
Да, это именно так. Я сейчас сижу перед вами, а вы сидите за своими гаджетами, и внутри каждого организма прямо в это время происходит энное количество мутаций. Это случается, пока мы спим, едим, идем по улице. Пока наша иммунная система справляется с возникающими мутациями, все хорошо. Когда возникает сбой и система перестает справляться, начинает развиваться опухолевый процесс. В случае с гематологическими болезнями, для этого достаточно мутации одной клетки. И это действительно, как кирпич на голову. Хронический лейкоз возникает спонтанно, мы не можем его спрогнозировать.
Как строится лечение при ХМЛ?
В первой линии терапии назначается Иматиниб. Если до 1999-го года после постановки диагноза пациенты проживали 3-4 года, то сегодня можно говорить о 20-летней выживаемости. Пациенты с ХМЛ продолжают жить полноценной спокойной жизнью и умирают также, как их сверстники от сердечно-сосудистых заболеваний, сахарного диабета и так далее. Лечение Иматинибом происходит амбулаторно. Пациент получает препарат в аптеке, принимает дома и живет, в общем, как совершенно обычный человек. Помимо Иматиниба, существуют препараты второго и третьего поколения. И даже уже четвертого, они пока проходят клинические исследования.
Можно ли беременеть при ХМЛ?
При лечении новыми препаратами, которые проходят клинические исследования, необходимо применять контрацептивы, потому что мы пока не знаем, как эти новые лекарства могут повлиять на плод. В случае с уже хорошо известными, необходимо принимать решение совместно с лечащим врачом, гематологом и гинекологом, ведущим беременность. Например, у Екатерины Юрьевны Челышевой, которая работает в НМИЦ гематологии, огромный опыт и большой регистр пациенток с хроническим миелолейкозом, которые забеременели и родили здоровых детишек. Если ситуация позволяет безопасно отменить терапию на время зачатия и хотя бы первый триместр, необходим ежемесячный мониторинг. Если мы видим, что молекулярный ответ потерян, то по жизненно важным показаниям терапию придется вернуть.
Полная отмена происходит, к сожалению, не так быстро, как нам хотелось бы. В случае с ингибиторами тирозинкиназы первого поколения – чуть дольше. Со вторым поколением – чуть раньше: примерно от трех до пяти лет постоянного приема. Достигаем молекулярного ответа, отменяем терапию, и там - пожалуйста. Снимаем ограничения в плане беременности и вообще, в принципе, большинство ограничений. Это обычный выздоровевший человек, излеченный от онкологического заболевания. Беременеть – можно. Единственное, что требуется - постоянный мониторинг со стороны именно гематолога.
Лечение препаратами второго и последующих поколений позволяют сохранить репродуктивные функции, хотя раньше это казалось нонсенсом. Сейчас даже в рекомендациях по лечению онкологических заболеваний рекомендовано обсудить с пациентами их репродуктивные планы, и только после этого назначать препарат. Сегодня существуют препараты, которые не так сильно влияют на фертильность, и у женщины остается возможность забеременеть и выносить здорового ребенка. Сейчас сохранение репродуктивных функций является нормой и одной из целей при лечении больных с ХМЛ. Это ли не счастье?
Есть ли какие-то ограничения, которые накладывает ХМЛ или их нет? Какова жизнь при ХМЛ и после ХМЛ, если мы добиваемся полной ремиссии и прекращаем лечение препаратами?
Я так радужно говорю о том, что все победили, все выиграли, но чтобы этого добиться, необходимо тесное сотрудничество между лечащим врачом и самим пациентом. Какие-либо изменения в жизни необходимо обсуждать с лечащим врачом, нельзя принимать решения самостоятельно - только после консультации с лечащим врачом.
Единственное строгое ограничение, которое действительно существует, - это употребление грейпфрутового сока. Это категорически запрещено. Если упростить, грейпфрутовой сок влияет на усваиваемость препаратов с ингибиторами тирозинкиназы, и они становятся неэффективными: то есть, ты принимаешь лекарство, а оно не действует так, как должно. Также существует ряд препаратов, которые могут усиливать эффект препаратов или снижать его, поэтому перед началом лечения у гематолога необходимо сообщить о всех лекарствах, которые вы принимаете постоянно. Если длительность приема препаратов не превышает неделю, то это ни на что не влияет, но если терапию назначают на постоянной основе, то может возникнуть конфликт. Особенно это касается гипотензивных препаратов для нормализации давления.
Если говорить о спорте, то можно постепенно возвращаться к нему после того, как всё - размеры селезенки, анализ крови, общее самочувствие - нормализуется. Умеренные физические нагрузки - это пожалуйста. Наши коллеги из США недавно провели исследования, которые доказали, что занятия йогой, дыхательные упражнения, цигун позитивно сказываются на качестве жизни пациентов с миелопролиферативными заболеваниями.
Можно ли ездить на море, проходить санаторно-курортное лечение?
Этот вопрос до конца неясен. Раньше каждый онкологический диагноз ставил крест на любой физиотерапии, любом санаторно-курортном лечении. Сейчас единственное, что я запрещаю всем, и не только своим пациентам, но и здоровым здоровым людям – избегать повышенного излучения солнечных лучей. В море купайтесь, сколько влезет, но от солнца следует закрываться. И мы сейчас говорим не только о тех, кто находится в ремиссии, но и о тех, кто находится на лечении, принимает медикаменты. Если чувствуете себя хорошо, анализ крови нормальный, то море - пожалуйста. Но вот активного солнца следует избегать - это пагубно сказывается на всех без исключения. Повышенное воздействие солнечных лучей, ультрафиолета повышает риск развития меланомы. Это доказано.
Можно ли полностью вылечить ХМЛ?
Хронический миелолейкоз - это заболевание, с которым можно жить, и мы этому учим. Существуют школы для диабетиков, школы для больных с артериальной гипертензией, а мы теперь проводим школы для больных с хроническим миелолейкозом: читаем лекции, консультируем больных, образовываем, чтобы они знали про болезнь больше, чем мы. При ХМЛ необходимо мониторить свое состояние и раз в полгода сдавать контрольные анализы. Сейчас проводятся общемировые исследования по поводу возможности полной отмены терапии. Примерно половине пациентов терапию отменяют. В другой половине случаев в течение первого полугода, к сожалению, приходится вернуться к терапии, потому что возникает рецидив. Все очень индивидуально.
прогноз продолжительности жизни, анализ крови, симптомы и лечение
Опухолевые патологии нередко затрагивают и кровеносную систему. Одним из опаснейших патологических состояний является хронический миелолейкоз – это раковое заболевание крови, характеризующееся беспорядочным размножением и ростом кровяных клеток. Данную патологию еще называют миелоидным лейкозом хронической формы.
Заболевание редко поражает представителей детского и подросткового возраста, чаще обнаруживаясь у 30-70-летних пациентов чаще мужского пола.
Что такое хронический миелолейкоз?
По сути, миелоидный лейкоз является опухолью, образующейся из ранних миелоидных клеток. Патология носит клоновый характер и среди всех гемобластозов составляет порядка 8,9% случаев.
Для миелоидного хронического лейкоза характерно бессимптомное развитие. Для диагностики необходимо провести анализ мазка крови, а также нужна костномозговая проба, взятая аспирационно (посредством тонкой иглы).
Для хронического миелолейкоза типично повышение в составе крови специфической разновидности лейкоцитов, называемых гранулоцитами. Формируются они в красном костномозговом веществе и в больших количествах проникают в кровь в несозревшем виде. При этом количество нормальных лейкоцитарных клеток снижается.
Причины
Этиологические факторы миелолейкоза хронического характера до сих пор являются предметом изучения и вызывают у ученых немало вопросов.
Достоверно выявлено, что на развитии хронического миелоидного лейкоза сказываются факторы:
- Радиоактивное облучение. Одним из доказательств подобной теории служит тот факт, что среди японцев, находящихся в зоне поражения атомной бомбы (случай с Нагасаки и Хиросимой), участились случаи развития хронической формы миелолейкоза;
- Влияние вирусов, электромагнитных лучей и веществ химического происхождения. Подобная теория является спорной и окончательного признания пока не получила;
- Наследственно обусловленный фактор. Исследования показали, что у лиц, обладающих нарушениями хромосомного характера, вероятность возникновения миелоидного лейкоза повышается. Обычно это пациенты с синдромом Дауна или Клайнфелтера и пр.;
- Прием некоторых медикаментов вроде цитостатиков, использующихся при лечении опухолей совместно с облучением. Кроме того, опасными в этом плане для здоровья препаратами могут оказаться алкены, спирты и альдегиды. Весьма отрицательно на самочувствии пациентов с миелолейкозом отражается никотиновая зависимость, усугубляющая состояние больных.
Структурные нарушения в красных костномозговых клеточных хромосомах приводят к рождению новых ДНК, обладающих аномальной структурой. В результате начинают производиться клоны аномальных клеток, которые постепенно вытесняют нормальные до такой степени, что их процентное количество в красном костном мозге становится превалирующим.
В итоге аномальные клетки множатся бесконтрольно, по аналогии с раковыми. Причем естественной их гибели по общепринятым традиционным механизмам не происходит.
Понятие о хроническом миелолейкозе и его причинах появления, расскажет следующее видео:
Попадая в общий кровоток, эти недозревшие до полноценных лейкоцитов клетки не справляются с основной своей задачей, что становится причиной отсутствия иммунной защиты и резистентности к воспалениям, аллергическим агентам со всеми вытекающими отсюда последствиями.Фазы
Развитие миелоидного лейкоза хронической формы происходит в три последовательных фазы.
- Фаза хроническая. Длится такая стадия около 3,5-4 лет. Обычно именно с ней большинство пациентов попадают к специалисту. Хронической фазе свойственно постоянство, потому как у больных наблюдается минимально возможный набор симптомокомплексных проявлений. Они бывают настолько незначительными, что пациенты временами и вовсе не придают им значения. Подобная стадия может обнаружиться при случайной сдаче анализа крови.
- Акселеративная фаза. Характеризуется активацией патологических процессов и быстрым увеличением недозрелых лейкоцитов в составе крови. Длительность периода акселерации составляет год-полтора. Если лечебный процесс подобран адекватно и начат вовремя, то вероятность возвращения патологического процесса на хроническую фазу возрастает.
- Бластный криз или терминальная фаза. Это стадия обострения, длится она не более полугода и заканчивается летально. Для нее характерно почти абсолютное замещение красных костномозговых клеток аномальными злокачественными клонами.
В целом патологии присущ лейкемический сценарий развития.
Симптомы
Клиническая картина миелолейкоза различается в соответствии с фазой патологии. Но можно выделить и общую симптоматику.
Пациенты отмечают беспричинное похудение, вялость, отсутствие аппетита. В процессе развития заболевания наблюдается характерное увеличение печени, селезенки, симптоматика геморрагического происхождения. У пациентов возникает склонность к кровоточивости, кожные покровы бледнеют, беспокоят костные боли, ночная гиперпотливость.
Хроническая стадия
 Для этой стадии хронического миелолейкоза типичны такие проявления:
Для этой стадии хронического миелолейкоза типичны такие проявления:
- Слабовыраженная симптоматика, свойственная хронической усталости. Общее самочувствие ухудшается, беспокоит бессилие, похудение;
- В связи с увеличением объемов селезенки, пациент отмечает быстрое насыщение при приеме пищи, в левой области живота часто возникает болезненность;
- В исключительных случаях возникает редкая симптоматика, связанная с тромбообразованием либо разжижением крови, головными болями, нарушениями памяти и внимания, зрительными расстройствами, одышкой, инфарктом миокарда.
- У мужчин на этой фазе может развиться чересчур долгая, вызывающая болевые проявления эрекция или приапический синдром.
Акселеративная
Акселеративная стадия характеризуется резким увеличением выраженности патологической симптоматики. Быстро прогрессирует анемия, а терапевтическое действие препаратов цитостатической группы заметно падает.
Лабораторная диагностика крови показывает стремительное увеличение лейкоцитарных клеток.
Терминальная
Для фазы бластного криза хронического миелолейкоза характерно общее ухудшение клинической картины:
- У пациента наблюдается ярко выраженная лихорадочная симптоматика, но без инфекционной этиологии. Температура может подниматься до 39°С, вызывая ощущение сильнейшей дрожи;
- Интенсивно проявляется геморрагическая симптоматика, обусловленная кровотечениями через кожу, кишечные оболочки, слизистые ткани и пр.;
- Резкая слабость, граничащая с истощением;
- Селезенка достигает невероятных размеров и легко пальпируется, что сопровождается тяжестью и болезненностью в животе слева.
Терминальная стадия обычно заканчивается летально.
Методы диагностики
Диагностикой этой формы лейкоза заведует гематолог. Именно он проводит осмотр и назначает лабораторный анализ крови, ультразвуковую диагностику области живота. Дополнительно проводится костномозговая пункция или биопсия, биохимия и цитохимические исследования, цитогенетический анализ.
Картина крови
Для хронического миелолейкоза типична такая картина крови:
- На хронической стадии на долю миелобластов в костномозговой жидкости или крови приходится порядка 10-19%, а базофилов – более 20%;
- На терминальном этапе лимфобласты и миелобласты превышают 20%-ный порог. При проведении биопсического исследования костномозговой жидкости обнаруживаются крупные скопления бластов.
Лечение
 Терапевтический процесс лечения хронического миелолейкоза складывается из таких направлений:
Терапевтический процесс лечения хронического миелолейкоза складывается из таких направлений:
- Химиотерапия;
- Костномозговая пересадка;
- Облучение;
- Лейкоферез;
- Эктомия селезенки
Химиотерапевтическое лечение предполагает применение традиционных препаратов вроде Миелосана, Цитозара, Гидроксиуреа и пр. Используются и новейшие препараты последнего поколения – Спрайсел или Гливек. Также показано употребление медикаментов на основе гидроксимочевины, Интерферон-α и пр.
Существует вариант полного выздоровления пациента, достигнуть которого можно только посредством костномозговой пересадки. Для этого подбирается донор среди родственников, хотя возможно донорство и посторонних лиц.
После пересадки у пациента отсутствует иммунная защита, поэтому он находится в стационаре до момента приживаемости донорских клеток. Постепенно костномозговая деятельность приходит в норму и пациент выздоравливает.
Если химиотерапия не оказывает необходимой эффективности, используется облучение. Эта процедура основана на применении гамма-лучей, которыми воздействуют на зону расположения селезенки. Задачей подобного лечения является остановка роста или уничтожение аномальных клеток.
В исключительных ситуациях показано удаление селезенки. Подобное вмешательство осуществляется преимущественно на фазе бластного криза. В результате общее течение патологии значительно улучшается, а эффективность лечения медикаментами возрастает.
Когда лейкоцитарный уровень достигает чрезмерно высоких показателей, проводится лейкоферез. Эта процедура практически идентична плазмаферезному кровоочищению. Нередко лейкоферез включают в комплексную терапию медикаментозными средствами.
Прогноз продолжительности жизни
Основная масса пациентов умирает в акселеративную и терминальную стадию патологического процесса. Около 7-10% умирают после диагностирования миелолейкоза в первые 24 месяца. А после бластного криза выживаемость может длиться около 4-6 месяцев.
Если удастся добиться ремиссии, то пациент может прожить после терминальной стадии около года.
Подробный видеоролик о диагностике и терапии хронического миелолейкоза:
Хронический миелолейкоз - симптомы болезни, профилактика и лечение Хронического миелолейкоза, причины заболевания и его диагностика на EUROLAB
Что такое Хронический миелолейкоз -
Хронический миелолейкоз - заболевание опухолевой природы, носящее клоновый характер и возникающее из ранних предшественниц миелопоэза, морфологическим субстратом которого являются преимущественно созревающие и зрелые гранулоциты, в основном нейтрофилы.
Что провоцирует / Причины Хронического миелолейкоза:
В структуре заболеваемости гемобластозами хронический миелолейкоз занимает пятое место (8,9% случаев). Нестандартизованный среднегодовой показатель заболеваемости на 100 000 населения составляет 1 случай. Он диагностируется редко в детском и юношеском возрасте, хронический миелолейкоз одинаково часто встречается среди мужчин и женщин, болеют обычно люди в возрасте 30—70 лет, в детском и юношеском возрасте заболевание встречается редко.
Патогенез (что происходит?) во время Хронического миелолейкоза:
Значительное увеличение числа случаев хронического миелолейкоза в Хиросиме и Нагасаки среди лиц, находившихся в зоне действия атомной бомбы, является одним из доказательств роли радиации в его развитии. Имеются данные о влиянии химических соединений и врожденных дефектах хромосом. В большинстве случаев хронического миелолейкоза выявляется Ph '-хромосома. Эта аномалия часто сочетается с трисомией 8, 9, 19, 21, делецией 5 и с другими дефектами хромосом. Иногда встречаются случаи Ph'-негативного варианта заболевания.
Митотический индекс и индекс метки промиелоцитов, миелоцитов костного мозга и периферической крови у больных хроническим миелолейкозом не отличаются от нормативных показателей, в то время как фракция миелобластов характеризуется кинетическими параметрами, обнаруживаемыми при остром миелобластном лейкозе.
Симптомы Хронического миелолейкоза:
В 86-88 % случаев хронического миелолейкоза в гранулоцитах, моноцитах, эритро- и мегакариоцитах костного мозга выявляется Ph'-хромосома. Характерным является отсутствие ее в лимфоцитах. Количество клеток с Ph'-хромосомой в костном мозге составляет около 98-100%. Вариант хронического миелолейкоза с отсутствием филадельфийской хромосомы встречается редко, отличается более неблагоприятным течением и меньшей средней продолжительностью жизни больных.
Выделяют хроническую, прогрессирующую и острую (бластный криз) стадии хронического миелолейкоза, характеризующиеся комплексом определенных признаков (таблица).
Примерная формулировка диагноза:
- Хронический миелолейкоз (с наличием или отсутствием Ph '-хромосомы) в хронической стадии с несколько увеличенной селезенкой, печенью, небольшим лейкоцитозом и тромбоцитозом.
- Хронический миелолейкоз в прогрессирующей стадии с выраженным увеличением селезенки и печени, нарастанием лейкоцитоза, анемии, тромбоцитопении, оссалгиями.
- Хронический миелолейкоз в стадии властного криза, резистентный к цитостатической терапии, с глубокой анемией, тромбоцитопеническим геморрагическим синдромом различной локализации, увеличением селезенки, печени, оссалгиями, интоксикацией.
На ранних этапах хронической стадии заболевания больные могут жаловаться на утомляемость и снижение работоспособности. Прогрессирующая стадия иногда развивается через 2-10 и более лет с момента установления диагноза. Она характеризуется значительным нарастанием количества лейкоцитов в основном за счет миелоцитов и промиелоцитов, увеличением размеров печени и селезенки, возможным развитием инфарктов селезенки и периспленита.
У больных в стадии властного криза отмечаются резкое ухудшение общего состояния, признаки интоксикации, лихорадка, боли в костях, анемия, геморрагии. В гемограмме и/или в костном мозге обнаруживается значительное количество миелобластов. В единичных случаях выявляются лимфобласты, что свидетельствует о поражении кроветворения на уровне полипотентной стволовой клетки.
Тяжесть течения заболевания усугубляется присоединяющимися бактериальными инфекциями на фоне снижения фагоцитарной активности гранулоцитов, содержания лизоцима и уровня бета-лизинов в сыворотке крови, угнетения продукции комплемента и антителообразования.
Предвидеть приближение властного криза помогают появление признаков резистентности к химиотерапии и изменение кариологического профиля лейкозных клеток (анеуплоидия преимущественно в виде гипердиплоидных клонов, большие уродливые ядра клеток). Моноклоновая популяция клеток с Ph'-хромосомой заменяется поликлоновой, отличающейся резкой анаплазией клеток (уродливость и увеличение диаметра клеток и др.), они выходят за пределы костного мозга, метастазируют в селезенку, лимфатические узлы, печень, кости, другие органы и ткани. При этом значительно увеличиваются отдельные группы лимфоузлов, меняется гемограмма: она нормализуется или в ней обнаруживают резко анаплазировапные элементы, трудно идентифицируемые морфологически и цитохимически. В пунктатах, отпечатках и биоптатах лимфатических узлов выявляются аналогичные клетки. Подобное течение хронического миелолейкоза рассматривается как эквивалент опухолевой прогрессии.
Диагностика Хронического миелолейкоза:
Стадия течения хронического миелолейкоза устанавливается на основании комплекса клинических данных и изменений со стороны кроветворения с учетом данных гемограммы, миелограммы, гистологического исследования. Иногда недостаточно явная клинико-гематологическая картина на начальном этапе хронической стадии заболевания не позволяет уверенно поставить диагноз хронического миелолейкоза. В этих случаях важное значение для диагностики имеет обнаружение Ph'-хромосомы в гранулоцитах, моноцитах, эритро- и мегакариоцитах костного мозга (следует помнить о вариантах хронического миелолейкоза без Ph'-хромосомы).
Иногда приходится дифференцировать хронический миелолейкоз с идиопатическим миелофиброзом (остеомиелосклерозом), при котором в течение многих лет лейкоцитоз в крови не достигает высоких цифр, обнаруживается увеличение селезенки и печени; в трепанобиоптате костного мозга выявляется значительное разрастание фиброзной ткани. В гемограмме при миелофиброзе может наблюдаться тромбоцитоз, в костном мозге — мегакариоцитоз, гиперплазия эритроцитного ростка, иногда сочетающаяся с увеличением количества эритроцитов в периферической крови. В отличие от хронического миелолейкоза не обнаруживается Ph'-хромосома, отмечается характерная рентгенологическая картина костей скелета; прохождение иглы при пункции грудины и трепанобиопсии подвздошной кости затруднено.
Лечение Хронического миелолейкоза:
Лечение хронического миелолейкоза определяется стадией заболевания. В случаях слабо выраженных клинико-гематологических проявлений хронической стадии рекомендуют общеукрепляющую терапию, полноценное питание, богатое витаминами, регулярное диспансерное наблюдение. Имеются сведения о благоприятном влиянии на течение заболевания а-интерферона.
При лейкоцитозе 30-50*109/л назначают миелосан по 2-4 мг/сут, при лейкоцитозе до 60- 150*109/л и доза его повышается до 6 мг/сут, при более высоком лейкоцитозе суточная доза препарата может быть увеличена до 8 мг. Цитопенический эффект начинает проявляться не ранее чем на 10-й день после начала приема миелосана. Нормализация гемограммы и уменьшение размеров селезенки обычно наступают на 3-6-й неделе лечения при общей дозе препарата 250-300 мг. В дальнейшем назначается поддерживающая терапия в виде приема 2-4 мг миелосана 1 раз в неделю или периодически проводят курсы миелосанотерапии при появлении первых признаков обострения процесса (повышение количества лейкоцитов до 20-25*109/л, увеличение размеров селезенки) число тромбоцитов уменьшается до 100*109/л, прием миелосана временно прекращают.
Лучевая терапия может быть назначена в качестве первичного лечения главным образом в тех случаях, когда основным клиническим симптомом является спленомегалия. При этом уровень лейкоцитов должен быть не ниже 100* 109/л. Лучевую терапию прекращают при снижении количества лейкоцитов до 7-20*109/л. Дальнейшее поддерживающее лечение миелосаном назначают не ранее чем через 1 мес. после отмены лучевой терапии.
В прогрессирующей стадии хронического миелолейкоза применяют моно- и полихимиотерапию.
Миелобромол назначают при значительном лейкоцитозе, в случаях недостаточной эффективности миелосана по 125-250 мг в день под строгим контролем показателей периферической крови. Нормализация гемограммы обычно наступает через 2-3 нед от начала лечения. Для поддерживающей терапии применяют миелобромол в дозах 125-250 мг 1 раз в 5-7-10 дней.
Допан используют при значительной спленомегалии, когда другие противолейкозные средства малоэффективны, его назначают по 6- 10 мг/сут однократно, 1 раз в 4-6-10 и более дней. Интервалы между отдельными приемами зависят от скорости и степени уменьшения числа лейкоцитов и размеров селезенки. Лечение допаном прекращают при снижении количества лейкоцитов до 5-7*109/л. Поскольку возможно появление диспепсических явлений, препарат назначают после ужина
с последующим приемом снотворного средства. Допан может быть рекомендован и для поддерживающего лечения по 6- 10 мг 1 раз в 2-4 нед под контролем данных гемограммы.
Гексафосфамид показан в основном в случаях развившейся резистентности к миелосану, допану, миелобромолу и лучевой терапии. При числе лейкоцитов в крови более 100*109/л его назначают по 20 мг в день, а при 40-60*109/л - по 10-20 мг 2 раза в неделю. Дозу уменьшают в зависимости от темпа снижения количества лейкоцитов. При их снижении до 10-15*109/л препарат отменяют. Курсовая доза составляет в среднем 140-600 мг, курс лечения 10-30 дней. Положительная динамика в ответ на лечение гексафосфамидом появляется, как правило, через 1-2 нед. Поддерживающую терапию гексафосфамидом проводят в дозах 10 и 20 мг 1 раз в 5, 7, 10 или 15 дней.
При лечении прогрессирующей стадии хронического миелолейкоза используют программы АВАМП или ЦВАМП. АВАМП назначают в виде 1% 2- или 10-дневных курсов с интервалом 10 дней. Она включает цитозар (30 мг/м внутримышечно в 1-й и 8-й день), метотрексат (12 мг/м внутримышечно на 2-й, 5-й и 9-й день), винкристин (1,5 мг/м2 внутривенно на 3-й и 10-й день), 6-меркаптопурин (60 мг/м2 ежедневно), преднизолон (50-60 мг/сут при тромбоцитопении менее 100*109/л). При сохранном тромбоцитопоэзе, гипертромбоцитозе и количестве лейкоцитов, превышающем 40*109/л, преднизолон назначать не следует. Программа ЦВАМП аналогична предыдущей, но вместо цитозара на 1, 3, 5, 7, 9-й день внутримышечно вводится циклофосфан в дозе 200-400 мг. Курсы полихимиотерапии проводят 3-4 раза в год. В перерывах между ними назначают миелосан по общепринятой методике и 6-меркаптопурин (100 мг ежедневно каждые 10 дней с 10-дневными перерывами).
Средством выбора при хроническим миелолейкозе, включая бластные кризы, является гидроксикарбамид. Противопоказания к применению его: лейкопения (ниже 3*109/л) и тромбоцитопения (ниже 100*109/л). Начальная доза препарата 1600 мг/м ежедневно внутрь. При числе лейкоцитов меньше 20* 10 /л доза гидроксикарбамида снижается до 600 мг/м2, при их количестве 5*109/л и менее лечение прекращают.
При развитии резистентности к цитостатической терапии в стадии прогрессирования процесса может быть использован лейкоцитаферез в сочетании с одной из схем полихимиотерапии. Срочными показаниями к лейкоцитаферезу являются клинические признаки стаза в сосудах головного мозга (головные боли, чувство «тяжести» в голове, снижение слуха, ощущение «приливов»), обусловленные гиперлейкоцитозом и гипертромбоцитозом.
При бластном кризе применяют программы химиотерапии, используемые при острых лейкозах. Развитие анемии, тромбоцитопенических геморрагии и инфекционных осложнений служит показанием к трансфузиям эритроцитной массы, тромбоконцентрата и антибактериальной терапии.
При наличии экстрамедуллярных опухолевых образований, угрожающих жизни больного (миндалины, закрывающие просвет гортани и др.), используют лучевую терапию.
Трансплантация костного мозга может быть применена у больных хроническим миелолейкозом в хронической фазе заболевания. Она обеспечивает развитие клинико-гематологической ремиссии у 70% больных.
Срочным показанием к спленэктомии при хроническим миелолейкозе является разрыв и угрожающий разрыв селезенки. К относительным показаниям относятся тяжелый абдоминальный дискомфорт, связанный с большими размерами органа, повторные перисплениты с резко выраженным болевым синдромом, «блуждающая» селезенка с опасностью перекрута ножки, глубокая тромбоцитопения, обусловленная явлениями гиперсплёнизма (встречается редко), выраженные гемолитические кризы.
К каким докторам следует обращаться если у Вас Хронический миелолейкоз:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Хронического миелолейкоза, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору – клиника Eurolab всегда к Вашим услугам! Лучшие врачи осмотрят Вас, изучат внешние признаки и помогут определить болезнь по симптомам, проконсультируют Вас и окажут необходимую помощь и поставят диагноз. Вы также можете вызвать врача на дом. Клиника Eurolab открыта для Вас круглосуточно.
Как обратиться в клинику:
Телефон нашей клиники в Киеве: (+38 044) 206-20-00 (многоканальный). Секретарь клиники подберет Вам удобный день и час визита к врачу. Наши координаты и схема проезда указаны здесь. Посмотрите детальнее о всех услугах клиники на ее персональной странице.
Если Вами ранее были выполнены какие-либо исследования, обязательно возьмите их результаты на консультацию к врачу. Если исследования выполнены не были, мы сделаем все необходимое в нашей клинике или у наших коллег в других клиниках.
У Вас ? Необходимо очень тщательно подходить к состоянию Вашего здоровья в целом. Люди уделяют недостаточно внимания симптомам заболеваний и не осознают, что эти болезни могут быть жизненно опасными. Есть много болезней, которые по началу никак не проявляют себя в нашем организме, но в итоге оказывается, что, к сожалению, их уже лечить слишком поздно. Каждое заболевание имеет свои определенные признаки, характерные внешние проявления – так называемые симптомы болезни. Определение симптомов – первый шаг в диагностике заболеваний в целом. Для этого просто необходимо по несколько раз в год проходить обследование у врача, чтобы не только предотвратить страшную болезнь, но и поддерживать здоровый дух в теле и организме в целом.
Если Вы хотите задать вопрос врачу – воспользуйтесь разделом онлайн консультации, возможно Вы найдете там ответы на свои вопросы и прочитаете советы по уходу за собой. Если Вас интересуют отзывы о клиниках и врачах – попробуйте найти нужную Вам информацию в разделе Вся медицина. Также зарегистрируйтесь на медицинском портале Eurolab, чтобы быть постоянно в курсе последних новостей и обновлений информации на сайте, которые будут автоматически высылаться Вам на почту.
Другие заболевания из группы Болезни крови, кроветворных органов и отдельные нарушения, вовлекающие иммунный механизм:
| B12-дефицитная анемия |
| Анемии, обусловленные нарушением синтеза утилизацией порфиринов |
| Анемии, обусловленные нарушением структуры цепей глобина |
| Анемии, характеризующиеся носительством патологически нестабильных гемоглобинов |
| Анемия Фанкони |
| Анемия, связанная со свинцовым отравлением |
| Апластическая анемия |
| Аутоиммунная гемолитическая анемия |
| Аутоиммунная гемолитическая анемия |
| Аутоиммунная гемолитическая анемия с неполными тепловыми агглютининами |
| Аутоиммунная гемолитическая анемия с полными Холодовыми агглютининами |
| Аутоиммунная гемолитическая анемия с тепловыми гемолизинами |
| Болезни тяжелых цепей |
| болезнь Верльгофа |
| Болезнь Виллебранда |
| болезнь Ди Гулъелъмо |
| болезнь Кристмаса |
| Болезнь Маркиафавы-Микели |
| Болезнь Рандю - Ослера |
| Болезнь тяжелых альфа-цепей |
| Болезнь тяжелых гамма-цепей |
| Болезнь Шенлейн - Геноха |
| Внекостномозговые поражения |
| Волосатоклеточный лейкоз |
| Гемобластозы |
| Гемолитико-уремический синдром |
| Гемолитико-уремический синдром |
| Гемолитическая анемия, связанная с дефицитом витамина Е |
| Гемолитическая анемия, связанная с дефицитом глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ) |
| Гемолитическая болезнь плода и новорожденного |
| Гемолитические анемии, связанные с механическим повреждением эритроцитов |
| Геморрагическая болезнь новорожденных |
| Гистиоцитоз злокачественный |
| Гистологическая классификация лимфогранулематоза |
| ДВС-синдром |
| Дефицит К-витаминзависимых факторов |
| Дефицит фактора I |
| Дефицит фактора II |
| Дефицит фактора V |
| Дефицит фактора VII |
| Дефицит фактора XI |
| Дефицит фактора XII |
| Дефицит фактора XIII |
| Железодефицитная анемия |
| Закономерности опухолевой прогрессии |
| Иммунные гемолитические анемии |
| Клоповое происхождение гемобластозов |
| Лейкопении и агранулоцитозы |
| Лимфосаркомы |
| Лимфоцитома кожи (болезнь Цезари) |
| Лимфоцитома лимфатического узла |
| Лимфоцитома селезенки |
| Лучевая болезнь |
| Маршевая гемоглобинурия |
| Мастоцитоз (тучноклеточный лейкоз) |
| Мегакариобластный лейкоз |
| Механизм угнетения нормального кроветворения при гемобластозах |
| Механическая желтуха |
| Миелоидная саркома (хлорома, гранулоцитарная саркома) |
| Миеломная болезнь |
| Миелофиброз |
| Нарушения коагуляционного гемостаза |
| Наследственная a-fi-липопротеинемия |
| Наследственная копропорфирия |
| Наследственная мегалобластная анемия при синдроме Леш - Найана |
| Наследственные гемолитические анемии, обусловленные нарушением активности ферментов эритроцитов |
| Наследственный дефицит активности лецитин-холестерин-ацилтрансферазы |
| Наследственный дефицит фактора X |
| Наследственный микросфероцитоз |
| Наследственный пиропойкилоцитоз |
| Наследственный стоматоцитоз |
| Наследственный сфероцитоз (болезнь Минковского-Шоффара) |
| Наследственный эллиптоцитоз |
| Наследственный эллиптоцитоз |
| Острая перемежающаяся порфирия |
| Острая постгеморрагическая анемия |
| Острые лимфобластные лейкозы |
| Острый лимфобластный лейкоз |
| Острый лимфобластный лейкоз |
| Острый малопроцентный лейкоз |
| Острый мегакариобластный лейкоз |
| Острый миелоидный лейкоз (острый нелимфобластный лейкоз, острый миелогенный лейкоз) |
| Острый монобластный лейкоз |
| Острый промиелоцитарный лейкоз |
| Острый промиелоцитарный лейкоз |
| Острый эритромиелоз (эритролейкоз, болезнь Ди Гульельмо) |
| Отдельные формы лейкозов |
| Пароксизмалъная холодовая гемоглобинурия |
| Пароксизмальная ночная гемоглобинурия (болезнь Маркьяфавы-Микели) |
| Парциальная красноклеточная аплазия |
| Патологическая анатомия поражения оболочек |
| Плазмоклеточный острый лейкоз |
| Полиорганная недостаточность |
| Поражение нервной системы |
| Порфирии |
| Принципы разделения злокачественных и доброкачественных опухолей системы крови |
| Приобретенные геморрагические коагулопатии |
| Причины гемобластозов |
| Пролимфоцитарный лейкоз |
| Ретикулез (ретикулогистиоцитоз, нелипидный ретикулоэндотелиоз, болезнь Абта-Леттерера-Сиве) |
| Серповидно-клеточная анемия |
| Серповидно-клеточная анемия |
| Синдром Дайемонда - Блекфана |
| Сублейкемический миелоз |
| Т-клеточный лейкоз-лимфома взрослых |
| Талассемия |
| Талассемия |
| Тромбофилий, связанные с дефицитом антитромбина III |
| Тромбоцитопатии |
| Тромбоцитопении |
| Фолиеводефицитная анемия |
| Хроническая лучевая болезнь |
| Хронический лимфолейкоз |
| Хронический лимфолейкоз (хронический лимфоидный лейкоз) |
| Хронический лимфоцитарный лейкоз |
| Хронический мегакариоцитарный лейкоз |
| Хронический миелоидный лейкоз |
| Хронический моноцитарный лейкоз |
| Хронический моноцитарный лейкоз |
| Хронический эритромиелоз |
| Цитостатическая болезнь |
| Энтеропатии и кишечный дисбактериоз |
| Эритремия |
| Эритремия (истинная полицитемия, эритроцитоз, болезнь Вакеза) |
| Эритропоэтическая копропорфирия |
| Эритропоэтическая протопорфирия |
| Эритропоэтические уропорфирии |
| Ювенильный миеломоноцитарный лейкоз |
что это такое, прогноз жизни, можно ли вылечиться
Онкологические заболевания способны поражать любые части организма, приводя к тяжелым и необратимым последствиям. Кровеносная система тому не исключение. В ней нередко развивается белокровие. Так называют развитие миелолейкоза. Что это такое и как с ним бороться?
Понятие и причины
Миелоидный лейкоз, стоящий под кодом № С92 в международной классификации болезней МКБ-10, представляет собой заболевание онкологического характера, которое развивается в стволовых клетках костного мозга. В этом органе производятся кровяные клетки: тромбоциты, лейкоциты и эритроциты. Когда возникает онкология, в крови обнаруживаются атипичные структуры, которые быстро размножаются. Их называют бластами.
Подобные клетки полностью прекращают создание и рост здоровых элементов крови. Со временем это влечет за собой полное прекращение работы костного мозга и распространение злокачественных клеток по организму через кровеносную систему.
Этиология возникновения миелолейкоза до сих пор является открытым вопросом, который активно обсуждается и исследуется учеными. На данный момент доктора говорят, что на развитие патологии влияет нездоровый образ жизни человека, влияние внешних факторов среды и некоторые заболевания организма.
Таким образом, выделяют следующие предрасполагающие факторы:
- Воздействие на организм химических и ядовитых веществ.
- Облучение высокими дозами радиации.
- Длительное лечение цитостатическими препаратами.
- Вирусные болезни.
- Вредные привычки.
- Патологические изменения структуры клеток костного мозга.
- Неправильное питание.
- Синдром Дауна.
- Наследственная предрасположенность.
Причины развития белокровия изучаются до сих пор, поэтому возможно данный перечень будет дополнен другими провоцирующими факторами.
Стадии патологии и симптомы
Миелоидный лейкоз бывает хроническим и острым. Первая форма протекает в три стадии, которые отличаются друг от друга особенностями течения и клиническими проявлениями. Существуют следующие степени:
- Хроническая стадия. Продолжается в течение 3-4 лет. На протяжении этого периода времени развивается скрытый миелолейкоз, симптомы которого не беспокоят пациента. Но селезенка больного медленно увеличивается в размере, повышается уровень лейкоцитов и тромбоцитов в крови. В конце стадии человек может ощущать боль в левом подреберье, общую слабость, повышенное потоотделение.
- Стадия акселерации. По признакам миелоидный лейкоз почти не отличается от предыдущей степени. Но при анализе крови доктора выявляют увеличение концентрации базофилов, появление миелоцитов, метамиелоцитов, промиелоцитов и бластов. В некоторых случаях больного беспокоит расстройство стула, кожный зуд, повышение температуры тела. На данной стадии проводят химиотерапию. Если после лечения число базофилов не снижается, прогноз неблагоприятный.
- Терминальная стадия. При этой степени симптомы миелолейкоза проявляются интенсивнее. У больного возникает резкая слабость, болезненность в суставах и костях, повышенная температура тела до критических отметок, похудение. Нередко у пациента развивается осложнение в виде инфаркта селезенки.
Миелоидный лейкоз всегда сопровождается изменениями в крови. Если существенно уменьшается уровень лейкоцитов, иммунитет становится слабее, возникают обострения хронических болезней, развитие инфекционных патологий, воспалительных процессов в лимфатических узлах.
При понижении концентрации тромбоцитов наблюдается ухудшение свертываемости крови, возникновение геморрагического синдрома, увеличение кровоточивости имеющихся ранок на коже, усиление кровотечения при месячных.
Также нередко развивается анемия, которая сопровождается приступами головокружения, слабостью во всем теле, бледностью кожи, обмороками, кислородным голоданием головного мозга.
Миеломонобластный лейкоз в острой форме встречается достаточно редко. При нем признаки патологии развиваются практически сразу. Пациенты жалуются на повышение температуры тела, ухудшение аппетита, снижение массы, одышку, болевой синдром в костях и суставах, кровотечение из носа.
Этот тип патологии протекает в разных формах: промиелоцитарный лейкоз, эозинофильный лейкоз, миеломоноцитарный лейкоз, монобластный лейкоз.
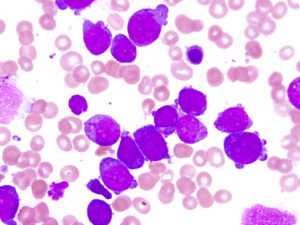 Промиелоцитарный лейкоз проявляется в виде скопления в кровеносной системе большого количества не созревших гранулоцитов. Поражает патология людей разных возрастов. В то время как миелоцитарный лейкоз чаще выявляется у детей. Болезнь, развивающаяся у детей от года до 4 лет, носит название ювенильный миеломоноцитарный лейкоз.
Промиелоцитарный лейкоз проявляется в виде скопления в кровеносной системе большого количества не созревших гранулоцитов. Поражает патология людей разных возрастов. В то время как миелоцитарный лейкоз чаще выявляется у детей. Болезнь, развивающаяся у детей от года до 4 лет, носит название ювенильный миеломоноцитарный лейкоз. Монобластная форма также поражает больше детей, затрагивает костный мозг. Эозинофильный тип лейкоза изменяет структуру эозинофилов крови, приводит к их аномальному увеличению.
Диагностика
Чтобы выявить промиелоцитарный лейкоз или иной вид миелолейкоза, врач назначает ряд исследований. В него входят:
- Лабораторный анализ крови.
- Биопсия и аспирация костного мозга.
- Компьютерная и магнитно-резонансная томография.
- Ультразвуковое исследование.
- Рентгенография.
Последние три дополнительных способа диагностики предназначены для того, что выявить возможное метастазирование во внутренних органах.
Методы лечения
Лечение миелолейкоза проводится разными способами. Одним из них является медикаментозная терапия. Доктора назначают цитостатические препараты, действие которых направлено на подавление роста и размножения атипичных клеток. Такие средства имеют массу серьезных побочных явлений.
Лучшим методом для борьбы с такой патологией как промиелоцитарный лейкоз или иной тип миелолейкоза считают пересадку костного мозга. Она дает высокий шанс на полное выздоровление больного. Для проведения операции требуется наличие донора. Им может выступать близкий родственник или чужой человек, подходящий для пересадки.
К оперативному вмешательству больного обязательно подготавливают. На это уходит примерно 10 дней. Врачи проводят химиотерапию или облучение для уничтожения раковых структур и предупреждения отторжения донорских клеток. После подготовки проводят саму пересадку костного мозга. Пациенту в вену вставляют катетер, через который и поступают клетки донора.
После операции назначают лечение для повышения работы иммунной системы. На приживление клеток уходит 2-4 недели. Через несколько месяцев костный мозг восстанавливается и начинает функционировать полноценно.
Миелоидный лейкоз влечет за собой разрастание селезенки, поэтому возможно проведение операции по ее удалению. Прибегают к ней, если произошел разрыв данного органа или существует угроза этого, а также при сильном дискомфорте из-за увеличения селезенки.
Прогноз при миелобластном лейкозе хронической формы благоприятен на первой стадии. Большинству пациентов удается выздороветь. На остальных стадиях шансы на выздоровление существенно снижаются. При острой форме патологии исход часто летальный.
лечение, показатели анализа крови, симптомы, причины, стадии и продолжительность жизни
Лимфолейкоз – это злокачественная опухоль, поражающая клетки лимфоидной ткани, из которой состоят лимфоузлы и другие внутренние органы. Согласно международной классификации заболеваний присвоен код по МКБ-10 С91.
Находящиеся в крови клетки – лейкоциты призваны для защиты человеческого организма от заболеваний и формируют иммунитет. При лимфолейкозе анализ крови показывает, что лимфоцит мутировал и изменил строение. Постепенно накопленные мутированные клетки начинают вытеснять здоровые и, когда превышают количество, отмечается снижение иммунитета. На последней стадии болезни анализ крови включает 98% нетипичных клеток и 2% здоровых.
Признаки лимфолейкоза
Проявления патологии отмечаются на последней стадии болезни. Но возникают тревожные признаки заболевания, на которые стоит обратить внимание. Симптомы лимфолейкоза:
- воспаление лимфоузлов, которое диагностируется при прощупывании;
- болезненные ощущения в селезенке и печени из-за увеличения размера;
- появление желтушного оттенка кожи;
- признаки анемии: предобморочные состояния, бледная кожа;
- ломота в суставах, слабость;
- частые простудные заболевания.
По статистике, заболеванию подвергаются дети возрастом от 5 лет, а также возможно возникновение у пожилых людей после 70 лет.
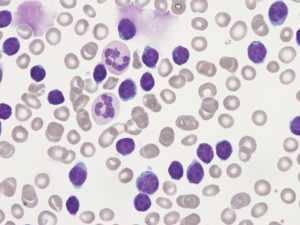
Кровь под микроскопом при лимфолейкозе
Медицина не может сказать, каковы причины возникновения патологии. Одна из главных версий – генетическая предрасположенность. На генетическом уровне в хромосомах лимфоцитов происходит бесконтрольное деление и рост. Предрасположенность, передающаяся по наследству, зафиксирована при хроническом лимфолейкозе. Ученые выяснили, что в семьях со случаями болезни риск заболевания родственников увеличивается в 6 раз.
Выделяют 2 формы лимфоидного лейкоза: острую и хроническую.
Хронический лимфолейкоз
Хронический лимфатический лейкоз – это процесс, при котором нарушается b-клеточный круговорот лимфоцитов. Изменённые лимфоциты воспроизводятся, не погибают и накапливаются в органах. Создаваемые антитела не выполняют защитную функцию.
Распространённость ХЛЛ составляет третью часть заболеваний. В 90% случаев болезнь развивается после 50 лет, при этом мужчины болеют чаще в 2 раза. Причины возникновения заболевания: наследственность, иммунитет, нарушения на генетическом уровне. Для хронического лимфолейкоза характерно развитие иммунодефицита, который повышает чувствительность к вирусам и порождает опухолевые клетки.
Виды и стадии заболевания
Классификация форм хронического типа:
- Доброкачественный лимфолейкоз характеризуется удовлетворительным состоянием пациента. Показатели лейкоцитов в крови растут медленно. Продолжительность жизни с момента констатирования болезни составляет 15-30 лет.
- Прогрессирующий лимфоидный лейкоз начинается так же, как и доброкачественный. Однако повышение лейкоцитов в крови наблюдается из месяца в месяц. Отмечается характерный симптом: увеличение лимфоузлов с мягкой консистенцией.
- Спленомегалическая форма характеризуется увеличением селезёнки и выраженными признаками анемии.
- Опухолевый вид ХХЛ характеризуется такой клинической картиной: лимфоузлы увеличены, с плотной консистенцией. Из-за поражения медиастинальных лимфоузлов происходит сдавливание органов. Показатель лейкоцитов в крови около 100 тыс.
- Т-клеточный лимфолейкоз может характеризоваться увеличением лимфоузлов, поражением кожи в виде бляшек, язв и опухоли.
Обследование лимфатических узлов
Выделяют стадии протекания болезни: начальную, развернутую и терминальную. При начальной стадии жалобы отсутствуют. Но с течением времени человек ощущает постоянную утомляемость, слабость, повышенную потливость. В крови количество лейкоцитов превышают 50 тыс., констатируется наличие клеток Боткина-Гумпрехта. Костный мозг характеризуется большим количеством лимфоцитов. Развёрнутая стадия представляет генерализованное увеличение лимфоузлов, увеличение размеров печени и селезенки. Из характерных признаков: отек лица, анемия, шум в ушных раковинах. При хроническом лимфолейкозе терминальной стадии выражен интоксикационный синдром. Увеличенные лимфоузлы сдавливают ткани, на фоне этого возникает болевой синдром. Развивается бластный криз.
Инфекционные осложнения при ХЛЛ возникают на любой стадии, наиболее часто проявляются в виде лёгочных инфекций.
Помимо доброкачественного течения болезни, хронический лимфоцитарный лейкоз становится причиной развития таких патологий, как волосатоклеточный лейкоз (ВЛЛ) и болезнь Рихтера. ВВЛ – редкая опухоль, поражающая лимфоидные клетки костного мозга, селезенки и крови. Синдром Рихтера – заболевание, при котором происходит развитие крупноклеточного образования – лимфомы.
Лечение
Хронический лимфолейкоз обычно имеет доброкачественный характер. Начальные стадии отличаются отсутствием симптоматики. При большой скорости прогрессирования назначается химиотерапия. Показаниями к терапии являются такие симптомы: увеличение лимфоузлов, провоцирующих сдавливание внутренних органов, потеря веса и анемические признаки. Выбор терапии основан на 3 факторах: характер болезни, возраст и состояние пациента, наличие сопутствующих осложнений. В зависимости от возрастной категории, в развитии патологии выделяют пациентов молодого, преклонного и старческого возраста.
Используется также метод лучевой терапии. Он эффективен при лечении лимфоузлов, находящихся в локальной зоне.
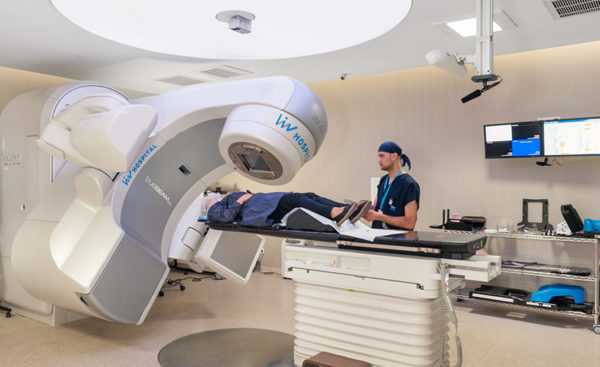
Острый лимфолейкоз
Острый лимфолейкоз – злокачественный вид поражения кровеносной системы, характеризующийся увеличением количества лимфобластов. Для типичного течения болезни характерно наличие анемии, увеличения лимфоузлов, постоянная кровоточивость, расстройство дыхательной системы и поражение центральной нервной системы.
ОЛЛ – онкологическое образование, которое имеет распространение среди детей дошкольного возраста. У детей наблюдается первичное появление болезни, у взрослых выступает в виде осложнения после хронического лимфолейкоза. Прогнозы выздоровления у ребенка являются неоднозначными, так как патология характеризуется рецидивами.
Причины возникновения
Этиология болезни основана на предположениях ученых о возможных факторах риска. Болезнь возникает из-за образования быстроразмножающихся клеток. Генетические нарушения, вызывающие патологические изменения, возникают ещё в утробе матери.
В группу повышенного риска также попадают люди, подвергнутые воздействию радиационных лучей.
Лучевые воздействия от радиотерапии, которыми устранялась опухоль другого вида, или облучение рентгенологическим аппаратом тоже могут способствовать развитию патологии. Риск развития острого лейкоза повышается при контакте беременной женщины с некоторыми группами токсических веществ.
Симптомы
Болезнь характеризуется стремительным развитием и разнообразной симптоматикой. Наиболее часто начало болезни носит симптомы: повышенная и субфебрильная температура, слабость, признаки интоксикации, дискомфорт и ощущение распирания в животе, частые боли. А также кровотечения из носа, отёки ног, появление кожных высыпаний, ноющие суставы.
Группы симптомов формируют синдромы, приводящие к сбою работы внутренних органов:
- анемический синдром – характеризуется субфебрильной температурой, предобморочным состоянием, быстрой утомляемостью;
- гиперпластический – внутренние органы увеличиваются в размере;
- геморрагический – кровоизлияния на кожных участках проявляются в виде мелких точек и крупных бляшек;
- болевой синдром – из-за интоксикации организма ощущается боль и ломота в суставах.
Происходит повреждение костной системы, головного мозга, черепно-мозговых нервов, органов пищеварения, почек. Есть вероятность лейкозной инфильтрация яичников.
Рак может привести также к патологии под названием миелолейкоз, при которой поражаются стволовые клетки костного мозга.
Диагностика
Формулировка диагноза осуществляется с помощью результатов ОАМ и биохимического анализа крови. Обязательный метод исследования – миелограмма. С его помощью берут мазок из костного мозга для дальнейшего исследования. В крови выявляется повышенное СОЭ, анемия и лейкоцитоз. Результат миелограммы говорит о наличии бластных клеток. Чтобы отследить онкологический процесс, назначается спинномозговая пункция. С помощью этого метода отслеживается состояние нервной системы.
На основании результатов исследования пациенту присваивают группу риска и назначают лечение. УЗИ проводят с целью обследовать селезёнку и печень, отследить размеры и степень поражения. Рентген помогает выявить распространение метастазов.
Дополнительная диагностика осуществляется методом иммунофенотипирования. Он дает возможность определить иммунофенотип бластных клеток опухолевого образования костного мозга. Это помогает достоверно диагностировать патологию, разделить пациентов на группы риска и предупредить возможные рецидивы.
Проводится также дифференциальная диагностика, исключающая все возможные варианты болезней и помогающая поставить правильный диагноз.
Лечение
Для лечения ОЛЛ используется химиотерапия. Выделяют регионарную, комбинированную и интратекальную химиотерапии.
Проведение процедуры химиотерапии
При регионарной химиотерапии вещество препарата вводится во внутренние органы. Комбинированная терапия предполагает введение нескольких противораковых препаратов. При интратекальной терапии препараты вводятся прямо в позвоночник, при наличии опухоли в спинном мозге. При этом пациент дополнительно лечится с помощью внутримышечных инъекций.
Химическая терапия имеет 3 этапа:
- Этап индукции характеризуется введением в организм вещества с целью достичь первой ремиссии. На этапе индукции происходит разрушение раковых клеток. Длительность лечения составляет 2 недели.
- На этапе консолидации уничтожается оставшаяся часть клеток. Для этой цели препараты вводятся через вену.
- Этап реиндукции длится несколько лет для поддержки ремиссии и исключения вероятности рецидивов. Во время поддерживающей терапии применяются антибиотики.
Переносимость химиотерапии носит личностный характер. Применение противоопухолевых препаратов имеет достаточно тяжелые последствия для организма. Это связано с активным распадом злокачественных клеток, которые приводят к образованию большого количества продуктов обмена, что вызывает интоксикацию организма. Также из-за низкого содержания лейкоцитов в крови высока вероятность заражения инфекциями. Поэтому важно соблюдать принципы ухода за пациентами в клиниках: полная изоляция, частые влажные уборки в палате, использование стерильной одежды медперсонала.
Если по истечению 33 дней терапии не наступает улучшений либо происходят ранние рецидивы, пациенту назначается пересадка костного мозга.

Внутренняя и внешняя лучевая терапия используются при распространении опухоли в спинном мозге. Применяется в виде излучения радиации в области опухолевого образования или введения специального вещества в ткань опухоли.
Лечить острый лимфолейкоз у детей и взрослых наиболее эффективно в зарубежных странах. В благоприятном исходе лечения способна помочь клиника в Израиле. Медики страны применяют в своей практике высококачественные препараты и современные технологии.
Прогноз жизни
Хронический лимфолейкоз – заболевание, не поддающееся лечению, но имеющее удовлетворительный прогноз. Агрессивное течение болезни с возможным летальным исходом составляет 15%. В других случаях продолжительность жизни составляет 15-20 лет с момента заболевания. Пациент может жить полноценной жизнью, выполняя при этом клинические рекомендации – систематически обследоваться, соблюдать здоровый образ жизни, наладить питание и исключить алкоголь. Обязательным условием является постоянная диета.
Острый лимфолейкоз имеет большую вероятность неблагоприятных прогнозов. По статистике, дети лучше поддаются лечению. У 70% детей после лечения наступает 5-летний период ремиссии. Взрослые поддаются ремиссии в 40-45% случаев. Детям с диагнозом возможно оформить инвалидность и получать денежное пособие.
Если своевременно начать лечить заболевание у детей, есть вероятность полного выздоровления. Для взрослых вероятность подобного исхода достаточно низкая.
симптомы, прогнозы, стадии и диагностика
Хронический лейкоз – это злокачественная опухоль, развивающаяся в кровеносной системе. В её формировании участвуют зрелые и молодые клетки из миелоидного или лимфоидного ряда. Болезнь поражает в основном взрослых людей после 50 лет. Но в последнее время врачи заметили омоложение болезни – все чаще диагностируется патология у детей. Симптомы проявляются в зависимости от вида лейкоза. Для уточнения диагноза требуется расширенное обследование пациента. По результатам анализов принимается решение о терапии.
Кровеносная система способна выполнять специфическую функцию – насыщение тканей с органами кислородом, полезными микроэлементами и витаминами. Обратно выводит продукты жизнедеятельности, углекислый газ и другие вещества. Онкологическое заболевание, поражающее кровь, считается одним из самых опасных.
Характеристика заболевания
Лейкемия развивается в органах кроветворения. Провоцирует болезнь увеличение главных клеток кровоснабжения, сохраняющих способность к дифференциации. Хронический лейкоз представляет собой лимфопролиферативную или миелопролиферативную патологию, характеризующуюся увеличением дифференцированных клеток крови. Отличается от острой формы тем, что в формировании участвует зрелая или созревающая клетка. Острый лейкоз формируется из низкодифференцированных клеток крови.
На первой стадии образуется опухоль доброкачественного типа. Новообразование способно несколько лет присутствовать у человека в организме, не принося дискомфорта и других побочных эффектов. В процессе развития происходит трансформация в злокачественный вид. Развитие протекает медленно.
Диагностируется данный вид лейкемии у взрослых после 40 лет и у пожилых людей. Мужчины больше подвержены заболеванию, чем женщины. Дети также подвержены хроническому лейкозу, но реже – встречается у 2% больных.
Причины развития патологии
Точной причины, вызывающей хроническую лейкемию, врачам не известно. Болезнь изучается, появляются новые теории развития. Учёные выделяют ряд факторов, которые способны спровоцировать развитие опухоли:
- Может развиваться из-за присутствия в организме вируса, влияющего на геном клеток – вирус Эпштейна-Барра, ретровирус, папилломы и другие.
- Наследственная предрасположенность.
- Хронический миелолейкоз провоцирует нарушения в хромосомном ряду (мутация 22 хромосомы и фрагмента длинного плеча).
- Онкологический процесс может спровоцировать воздействие на организм радиоактивного облучения в высокой дозе.
- Взаимодействие с токсичными химическими соединениями и канцерогенными веществами – краски, продукты нефтепереработки, бензол и другие.
- Влияние специфических лекарственных средств – из группы цитостатиков и антибиотиков, соли золота.
- Злоупотребление никотином и спиртными напитками.
Хронический лимфоцитарный лейкоз вызывает взаимодействие с токсичными гербицидными и пестицидными средствами на протяжении длительного времени. Хронический миелоидный лейкоз чаще развивается при влиянии на организм высоких доз радиационного облучения.
Клиника болезни связана с иммунными нарушениями в гематологической структуре – анемия, снижение уровня тромбоцитов, коллагенозом.
В медицинской практике есть примеры, когда установить причину развития опухоли не удалось. Присутствовало нескольких провоцирующих факторов.
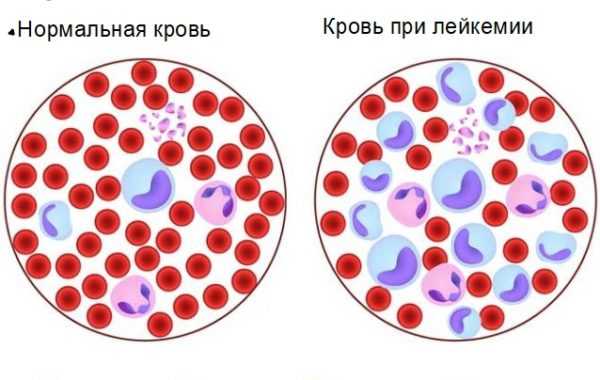
Разновидности хронического лейкоза
Опухолевый процесс, поражающий кроветворение, изучает гематология. Хроническую лейкемию формирует зрелый вид клеток и ряд созревающих элементов. Хронический вид лейкоза подразделяют на две большие группы – хронический лимфоцитарный лейкоз и хронический миелоидный лейкоз.
Форма опухоли зависит от клетки-субстрата, которая сформировала патологию – лимфобластный, миелоидный и моноцитарный вид.
Хронический лимфоцитарный рак включает следующие типы заболеваний:
- Лимфоматоз кожи, или болезнь Сезари;
- Хронический лимфолейкоз;
- Различные виды парапротеинемических гемобластоз – патологии лёгких или тяжёлых цепей с макроглобулинемией Вальденстрема, миеломная болезнь;
- Волосатоклеточный лейкоз.
К миелоидной форме относят хронический миелолейкоз, истинную полицитемию с эритромиелозом и другие.
Моноцитарная группа подразделяется на гистиоцитоз и миеломоноцитарный лейкоз.
Течение патологии проходит две стадии:
- Первая – это доброкачественная форма (моноклоновая).
- Вторая – злокачественная (поликлоновая).
Развитие онкологического процесса условно делят на три стадии:
- На начальной стадии злокачественный процесс протекает в области поражённого участка, не выходя за границы – симптомов болезни нет.
- Развёрнутая стадия может характеризоваться увеличением опухоли в размерах, поражением соседних тканей – появляются первые признаки патологии.
- На терминальной стадии опухолевый процесс распространяется на весь организм, присутствуют метастазы в отдаленных участках – наблюдается клиническая картина онкологии.
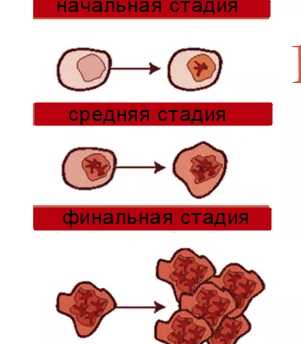
Стадии лейкоза
Симптомы миелоидной формы заболевания
На начальной стадии миелолейкоз протекает бессимптомно. Иногда могут наблюдаться признаки, несвойственные патологии. Присутствуют структурные изменения в крови, но выявить их можно только при проведении анализа. Больные жалуются на мышечную слабость, увеличение потоотделения, температура тела колеблется от 37 до 38 градусов, болевые ощущения в области правого ребра.
Развернутая стадия может отличаться более выраженными признаками:
- Селезёнка с печенью увеличиваются в размерах;
- Пострадавший начинает резко худеть;
- В костных тканях и суставах присутствуют боли;
- На кожных покровах и слизистых присутствуют лейкемические инфильтраты;
- В каловых массах и моче наблюдаются примеси крови;
- У женщин в период менструации отмечается сильная кровопотеря;
- Влагалищные кровотечения, не связанные с менструальным циклом;
- Удаление зуба сопровождается сильным кровотечением.
На последней стадии симптомы приобретают острый характер с признаками интоксикации организма. Симптоматика напоминает острую форму лейкоза – кожные поражения, сильная кровопотеря, инфекционные поражения организма, температура тела повышается до 40 градусов. В тяжёлой форме возможно наступление разрыва селезёнки.
Симптомы лимфоидной формы болезни
Главным признаком болезни этой формы считается увеличение лимфатических узлов. Происходит это в развернутый период протекания болезни. Начальная стадия протекает без выраженных признаков. На второй стадии увеличиваются пораженные лимфоузлы, постепенно распространяется на остальные виды лимфатических узлов. Лейкоцитоз провоцирует увеличение селезёнки с печенью. Лимфоузлы, превышающие нормальные размеры, передавливают желчевыводящие пути и полую вену. Внешне наблюдаются признаки желтухи, отекание мягких тканей лица и шеи с руками. Больной жалуется на болевые ощущения в суставах, зудящий эффект на коже и вторичное инфекционное поражение.
Отёки возле глаз у человека
Интоксикационные симптомы проявляются – мышечной слабостью, повышенным потоотделением, лихорадочным состоянием, отсутствием позывов к мочевыделению, увеличение сердечного ритма сопровождается головокружением и одышкой, могут присутствовать глубокие обмороки.
Терминальная стадия характеризуется геморрагическим и иммунодефицитным синдромами. В верхних слоях дермы и слизистых наблюдаются точечные кровоизлияния, у больного присутствуют носовые кровотечения, кровоточат десны, у женщин продолжительные маточные выделения крови. Иммунная система, пораженная опухолевым процессом, не способна выполнять защиту организма, что проявляется частыми инфекционными осложнениями – бронхит, пневмония, туберкулез, грибок кожи, воспалительные процессы в тканях, болезни почек и герпес.
Внутренние органы претерпевают серьёзные структурные изменения. Организм переносит сильнейшую истощённость. Развивается почечная недостаточность. Продолжительные кровотечения, инфекции и дефицит гемоглобина могут спровоцировать смерть пациента. Хронический лимфолейкоз способен трансформироваться в острый лейкоз с лимфосаркомой.
Диагностика заболевания
Точный диагноз врач сможет поставить после тщательного обследования больного. Диагностика лимфолейкоза включает следующие процедуры:
- Проводится физикальный осмотр пациента и собирается полный словесный анамнез о течении болезни.
- Кровь нужно сдать на общий анализ и онкомаркеры – характеристиками рака считаются анемия, присутствие миелоцитов с гранулоцитами, бластный криз, лейкоцитоз с лимфоцитозом, выявляются лимфобласты и клетки Боткина-Гумпрехта.
- Проводится процедура стернальной пункции костного мозга, которая покажет состояние клеточного ряда крови и жировой ткани.
- Трепанобиопсия с биопсией лимфатических узлов покажет степень злокачественности новообразования и стадию болезни.
- Ультразвуковое исследование покажет степень поражения лимфатических узлов с печенью, почками и селезёнкой.
- Органы грудной клетки изучаются при помощи рентгенографии.
- Дополнительно для уточнения состояния пациента назначается лимфосцинтиграфия и МСКТ органов брюшной полости.
При получении всех результатов анализов врач сможет установить вид опухоли, степень поражения органов. На основании этого будет принято решение о курсе терапии и сроке проводимых мероприятий.
Лечение и прогноз выживаемости больных
На начальной стадии обычно консервативное лечение не применяется. Пациент находится под наблюдением врача. На данном этапе больному рекомендуется исключить физические нагрузки, стрессовые ситуации, воздействие прямых солнечных лучей, лечебные процедуры, связанные с электропрогреванием и теплолечением. Назначается сбалансирование питание, насыщенное витаминами и микроэлементами, ежедневные прогулки на свежем воздухе в течение продолжительного времени.

На второй (развёрнутой) стадии заболевания применяется химиотерапия и лучевое облучение. Для химиотерапии используются лекарственные препараты из группы цитостатиков – Бусульфан, Митобронитол, Гидроксимочевина и другие. Облучение гамма-лучами применяется для блокирования увеличения селезёнки. Иногда врачи применяют лейкаферез. Дозировка и сроки подбираются индивидуально для каждого больного. Данные процедуры позволяют остановить развитие опухоли и предотвратить бластный криз. Эффективным методом в борьбе с раком крови служит трансплантация костного мозга. Для проведения операции используются собственные стволовые клетки или донорские. Зависит от состояния пациента.
На терминальном этапе болезни применяется полихимиотерапия с использованием высоких доз лекарственных препаратов. Также используется симптоматическое лечение и методы паллиативной медицины для купирования болевых синдромов.
Точно сказать прогноз лечения врач не сможет – зависит от формы рака, физического состояния пациента и степени поражения организма. В среднем продолжительность жизни больных с таким диагнозом составляет от 3 до 5 лет. Есть примеры в медицинской практике жизни более 15 лет. Рекомендуется выполнять клинические рекомендации лечащего врача, соблюдать режим питания и прогулок на свежем воздухе. Это позволит увеличить шанс прожить дольше с минимальными осложнениями.
Острый промиелоцитарный лейкоз — Википедия
Острый промиелоцитарный лейкоз (ОПМЛ, ОПЛ) — это особый подвид острого миелоидного лейкоза (ОМЛ), злокачественного опухолевого заболевания белых кровяных клеток, по Франко-Американо-Британской классификации (ФАБ) относящийся к подтипу М3.[1] При ОПЛ наблюдается аномальное накопление в костном мозгу и в крови незрелых гранулоцитов, так называемых промиелоцитов. Эта форма ОМЛ характеризуется типичной хромосомной транслокацией, вовлекающей ген рецептора ретиноевой кислоты типа альфа (RARα или RARA) и ген белка острого промиелоцитарного лейкоза (PML), что приводит к образованию аномального фузионного онкопротеина PML-RARalpha и к неконтролируемому размножению мутантных промиелоцитов. Эта форма ОМЛ также отличается уникальным ответом на лечение полностью транс-ретиноевой кислотой и триоксидом мышьяка. Острый промиелоцитарный лейкоз был впервые описан и охарактеризован в 1957 году[2][3]французскими и норвежскими врачами-онкогематологами. В то время ОПЛ считался сверхострым и фатальным заболеванием, одной из самых неблагоприятных форм ОМЛ.[1] В настоящее время ОПЛ с классической транслокацией, напротив, считается одной из самых благоприятных и хорошо излечимых форм острого миелоидного лейкоза, с 12-летней выживаемостью без прогрессирования приблизительно 70 %.[1][4]
Симптомы ОПЛ в целом сходны с симптомами других форм ОМЛ. В частности, возможны следующие симптомы:[5]
Кровоточивость и кровотечения вследствие тромбоцитопении (пониженного содержания тромбоцитов в крови) может наблюдаться в следующих формах:
Острый промиелоцитарный лейкоз обычно характеризуется наличием реципрокной хромосомной транслокации между участком хромосомы 17, содержащим ген рецептора ретиноевой кислоты типа альфа, и участком хромосомы 15, содержащим ген так называемого белка острого промиелоцитарного лейкоза (PML). Эта транслокация приводит к образованию аномального онкогенного фузионного протеина PML-RARalpha. Эта транслокация обозначается как t(15;17)(q22;q21) и встречается в 95 % случаев ОПЛ. А ген рецептора RAR зависит от ретиноевой кислоты для регуляции транскрипции.[1]
Описаны при ПМЛ также 8 типов других редких хромосомных транслокаций, приводящих к формированию других аномальных фузионных онкопротеинов гена RARalpha с другими генами, в частности транслокация t(11;17), приводящая к слиянию гена RARalpha с геном так называемого «цинкового пальцеобразного белка промиелоцитарного лейкоза» (c геном PLZF, известным также как ген ZBTB16)[6], с геном нуклеофосмина (NPM1), с геном, ассоциированным с ядерным матриксом (NUMA1), с геном фактора 5b сигнальной трансдукции и активации транскрипции (STAT5B), с геном регуляторной субъединицы 1α протеинкиназы А (PRKAR1A), с геном фактора, взаимодействующего с белками PAPOLA и CPSF1 (FIP1L1), с геном корепрессора BCL-6 или с геном олигонуклетид/олигосахарид-связывающей последовательности 2A (OBFC2A, также известный как NABP1). Некоторые из этих хромосомных аномалий также являются чувствительными к лечению полностью транс-ретиноевой кислотой, либо их чувствительность к лечению полностью транс-ретиноевой кислотой неизвестна вследствие большой редкости этих хромосомных перестроек. Известно, что формы ОПЛ с хромосомными перестройками, приводящими к образованию аномальных фузионных онкопротеинов STAT5B/RARA и PLZF/RARA, резистентен к лечению полностью транс-ретиноевой кислотой и поэтому имеют худший прогноз.[1]
Слияние генов белков PML и RARA в результате транслокации t(15;17)(q22;q21) приводит к образованию аномального гибридного фузионного онкопротеина с изменёнными (необычными) внутриклеточными функциями. Этот аномальный онкопротеин с повышенным аффинитетом связывается с регуляторными участками внутриклеточной ДНК, блокируя транскрипцию важных генов, необходимых для процесса созревания и дифференцировки гранулоцитов. Он делает это при помощи усиленного взаимодействия молекул белка ядерного корепрессора (NCOR) и молекул гистон-деацетилазы (HDAC). Хотя хромосомная транслокация, включающая ген RARalpha, считается необходимой для инициации (начала) процесса лейкозогенеза, она сама по себе не достаточна для возникновения ПМЛ — требуется также приобретение этими клетками дополнительных мутаций.[1]
Мутация t(11;17), приводящая к образованию аномального фузионного онкопротеина RAR-α/PLZF приводит к развитию такого подтипа ОПЛ, который не чувствителен к стандартной терапии полностью транс-ретиноевой кислотой и/или триоксидом мышьяка и менее чувствителен, по сравнению с более частым вариантом RAR-α/PML, к стандартной химиотерапии ОМЛ, в частности к цитарабину и антрациклинам, таким, как даунорубицин, идарубицин, митоксантрон. Это приводит к худшему прогнозу в этой подгруппе пациентов.[1]
Острый промиелоцитарный лейкоз может быть отдифференцирован от других форм ОМЛ на основании патоморфологического исследования трепанобиоптата и аспирата костного мозга, а также крови, при котором может быть установлено, что бластные клетки по своему строению являются промиелоцитами. Дальнейшая диагностика требует цитогенетического исследования на характерные транслокации длинных плеч хромосом 17 и 15 или 17 и 11 — t(15,17) или t(11,17) и тестирования на наличие фузионных генов PML/RARA или PLZF/RARA, что может быть сделано при помощи полимеразной цепной реакции или флуоресцентной in situ гибридизации. Иногда могут встречаться скрытые транслокации, не обнаруживаемые при стандартном цитогенетическом исследовании. В подобных случаях полимеразная цепная реакция (ПЦР) критически необходима для подтверждения (верификации) диагноза.[1] Наличие в бластных клетках периферической крови большого количества телец Ауэра делает диагноз острого промиелоцитарного лейкоза очень вероятным, так как для бластных промиелоцитов очень характерно обилие телец Ауэра (по сравнению с более ранними бластными клетками типов M0, M1 и M2).
Индукционное лечение[править | править код]
Полностью транс-ретиноевая кислотаОПЛ является уникальным среди острых миелоидных лейкозов по своей чувствительности к полностью транс-ретиноевой кислоте, кислой форме витамина А и к триоксиду мышьяка.[1] Лечение полностью транс-ретиноевой кислотой вызывает диссоциацию белкового комплекса RAR с белками NCOR (ядерным корепрессором) и HDACL (лиганд гистон-деацетилазы) и позволяет, напротив, связываться с рецептором RAR активаторам транскрипции и гистон-ацетилтрансферазам. Это, в свою очередь, позволяет запуститься процессу транскрипции нужных генов и процессу дифференцировки незрелых лейкозных промиелоцитов в зрелые гранулоциты. Таким образом, благодаря влиянию полностью транс-ретиноевой кислоты, «исправляется» аберрантная работа онкогенного транскрипционного фактора PML/RARalpha. При этом, в отличие от традиционной химиотерапии, полностью транс-ретиноевая кислота непосредственно не убивает злокачественные клетки. Вместо этого полностью транс-ретиноевая кислота вызывает их терминальную дифференцировку, после которой они подвергаются спонтанному апоптозу подобно здоровым гранулоцитам, у которых истёк отведённый им срок жизни (причём «в норме», до приобретения злокачественным клоном анти-апоптотических мутаций, апоптоз этих дифференцировавшихся под влиянием ATRA злокачественных клеток происходит гораздо быстрее, чем апоптоз здоровых гранулоцитов).[1] Полностью транс-ретиноевая кислота одна (в монотерапии) способна вызвать ремиссию при ОПЛ. Однако ремиссия, вызванная применением одной лишь ATRA, при ОПЛ, как правило, кратковременна в отсутствие одновременно проводимой «традиционной» химиотерапии и/или лечения триоксидом мышьяка, так как лейкозные клетки довольно быстро приобретают устойчивость к ATRA.[1] Начиная с 2013 года стандартом лечения ОПЛ является одновременное применение ATRA и триоксида мышьяка (плюс-минус традиционная химиотерапия).[7] До 2013 года стандартом лечения ОПЛ было одновременное применение ATRA и традиционной химиотерапии, основанной на применении антрациклинов (даунорубицин, доксорубицин, идарубицин или митоксантрон).
Ранее, до выявления того факта, что ОПЛ менее других разновидностей ОМЛ нуждается в традиционной химиотерапии и менее других разновидностей ОМЛ чувствителен к цитарабину, зато более других разновидностей чувствителен к антрациклинам, и что добавление цитарабина или других агентов не увеличивает процент полных ремиссий и общую выживаемость по сравнению с сочетанием «ATRA + антрациклин», зато более токсично, вместо схемы «ATRA + монотерапия антрациклином» часто применяли лечение «ATRA + та или иная схема традиционной противолейкозной химиотерапии» (например, ATRA + «7+3» или ATRA + ADE). Обе разновидности лечения (ATRA плюс триоксид мышьяка и ATRA плюс традиционная химиотерапия) приводят к примерно одинаковым результатам — около 90—95 % полных клинических и гематологических ремиссий. Но поскольку триоксид мышьяка менее токсичен и даёт меньше побочных эффектов, чем традиционная химиотерапия, и более специфичен в отношении клеток ОПЛ, то именно сочетание ATRA и триоксида мышьяка стало новым стандартом лечения ОПЛ.[4]
Лечение полностью транс-ретиноевой кислотой ассоциируется с уникальным побочным эффектом, ранее называвшимся «синдром ретиноевой кислоты» (более современное и корректное название «дифференциационный синдром» или «синдром дифференциации»)].[8] Дифференциационный синдром проявляется затруднением лёгочного дыхания (диспноэ), головной болью, лихорадкой (гипертермией), прибавкой массы тела, периферическими отеками, коагулопатией (кровоточивостью или тромбозами, ДВС-синдромом). Лечится дифференциационный синдром немедленным назначением глюкокортикоидов, например, преднизолона или дексаметазона, назначением гепарина для профилактики ДВС-синдрома и немедленным присоединением (или увеличением дозы) химиотерапии к уже проводящемуся лечению ATRA. При резко выраженном дифференциационном синдроме может потребоваться временная отмена или временное снижение дозы ATRA.[9] Этиологию дифференциационного синдрома связывают с массивным высвобождением цитокинов из массово дифференцирующихся и затем погибающих лейкозных промиелоцитов, что приводит к резкому повышению проницаемости капилляров (отеки, диспноэ и др.) и нарушениям в свертывающей системе крови.[9]
Моноклональное антитело гемтузумаб озогамицин (Милотарг) в комбинации с ATRA также было успешно использовано в лечении ОПЛ.[10] Однако оно было изъято с рынка США из-за подозрений в чрезмерной токсичности этого лекарства и отсутствии у него положительного влияния на общую и безрецидивную выживаемость больных с ОМЛ, отсутствии преимуществ перед традиционной химиотерапией. В Австралии, Канаде или Великобритании это лекарство никогда не продавалось.[10][11] Гемтузумаб озогамицин в комбинации с ATRA вызывал положительный ответ у приблизительно 84 % пациентов с ОПЛ, что сравнимо с цифрами, наблюдавшимися у пациентов, лечившихся традиционной комбинацией «ATRA плюс антрациклин».[10] Поскольку гемтузумаб озогамицин обладает меньшей кардиотоксичностью, чем антрациклины, такой вариант лечения мог бы быть более предпочтительным для пожилых больных с ОПЛ и больных с сопутствующими сердечно-сосудистыми заболеваниями.[10]
Консолидационное лечение[править | править код]
После достижения стойкой ремиссии стандартно рекомендуется 2 года поддерживающей терапии ATRA в сочетании с меркаптопурином и метотрексатом.[12] Значительный процент больных с ОПЛ рецидивирует без проведения поддерживающей терапии.[9] В европейском исследовании по ОПЛ, частота рецидивов в течение 2 лет среди тех, кто не получал поддерживающей химиотерапии, составляла 27 %, по сравнению с 11 % рецидивов у тех, которые поддерживающую химиотерапию получали.[13] Аналогично, в исследовании по ОПЛ, проведённом в США в 2000 году, общая 5-летняя выживаемость среди больных с ОПЛ, получавших поддерживающую терапию ATRA, составляла 61 %, по сравнению с 31 % среди тех, кто поддерживающую терапию ATRA не получал.[14]
Рецидив или рефрактерное заболевание[править | править код]
При рецидивах и рефрактерности ОПЛ в настоящее время изучается применение триоксида мышьяка. Были сообщения о достижении ремиссии при помощи монотерапии триоксидом мышьяка.[15] Исследования показали, что триоксид мышьяка вызывает реорганизацию ядерных телец и способствует деактивации и деградации мутантного PML-RAR онкопротеина.[16] Триоксид мышьяка также повышает активность каспазы, что вызывает апоптоз клеток.[17] Подобно ATRA, профилактическое применение триоксида мышьяка в поддерживающей терапии способно снизить риск рецидивов при ОПЛ, особенно у пациентов из группы высокого риска.[18] В Японии синтетический ретиноид, тамибаротен, лицензирован для применения при резистентном к ATRA ОПЛ.[19]
Помимо этого, при рецидивах и рефрактерности ОПЛ сохраняет своё значение и традиционная противолейкозная химиотерапия, в частности схемы «7+3», ADE, FLAG-подобные режимы и другие, а также высокодозная химиотерапия и аллогенная трансплантация гемопоэтических стволовых клеток.
Исследовательские агенты[править | править код]
Некоторые исследования показывают возможную потенциальную эффективность ингибиторов гистон-деацетилазы, таких, как вориностат или вальпроевая кислота, в лечении ОПЛ.[20][21][22]
Острый промиелоцитарный лейкоз представляет сравнительно редкую форму ОМЛ, всего около 10 — 12 % от всех случаев ОМЛ.[10] Средний возраст больных ОПЛ — приблизительно 30 — 40 лет,[23] что гораздо моложе, чем средний возраст больных с другими подтипами ОМЛ (70 лет). Частота ОПЛ выше среди пациентов латиноамериканского или южноевропейского происхождения.[24] ОПЛ может также возникнуть как вторичный лейкоз у больных, получавших лечение антрациклинами (например, доксорубицином, идарубицином, митоксантроном), алкилирующими агентами (например, циклофосфамидом) или ингибиторами топоизомеразы II (например, этопозидом), вследствие канцерогенности этих агентов. Большинство пациентов, получавших лечение этими агентами, у которых впоследствии развился ОПЛ, составляют больные с раком молочной железы в анамнезе.[25][26][27] У приблизительно 40 % пациентов с ОПЛ обнаруживаются, помимо t(15;17)(q22;q21), приводящей к появлению PML/RARalpha, дополнительные хромосомные аномалии в лейкозных клетках, такие, как трисомия 8-й хромосомы или изохромосома 17, но они, по-видимому, не оказывают существенного влияния на долгосрочный прогноз.[1]
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 Kotiah, SD; Besa, EC. Sarkodee-Adoo, C; Talavera, F; Sacher, RA; McKenna, R; Besa, EC: Acute Promyelocytic Leukemia (неопр.). Medscape Reference. WebMD (3 июня 2013). Дата обращения 14 января 2014.
- ↑ Tallman M.S., Altman J.K. Curative strategies in acute promyelocytic leukemia (неопр.) // Hematology Am Soc Hematol Educ Program. — 2008. — Т. 2008. — С. 391—399. — doi:10.1182/asheducation-2008.1.391. — PMID 19074116.
- ↑ Hillestad, L.K. Acute promyelocytic leukemia (неопр.) // Acta Med Scand.. — 1957. — November (т. 159, № 3). — С. 189—194. — doi:10.1111/j.0954-6820.1957.tb00124.x. — PMID 13508085.
- ↑ 1 2 Adès, L; Guerci, A; Raffoux, E; Sanz, M; Chevallier, P; Lapusan, S; Recher, C; Thomas, X; Rayon, C; Castaigne, S; Tournilhac, O; de Botton, S; Ifrah, N; Cahn JY; Solary E; Gardin, C; Fegeux, N; Bordessoule, D; Ferrant, A; Meyer-Monard, S; Vey, N; Dombret, H; Degos, L; Chevret, S; Fenaux, P; European APL Group. Very long-term outcome of acute promyelocytic leukemia after treatment with all-trans retinoic acid and chemotherapy: the European APL Group experience (англ.) // Blood (англ.)русск. : journal. — American Society of Hematology (англ.)русск., 2010. — March (vol. 115, no. 9). — P. 1690—1696. — doi:10.1182/blood-2009-07-233387. — PMID 20018913. (недоступная ссылка)
- ↑ Kotiah, SD; Besa, EC. Sarkodee-Adoo, C; Talavera, F; Sacher, RA; McKenna, R; Besa, EC: Acute Promyelocytic Leukemia Clinical Presentation (неопр.). Medscape Reference. WebMD (3 июня 2013). Дата обращения 14 января 2014.
- ↑ Chen Z., Brand N.J., et al. Fusion between a novel Krüppel-like zinc finger gene and the retinoic acid receptor-alpha locus due to a variant t(11;17) translocation associated with acute promyelocytic leukaemia (англ.) // The EMBO Journal (англ.)русск. : journal. — 1993. — March (vol. 12, no. 3). — P. 1161—1167. — PMID 8384553.
- ↑ Francesco Lo-Coco, M.D., et al. Retinoic Acid and Arsenic Trioxide for Acute Promyelocytic Leukemia (англ.) // The New England Journal of Medicine : journal. — 2013. — July (vol. 369, no. 2). — P. 111—121. — doi:10.1056/NEJMoa1300874.
- ↑ Breccia, M; Latagliata, R; Carmosino, I; Cannella, L; Diverio, D; Guarini, A; De Propris, MS; Petti, MC; Avvisati, G; Cimino, G; Mandelli, F; Lo-Coco, F. Clinical and biological features of acute promyelocytic leukemia patients developing retinoic acid syndrome during induction treatment with all-trans retinoic acid and idarubicin (англ.) // Haematologica (англ.)русск. : journal. — 2008. — December (vol. 93, no. 12). — P. 1918—1920. — doi:10.3324/haematol.13510. — PMID 18945746.
- ↑ 1 2 3 Kotiah, SD; Besa, EC. Sarkodee-Adoo, C; Talavera, F; Sacher, RA; McKenna, R; Besa, EC: Acute Promyelocytic Leukemia Treatment & Management (неопр.). Medscape Reference. WebMD (3 июня 2013). Дата обращения 14 января 2014.
- ↑ 1 2 3 4 5 Ravandi, F; Estey, EH; Appelbaum, FR; Lo-Coco, F; Schiffer, CA; Larson, RA; Burnett, AK; Kantarjian, H.M. Gemtuzumab Ozogamicin: Time to Resurrect? (англ.) // Journal of Clinical Oncology (англ.)русск.. — 2012. — November (vol. 30, no. 32). — P. 3921—3923. — doi:10.1200/JCO.2012.43.0132. — PMID 22987091.
- ↑ Martindale: The Complete Drug Reference (неопр.). — Pharmaceutical Press (англ.)русск., 2011.
- ↑ Kotiah, SD. Anand, J; Braden, CD; Harris, JE: Acute Promyelocytic Leukema Treatment Protocols (неопр.). Medscape Reference. WebMD (28 октября 2013). Дата обращения 14 января 2014.
- ↑ Fenaux, P; Chastang, C; Chevret, S; Sanz, M; Dombret, H; Archimbaud, E; Fey, M; Rayon, C; Huguet, F; Sotto, JJ; Gardin, C; Makhoul, PC; Travade, P; Solary, E; Fegueux, N; Bordessoule, D; Miguel, JS; Link, H; Desablens, B; Stamatoullas, A; Deconinck, E; Maloisel, F; Castaigne, S; Preudhomme, C; Degos, L. A Randomized Comparison of All Transretinoic Acid (ATRA) Followed by Chemotherapy and ATRA Plus Chemotherapy and the Role of Maintenance Therapy in Newly Diagnosed Acute Promyelocytic Leukemia (англ.) // Blood (англ.)русск. : journal. — American Society of Hematology (англ.)русск., 1999. — August (vol. 94, no. 4). — P. 1192—1200. — PMID 10438706. (недоступная ссылка)
- ↑ Tallman, MS; Andersen, JW; Schiffer, CA; Appelbaum, FR; Feusner, JH; Woods, WG; Ogden, A; Weinstein, H; Shepherd, L; Willman, C; Bloomfield, CD; Rowe, JM; Wiernik, P.H. All-transretinoic acid in acute promyelocytic leukemia: long-term outcome and prognostic factor analysis from the North American Intergroup protocol (англ.) // Blood (англ.)русск. : journal. — American Society of Hematology (англ.)русск., 2002. — December (vol. 100, no. 13). — P. 4298—4302. — doi:10.1182/blood-2002-02-0632. — PMID 12393590. (недоступная ссылка)
- ↑ Soignet S.L., Maslak P., Wang Z.G., et al. Complete remission after treatment of acute promyelocytic leukemia with arsenic trioxide (англ.) // The New England Journal of Medicine : journal. — 1998. — November (vol. 339, no. 19). — P. 1341—1348. — doi:10.1056/NEJM199811053391901. — PMID 9801394.
- ↑ Soignet,Complete Remission After Treatment of APL with Arsenic Trioxide 1998, 1346
- ↑ Soignet, 1998, 1347
- ↑ Arsenic Compound Improves Survival in Acute Promyelocytic Leukemia Patients . Sept 2007
- ↑ Miwako, I; Kagechika, H. Tamibarotene (неопр.) // Drugs Today (Barc). — 2007. — August (т. 43, № 8). — С. 563—568. — doi:10.1358/dot.2007.43.8.1072615. — PMID 17925887.
- ↑ Martens, JH; Brinkman, AB; Simmer, F; Francoijs, KJ; Nebbioso, A; Ferrara, F; Altucci, L; Stunnenberg, H.G. PML-RARa/RXR Alters the Epigenetic Landscape in Acute Promyelocytic Leukemia (англ.) // Cancer Cell : journal. — 2010. — February (vol. 17, no. 2). — P. 173—185. — doi:10.1016/j.ccr.2009.12.042. — PMID 20159609. Архивировано 15 марта 2013 года.
- ↑ Leiva, M; Moretti, S; Soilihi, H; Pallavicini, I; Peres, L; Mercurio, C; Dal Zuffo, R; Minucci, S; de Thé, H. Valproic acid induces differentiation and transient tumor regression, but spares leukemia-initiating activity in mouse models of APL (англ.) // Leukemia : journal. — 2012. — July (vol. 26, no. 7). — P. 1630—1637. — doi:10.1038/leu.2012.39. — PMID 22333881.
- ↑ Histone deacetylase inhibitors induce remission in transgenic models of therapy-resistant acute promyelocytic leukemia (англ.) // He, LZ; Tolentino, T; Grayson, P; Zhong, S; Warrell, RP Jr; Rifkind, RA; Marks, PA; Richon, VM; Pandolfi, PP : journal. — Vol. 108, no. 9. — P. 1321—1330. — doi:10.1172/JCI11537. — PMID 11696577.
- ↑ Schiffer, CA; Stone, R. M. Chapter 124: Acute Myeloid Leukemia in Adults // Holland-Frei Cancer Medicine (неопр.) / Bast, RC; Kufe, DW; Pollock, R. E.. — 5th. — Hamilton, ON: BC Decker, 2000.
- ↑ Douer, D; Santillana, S; Ramezani, L; Samanez, C; Slovak, ML; Lee, MS; Watkins, K; Williams, T; Vallejos, C. Acute promyelocytic leukaemia in patients originating in Latin America and is associated with an increased frequency of the bcr1 subtype of the PML/RARalpha fusion gene (англ.) // British Journal of Haematology (англ.)русск. : journal. — 2003. — August (vol. 122, no. 4). — P. 563—570. — doi:10.1046/j.1365-2141.2003.04480.x. — PMID 12899711.
- ↑ Ravandi, F. Therapy-related acute promyelocytic leukemia (англ.) // Haematologica (англ.)русск.. — 2011. — April (vol. 96, no. 4). — P. 493—495. — doi:10.3324/haematol.2011.041970. — PMID 21454880.
- ↑ Elliott, MA; Letendre, L; Tefferi, A; Hogan, WJ; Hook, C; Kaufmann, SH; Pruthi, RK; Pardanani, A; Begna, KH; Ashrani, AA; Wolanskyj, AP; Al-Kali, A; Litzow, M.R. Therapy-related acute promyelocytic leukemia: observations relating to APL pathogenesis and therapy (англ.) // European Journal of Haematology : journal. — 2012. — March (vol. 88, no. 3). — P. 237—243. — doi:10.1111/j.1600-0609.2011.01727.x. — PMID 22023492.
- ↑ Rashidi, A; Fisher, S.I. Therapy-related acute promyelocytic leukemia: a systematic review (англ.) // Medical Oncology : journal. — 2013. — Vol. 30, no. 3. — P. 625. — doi:10.1007/s12032-013-0625-5. — PMID 23771799.
«Что такое лейкемия?» – Яндекс.Знатоки
Лейкемия (лейкоз, белокровие, рак крови) — это злокачественная опухоль крови. При данном заболевании нарушено нормальное кроветворение, в результате чего увеличивается количество незрелых клеток-лейкоцитов в костном мозге. Клетки-лейкоциты состоят из следующего подвида клеток: нейтрофилов (гранулоциты), лимфоцитов, эозинофилов, базофилов, моноцитов. Все они выполняют функцию иммунной защиты в организме человека. Существует достаточно много видов лейкозов, однако среди них выделяют два основных типа: острые лейкозы и хронические лейкозы.
Острый лейкоз — это злокачественная опухоль крови, при которой в костном мозге увеличивается количество клеток-бластов (т.е. молодых лейкоцитов, “глупых”, которые не могут выполнять свои функции). Эти клетки, бесконтрольно размножаясь в костном мозге, занимают место здоровых кроветворных клеток, а затем выходят из костного мозга и циркулируют по сосудам. В результате быстрого и бесконтрольного размножения, в анализах крови пациентов с таким заболеванием снижается уровень гемоглобина, тромбоцитов, здоровых лейкоцитов, из-за чего возникает выраженная слабость, усталость, кровоточивость и инфекции.
До настоящего времени не определена точная причина острого лейкоза. У некоторых заболевание может возникнуть без каких-либо известных причин. У других после контакта с радиацией, какими-либо химическими веществами или на фоне другого гематологического заболевания.
Симптомы заболевания не являются специфичными для лейкозов, то есть начало заболевания может протекать бессимптомно или схоже с другими, к примеру, инфекционными заболеваниями (слабость, вялость, может также проявляться кровоточивостью). Иногда заподозрить заболевание можно только после сдачи обычного анализа крови.
Диагноз острый лейкоз можно установить с помощью исследования костного мозга, в некоторых случаях исследуют кровь из вены. Для исследования костного мозга необходимо выполнить аспирационную биопсию (пункцию)— с помощью специальной иглы из кости берут жидкую часть костного мозга, которую затем исследуют с помощью различных методов. Обязательным условием для постановки правильного диагноза является содержание клеток-бластов в костном мозге более 20%. После того, как диагноз установлен, начинают лечение.
Золотым стандартом лечения острого лейкоза является химиотерапия. Молодым пациентам проводят агрессивную химиотерапию с целью достижения ремиссии. Ремиссия — это отсутствие бластных клеток в костном мозге. Взрослым пациентам старше 60-65 лет и имеющим тяжелые сопутствующие заболевания не проводится агрессивная химиотерапия, так как она может больше навредить, чем принести пользы. Таким пациентам проводят химиотерапию в малых дозах, чтобы уменьшить проявления заболевания и улучшить качество жизни.
По статистике по данным базы данных GLOBOCAN в 2018 году было выявлено 437033 новых случаев острых лейкозов, что составляет 2,4% от общего количества онкологических заболеваний. Чаще всего острый лейкоз возникает у детей, что составляет около 30% всех детских онкологических заболеваний. Острый лейкоз — это очень опасное заболевание, которое без вовремя предпринятых мер по постановке диагноза и начала терапии приводит к гибели пациента.
Все острые лейкозы делятся на лимфобластные и миелоидные. Редко встречаются так называемые лейкозы со смешанным фенотипом, которые несут в себе два клона опухолевых клеток — лимфоидный и миелоидный.
Хронический лейкоз — это злокачественная опухоль крови, которая может протекать медленно, в течение многих лет не проявляя себя какими-либо симптомами. В результате в костном мозге образуется большое количество не молодых бластных клеток, а более зрелых. Среди данной группы лейкозов выделяют два основных подтипа: хронический лимфоцитарный лейкоз (по-другому при определенных обстоятельствах заболевание может называться лимфома из малых лимфоцитов) и хронический миелоцитарный лейкоз.
До настоящего времени не определена точная причина хронических лейкозов. Однако известно, что, к примеру, хронический миелоцитарный лейкоз возникает вследствие нарушения содержания хромосом в клетке (появляется так называемая «филадельфийская хромосома»).
Заболевание может протекать бессимптомно. Однако у некоторых пациентов могут появиться так называемые В-симптомы, а именно: сильная потливость, быстрое похудание и постоянное повышение температуры.
Диагноз можно установить с помощью исследования костного мозга, в некоторых случаях исследуют кровь из вены. Для исследования костного мозга необходимо выполнить аспирационную биопсию (пункцию) — с помощью специальной иглы из кости берут жидкую часть костного мозга, которую затем исследуют с помощью различных методов.
К методам лечения хронических лейкозов относят химиотерапию, таргетную терапию.
Стоит отметить, что в данной статье перечислены не все виды хронических лейкозов, а наиболее часто встречающиеся.
Все хронические лейкозы могут переходить в другие заболевания, это состояние называют трансформацией. К примеру, хронический лимфолейкоз может трансформироваться в синдром Рихтера, который требует очень агрессивной терапии, а хронический миелолейкоз в острый лейкоз.