Эпидуральное пространство позвоночника
Эпидуральная анестезия — Википедия
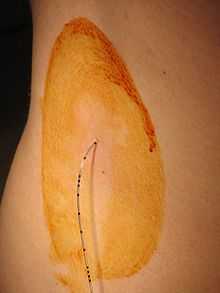 Эпидуральный катетер в месте введения. Операционное поле обработано антисептиком. Видны метки глубины на катетере
Эпидуральный катетер в месте введения. Операционное поле обработано антисептиком. Видны метки глубины на катетере Эпидуральная анестезия, она же «перидуральная» — один из методов регионарной анестезии, при котором лекарственные препараты вводятся в эпидуральное пространство позвоночника через катетер. Инъекция приводит к потере болевой чувствительности (анальгезия), потере общей чувствительности (анестезия) или к расслаблению мышц (миорелаксация).
Механизм действия эпидуральной анестезии связан, преимущественно, с проникновением препаратов через дуральные муфты в субарахноидальное пространство, и вследствие этого, блокадой прохождения нервных импульсов (в том числе болевых) по корешковым нервам и далее в спинной мозг.
Принцип действия эпидуральной анестезии[править | править код]
В человеческом организме спинной мозг и корешки спинного мозга окутаны специальной оболочкой — твердой мозговой оболочкой. Эпидуральное пространство окружает эту оболочку и проходит вдоль позвоночника. Инъекция анастезирующего средства в эпидуральное пространство вызывает потерю болевой чувствительности.
Схема: продольный разрез позвоночника с введенной эпидуральной иглой. Объяснения в текстеОблегчение боли происходит благодаря блокированию передачи болевых импульсов по нервным окончаниям спинного мозга.
В отличие от субарахноидальной, эпидуральная анестезия не приводит к миорелаксации и потере общей чувствительности, поэтому её используют при родах.
В зависимости от области применения, исполнение эпидуральной анестезии (анальгезии) может быть сопряжено с большим или меньшим риском. Анальгезия груди, живота, паховой области и ног менее рискованна, чем анальгезия шеи и рук. Анальгезия головы с помощью эпидуральной анестезии невозможна, потому что сенсорная иннервация головы осуществляется через черепно-мозговую нервную систему. Эпидуральная анестезия может применяться:
- Для местного обезболивания. В случае отсутствия хирургического вмешательства, например, при родах.
- Как дополнение к общей анестезии. Эпидуральная анестезия может снизить потребность в опиоидах во время некоторых операций (гистерэктомия, лапаротомия и др.).
- В качестве полной анестезии. Некоторые операции (например, кесарево сечение) могут выполняться под эпидуральной анестезией. Пациенты обычно остаются в сознании, однако доза для такой анестезии значительно выше, чем для местного обезболивания.
- Для послеоперационного обезболивания. Препараты вводятся в течение нескольких дней. Пациенту дается возможность контролировать количество вводимого препарата для снижения боли.
- Как лечение боли в спине. Инъекции анальгетиков и стероидов в эпидуральную область могут снимать некоторые виды боли в спине.
Для эпидуральной анестезии применяюся специально предназначенные (особо очищенные и не содержащие консервантов) растворы для эпи- и субдурального введения. Наиболее часто применяются местные анестетики — лидокаин, бупивакаин и ропивакаин.
Для усиления действия местных анестетиков в раствор для эпидуральной анестезии нередко добавляют опиаты, например, морфин, фентанил, промедол, бупренорфин. При этом дозы опиатов во много раз меньше, чем при введении в вену или внутримышечно, а качество обеспечиваемой анальгезии и её продолжительность лучше. При эпидуральном введении опиатов значительно реже бывают характерные для опиатов побочные явления — тошнота, рвота, угнетение дыхания, головокружение и пр., поскольку при таком способе введения наступает спинальная, а не центральная опиатная анальгезия. Так, введение 5 мг морфина в вену способно обеспечить адекватное обезболивание при послеоперационных болях на 4-6 ч, а введение всего 1 мг морфина в эпидуральное пространство обеспечивает стойкое исчезновение боли на 18-24 ч.
По Фармакопее, принятой в Российской Федерации, ни один из опиоидных анальгетиков не разрешен для введения в эпидуральное пространство.
Другие часто добавляемые в раствор для эпидуральной анестезии компоненты — клонидин (клофелин), кетамин. При этом тоже требуются намного меньшие дозы, чем при системном введении, и удается избежать побочных эффектов (снижения артериального давления в случае клофелина, галлюцинаций и тревоги — в случае кетамина). Крайне редко в раствор добавляют физостигмин, препарат, чья анальгетическая активность основана на усилении проведения «противоболевых» (антиноцицептивных) импульсов в холинергических волокнах, в противовес болевым импульсам, передающимся по симпатическим волокнам.
Эпидуральная анестезия считается эффективным и достаточно безопасным методом обезболивания. Тем не менее, этот метод является медицинским вмешательством, и, соответственно, имеет свои противопоказания и осложнения. К специфическим рискам относятся риск увеличения продолжительности родового периода и необходимость использования инструментов (щипцов, вакуум-экстрактора) вплоть до оперативного вмешательства, а также индивидуальная аллергическая реакция на анестезирующий препарат.
Идентификация эпидурального пространства.[править | править код]
Игла попадает в эпидуральное пространство, как только её конец проходит через жёлтую связку, отодвигая твердую мозговую оболочку. Возникающее отрицательное давление подтверждает то мнение, что эпидуральное пространство представляет собой лишь потенциально существующий канал. Точная идентификация момента попадания иглы в эпидуральное пространство снижает риск повреждения твердой мозговой оболочки. Методы идентификации эпидурального пространства делятся на две основные категории: методика «утраты сопротивления» и методика «висячей капли».
Методика «утраты сопротивления» — наиболее распространенный способ идентификации эпидурального пространства. Проведение иглы через кожу в межостистую связку ощущается как значительное сопротивление. Когда конец иглы входит в толщу межостистой связки, мандрен извлекают и к игле присоединяют шприц, заполненный воздухом или изотоническим раствором натрия хлорида. Если попытка ввести раствор встретит значительное сопротивление или будет невозможна, то конец иглы действительно находится в толще межостистой связки и её можно продвигать вперед.
Контролировать продвижение иглы можно двумя способами. Один состоит в том, что иглу с подсоединенным шприцем медленно непрерывно продвигают вперед левой рукой, а правой постоянно оказывают давление на поршень шприца. При попадании конца иглы в эпидуральное пространство резко снижается сопротивление и поршень внезапно легко продвигается вперед. Второй способ заключается в том, что иглу продвигают поступательными движениями, за один раз подавая её вперед на несколько миллиметров, после чего останавливаются и осторожно надавливают на поршень шприца, пытаясь определить по ощущениям — находится ли игла ещё в толще связок, или же сопротивление уже утрачено и она попала в эпидуральное пространство. Второй способ быстрее и практичнее, но требует некоторого опыта, чтобы вовремя остановиться и избежать перфорации твердой мозговой оболочки.
Используя методику «утраты сопротивления», можно вводить изотонический раствор натрия хлорида или воздух, в зависимости от предпочтений анестезиолога. Имеются сообщения о том, что пузырьки воздуха могут быть причиной неполной или мозаичной блокады, но это возможно лишь при введении значительных объёмов воздуха. Изотонический раствор натрия хлорида легко спутать с цереброспинальной жидкостью, что создает затруднения при подозрении на непреднамеренную пункцию твердой мозговой оболочки.
Методика «висячей капли». Иглу (лучше со щитком) вводят глубоко в межостистую связку, после чего удаляют мандрен. К павильону иглы подвешивают каплю жидкости — чаще всего изотонического раствора натрия хлорида. Пока игла продвигается через плотные связки, капля не смещается. После пункции жёлтой связки и попадания конца иглы в эпидуральное пространство «висячая капля» исчезает в просвете иглы под воздействием отрицательного давления. Однако, если игла окажется обтурированной, то капля не будет втягиваться из павильона в просвет иглы и её будут продвигать вперед вплоть до того момента, когда истечение цереброспинальной жидкости засвидетельствует перфорацию твердой мозговой оболочки. Следует отметить, что методику «висячей капли» применяют только очень опытные анестезиологи. Также данная методика используется для околосрединного доступа.
Уровень пункции эпидурального пространства.[править | править код]
Эпидуральная пункция может выполняться на уровне всех четырёх отделов позвоночника: шейном, грудном, поясничном, крестцовом.
Эпидуральная анестезия на поясничном уровне выполняется с использованием срединного или околосрединного доступа. Срединный доступ. Больного укладывают, обрабатывают область пункции раствором антисептика и укрывают стерильным операционным бельем. Межостистый промежуток LIV-LV находится на уровне линии, соединяющей гребни подвздошных костей. Легче всего пальпировать промежутки между LIII-LIV и LIV-LV. Кожу инфильтрируют раствором местного анестетика и затем перфорируют иглой размером 18 G. В образовавшееся отверстие вводят иглу для эпидуральной пункции и продвигают её вперед и параллельно выше расположенному остистому отростку (то есть в слегка краниальном направлении). При попадании в связочные структуры по срединной линии к павильону иглы присоединяют шприц, и при подаче раствора следует удостовериться в ощущении сопротивления. Очень важно ощутить сопротивление связок именно в этот момент, так как в противном случае может возникнуть ошибочное ощущение утраты сопротивления при случайном попадании иглы в мышечные ткани или жировые отложения, что приведет к инъекции анестетика не в эпидуральное пространство, и блокада не состоится. После ощущения сопротивления связок иглу продвигают вперед до входа в эпидуральное пространство, которое идентифицируют по утрате сопротивления (методику см. выше).
Околосрединный доступ. К околосрединному (парамедианному) доступу прибегают в тех случаях, когда предшествующее хирургическое вмешательство или дегенеративные изменения позвоночника серьезно затрудняют использование срединного доступа. Эта методика сложнее для начинающих, потому что игла проходит через мышечные ткани, минуя над остистую и межостистую связки, и ощущение сопротивления возникает только во время пункции жёлтой связки. Больного укладывают, обрабатывают область пункции раствором антисептика и укрывают стерильным операционным бельем — все как для срединного доступа. Кожу инфильтрируют раствором местного анестетика на 2-4 см латеральное нижней точки вышерасположенного остистого отростка. Толстой иглой перфорируют кожу, в образовавшееся отверстие вводят эпидуральную иглу и направляют её к срединной линии и в слегка краниальном направлении. Продвигать иглу следует с таким расчетом, чтобы она пересекла воображаемую срединную линию на глубине 4-6 см от поверхности. После того как игла пройдет через кожу, к ней присоединяют шприц; по мере прохождения через мышечные ткани будет ощущаться некоторое сопротивление подаваемому из шприца раствору. Это незначительное сопротивление следует верифицировать неоднократно, пока внезапное возрастание сопротивления не засвидетельствует попадания в жёлтую связку.
Помимо сопротивления, попадание в жёлтую связку вызывает характерное ощущение чего-то жесткого, грубого. Неожиданное ощущение потери сопротивления по мере продвижения через жёлтую связку означает, что игла попала в эпидуральное пространство. Трудности, связанные с проведением стандартного эпидурального катетера через иглу Туохи, могут быть обусловлены сочетанием изогнутого конца иглы с углом околосрединного доступа, что придает слишком косое направление продвижению катетера. Учитывая эти факторы, некоторые анестезиологи предпочитают использовать при околосрединном доступе на поясничном уровне прямую иглу Кроуфорда.
Эпидуральная анестезия на грудном уровне технически сложнее, чем на поясничном, а риск повреждения спинного мозга выше. Поэтому очень важно, чтобы до проведения торакальной эпидуральной анестезии анестезиолог в совершенстве овладел срединным и околосрединным доступом для пункции эпидурального пространства на поясничном уровне. Так как остистые отростки грудных позвонков наклонены вниз и частично перекрывают друг друга, эпидуральную анестезию в грудном отделе чаще выполняют с помощью околосрединного доступа, хотя иногда используют и срединный.
Срединный доступ. Оба доступа для торакальной эпидуральной анестезии обеспечивают блокаду дерматомов, соответствующих сегментам спинного мозга в области введения анестетика. Межостистые промежутки в этом отделе лучше всего идентифицируются в положении больного сидя. В верхнем грудном отделе остистые отростки позвонков наклонены под более острым углом, поэтому иглу здесь следует направлять более краниально. Толщина надостистой и межостистой связки значительно меньше, чем в поясничном отделе, так что жёлтая связка здесь обычно находится на глубине не более чем 3-4 см от поверхности кожи. Внезапная утрата сопротивления свидетельствует о попадании в эпидуральное пространство. При пункции эпидурального пространства краниальнее поясничного отдела возможен прямой контакт со спинным мозгом. Если при попытке пункции эпидурального пространства возникла интенсивная жгучая боль, следует подумать прежде всего о прямом контакте иглы со спинным мозгом и рекомендуется немедленно извлечь иглу. Повторные контакты с костью без попадания в связки или эпидуральное пространство являются показанием к использованию околосрединного доступа.
Околосрединныи доступ. Идентифицируются межостистые промежутки, кожу инфильтрируют раствором местного анестетика на 2 см латеральнее нижней точки вышерасположенного остистого отростка. Иглу вводят почти перпендикулярно к коже, под небольшим углом к срединной линии (10-15°) до контакта с пластинкой или ножкой позвонка. После этого иглу оттягивают назад и направляют немного краниальнее в попытке избежать контакта с пластинкой позвонка. Если это получается, то конец иглы должен находиться в контакте с жёлтой связкой. К игле присоединяют шприц и её продвигают вперед, используют методику потери сопротивления или висячей капли. В отличие от околосрединного доступа в поясничном отделе, расстояние, которое должна преодолеть игла в грудном отделе до пересечения жёлтой связки, гораздо короче, эпидуральное пространство достигается быстрее.
Введение анестетика[править | править код]
Введение местного анестетика в эпидуральное пространство неизменно начинается с инъекции тест-дозы. С этой целью обычно применяют 3-5 мл местного анестетика (например, лидокаина) в сочетании с адреналином в пропорции 1:200 000. Тест-дозу можно вводить как через пункционную иглу, так и через катетер. Теоретически, предварительная инъекция местного анестетика через иглу несколько растягивает эпидуральное пространство, что облегчает проведение катетера. С другой стороны, не исключено, что предварительное введение анестетика через иглу может завуалировать парестезии во время проведения катетера. Клинический опыт показывает, что тест-дозу можно вводить как через иглу, так и через катетер, обе тактики характеризуются высокой степенью удачной установки катетера и минимальным риском повреждения нервных структур. Если тест-доза попала в кровеносный сосуд, то спустя 30-60 с частота сердечных сокращений увеличится на 20 %. При инъекции в субарахноидальное пространство в течение 3 мин разовьются симптомы спинномозговой анестезии.
Введение местного анестетика дробными дозами — важная мера безопасности при эпидуральной анестезии. Многие анестезиологи считают, что после тест-дозы следует вводить не более 5 мл анестетика одномоментно, и каждая последующая инъекция должна выполняться после предварительной аспирационной пробы, чтобы не пропустить случайного повреждения твердой мозговой оболочки или сосуда. Уменьшение разовой дозы до 5 мл и соблюдение интервала между инъекциями не менее 3-5 мин значительно уменьшает выраженность осложнений при непреднамеренном введении местного анестетика в субарахноидальное пространство или кровеносный сосуд. Попадание 5 мл анестетика в субарахноидальное пространство может привести к относительно высокой субарахноидальной блокаде, но в любом случае это предпочтительней, чем продолжительная тотальная спинномозговая блокада при случайном введении всей расчетной дозы.
Выбор анестетика и его концентрации зависит от характера и продолжительности предстоящей операции, а также от желаемой интенсивности сенсорной и моторной блокады. Как и при спинномозговой анестезии, добавление опиоидов к местным анестетикам потенцирует эпидуральную анестезию.
Применение катетера позволяет использовать анестетики как короткого, так и длительного действия. Если используется методика однократной инъекции, то применяют анестетики средней продолжительности или длительного действия. Например, ортопедические вмешательства на нижних конечностях требуют полной сенсорной блокады в сочетании с умеренной или выраженной моторной блокадой. Это можно обеспечить с помощью следующих анестетиков: 3% раствор хлоропрокаина, для которого характерно быстрое начало действия, полная сенсорная и выраженная моторная блокада; 1,5-2 % раствор лидокаина или мепивакаина — при средней скорости развития эффекта они обеспечивают хорошую сенсорную и моторную блокаду; 0,5-0,75 % раствор бупивакаина начинает действовать медленно, характеризуется глубокой сенсорной блокадой и моторной блокадой различной степени. Более низкие концентрации бупивакаина не подходят для вмешательств, где требуется адекватная моторная блокада.
Факторы, влияющие на эпидуральную анестезию[править | править код]
Точная доза местного анестетика при эпидуральной анестезии зависит от многих факторов, но в упрощенном виде она составляет 1-2 мл раствора анестетика на каждый сегмент спинного мозга, который необходимо блокировать. Это означает, например, что при пункции на поясничном уровне необходим большой объём анестетика, чтобы обеспечить сенсорную и моторную блокаду при вмешательстве на органах брюшной полости. И, наоборот, для сегментарной блокады достаточно меньшей дозы — примеры включают анестезию на поясничном уровне для обезболивания в родах, анестезию на среднегрудном уровне для обезболивания после операций на органах верхнего этажа брюшной полости или после торакальных вмешательств.
Доза анестетика колеблется в рекомендуемых пределах, потому что действие препарата внутри эпидурального пространства носит не вполне предсказуемый характер. Кроме того, объём и конфигурация эпидурального пространства весьма вариабельны и изменяются с возрастом. Предполагается, что при эпидуральной анестезии у местного анестетика есть две анатомические точки приложения:
- расположенные эпидурально нервные корешки и спинномозговые узлы, куда препарат поступает после диффузии через межпозвоночные отверстия;
- субарахноидальное пространство, куда препарат поступает либо путём диффузии через твердую мозговую оболочку, либо через дуральные муфты в межпозвоночных отверстиях, либо через эпидуральный лимфатический ствол.
Доза местного анестетика определяется объёмом и концентрацией введенного раствора. Если при одной и той же дозе варьировать объём и концентрацию раствора, то физиологическая реакция на введение анестетика может изменяться. При большом объёме и низкой концентрации местный анестетик вызовет сенсорную блокаду на высоком уровне и слабо выраженную моторную блокаду, в то время как малые объёмы концентрированного анестетика, наоборот, приведут к мощной сенсорной и моторной блокаде на низком уровне. При низких концентрациях моторная блокада практически не достигается, поэтому слабоконцентрированные растворы предназначены для сенсорной блокады.
Катетеризация эпидурального пространства позволяет вводить расчетную дозу дробно, в несколько приемов.
Эффективность эпидуральной анестезии оценивают отдельно по каждой модальности. Симпатическую блокаду оценивают по кожной температуре, сенсорную — с помощью укола иглой, двигательную — по шкале Бромэджа. Шкала Бромэджа определяет возможность полного сгибания в коленном и голеностопном суставе как «отсутствие блокады», возможность полного сгибания в коленном суставе и неспособность поднять выпрямленную ногу как «частичную блокаду», неспособность согнуть ногу в колене при сохраненном сгибании стопы как «почти полную блокаду», и отсутствие движений в нижней конечности как «полную блокаду».
Повторные дозы препарата следует вводить до того момента, когда интенсивность блокады уменьшится и больной начнет испытывать боль. Для определения этого момента лучше всего подходит оценка уровня сенсорной блокады. При эпидуральной анестезии характерной особенностью каждого анестетика является «время двухсегментарной регрессии», то есть промежуток времени, необходимый для снижения максимального уровня сенсорной блокады на два сегмента. По истечении времени двухсегментарной регрессии следует ввести одну треть или половину от первоначальной дозы анестетика. Некоторые анестезиологи предпочитают вводить повторные дозы через определенный временной интервал, не дожидаясь клинических изменений и руководствуясь собственным опытом работы с препаратом, но такой подход вследствие вариабельности реакции может привести к слишком высокому или, наоборот, слишком низкому уровню блокады.
Дозу, необходимую для достижения адекватного уровня анестезии, снижают у пожилых пациентов в связи с уменьшением у них объёма или растяжимости эпидуралъного пространства. Одна и та же доза или объём препарата у пожилого пациента вызовет более высокую блокаду, нежели у молодого. Титрование дозы в зависимости от клинического эффекта — лучший способ адекватного обеспечения эпидуральной анестезии у лиц пожилого возраста.
При эпидуральной анестезии у взрослых не существует четкой корреляции между массой тела и распространением анестетика в краниальном направлении. Возможное исключение из этого правила — лица с выраженным ожирением, у которых снижение объёма эпидурального пространства требует уменьшения дозы.
Рост больного, напротив, оказывает некоторое влияние на краниальное распространение анестетика в эпидуральном пространстве. При росте ниже 150 см следует вводить анестетик из расчета 1 мл на сегмент, в то время как у более высоких больных дозу увеличивают до 2 мл на сегмент. Существуют достаточно сложные расчеты дозы для больных выше 150 см, но на практике сначала вводят среднерасчетную начальную дозу, а последующие дозы титруют по клиническому эффекту.
При хирургических вмешательствах в зоне иннервации крупных нервов L5-S1 и S2 следует учитывать, что если вводить анестетик в положении пациента сидя (это можно сделать однократно через иглу), то большое количество препарата непосредственно воздействует на корешки, что увеличивает вероятность успешной блокады.
Эффекты от введения вазоконстрикторов в эпидуральное пространство не очень хорошо изучены. При добавлении адреналина к бупивакаину время двухсегментарной регрессии не увеличивалось, тогда как при добавлении адреналина к лидокаину или мепивакаину многие анестезиологи отмечают явное увеличение продолжительности действия. При эпидуральной анестезии применяют высокие дозы местных анестетиков. Добавление вазоконстрикторов в раствор местного анестетика уменьшает абсорбцию анестетика в системный кровоток и сочетанные осложнения, а также ограничивает краниальное распространение анестетика. Кроме того, вазоконстрикторы улучшают качество блокады.
Коммерчески доступные растворы местных анестетиков имеют рН от 3,5 до 5,5, что обусловлено требованием химической стабильности и асептики. Будучи слабыми основаниями, при таком рН они существуют главным образом в ионизированной форме. В то время как концентрация ионизированной фракции определяет распространение анестетика в эпидуральном пространстве, от концентрации неионизированной фракции зависят поступление анестетика через мембрану нервных клеток и, следовательно, быстрота наступления эффекта. Эти закономерности привели к созданию различных модификаций растворов местных анестетиков, включая карбонирование и добавление бикарбоната натрия с целью повышения рН раствора до физиологического непосредственно перед инъекцией. Возникающее увеличение концентрации неионизированной фракции приводит к ускорению наступления эффекта и, возможно, к углублению блокады. Такой подход используют для анестетиков, растворы которых не теряют своих свойств при увеличении рН до физиологического, к их числу относятся лидокаин, мепивакаин и хлоропрокаин. Раствор бупивакаина, напротив, преципитирует при рН выше 6,8.
Успешность эпидуральной анестезии зависит от многих факторов. Слабая сенсорная блокада на низком уровне может быть обусловлена недостаточной начальной дозой или объёмом анестетика, или же слишком ранним началом операции, когда между инъекцией и хирургическим разрезом прошло мало времени и анестетик не успел распределиться.
Иногда причиной неэффективной анестезии может быть мозаичная блокада. Анатомия эпидурального пространства вариабельна, некоторые исследователи даже обнаружили в нём перегородку, расположенную по срединной линии. Дальнейшие исследования подтвердили такую возможность, но ткань перегородки оказалась проницаемой и не представляющей барьера для диффузии. Введение катетера более чем на 4 см за пределы иглы может привести к отклонению его от средней линии или к миграции в область муфты твердой мозговой оболочки, что чревато неадекватным или односторонним распределением анестетика в эпидуральном пространстве. Если такое случилось, то больного следует повернуть на бок, соответствующий стороне неадекватной анестезии, и повторить инъекцию: этот манёвр иногда позволяет разрешить проблему. Неэффективность эпидуральной анестезии иногда проявляется как слабая двигательная блокада, в этом случае следует увеличить концентрацию анестетика или поменять его на другой препарат.
Одной из причин неэффективной эпидуральной анестезии является недостаточная блокада крестцовых сегментов, особенно при вмешательствах на дистальных отделах нижних конечностей. Вероятные причины рассмотрены выше и обусловлены большим диаметром нервных корешков. Введение первой дозы анестетика в положении больного сидя позволяет свести к минимуму эту проблему. Если недостаточная блокада крестцовых сегментов оказалась выявленной уже после обработки операционного поля, то подъём головного конца операционного стола и повторная инъекция анестетика иногда позволяют углубить блокаду.
Висцеральные боли во время операций на брюшной полости связаны с раздражением брюшины. Даже если для операций на нижнем этаже брюшной полости достаточно блокады нижнегрудных сегментов, то при высокой вероятности тракции и стимуляции внутрибрюшных структур (например, паховой связки, семенного канатика) следует дополнительно блокировать верхнегрудные сегменты.
Трудная или неэффективная эпидуральная анестезия может быть обусловлена некоторыми техническими факторами. При непреднамеренной пункции твердой мозговой оболочки следует извлечь иглу и выполнить пункцию на другом уровне. Иногда в подобном случае, используя подходящий раствор местного анестетика, можно провести спинномозговую анестезию. Возможна перфорация твердой мозговой оболочки катетером при правильном положении иглы. Это верифицируется истечением спинномозговой жидкости, анестезиолог может использовать катетер для длительной спинномозговой анестезии или удалить катетер и выполнить эпидуральную пункцию вновь.
Редко встречающееся, но очень коварное явление — катетеризация субдурального пространства. Вероятно, это происходит при частичной пункции твердой мозговой оболочки, когда цереброспинальная жидкость не попадает в просвет иглы, но вводимый катетер проходит в субдуральное пространство. Цереброспинальная жидкость не может быть аспирирована. Последствия случайного введения анестетика в субдуралъное пространство чрезвычайно варьируют. Имеются сообщения об очень высокой односторонней блокаде с выпадением какой-либо модальности, несмотря на полную анестезию с противоположной стороны. Например, описаны полная сенсорная блокада при отсутствии двигательной и полная моторная блокада при незначительной сенсорной. Начало действия медленное и эффект не соответствует количеству вводимого анестетика. При отсутствии миелографии диагноз можно поставить только методом исключения.
Другой технической ошибкой, приводящей к неэффективной эпидуральной анестезии, является канюляция эпидуральной вены иглой или катетером. Если произошла пункция вены иглой, то её удаляют и пункцию повторяют. Если из катетера аспирируется кровь, то его следует подтянуть, промыть изотоническим раствором натрия хлорида и провести повторную аспирацию. Обычно катетер не проходит далеко в просвет вены. Введение тест-дозы анестетика с адреналином позволяет быстро распознать внутривенное расположение катетера по характерной реакции симпатической нервной системы.
Ещё одна причина неэффективной эпидуральной блокады — ложное ощущение утраты сопротивления. У некоторых молодых людей связки позвоночника мягкие и сопротивление инъекции не столь отчетливо, как обычно. Анестезиолог может ошибочно полагать, что игла вошла в эпидуральное пространство, в то время как она находится в межостистой связке. У больного может быть кистозная дегенерация ткани связок и попадание иглы в эту область может ощущаться как утрата сопротивления. Подобным же образом ложное ощущение утраты сопротивления может возникать при попадании иглы в мышечный массив при отклонении от срединной линии.
Методика комбинированной эпидуральной анестезии[править | править код]
Премедикация проводится по общепринятой методике. За 5-10 мин до операции на операционном столе внутривенно вводили следующие препараты:
Атропин — 0,007-8 мг/кг — 0,5 мл 0,1 % раствора
Димедрол – 0,15 мг/кг – 1 мл 1% раствора Диазепам – 0,15 мг/кг – 1,5-2 мл 0,5% раствора Промедол - 0,2 - 0,25 мг/кг – 0,5-1 мл 2% раствора
Проведение комбинированной эпидуральной анестезии при операциях на нижнем этаже брюшины, промежности, нижних конечностях представляется менее трудоемким для врача анестезиолога-реаниматолога.
В этих случаях возможно проведение анестезии без вспомогательной ИВЛ и дозировка вводимых дополнительно гипнотиков аналогична дозировкам при комбинированной проводниковой анестезии. Более серьезного отношения к себе требует комбинированная эпидуральная анестезия при торакальных операциях и операциях на пищеводе.
Рекомендуется в этой категории пациентов предоперационную подготовку проводить в условиях отделения реанимации и интенсивной терапии.
Учитывая объём и травматичность предстоящей операции, всем пациентам предварительно с целью обеспечения надежного венозного доступа катетеризировалась центральная вена с дальнейшим мониторингом центрального венозного давления (ЦВД), как одного из показателей волемического статуса.
Желательно установить катетер в эпидуральное пространство заранее, не отвлекаясь на эту процедуру в день операции.
В отделении реанимации и интенсивной терапии дополнительно проводится инфузионная терапия, профилактическая антибактериальная терапия, превентивная анальгезия, симптоматическая терапия.
Особое место занимает предварительная «водная нагрузка» непосредственно перед операцией. Объём вводимой жидкости должен составлять не менее 8-10 мл/кг, причем качественному составу уделяется большое значение. 30-40 % вводимого объёма должен представлять плазмозаменитель с выраженным «экспандерным» действием, желательно представитель группы гидроксиэтилкрахмалов.
Введение анестетика производится дробно. Первая доза, равная ? общей расчетной дозы вводится непосредственно на операционном столе до введения в наркоз. Основная доза местного анестетика сводится дробно в течение 10-15 мин после интубации и перевода пациента на ИВЛ.
В последующем, с целью избежания нежелательных отрицательных гемодинамических сдвигов рекомендуется постоянное введение раствора местного анестетики с наркотическим препаратом посредством шприцевого насоса в обычной расчетной дозе.
Убедившись в том, что дислокации катетера нет, пациента вводят в состояние наркоза по общепринятой методике. Индукция в наркоз производится путём введение кетамина в дозе 1,5-2 мг/кг в течение 1-2 минут с последующим введением 5-10 мг диазепама и тест-дозы ардуана (0,5-1 мг). После утраты сознания следует инъекция 0,1-0,2 мг фентанила и дитилина в дозе 1,5-2 мг/кг. После интубации трахеи в течение всего периода анестезии и операции ИВЛ проводится смесью воздуха с 40-60 % кислорода.
Поддержание анестезии осуществляется дробным введением калипсола (1,5-2 мг/кг/ч), фентанила (0,0045-0,0005 мкг/кг/ч) на фоне введения пропофола из расчета 4-6 мг/кг/ч. В наиболее травматичные этапы операции приходится углублять нейровегетативную защиту за счет дополнительного введения наркозных препаратов.
При проведении комбинированной эпидуральной анестезии в сравнении с тотальной внутривенной анестезией в условиях ИВЛ удается достигнуть:
-уменьшения общего количества наркотических препаратов; -уменьшения общего количества мышечных релаксантов; -сокращения времени постнаркозной депрессии сознания и дыхания; -сокращения времени нахождения пациента на ИВЛ после операции; -достижения надежной нейровегетативной блокады; -возможности адекватного послеоперационного обезболивания без злоупотребления наркотическими препаратами; -профилактики послеоперационных нарушений моторно-эвакуаторной функции кишечника.
Осложнения после эпидуральной анестезии достаточно редки. Прогноз общего риска — 1 на каждые 23 000 - 50 000 случаев; риск осложнений от эпидуральной анестезии во время родов ещё ниже — 1 на каждые 80 000[1]. Возможные осложнения:
- Приблизительно у 1 из 20 больных не достигается необходимый уровень анальгезии. Обезболивание мозаичное или отсутствует.
- У пациентов с коагулопатией возможно образование эпидуральной гематомы, если при выполнении процедуры было случайно повреждено эпидуральное венозное сплетение
- Резорбтивное токсическое действие бупивакаина
- Большие дозы местного анестетика или адъюванта могут быть токсичными для пациента
- Непреднамеренная пункция твёрдой мозговой оболочки
- Непосредственно пункция толстой эпидуральной иглой может привести к вытеканию ликвора в эпидуральное пространство, что, в свою очередь, может привести к постпункционным головным болям. Тяжесть головных болей и их продолжительность широко варьируют, однако обычно проходят без последствий через несколько дней. В исключительных случаях боли могут сохранятся годами.
- Если катетер был введён в субарахноидальное пространство, но не проводилась верификация при помощи тест-дозы, то введение стандартных для эпидуральноё анестезии доз местного анестетика приведёт к высокому блоку (параличу дыхания и остановке сердечной деятельности)
- При установке катетера на грудном уровне, возможно повреждение спинного мозга и развитие паралича
- В. И. Кулаков с соавт «Обезболивание родов» 1998 г.
- В. Л. Тюков «Анестезия и реанимация» под редакцией О. А. Долиной стр. 354. М 1998
- А. П. Зильбер, Е. М. Шифман «Акушерство глазами анестезиолога» 1997 г.
Клиническая анатомия позвоночника и спинного мозга
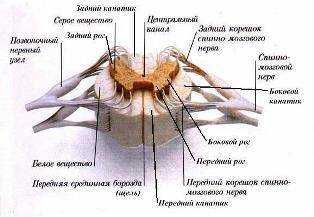 Уважаемые коллеги, предлагаемый вам материал в свое время был подготовлен автором для главы руководства по нейроаксиальной анестезии, которое, в силу ряда причин, не было завершено и не вышло в свет. Мы полагаем, что представленная ниже информация будет интересна не только начинающим анестезиологам, но и опытным специалистам, поскольку она отражает наиболее современные представления об анатомии позвоночника, эпидурального и субарахноидального пространств с точки зрения анестезиолога.
Уважаемые коллеги, предлагаемый вам материал в свое время был подготовлен автором для главы руководства по нейроаксиальной анестезии, которое, в силу ряда причин, не было завершено и не вышло в свет. Мы полагаем, что представленная ниже информация будет интересна не только начинающим анестезиологам, но и опытным специалистам, поскольку она отражает наиболее современные представления об анатомии позвоночника, эпидурального и субарахноидального пространств с точки зрения анестезиолога.
Анатомия позвоночника
Как известно, позвоночный столб состоит из 7 шейных, 12 грудных и 5 поясничных позвонков с прилегающими к ним крестцом и копчиком. Он имеет несколько клинически значимых изгибов. Наибольшие изгибы кпереди (лордоз) расположены на уровнях С5 и L4-5, кзади — на уровнях Th5 и S5. Эти анатомические особенности в совокупности с баричностью местных анестетиков играют важную роль в сегментарном распределении уровня спинального блока.
Особенности отдельных позвонков оказывают влияние на технику, в первую очередь, эпидуральной пункции. Остистые отростки отходят под различными углами на разных уровнях позвоночника. В шейном и поясничном отделах они располагаются почти горизонтально по отношению к пластине, что облегчает срединный доступ при перпендикулярном расположении иглы к оси позвоночника. На средне-грудном уровне (Th5-9) остистые отростки отходят под достаточно острыми углами, что делает предпочтительным парамедиальный доступ. Отростки верхних грудных (Th2-4) и нижних грудных (Th20-12) позвонков ориентированы промежуточно по сравнению с двумя вышеуказанными особенностями. На этих уровнях ни один из доступов не имеет преимуществ перед другим.
Доступ к эпидуральному (ЭП) и субарахноидальному пространству (СП) осуществляется между пластинами (интерламинарно). Верхние и нижние суставные отростки формируют фасеточные суставы, которые играют важную роль в правильном размещении пациента перед пункцией ЭП. Правильное расположение пациента перед пункцией ЭП определяется ориентацией фасеточных суставов. Поскольку фасеточные суставы поясничных позвонков ориентированы в сагиттальной плоскости и обеспечивают сгибание вперед-назад, то максимальное сгибание позвоночника (поза эмбриона) увеличивает интерламинарные пространства между поясничными позвонками.
Фасеточные суставы грудных позвонков ориентированы горизонтально и обеспечивают ротационные движения позвоночника. Следовательно, избыточное сгибание позвоночника не дает дополнительных преимуществ при пункции ЭП на грудном уровне.
Анатомические костные ориентиры
Идентификация необходимого межпозвонкового промежутка является залогом успеха эпидуральной и спинальной анестезии, а также необходимым условием безопасности пациента.
В клинических условиях выбор уровня пункции осуществляется анестезиологом посредством пальпации с целью выявления определенных костных ориентиров. Известно, что 7-й шейный позвонок имеет наиболее выраженный остистый отросток. В то же время необходимо учитывать, что у пациентов со сколиозом наиболее выступающим может быть остистый отросток 1-го грудного позвонка (примерно у ⅓ пациентов).
Линия, соединяющая нижние углы лопаток, проходит через остистый отросток 7-го грудного позвонка, а линия, соединяющая гребни подвздошных костей (линия Тюффье), проходит через 4-й поясничный позвонок (L4).
Идентификация необходимого межпозвонкового промежутка при помощи костных ориентиров далеко не всегда является корректной. Известны результаты исследования Broadbent и соавт. (2000), в котором один из анестезиологов при помощи маркера отмечал определенный межпозвонковый промежуток на поясничном уровне и пытался идентифицировать его уровень в положении больного сидя, второй совершал ту же попытку в положении пациента на боку. Затем над сделанной отметкой прикрепляли контрастный маркер и проводили магнитно-резонансную томографию.
Чаще всего истинный уровень, на котором была сделана отметка, находился от одного до четырех сегментов ниже, по сравнению с теми значениями, которые были указаны анестезиологами, участвовавшими в исследовании. Правильно идентифицировать межпозвонковый промежуток удалось лишь в 29% случаев. Точность определения не зависела от положения пациента, но ухудшалась у пациентов с избыточным весом. Кстати говоря, спинной мозг заканчивался на уровне L1 только у 19% пациентов (у остальных на уровне L2), что создавало угрозу его повреждения при ошибочном выборе высокого уровня пункции. Что затрудняет правильный выбор межпозвонкового промежутка?
Есть данные о том, что линия Тюффье соответствует уровню L4 лишь у 35% людей (Reynolds F., 2000). Для остальных 65% эта линия расположена на уровне от L3-4 до L5-S1.
Необходимо отметить, что ошибка на 1-2 сегмента при выборе уровня пункции эпидурального пространства, как правило, не сказывается на эффективности эпидуральной анестезии и анальгезии.
Связки позвоночника
По передней поверхности тел позвонков от черепа до крестца проходит передняя продольная связка, которая жестко фиксирована к межпозвонковым дискам и краям тел позвонков. Задняя продольная связка соединяет задние поверхности тел позвонков и образует переднюю стенку позвоночного канала.
Пластины позвонков соединяются желтой связкой, а задние остистые отростки — межостистыми связками. По наружной поверхности остистых отростков C7-S1 проходит надостистая связка. Ножки позвонков не соединены связками, в результате образуются межпозвонковые отверстия, через которые выходят спинномозговые нервы.
Желтая связка состоит из двух листков, сращенных по средней линии под острым углом. В связи с этим она как бы натянута в виде «тента». В шейном и грудном отделах желтая связка может быть не сращена по средней линии, что вызывает проблемы при идентификации ЭП по тесту потери сопротивления. Желтая связка тоньше по средней линии (2-3 мм) и толще по краям (5-6 мм). В целом она имеет наибольшую толщину и плотность на поясничном (5-6 мм) и грудном уровнях (3-6 мм), и наименьшую в шейном отделе (1,53 мм). Вместе с дужками позвонков желтая связка формирует заднюю стенку позвоночного канала.
При проведении иглы срединным доступом она должна пройти сквозь надостистые и межостистые связки, а затем сквозь желтую связку. При парамедиальном доступе игла минует надостистую и межостистую связки, сразу достигая желтой связки. Желтая связка плотнее других (на 80% состоит из эластических волокон), поэтому возрастание сопротивления при прохождении ее иглой, с последующей его потерей, как известно, используют для идентификации ЭП.
Расстояние между желтой связкой и твердой мозговой оболочкой в поясничном отделе не превышает 5-6 мм и зависит от таких факторов, как артериальное и венозное давление, давление в спинномозговом канале, давление в брюшной полости (беременность, абдоминальный компартмент-синдром и т. д.) и полости грудной клетки (ИВЛ).
С возрастом желтая связка уплотняется (оссифицируется), что затрудняет проведение через нее иглы. Данный процесс наиболее выражен на уровне нижних грудных сегментов.
Оболочки спинного мозга
Спинномозговой канал имеет три соединительно-тканных оболочки, защищающих спинной мозг: твердую мозговую оболочку, паутинную (арахноидальную) оболочку и мягкую мозговую оболочку. Эти оболочки участвуют в формировании трех пространств: эпидурального, субдурального и субарахноидального. Непосредственно спинной мозг (СМ) и корешки укрывает хорошо васкуляризированная мягкая мозговая оболочка, субарахноидальное пространство ограничено двумя прилегающими друг к другу оболочками — паутинной и твердой мозговой.
Все три оболочки СМ продолжаются и в латеральном направлении, формируя соединительнотканное покрытие спинномозговых корешков и смешанных спинномозговых нервов (эндоневрий, периневрий и эпиневрий). Субарахноидальное пространство тоже на коротком протяжении распространяется вдоль корешков и спинномозговых нервов, заканчиваясь на уровне межпозвонковых отверстий.
В отдельных случаях манжеты, образованные твердой мозговой оболочкой, удлиняются на сантиметр и более (в редких случаях на 6-7 см) вдоль смешанных спинномозговых нервов и значительно выходят за пределы межпозвонковых отверстий. Этот факт необходимо учитывать при выполнении блокады плечевого сплетения из надключичных доступов, поскольку в этих случаях даже при правильной ориентации иглы возможно интратекальное введение местного анестетика с развитием тотального спинального блока.
Твердая мозговая оболочка (ТМО) представляет собой листок соединительной ткани, состоящей из коллагеновых волокон, ориентированных как поперечно, так и продольно, а также некоторого количества эластических волокон, ориентированных в продольном направлении.
На протяжении длительного времени считали, что волокна ТМО имеют преимущественно продольную ориентацию. В связи с этим рекомендовали при пункции субарахноидального пространства ориентировать срез спинальной иглы с режущим кончиком вертикально, чтобы он не пересекал волокна, а как бы их раздвигал. Позднее при помощи электронной микроскопии выявили достаточно беспорядочное расположение волокон ТМО — продольное, поперечное и частично циркулярное. Толщина ТМО вариабельна (от 0,5 до 2 мм) и может отличаться на разных уровнях у одного и того же пациента. Чем толще ТМО, тем выше ее способность к ретракции (стягиванию) дефекта.
ТМО, наиболее толстая из всех оболочек СМ, на протяжении длительного времени рассматривалась как наиболее значимый барьер между ЭП и подлежащими тканями. В действительности это не так. Экспериментальные исследования с морфином и альфентанилом, выполненные на животных, показали, что ТМО является наиболее проницаемой оболочкой СМ (Bernards C., Hill H., 1990).
Ложное умозаключение о ведущей барьерной функции ТМО на пути диффузии привело к неправильной трактовке ее роли в генезе постпункционной головной боли (ППГБ). Если предположить, что ППГБ обусловлена подтеканием спинномозговой жидкости (СМЖ) через пункционный дефект в оболочках СМ, мы должны сделать правильный вывод о том, какая из них ответственна за эту утечку.
Поскольку СМЖ находится под паутинной оболочкой, то именно дефект этой оболочки, а не ТМО играет роль в механизмах ППГБ. В настоящее время нет доказательных данных, свидетельствующих о том, что именно дефект оболочек СМ, а значит его форма и размер, а также скорость потерь СМЖ (а значит, размер и форма кончика иглы) оказывают влияние на развитие ППГБ.
Это вовсе не означает, что некорректными являются клинические наблюдения, свидетельствующие, что использование тонких игл, игл типа «pencil-point», а также вертикальная ориентация среза игл типа Quincke снижают частоту ППГБ. Однако некорректны объяснения данного эффекта, в частности, утверждения, что при вертикальной ориентации среза игла не пересекает волокна ТМО, а «раздвигает» их. Данные заявления полностью игнорируют современные представления об анатомии ТМО, состоящей из беспорядочно расположенных волокон, а не ориентированных вертикально. В то же время клетки паутинной оболочки имеют цефало-каудальную ориентацию. В связи с этим при продольной ориентации среза игла оставляет в ней узкое щелевидное отверстие, повреждая меньшее количество клеток, чем при перпендикулярной ориентации. Однако это только предположение, требующее серьезных экспериментальных подтверждений.
Паутинная оболочка
Паутинная оболочка состоит из расположенных в одной плоскости и перекрывающих друг друга 6-8 слоев плоских эпителиально-подобных клеток, плотно соединенных между собой и имеющих продольную ориентацию. Паутинная оболочка является не просто пассивным резервуаром для СМЖ, она активно участвует в транспорте различных веществ.
Не так давно было установлено, что в паутинной оболочке вырабатываются метаболические энзимы, которые могут оказывать воздействие на метаболизм отдельных веществ (например, адреналина) и нейротрансмиттеры (ацетилхолин), имеющие значение для реализации механизмов спинальной анестезии. Активный транспорт веществ через паутинную оболочку осуществляется в области манжет спинномозговых корешков. Здесь происходит одностороннее перемещение веществ из СМЖ в ЭП, что увеличивает клиренс введенных в СП местных анестетиков. Пластинчатое строение паутинной оболочки способствует ее легкому отделению от ТМО при спинальной пункции.
Тонкая паутинная оболочка, на самом деле, обеспечивает более 90% резистентности на пути диффузии препаратов из ЭП в СМЖ. Дело в том, что дистанция между беспорядочно ориентированными коллагеновыми волокнами ТМО достаточно велика для того, чтобы создавать барьер на пути молекул лекарственных средств. Клеточная архитектоника паутинной оболочки, напротив, обеспечивает наибольшее препятствие диффузии и объясняет тот факт, что СМЖ находится в субарахноидальном пространстве, но отсутствует в субдуральном.
Осознание роли паутинной оболочки, как основного барьера на пути диффузии из ЭП в СМЖ, позволяет по-новому взглянуть на зависимость диффузионной способности препаратов от их способности растворяться в жирах. Традиционно принято считать, что более липофильные препараты характеризуются большей диффузионной способностью. На этом основаны рекомендации предпочтительного использования для ЭА липофильных опиоидов (фентанил), обеспечивающих быстро развивающуюся сегментарную анальгезию. В то же время в экспериментальных исследованиях установлено, что проницаемость гидрофильного морфина через оболочки спинного мозга существенно не отличается от таковой фентанила (Bernards C., Hill H., 1992). Установлено, что спустя 60 мин после эпидуральной инъекции 5 мг морфина на уровне L3-4 определяются в ликворе уже на уровне шейных сегментов (Angst M. et al., 2000).
Объяснением этому является тот факт, что диффузия из эпидурального в субарахноидальное пространство осуществляется непосредственно сквозь клетки паутинной оболочки, поскольку межклеточные связи настолько плотны, что исключают возможность проникновения молекул между клетками. В процессе диффузии препарат должен проникнуть в клетку через двойную липидную мембрану, а затем, еще раз преодолев мембрану, попасть в СП. Паутинная оболочка состоит из 6-8 слоев клеток. Таким образом, в процессе диффузии вышеуказанный процесс повторяется 12-16 раз.
Препараты с высокой жирорастворимостью термодинамически более стабильны в двойном липидном слое, чем в водном внутри- или внеклеточном пространстве, в связи с этим, им «труднее» покинуть мембрану клетки и переместиться во внеклеточное пространство. Таким образом, замедляется их диффузия сквозь паутинную оболочку. Препараты с плохой растворимостью в жирах имеют противоположную проблему — они стабильны в водной среде, но с трудом проникают в липидную мембрану, что тоже замедляет их диффузию.
Препараты, с промежуточной способностью растворяться в жирах, в наименьшей степени подвержены вышеуказанным водно-липидным взаимодействиям.
В то же время способность проникать через оболочки СМ не является единственным фактором, определяющим фармакокинетику препаратов, введенных в ЭП. Другим важным фактором (который зачастую игнорируется) является объем их поглощения (секвестрации) жировой клетчаткой ЭП. В частности, установлено, что длительность пребывания опиоидов в ЭП линейно зависит от их способности растворяться в жирах, поскольку эта способность определяет объем секвестрации препарата в жировой клетчатке. За счет этого затрудняется проникновение липофильных опиоидов (фентанил, суфентанил) к СМ. Имеются веские основания полагать, что при непрерывной эпидуральной инфузии этих препаратов анальгетический эффект достигается преимущественно за счет их абсорбции в кровоток и супрасегментарного (центрального) действия. В отличие от этого, при болюсном введении анальгетический эффект фентанила обусловлен в основном его действием на сегментарном уровне.
Таким образом, распространенное представление о том, что препараты с большей способностью растворяться в жирах после эпидурального введения быстрее и проще проникают в СМ, является не совсем корректным.
Эпидуральное пространство
ЭП является частью спинномозгового канала между его наружной стенкой и ТМО, простирается от большого затылочного отверстия до крестцово-копчиковой связки. ТМО прикрепляется к большому затылочному отверстию, а также к 1-му и 2-му шейным позвонкам, в связи с этим растворы, введенные в ЭП, не могут подняться выше этого уровня. ЭП расположено кпереди от пластины, с боков ограничено ножками, а спереди телом позвонка.
ЭП содержит:
- жировую клетчатку,
- спинномозговые нервы, выходящие из спинномозгового канала через межпозвонковые отверстия,
- кровеносные сосуды, питающие позвонки и спинной мозг.
Сосуды ЭП в основном представлены эпидуральными венами, формирующими мощные венозные сплетения с преимущественно продольным расположением сосудов в боковых частях ЭП и множеством анастомотических веточек. ЭП имеет минимальное наполнение в шейном и грудном отделах позвоночника, максимальное — в поясничном отделе, где эпидуральные вены имеют максимальный диаметр.
Описания анатомии ЭП в большинстве руководств по регионарной анестезии представляют жировую клетчатку в виде однородного слоя, прилегающего к ТМО и заполняющего ЭП. Вены ЭП обычно изображают в виде сплошной сети (венозное сплетение Батсона), прилегающей к СМ на всем его протяжении. Хотя еще в 1982 г. были опубликованы данные исследований, выполненных с использованием КТ и контрастирования вен ЭП (Meijenghorst G., 1982). Согласно этим данным, эпидуральные вены располагаются преимущественно в переднем и отчасти в боковых отделах ЭП. Позднее эти сведения были подтверждены в работах Hogan Q. (1991), показавшего, кроме того, что жировая клетчатка в ЭП скомпонована в виде отдельных «пакетов», располагающихся в основном в заднем и боковых отделах ЭП, т. е. не имеет характера сплошного слоя.
Переднезадний размер ЭП прогрессивно сужается с поясничного уровня (5-6 мм) к грудному (3-4 мм) и становится минимальным на уровне С3-6.
В обычных условиях давление в ЭП имеет отрицательное значение. Наиболее низким оно является в шейном и грудном отделах. Увеличение давления в грудной клетке при кашле, пробе Вальсальвы приводит к повышению давления в ЭП. Введение жидкости в ЭП повышает давление в нем, величина этого повышения зависит от скорости и объема введенного раствора. Параллельно увеличивается давление и в СП.
Давление в ЭП становится положительным в поздних сроках беременности за счет повышения внутрибрюшного давления (через межпозвонковые отверстия передается в ЭП) и расширения эпидуральных вен. Уменьшение объема ЭП способствует более широкому распространению местного анестетика.
Непреложным является факт, что препарат, введенный в ЭП, попадает в СМЖ и СМ. Менее изученным является вопрос — каким образом он туда попадает? В ряде руководств по регионарной анестезии описывается латеральное распространение препаратов, введенных в ЭП с последующей их диффузией через манжеты спинномозговых корешков в СМЖ (Cousins M., Bridenbaugh P., 1998).
Данная концепция логически обосновывается несколькими фактами. Во-первых, в манжетах спинномозговых корешков имеются паутинные грануляции (ворсинки), аналогичные таковым в головном мозге. Через эти ворсинки осуществляется секреция СМЖ в субарахноидальное пространство. Во-вторых, еще в конце XIX в. в экспериментальных исследованиях Key и Retzius было установлено, что вещества, введенные в СП животных, позднее обнаруживались в ЭП. В-третьих, было выявлено, что эритроциты удаляются из СМЖ путем пассажа через те же паутинные ворсинки. Эти три факта логически были объединены, и сделан вывод, что молекулы лекарственных веществ, размер которых меньше, чем размер эритроцитов, также могут проникать из ЭП в субарахноидальное через паутинные ворсинки. Этот вывод, конечно, привлекателен, но он является ложным, построен на умозрительных заключениях и не подкреплен ни одним экспериментальным или клиническим исследованием.
Между тем при помощи экспериментальных нейрофизиологических исследований установлено, что транспорт любых веществ через паутинные ворсинки осуществляется путем микропиноцитоза и только в одном направлении — из СМЖ наружу (Yamashima T. et al., 1988 и др.). Если бы это было не так, то любая молекула из венозного кровотока (большинство ворсинок омывается венозной кровью) могла бы легко проникнуть в СМЖ, обходя, таким образом, гематоэнцефалический барьер.
Существует еще одна распространенная теория, объясняющая проникновение препаратов из ЭП в СМ. Согласно этой теории, препараты с высокой способностью растворяться в жирах (а точнее, неионизированные формы их молекул) диффундируют через стенку корешковой артерии, проходящей в ЭП, и с током крови попадают в СМ. Данный механизм также не имеет никаких подтверждающих данных.
В экспериментальных исследованиях на животных изучена скорость проникновения в СМ фентанила, введенного в ЭП, при интактных корешковых артериях и после наложения зажима на аорту, блокирующего кровоток в этих артериях (Bernards S., Sorkin L., 1994). Не выявлено различий в скорости проникновения фентанила в СМ, однако выявлена замедленная элиминацию фентанила из СМ при отсутствии кровотока по корешковым артериям. Таким образом, корешковые артерии играют важную роль лишь в «вымывании» препаратов из СМ. Тем не менее опровергнутая «артериальная» теория транспорта препаратов из ЭП в СМ продолжает упоминаться в специальных руководствах.
Таким образом, в настоящее время экспериментально подтвержден лишь один механизм проникновения лекарственных препаратов из ЭП в СМЖ/СМ — диффузия через оболочки СМ (см. выше).
Новые данные по анатомии эпидурального пространства
Большинство ранних исследований анатомии ЭП были выполнены с помощью введения рентгеноконтрастных растворов или при аутопсии. Во всех этих случаях исследователи сталкивались с искажением нормальных анатомических соотношений, обусловленных смещением компонентов ЭП относительно друг друга.
Интересные данные были получены в последние годы при помощи компьютерной томографии и эпидуроскопической техники, позволяющей изучать функциональную анатомию ЭП в непосредственной связи с техникой эпидуральной анестезии. Например, при помощи компьютерной томографии было подтверждено, что спинальный канал выше поясничного отдела имеет овальную форму, а в нижних сегментах – треугольную.
С помощью 0,7 мм эндоскопа, введенного через иглу Туохи 16G, было установлено, что объем ЭП увеличивается при глубоком дыхании, что может облегчить его катетеризацию (Igarashi, 1999). По данным КТ, жировая ткань преимущественно сконцентрирована под желтой связкой и в области межпозвонковых отверстий. Жировая клетчатка практически полностью отсутствует на уровнях С7-Тh2, при этом твердая оболочка непосредственно соприкасается с желтой связкой. Жир эпидурального пространства скомпонован в ячейки, покрытые тонкой мембраной. На уровне грудных сегментов жир фиксирован к стенке канала только по задней средней линии, а в ряде случаев рыхло прикрепляется к твердой оболочке. Это наблюдение может частично объяснить случаи асимметрического распределения растворов МА.
При отсутствии дегенеративных заболеваний позвоночника, межпозвонковые отверстия обычно открыты, независимо от возраста, что позволяет введенным растворам свободно покидать ЭП.
При помощи магнитно-резонансной томографии были получены новые данные об анатомии каудальной (сакральной) части ЭП. Расчеты, выполненные на костном скелете, свидетельствовали о том, что его средний объем составляет 30 мл (12-65 мл). Исследования, выполненные с применением МРТ, позволили учесть объем ткани, заполняющей каудальное пространство, и установить, что его истинный объем не превышает 14,4 мл (9,5-26,6 мл) (Crighton, 1997). В той же работе было подтверждено, что дуральный мешок заканчивается на уровне средней трети сегмента S2.
Воспалительные заболевания и ранее перенесенные операции искажают нормальную анатомию ЭП.
Субдуральное пространство
С внутренней стороны к ТМО очень близко прилежит паутинная оболочка, которая тем не менее с ней не соединяется. Пространство, образуемое этими оболочками, называют субдуральным.
Термин «субдуральная анестезия» является некорректным и не идентичным термину «субарахноидальная анестезия». Случайное введение анестетика между паутинной и твердой мозговой оболочками может явиться причиной неадекватной спинальной анестезии.
Субарахноидальное пространство
Начинается от большого затылочного отверстия (где переходит в интракраниальное субарахноидальное пространство) и продолжается приблизительно до уровня второго крестцового сегмента, ограничивается паутинной и мягкой мозговой оболочками. Оно включает в себя СМ, спинномозговые корешки и спинномозговую жидкость.
Ширина спинального канала составляет около 25 мм на шейном уровне, на грудном он сужается до 17 мм, на поясничном (L1) расширяется до 22 мм, а еще ниже — до 27 мм. Переднезадний размер на всем протяжении составляет 15-16 мм.
Внутри спинального канала располагаются СМ и конский хвост, СМЖ, а также кровеносные сосуды, питающие СМ. Окончание СМ (conus medullaris) находится на уровне L1-2. Ниже конуса СМ трансформируется в пучок нервных корешков (конский хвост), свободно «плавающих» в СМЖ в пределах дурального мешка. В настоящее время рекомендуется осуществлять пункцию субарахноидального пространства в межпозвонковом промежутке L3-4, чтобы снизить до минимума вероятность травмы иглой СМ. Корешки конского хвоста достаточно мобильны, и опасность их травмирования иглой крайне мала.
Спинной мозг
Располагается на протяжении от большого затылочного отверстия до верхнего края второго (очень редко третьего) поясничного позвонка. Его средняя протяженность составляет 45 см. У большинства людей СМ заканчивается на уровне L2, в редких случаях достигая нижнего края 3-го поясничного позвонка.
Кровоснабжение спинного мозга
СМ снабжается спинальными ветвями позвоночной, глубокой шейной, межреберных и поясничной артерий. Передние корешковые артерии входят в спинной мозг поочередно — то справа, то слева (чаще слева). Задние спинальные артерии являются ориентированными вверх и вниз продолжениями задних корешковых артерий. Ветви задних спинальных артерий соединяются анастомозами с аналогичными ветвями передней спинальной артерии, образуя многочисленные сосудистые сплетения в мягкой мозговой оболочке (пиальную сосудистую сеть).
Тип кровоснабжения СМ зависит от уровня вхождения в спинномозговой канал самой большой по диаметру корешковой (радикуломедулярной) артерии — так называемой артерии Адамкевича. Возможны различные анатомические варианты кровоснабжения СМ, в том числе такой, при котором все сегменты ниже Th3-3 питаются из одной артерии Адамкевича (вариант а, около 21% всех людей).
В других случаях возможны:
б) нижняя дополнительная радикуломедуллярная артерия, сопровождающая один из поясничных или 1-й крестцовый корешок,
в) верхняя дополнительная артерия, сопровождающая один из грудных корешков,
г) рассыпной тип питания СМ (три и более передних радикуломедуллярных артерии).
Как в варианте а, так и в варианте в, нижняя половина СМ снабжается только одной артерией Адамкевича. Повреждение данной артерии, компрессия ее эпидуральной гематомой или эпидуральным абсцессом способны вызвать тяжкие и необратимые неврологические последствия.
От СМ кровь оттекает через извилистое венозное сплетение, которое также располагается в мягкой оболочке и состоит из шести продольно ориентированных сосудов. Это сплетение сообщается с внутренним позвоночным сплетением ЭП из которого кровь оттекает через межпозвонковые вены в системы непарной и полунепарной вен.
Вся венозная система ЭП не имеет клапанов, поэтому она может служить дополнительной системой оттока венозной крови, например, у беременных при аорто-кавальной компрессии. Переполнение кровью эпидуральных вен повышает риск их повреждения при пункции и катетеризации ЭП, в том числе увеличивается вероятность случайного внутрисосудистого введения местных анестетиков.
Спинномозговая жидкость
Спинной мозг омывается СМЖ, которая играет амортизирующую роль, защищая его от травм. СМЖ представляет собой ультрафильтрат крови (прозрачная бесцветная жидкость), который образуется хориоидальным сплетением в боковом, третьем и четвертом желудочках головного мозга. Скорость продукции СМЖ составляет около 500 мл в день, поэтому даже потеря ее значительного объема быстро компенсируется.
СМЖ содержит протеины и электролиты (в основном Na+ и Cl-) и при 37° С имеет удельный вес 1,003-1,009.
Арахноидальные (пахионовы) грануляции, расположенные в венозных синусах головного мозга, дренируют большую часть СМЖ. Скорость абсорбции СМЖ зависит от давления в СП. Когда это давление превышает давление в венозном синусе, открываются тонкие трубочки в пахионовых грануляциях, которые пропускают СМЖ в синус. После того как давление выравнивается, просвет трубочек закрывается. Таким образом, имеет место медленная циркуляция СМЖ из желудочков в СП и далее, в венозные синусы. Небольшая часть СМЖ абсорбируется венами СП и лимфатическими сосудами, поэтому в позвоночном субарахноидальном пространстве происходит некоторая локальная циркуляция СМЖ. Абсорбция СМЖ эквивалентна ее продукции, поэтому общий объем СМЖ обычно находится в пределах 130-150 мл.
Возможны индивидуальные различия объема СМЖ в люмбосакральных отделах спинального канала, которые могут оказывать влияние на распределение МА. Исследования при помощи ЯМР выявили вариабельность объемов СМЖ люмбосакрального отдела в объемах от 42 до 81 мл (Carpenter R., 1998). Интересно отметить, что люди с избыточным весом имеют меньший объем СМЖ. Наблюдается отчетливая корреляция между объемом СМЖ и эффектом спинальной анестезии, в частности, максимальной распространенностью блока и скоростью его регрессии.
Корешки спинного мозга и спинномозговые нервы
Каждый нерв образуется за счет соединения переднего и заднего корешка СМ. Задние корешки имеют утолщения — ганглии задних корешков, которые содержат тела нервных клеток соматических и вегетативных сенсорных нервов. Передние и задние корешки по отдельности проходят латерально через паутинную и ТМО прежде, чем объединиться на уровне межпозвоночных отверстий, формируя смешанные спинномозговые нервы. Всего существует 31 пара спинномозговых нервов: 8 шейных, 12 грудных, 5 поясничных, 5 крестцовых и одна копчиковая.
СМ растет медленнее позвоночного столба, поэтому он короче позвоночника. В результате этого сегменты и позвонки не находятся в одной горизонтальной плоскости. Поскольку сегменты СМ короче соответствующих позвонков, то в направлении от шейных сегментов к крестцовым постепенно увеличивается расстояние, которое необходимо преодолеть спинномозговому нерву, чтобы достичь «своего» межпозвоночного отверстия. На уровне крестца это расстояние составляет 10-12 см. Поэтому нижние поясничные корешки удлиняются и загибаются каудально, формируя вместе с крестцовыми и копчиковыми корешками конский хвост.
В пределах субарахноидального пространства корешки покрыты только слоем мягкой мозговой оболочки. Это является отличием от ЭП, где они становятся большими смешанными нервами со значительным количеством соединительной ткани как внутри, так и снаружи нерва. Это обстоятельство является объяснением того, что для спинальной анестезии требуются намного меньшие дозы местного анестетика, в сравнении с таковыми для эпидуральной блокады.
Индивидуальные особенности анатомии спинальных корешков могут определять вариабельность эффектов спинальной и эпидуральной анестезии. Размеры нервных корешков у различных людей могут значительно варьировать. В частности, диаметр корешка L5 может колебаться от 2,3 до 7,7 мм. Задние корешки имеют больший размер по сравнению с передними, но состоят из трабекул, достаточно легко отделимых друг от друга. За счет этого они обладают большей поверхностью соприкосновения и большей проницаемостью для местных анестетиков по сравнению с тонкими и не имеющими трабекулярной структуры передними корешками. Эти анатомические особенности отчасти объясняют более легкое достижение сенсорного блока по сравнению с моторным.
А. М. Овечкин
2012 г.
Что такое эпидуральное пространство позвоночника
Клиническая анатомия позвоночника и спинного мозга
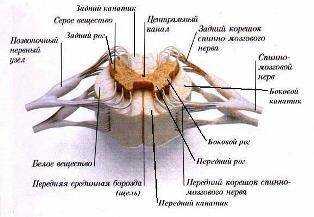 Уважаемые коллеги, предлагаемый вам материал в свое время был подготовлен автором для главы руководства по нейроаксиальной анестезии, которое, в силу ряда причин, не было завершено и не вышло в свет. Мы полагаем, что представленная ниже информация будет интересна не только начинающим анестезиологам, но и опытным специалистам, поскольку она отражает наиболее современные представления об анатомии позвоночника, эпидурального и субарахноидального пространств с точки зрения анестезиолога.
Уважаемые коллеги, предлагаемый вам материал в свое время был подготовлен автором для главы руководства по нейроаксиальной анестезии, которое, в силу ряда причин, не было завершено и не вышло в свет. Мы полагаем, что представленная ниже информация будет интересна не только начинающим анестезиологам, но и опытным специалистам, поскольку она отражает наиболее современные представления об анатомии позвоночника, эпидурального и субарахноидального пространств с точки зрения анестезиолога. Анатомия позвоночника
Как известно, позвоночный столб состоит из 7 шейных, 12 грудных и 5 поясничных позвонков с прилегающими к ним крестцом и копчиком. Он имеет несколько клинически значимых изгибов. Наибольшие изгибы кпереди (лордоз) расположены на уровнях С5 и L4-5, кзади — на уровнях Th5 и S5. Эти анатомические особенности в совокупности с баричностью местных анестетиков играют важную роль в сегментарном распределении уровня спинального блока.
Особенности отдельных позвонков оказывают влияние на технику, в первую очередь, эпидуральной пункции. Остистые отростки отходят под различными углами на разных уровнях позвоночника. В шейном и поясничном отделах они располагаются почти горизонтально по отношению к пластине, что облегчает срединный доступ при перпендикулярном расположении иглы к оси позвоночника. На средне-грудном уровне (Th5-9) остистые отростки отходят под достаточно острыми углами, что делает предпочтительным парамедиальный доступ. Отростки верхних грудных (Th2-4) и нижних грудных (Th20-12) позвонков ориентированы промежуточно по сравнению с двумя вышеуказанными особенностями. На этих уровнях ни один из доступов не имеет преимуществ перед другим.
Доступ к эпидуральному (ЭП) и субарахноидальному пространству (СП) осуществляется между пластинами (интерламинарно). Верхние и нижние суставные отростки формируют фасеточные суставы, которые играют важную роль в правильном размещении пациента перед пункцией ЭП. Правильное расположение пациента перед пункцией ЭП определяется ориентацией фасеточных суставов. Поскольку фасеточные суставы поясничных позвонков ориентированы в сагиттальной плоскости и обеспечивают сгибание вперед-назад, то максимальное сгибание позвоночника (поза эмбриона) увеличивает интерламинарные пространства между поясничными позвонками.
Фасеточные суставы грудных позвонков ориентированы горизонтально и обеспечивают ротационные движения позвоночника. Следовательно, избыточное сгибание позвоночника не дает дополнительных преимуществ при пункции ЭП на грудном уровне.
Анатомические костные ориентиры
Идентификация необходимого межпозвонкового промежутка является залогом успеха эпидуральной и спинальной анестезии, а также необходимым условием безопасности пациента.
В клинических условиях выбор уровня пункции осуществляется анестезиологом посредством пальпации с целью выявления определенных костных ориентиров. Известно, что 7-й шейный позвонок имеет наиболее выраженный остистый отросток. В то же время необходимо учитывать, что у пациентов со сколиозом наиболее выступающим может быть остистый отросток 1-го грудного позвонка (примерно у ⅓ пациентов).
Линия, соединяющая нижние углы лопаток, проходит через остистый отросток 7-го грудного позвонка, а линия, соединяющая гребни подвздошных костей (линия Тюффье), проходит через 4-й поясничный позвонок (L4).
Идентификация необходимого межпозвонкового промежутка при помощи костных ориентиров далеко не всегда является корректной. Известны результаты исследования Broadbent и соавт. (2000), в котором один из анестезиологов при помощи маркера отмечал определенный межпозвонковый промежуток на поясничном уровне и пытался идентифицировать его уровень в положении больного сидя, второй совершал ту же попытку в положении пациента на боку. Затем над сделанной отметкой прикрепляли контрастный маркер и проводили магнитно-резонансную томографию.
Чаще всего истинный уровень, на котором была сделана отметка, находился от одного до четырех сегментов ниже, по сравнению с теми значениями, которые были указаны анестезиологами, участвовавшими в исследовании. Правильно идентифицировать межпозвонковый промежуток удалось лишь в 29% случаев. Точность определения не зависела от положения пациента, но ухудшалась у пациентов с избыточным весом. Кстати говоря, спинной мозг заканчивался на уровне L1 только у 19% пациентов (у остальных на уровне L2), что создавало угрозу его повреждения при ошибочном выборе высокого уровня пункции. Что затрудняет правильный выбор межпозвонкового промежутка?
Есть данные о том, что линия Тюффье соответствует уровню L4 лишь у 35% людей (Reynolds F., 2000). Для остальных 65% эта линия расположена на уровне от L3-4 до L5-S1.
Необходимо отметить, что ошибка на 1-2 сегмента при выборе уровня пункции эпидурального пространства, как правило, не сказывается на эффективности эпидуральной анестезии и анальгезии.
Связки позвоночника
По передней поверхности тел позвонков от черепа до крестца проходит передняя продольная связка, которая жестко фиксирована к межпозвонковым дискам и краям тел позвонков. Задняя продольная связка соединяет задние поверхности тел позвонков и образует переднюю стенку позвоночного канала.
Пластины позвонков соединяются желтой связкой, а задние остистые отростки — межостистыми связками. По наружной поверхности остистых отростков C7-S1 проходит надостистая связка. Ножки позвонков не соединены связками, в результате образуются межпозвонковые отверстия, через которые выходят спинномозговые нервы.
Желтая связка состоит из двух листков, сращенных по средней линии под острым углом. В связи с этим она как бы натянута в виде «тента». В шейном и грудном отделах желтая связка может быть не сращена по средней линии, что вызывает проблемы при идентификации ЭП по тесту потери сопротивления. Желтая связка тоньше по средней линии (2-3 мм) и толще по краям (5-6 мм). В целом она имеет наибольшую толщину и плотность на поясничном (5-6 мм) и грудном уровнях (3-6 мм), и наименьшую в шейном отделе (1,53 мм). Вместе с дужками позвонков желтая связка формирует заднюю стенку позвоночного канала.
При проведении иглы срединным доступом она должна пройти сквозь надостистые и межостистые связки, а затем сквозь желтую связку. При парамедиальном доступе игла минует надостистую и межостистую связки, сразу достигая желтой связки. Желтая связка плотнее других (на 80% состоит из эластических волокон), поэтому возрастание сопротивления при прохождении ее иглой, с последующей его потерей, как известно, используют для идентификации ЭП.
Расстояние между желтой связкой и твердой мозговой оболочкой в поясничном отделе не превышает 5-6 мм и зависит от таких факторов, как артериальное и венозное давление, давление в спинномозговом канале, давление в брюшной полости (беременность, абдоминальный компартмент-синдром и т. д.) и полости грудной клетки (ИВЛ).
С возрастом желтая связка уплотняется (оссифицируется), что затрудняет проведение через нее иглы. Данный процесс наиболее выражен на уровне нижних грудных сегментов.
Оболочки спинного мозга
Спинномозговой канал имеет три соединительно-тканных оболочки, защищающих спинной мозг: твердую мозговую оболочку, паутинную (арахноидальную) оболочку и мягкую мозговую оболочку. Эти оболочки участвуют в формировании трех пространств: эпидурального, субдурального и субарахноидального. Непосредственно спинной мозг (СМ) и корешки укрывает хорошо васкуляризированная мягкая мозговая оболочка, субарахноидальное пространство ограничено двумя прилегающими друг к другу оболочками — паутинной и твердой мозговой.
Все три оболочки СМ продолжаются и в латеральном направлении, формируя соединительнотканное покрытие спинномозговых корешков и смешанных спинномозговых нервов (эндоневрий, периневрий и эпиневрий). Субарахноидальное пространство тоже на коротком протяжении распространяется вдоль корешков и спинномозговых нервов, заканчиваясь на уровне межпозвонковых отверстий.
В отдельных случаях манжеты, образованные твердой мозговой оболочкой, удлиняются на сантиметр и более (в редких случаях на 6-7 см) вдоль смешанных спинномозговых нервов и значительно выходят за пределы межпозвонковых отверстий. Этот факт необходимо учитывать при выполнении блокады плечевого сплетения из надключичных доступов, поскольку в этих случаях даже при правильной ориентации иглы возможно интратекальное введение местного анестетика с развитием тотального спинального блока.
Твердая мозговая оболочка (ТМО) представляет собой листок соединительной ткани, состоящей из коллагеновых волокон, ориентированных как поперечно, так и продольно, а также некоторого количества эластических волокон, ориентированных в продольном направлении.
На протяжении длительного времени считали, что волокна ТМО имеют преимущественно продольную ориентацию. В связи с этим рекомендовали при пункции субарахноидального пространства ориентировать срез спинальной иглы с режущим кончиком вертикально, чтобы он не пересекал волокна, а как бы их раздвигал. Позднее при помощи электронной микроскопии выявили достаточно беспорядочное расположение волокон ТМО — продольное, поперечное и частично циркулярное. Толщина ТМО вариабельна (от 0,5 до 2 мм) и может отличаться на разных уровнях у одного и того же пациента. Чем толще ТМО, тем выше ее способность к ретракции (стягиванию) дефекта.
ТМО, наиболее толстая из всех оболочек СМ, на протяжении длительного времени рассматривалась как наиболее значимый барьер между ЭП и подлежащими тканями. В действительности это не так. Экспериментальные исследования с морфином и альфентанилом, выполненные на животных, показали, что ТМО является наиболее проницаемой оболочкой СМ (Bernards C., Hill H., 1990).
Ложное умозаключение о ведущей барьерной функции ТМО на пути диффузии привело к неправильной трактовке ее роли в генезе постпункционной головной боли (ППГБ). Если предположить, что ППГБ обусловлена подтеканием спинномозговой жидкости (СМЖ) через пункционный дефект в оболочках СМ, мы должны сделать правильный вывод о том, какая из них ответственна за эту утечку.
Поскольку СМЖ находится под паутинной оболочкой, то именно дефект этой оболочки, а не ТМО играет роль в механизмах ППГБ. В настоящее время нет доказательных данных, свидетельствующих о том, что именно дефект оболочек СМ, а значит его форма и размер, а также скорость потерь СМЖ (а значит, размер и форма кончика иглы) оказывают влияние на развитие ППГБ.
Это вовсе не означает, что некорректными являются клинические наблюдения, свидетельствующие, что использование тонких игл, игл типа «pencil-point», а также вертикальная ориентация среза игл типа Quincke снижают частоту ППГБ. Однако некорректны объяснения данного эффекта, в частности, утверждения, что при вертикальной ориентации среза игла не пересекает волокна ТМО, а «раздвигает» их. Данные заявления полностью игнорируют современные представления об анатомии ТМО, состоящей из беспорядочно расположенных волокон, а не ориентированных вертикально. В то же время клетки паутинной оболочки имеют цефало-каудальную ориентацию. В связи с этим при продольной ориентации среза игла оставляет в ней узкое щелевидное отверстие, повреждая меньшее количество клеток, чем при перпендикулярной ориентации. Однако это только предположение, требующее серьезных экспериментальных подтверждений.
Паутинная оболочка
Паутинная оболочка состоит из расположенных в одной плоскости и перекрывающих друг друга 6-8 слоев плоских эпителиально-подобных клеток, плотно соединенных между собой и имеющих продольную ориентацию. Паутинная оболочка является не просто пассивным резервуаром для СМЖ, она активно участвует в транспорте различных веществ.
Не так давно было установлено, что в паутинной оболочке вырабатываются метаболические энзимы, которые могут оказывать воздействие на метаболизм отдельных веществ (например, адреналина) и нейротрансмиттеры (ацетилхолин), имеющие значение для реализации механизмов спинальной анестезии. Активный транспорт веществ через паутинную оболочку осуществляется в области манжет спинномозговых корешков. Здесь происходит одностороннее перемещение веществ из СМЖ в ЭП, что увеличивает клиренс введенных в СП местных анестетиков. Пластинчатое строение паутинной оболочки способствует ее легкому отделению от ТМО при спинальной пункции.
Тонкая паутинная оболочка, на самом деле, обеспечивает более 90% резистентности на пути диффузии препаратов из ЭП в СМЖ. Дело в том, что дистанция между беспорядочно ориентированными коллагеновыми волокнами ТМО достаточно велика для того, чтобы создавать барьер на пути молекул лекарственных средств. Клеточная архитектоника паутинной оболочки, напротив, обеспечивает наибольшее препятствие диффузии и объясняет тот факт, что СМЖ находится в субарахноидальном пространстве, но отсутствует в субдуральном.
Осознание роли паутинной оболочки, как основного барьера на пути диффузии из ЭП в СМЖ, позволяет по-новому взглянуть на зависимость диффузионной способности препаратов от их способности растворяться в жирах. Традиционно принято считать, что более липофильные препараты характеризуются большей диффузионной способностью. На этом основаны рекомендации предпочтительного использования для ЭА липофильных опиоидов (фентанил), обеспечивающих быстро развивающуюся сегментарную анальгезию. В то же время в экспериментальных исследованиях установлено, что проницаемость гидрофильного морфина через оболочки спинного мозга существенно не отличается от таковой фентанила (Bernards C., Hill H., 1992). Установлено, что спустя 60 мин после эпидуральной инъекции 5 мг морфина на уровне L3-4 определяются в ликворе уже на уровне шейных сегментов (Angst M. et al., 2000).
Объяснением этому является тот факт, что диффузия из эпидурального в субарахноидальное пространство осуществляется непосредственно сквозь клетки паутинной оболочки, поскольку межклеточные связи настолько плотны, что исключают возможность проникновения молекул между клетками. В процессе диффузии препарат должен проникнуть в клетку через двойную липидную мембрану, а затем, еще раз преодолев мембрану, попасть в СП. Паутинная оболочка состоит из 6-8 слоев клеток. Таким образом, в процессе диффузии вышеуказанный процесс повторяется 12-16 раз.
Препараты с высокой жирорастворимостью термодинамически более стабильны в двойном липидном слое, чем в водном внутри- или внеклеточном пространстве, в связи с этим, им «труднее» покинуть мембрану клетки и переместиться во внеклеточное пространство. Таким образом, замедляется их диффузия сквозь паутинную оболочку. Препараты с плохой растворимостью в жирах имеют противоположную проблему — они стабильны в водной среде, но с трудом проникают в липидную мембрану, что тоже замедляет их диффузию.
Препараты, с промежуточной способностью растворяться в жирах, в наименьшей степени подвержены вышеуказанным водно-липидным взаимодействиям.
В то же время способность проникать через оболочки СМ не является единственным фактором, определяющим фармакокинетику препаратов, введенных в ЭП. Другим важным фактором (который зачастую игнорируется) является объем их поглощения (секвестрации) жировой клетчаткой ЭП. В частности, установлено, что длительность пребывания опиоидов в ЭП линейно зависит от их способности растворяться в жирах, поскольку эта способность определяет объем секвестрации препарата в жировой клетчатке. За счет этого затрудняется проникновение липофильных опиоидов (фентанил, суфентанил) к СМ. Имеются веские основания полагать, что при непрерывной эпидуральной инфузии этих препаратов анальгетический эффект достигается преимущественно за счет их абсорбции в кровоток и супрасегментарного (центрального) действия. В отличие от этого, при болюсном введении анальгетический эффект фентанила обусловлен в основном его действием на сегментарном уровне.
Таким образом, распространенное представление о том, что препараты с большей способностью растворяться в жирах после эпидурального введения быстрее и проще проникают в СМ, является не совсем корректным.
Эпидуральное пространство
ЭП является частью спинномозгового канала между его наружной стенкой и ТМО, простирается от большого затылочного отверстия до крестцово-копчиковой связки. ТМО прикрепляется к большому затылочному отверстию, а также к 1-му и 2-му шейным позвонкам, в связи с этим растворы, введенные в ЭП, не могут подняться выше этого уровня. ЭП расположено кпереди от пластины, с боков ограничено ножками, а спереди телом позвонка.
- жировую клетчатку,
- спинномозговые нервы, выходящие из спинномозгового канала через межпозвонковые отверстия,
- кровеносные сосуды, питающие позвонки и спинной мозг.
Сосуды ЭП в основном представлены эпидуральными венами, формирующими мощные венозные сплетения с преимущественно продольным расположением сосудов в боковых частях ЭП и множеством анастомотических веточек. ЭП имеет минимальное наполнение в шейном и грудном отделах позвоночника, максимальное — в поясничном отделе, где эпидуральные вены имеют максимальный диаметр.
Описания анатомии ЭП в большинстве руководств по регионарной анестезии представляют жировую клетчатку в виде однородного слоя, прилегающего к ТМО и заполняющего ЭП. Вены ЭП обычно изображают в виде сплошной сети (венозное сплетение Батсона), прилегающей к СМ на всем его протяжении. Хотя еще в 1982 г. были опубликованы данные исследований, выполненных с использованием КТ и контрастирования вен ЭП (Meijenghorst G., 1982). Согласно этим данным, эпидуральные вены располагаются преимущественно в переднем и отчасти в боковых отделах ЭП. Позднее эти сведения были подтверждены в работах Hogan Q. (1991), показавшего, кроме того, что жировая клетчатка в ЭП скомпонована в виде отдельных «пакетов», располагающихся в основном в заднем и боковых отделах ЭП, т. е. не имеет характера сплошного слоя.
Переднезадний размер ЭП прогрессивно сужается с поясничного уровня (5-6 мм) к грудному (3-4 мм) и становится минимальным на уровне С3-6.
В обычных условиях давление в ЭП имеет отрицательное значение. Наиболее низким оно является в шейном и грудном отделах. Увеличение давления в грудной клетке при кашле, пробе Вальсальвы приводит к повышению давления в ЭП. Введение жидкости в ЭП повышает давление в нем, величина этого повышения зависит от скорости и объема введенного раствора. Параллельно увеличивается давление и в СП.
Давление в ЭП становится положительным в поздних сроках беременности за счет повышения внутрибрюшного давления (через межпозвонковые отверстия передается в ЭП) и расширения эпидуральных вен. Уменьшение объема ЭП способствует более широкому распространению местного анестетика.
Непреложным является факт, что препарат, введенный в ЭП, попадает в СМЖ и СМ. Менее изученным является вопрос — каким образом он туда попадает? В ряде руководств по регионарной анестезии описывается латеральное распространение препаратов, введенных в ЭП с последующей их диффузией через манжеты спинномозговых корешков в СМЖ (Cousins M., Bridenbaugh P., 1998).
Данная концепция логически обосновывается несколькими фактами. Во-первых, в манжетах спинномозговых корешков имеются паутинные грануляции (ворсинки), аналогичные таковым в головном мозге. Через эти ворсинки осуществляется секреция СМЖ в субарахноидальное пространство. Во-вторых, еще в конце XIX в. в экспериментальных исследованиях Key и Retzius было установлено, что вещества, введенные в СП животных, позднее обнаруживались в ЭП. В-третьих, было выявлено, что эритроциты удаляются из СМЖ путем пассажа через те же паутинные ворсинки. Эти три факта логически были объединены, и сделан вывод, что молекулы лекарственных веществ, размер которых меньше, чем размер эритроцитов, также могут проникать из ЭП в субарахноидальное через паутинные ворсинки. Этот вывод, конечно, привлекателен, но он является ложным, построен на умозрительных заключениях и не подкреплен ни одним экспериментальным или клиническим исследованием.
Между тем при помощи экспериментальных нейрофизиологических исследований установлено, что транспорт любых веществ через паутинные ворсинки осуществляется путем микропиноцитоза и только в одном направлении — из СМЖ наружу (Yamashima T. et al., 1988 и др.). Если бы это было не так, то любая молекула из венозного кровотока (большинство ворсинок омывается венозной кровью) могла бы легко проникнуть в СМЖ, обходя, таким образом, гематоэнцефалический барьер.
Существует еще одна распространенная теория, объясняющая проникновение препаратов из ЭП в СМ. Согласно этой теории, препараты с высокой способностью растворяться в жирах (а точнее, неионизированные формы их молекул) диффундируют через стенку корешковой артерии, проходящей в ЭП, и с током крови попадают в СМ. Данный механизм также не имеет никаких подтверждающих данных.
В экспериментальных исследованиях на животных изучена скорость проникновения в СМ фентанила, введенного в ЭП, при интактных корешковых артериях и после наложения зажима на аорту, блокирующего кровоток в этих артериях (Bernards S., Sorkin L., 1994). Не выявлено различий в скорости проникновения фентанила в СМ, однако выявлена замедленная элиминацию фентанила из СМ при отсутствии кровотока по корешковым артериям. Таким образом, корешковые артерии играют важную роль лишь в «вымывании» препаратов из СМ. Тем не менее опровергнутая «артериальная» теория транспорта препаратов из ЭП в СМ продолжает упоминаться в специальных руководствах.
Таким образом, в настоящее время экспериментально подтвержден лишь один механизм проникновения лекарственных препаратов из ЭП в СМЖ/СМ — диффузия через оболочки СМ (см. выше).
Новые данные по анатомии эпидурального пространства
Большинство ранних исследований анатомии ЭП были выполнены с помощью введения рентгеноконтрастных растворов или при аутопсии. Во всех этих случаях исследователи сталкивались с искажением нормальных анатомических соотношений, обусловленных смещением компонентов ЭП относительно друг друга.
Интересные данные были получены в последние годы при помощи компьютерной томографии и эпидуроскопической техники, позволяющей изучать функциональную анатомию ЭП в непосредственной связи с техникой эпидуральной анестезии. Например, при помощи компьютерной томографии было подтверждено, что спинальный канал выше поясничного отдела имеет овальную форму, а в нижних сегментах – треугольную.
С помощью 0,7 мм эндоскопа, введенного через иглу Туохи 16G, было установлено, что объем ЭП увеличивается при глубоком дыхании, что может облегчить его катетеризацию (Igarashi, 1999). По данным КТ, жировая ткань преимущественно сконцентрирована под желтой связкой и в области межпозвонковых отверстий. Жировая клетчатка практически полностью отсутствует на уровнях С7-Тh2, при этом твердая оболочка непосредственно соприкасается с желтой связкой. Жир эпидурального пространства скомпонован в ячейки, покрытые тонкой мембраной. На уровне грудных сегментов жир фиксирован к стенке канала только по задней средней линии, а в ряде случаев рыхло прикрепляется к твердой оболочке. Это наблюдение может частично объяснить случаи асимметрического распределения растворов МА.
При отсутствии дегенеративных заболеваний позвоночника, межпозвонковые отверстия обычно открыты, независимо от возраста, что позволяет введенным растворам свободно покидать ЭП.
При помощи магнитно-резонансной томографии были получены новые данные об анатомии каудальной (сакральной) части ЭП. Расчеты, выполненные на костном скелете, свидетельствовали о том, что его средний объем составляет 30 мл (12-65 мл). Исследования, выполненные с применением МРТ, позволили учесть объем ткани, заполняющей каудальное пространство, и установить, что его истинный объем не превышает 14,4 мл (9,5-26,6 мл) (Crighton, 1997). В той же работе было подтверждено, что дуральный мешок заканчивается на уровне средней трети сегмента S2.
Воспалительные заболевания и ранее перенесенные операции искажают нормальную анатомию ЭП.
Субдуральное пространство
С внутренней стороны к ТМО очень близко прилежит паутинная оболочка, которая тем не менее с ней не соединяется. Пространство, образуемое этими оболочками, называют субдуральным.
Термин «субдуральная анестезия» является некорректным и не идентичным термину «субарахноидальная анестезия». Случайное введение анестетика между паутинной и твердой мозговой оболочками может явиться причиной неадекватной спинальной анестезии.
Субарахноидальное пространство
Начинается от большого затылочного отверстия (где переходит в интракраниальное субарахноидальное пространство) и продолжается приблизительно до уровня второго крестцового сегмента, ограничивается паутинной и мягкой мозговой оболочками. Оно включает в себя СМ, спинномозговые корешки и спинномозговую жидкость.
Ширина спинального канала составляет около 25 мм на шейном уровне, на грудном он сужается до 17 мм, на поясничном (L1) расширяется до 22 мм, а еще ниже — до 27 мм. Переднезадний размер на всем протяжении составляет 15-16 мм.
Внутри спинального канала располагаются СМ и конский хвост, СМЖ, а также кровеносные сосуды, питающие СМ. Окончание СМ (conus medullaris) находится на уровне L1-2. Ниже конуса СМ трансформируется в пучок нервных корешков (конский хвост), свободно «плавающих» в СМЖ в пределах дурального мешка. В настоящее время рекомендуется осуществлять пункцию субарахноидального пространства в межпозвонковом промежутке L3-4, чтобы снизить до минимума вероятность травмы иглой СМ. Корешки конского хвоста достаточно мобильны, и опасность их травмирования иглой крайне мала.
Спинной мозг
Располагается на протяжении от большого затылочного отверстия до верхнего края второго (очень редко третьего) поясничного позвонка. Его средняя протяженность составляет 45 см. У большинства людей СМ заканчивается на уровне L2, в редких случаях достигая нижнего края 3-го поясничного позвонка.
Кровоснабжение спинного мозга
СМ снабжается спинальными ветвями позвоночной, глубокой шейной, межреберных и поясничной артерий. Передние корешковые артерии входят в спинной мозг поочередно — то справа, то слева (чаще слева). Задние спинальные артерии являются ориентированными вверх и вниз продолжениями задних корешковых артерий. Ветви задних спинальных артерий соединяются анастомозами с аналогичными ветвями передней спинальной артерии, образуя многочисленные сосудистые сплетения в мягкой мозговой оболочке (пиальную сосудистую сеть).
Тип кровоснабжения СМ зависит от уровня вхождения в спинномозговой канал самой большой по диаметру корешковой (радикуломедулярной) артерии — так называемой артерии Адамкевича. Возможны различные анатомические варианты кровоснабжения СМ, в том числе такой, при котором все сегменты ниже Th3-3 питаются из одной артерии Адамкевича (вариант а, около 21% всех людей).
В других случаях возможны:
б) нижняя дополнительная радикуломедуллярная артерия, сопровождающая один из поясничных или 1-й крестцовый корешок,
в) верхняя дополнительная артерия, сопровождающая один из грудных корешков,
г) рассыпной тип питания СМ (три и более передних радикуломедуллярных артерии).
Как в варианте а, так и в варианте в, нижняя половина СМ снабжается только одной артерией Адамкевича. Повреждение данной артерии, компрессия ее эпидуральной гематомой или эпидуральным абсцессом способны вызвать тяжкие и необратимые неврологические последствия.
От СМ кровь оттекает через извилистое венозное сплетение, которое также располагается в мягкой оболочке и состоит из шести продольно ориентированных сосудов. Это сплетение сообщается с внутренним позвоночным сплетением ЭП из которого кровь оттекает через межпозвонковые вены в системы непарной и полунепарной вен.
Вся венозная система ЭП не имеет клапанов, поэтому она может служить дополнительной системой оттока венозной крови, например, у беременных при аорто-кавальной компрессии. Переполнение кровью эпидуральных вен повышает риск их повреждения при пункции и катетеризации ЭП, в том числе увеличивается вероятность случайного внутрисосудистого введения местных анестетиков.
Спинномозговая жидкость
Спинной мозг омывается СМЖ, которая играет амортизирующую роль, защищая его от травм. СМЖ представляет собой ультрафильтрат крови (прозрачная бесцветная жидкость), который образуется хориоидальным сплетением в боковом, третьем и четвертом желудочках головного мозга. Скорость продукции СМЖ составляет около 500 мл в день, поэтому даже потеря ее значительного объема быстро компенсируется.
СМЖ содержит протеины и электролиты (в основном Na+ и Cl-) и при 37° С имеет удельный вес 1,003-1,009.
Арахноидальные (пахионовы) грануляции, расположенные в венозных синусах головного мозга, дренируют большую часть СМЖ. Скорость абсорбции СМЖ зависит от давления в СП. Когда это давление превышает давление в венозном синусе, открываются тонкие трубочки в пахионовых грануляциях, которые пропускают СМЖ в синус. После того как давление выравнивается, просвет трубочек закрывается. Таким образом, имеет место медленная циркуляция СМЖ из желудочков в СП и далее, в венозные синусы. Небольшая часть СМЖ абсорбируется венами СП и лимфатическими сосудами, поэтому в позвоночном субарахноидальном пространстве происходит некоторая локальная циркуляция СМЖ. Абсорбция СМЖ эквивалентна ее продукции, поэтому общий объем СМЖ обычно находится в пределах 130-150 мл.
Возможны индивидуальные различия объема СМЖ в люмбосакральных отделах спинального канала, которые могут оказывать влияние на распределение МА. Исследования при помощи ЯМР выявили вариабельность объемов СМЖ люмбосакрального отдела в объемах от 42 до 81 мл (Carpenter R., 1998). Интересно отметить, что люди с избыточным весом имеют меньший объем СМЖ. Наблюдается отчетливая корреляция между объемом СМЖ и эффектом спинальной анестезии, в частности, максимальной распространенностью блока и скоростью его регрессии.
Корешки спинного мозга и спинномозговые нервы
Каждый нерв образуется за счет соединения переднего и заднего корешка СМ. Задние корешки имеют утолщения — ганглии задних корешков, которые содержат тела нервных клеток соматических и вегетативных сенсорных нервов. Передние и задние корешки по отдельности проходят латерально через паутинную и ТМО прежде, чем объединиться на уровне межпозвоночных отверстий, формируя смешанные спинномозговые нервы. Всего существует 31 пара спинномозговых нервов: 8 шейных, 12 грудных, 5 поясничных, 5 крестцовых и одна копчиковая.
СМ растет медленнее позвоночного столба, поэтому он короче позвоночника. В результате этого сегменты и позвонки не находятся в одной горизонтальной плоскости. Поскольку сегменты СМ короче соответствующих позвонков, то в направлении от шейных сегментов к крестцовым постепенно увеличивается расстояние, которое необходимо преодолеть спинномозговому нерву, чтобы достичь «своего» межпозвоночного отверстия. На уровне крестца это расстояние составляет 10-12 см. Поэтому нижние поясничные корешки удлиняются и загибаются каудально, формируя вместе с крестцовыми и копчиковыми корешками конский хвост.
В пределах субарахноидального пространства корешки покрыты только слоем мягкой мозговой оболочки. Это является отличием от ЭП, где они становятся большими смешанными нервами со значительным количеством соединительной ткани как внутри, так и снаружи нерва. Это обстоятельство является объяснением того, что для спинальной анестезии требуются намного меньшие дозы местного анестетика, в сравнении с таковыми для эпидуральной блокады.
Индивидуальные особенности анатомии спинальных корешков могут определять вариабельность эффектов спинальной и эпидуральной анестезии. Размеры нервных корешков у различных людей могут значительно варьировать. В частности, диаметр корешка L5 может колебаться от 2,3 до 7,7 мм. Задние корешки имеют больший размер по сравнению с передними, но состоят из трабекул, достаточно легко отделимых друг от друга. За счет этого они обладают большей поверхностью соприкосновения и большей проницаемостью для местных анестетиков по сравнению с тонкими и не имеющими трабекулярной структуры передними корешками. Эти анатомические особенности отчасти объясняют более легкое достижение сенсорного блока по сравнению с моторным.
источник
Что такое эпидуральное пространство позвоночника
В переднем эпидуральном пространстве задняя продольная связка не фиксирована на всем протяжении позвоночного столба, а прикрепляется только к фиброзному кольцу межпозвоночных дисков. В передних отделах твердая мозговая оболочка достаточно плотно спаяна с задней продольной связкой и образуемое переднее эпидуральное пространство находится между задней продольной связкой и передней поверхностью твердой мозговой оболочки с одной стороны и периостом тел позвонков — с другой.
Таким образом, оно разделено на вертикальные отделы на каждом уровне позвонка. Кроме этого, в большинстве случаев оно еще разделяется на две латеральные половины.
В нижнем поясничном отделе, начиная с уровня L4-L5, размеры дурального мешка постепенно уменьшаются, поэтому передняя поверхность твердой мозговой оболочки спинного мозга и задняя продольная связка постепенно расходятся, и это пространство заполняется жировой клетчаткой, количество которой постепенно увеличивается в каудальном направлении.
В передних отделах эпидурального пространства располагается хорошо выраженное венозное сплетение, которое на уровне Th20-L2 принимает базилярно-позвоночные вены, идущие вглубь тела позвонков. Эпидуральные вены — бесклапанные сосуды, соединяющиеся в краниальном направлении с синусами головного мозга, каудально — с подвздошными венами посредством крестцового венозного сплетения, а также с брюшными и грудными венами.
Наличие прямого сообщения эпидуральных вен с синусами головного мозга может быть причиной попадания лекарственных препаратов, воздуха, химических веществ непосредственно в головной мозг и сердце. На рисунке схематично представлены венозные сплетения позвоночника.
В задних отделах эпидуральная клетчатка под желтой связкой распространяется на пластины позвонков и в этих местах ограничивает прилегание твердой мозговой оболочки и периоста пластин позвонков. Такие анатомические особенности заднего отдела эпидурального пространства могут быть причиной скручивания дистального конца эндоскопа и затруднять его дальнейшее продвижение при эпидуроскопии. Ширина заднего эпидурального пространства в поясничном отделе в переднезаднем направлении по средней линии порядка 5-6 мм.
В грудном отделе размеры его несколько меньше, чем в поясничном, но здесь оно становится непрерывным. Тонкий слой эпидуральной клетчатки распространяется между пластинами позвонков и твердой мозговой оболочкой. Эндоскоп, продвигаемый в грудном отделе эпидурального пространства, обычно идет легко, не встречая препятствий на своем пути.
В каудальном направлении клетчатка постепенно истончается и в верхнегрудном и нижнешейном отделах она уже практически отсутствует. Твердая мозговая оболочка тесно прилежит к периосту пластин позвонков.
Рыхлая жировая клетчатка покрыта тонкой и гладкой капсулой. Жировая ткань в эпидуральном пространстве лежит достаточно свободно, однако, в некоторых случаях, может быть плотно фиксирована к твердой мозговой оболочке и нервным корешкам.
В латеральном отделе эпидурального пространства, которое имеет свободное сообщение с паравертебральным пространством через межпозвоночное отверстие, располагаются корешки и сопровождающие их сосуды, окруженные жировой тканью. Наличие вышеописанного сообщения с паравертебральным пространством имеет практическое значение, так как через него происходит «естественная потеря» введенных эпидурально лекарственных веществ.
При развитии дегенеративно-дистрофических процессов, сопровождающихся сужением межпозвоночного отверстия, и с возрастом «потери» будут уменьшаться, что надо учитывать при проведении эпидуроскопии с введением лекарств.
Все три оболочки спинного мозга сопровождают корешки нервов в направлении межпозвоночного отверстия, где твердая мозговая оболочка постепенно истончаясь, соединяется с периневрием спинномозгового нерва и окружающей его жировой клетчаткой.
Наличие достаточно выраженной жировой ткани в эпидуральном пространстве обеспечивает высокую адсорбцию введенных медикаментов и различных химических веществ. Этим объясняется продолжительный период действия лекарственных препаратов, введенных эпидурально.
источник
Эпидуральное пространство позвоночника это
Клиническая анатомия позвоночника и спинного мозга
 Уважаемые коллеги, предлагаемый вам материал в свое время был подготовлен автором для главы руководства по нейроаксиальной анестезии, которое, в силу ряда причин, не было завершено и не вышло в свет. Мы полагаем, что представленная ниже информация будет интересна не только начинающим анестезиологам, но и опытным специалистам, поскольку она отражает наиболее современные представления об анатомии позвоночника, эпидурального и субарахноидального пространств с точки зрения анестезиолога.
Уважаемые коллеги, предлагаемый вам материал в свое время был подготовлен автором для главы руководства по нейроаксиальной анестезии, которое, в силу ряда причин, не было завершено и не вышло в свет. Мы полагаем, что представленная ниже информация будет интересна не только начинающим анестезиологам, но и опытным специалистам, поскольку она отражает наиболее современные представления об анатомии позвоночника, эпидурального и субарахноидального пространств с точки зрения анестезиолога. Анатомия позвоночника
Как известно, позвоночный столб состоит из 7 шейных, 12 грудных и 5 поясничных позвонков с прилегающими к ним крестцом и копчиком. Он имеет несколько клинически значимых изгибов. Наибольшие изгибы кпереди (лордоз) расположены на уровнях С5 и L4-5, кзади — на уровнях Th5 и S5. Эти анатомические особенности в совокупности с баричностью местных анестетиков играют важную роль в сегментарном распределении уровня спинального блока.
Особенности отдельных позвонков оказывают влияние на технику, в первую очередь, эпидуральной пункции. Остистые отростки отходят под различными углами на разных уровнях позвоночника. В шейном и поясничном отделах они располагаются почти горизонтально по отношению к пластине, что облегчает срединный доступ при перпендикулярном расположении иглы к оси позвоночника. На средне-грудном уровне (Th5-9) остистые отростки отходят под достаточно острыми углами, что делает предпочтительным парамедиальный доступ. Отростки верхних грудных (Th2-4) и нижних грудных (Th20-12) позвонков ориентированы промежуточно по сравнению с двумя вышеуказанными особенностями. На этих уровнях ни один из доступов не имеет преимуществ перед другим.
Доступ к эпидуральному (ЭП) и субарахноидальному пространству (СП) осуществляется между пластинами (интерламинарно). Верхние и нижние суставные отростки формируют фасеточные суставы, которые играют важную роль в правильном размещении пациента перед пункцией ЭП. Правильное расположение пациента перед пункцией ЭП определяется ориентацией фасеточных суставов. Поскольку фасеточные суставы поясничных позвонков ориентированы в сагиттальной плоскости и обеспечивают сгибание вперед-назад, то максимальное сгибание позвоночника (поза эмбриона) увеличивает интерламинарные пространства между поясничными позвонками.
Фасеточные суставы грудных позвонков ориентированы горизонтально и обеспечивают ротационные движения позвоночника. Следовательно, избыточное сгибание позвоночника не дает дополнительных преимуществ при пункции ЭП на грудном уровне.
Анатомические костные ориентиры
Идентификация необходимого межпозвонкового промежутка является залогом успеха эпидуральной и спинальной анестезии, а также необходимым условием безопасности пациента.
В клинических условиях выбор уровня пункции осуществляется анестезиологом посредством пальпации с целью выявления определенных костных ориентиров. Известно, что 7-й шейный позвонок имеет наиболее выраженный остистый отросток. В то же время необходимо учитывать, что у пациентов со сколиозом наиболее выступающим может быть остистый отросток 1-го грудного позвонка (примерно у ⅓ пациентов).
Линия, соединяющая нижние углы лопаток, проходит через остистый отросток 7-го грудного позвонка, а линия, соединяющая гребни подвздошных костей (линия Тюффье), проходит через 4-й поясничный позвонок (L4).
Идентификация необходимого межпозвонкового промежутка при помощи костных ориентиров далеко не всегда является корректной. Известны результаты исследования Broadbent и соавт. (2000), в котором один из анестезиологов при помощи маркера отмечал определенный межпозвонковый промежуток на поясничном уровне и пытался идентифицировать его уровень в положении больного сидя, второй совершал ту же попытку в положении пациента на боку. Затем над сделанной отметкой прикрепляли контрастный маркер и проводили магнитно-резонансную томографию.
Чаще всего истинный уровень, на котором была сделана отметка, находился от одного до четырех сегментов ниже, по сравнению с теми значениями, которые были указаны анестезиологами, участвовавшими в исследовании. Правильно идентифицировать межпозвонковый промежуток удалось лишь в 29% случаев. Точность определения не зависела от положения пациента, но ухудшалась у пациентов с избыточным весом. Кстати говоря, спинной мозг заканчивался на уровне L1 только у 19% пациентов (у остальных на уровне L2), что создавало угрозу его повреждения при ошибочном выборе высокого уровня пункции. Что затрудняет правильный выбор межпозвонкового промежутка?
Есть данные о том, что линия Тюффье соответствует уровню L4 лишь у 35% людей (Reynolds F., 2000). Для остальных 65% эта линия расположена на уровне от L3-4 до L5-S1.
Необходимо отметить, что ошибка на 1-2 сегмента при выборе уровня пункции эпидурального пространства, как правило, не сказывается на эффективности эпидуральной анестезии и анальгезии.
Связки позвоночника
По передней поверхности тел позвонков от черепа до крестца проходит передняя продольная связка, которая жестко фиксирована к межпозвонковым дискам и краям тел позвонков. Задняя продольная связка соединяет задние поверхности тел позвонков и образует переднюю стенку позвоночного канала.
Пластины позвонков соединяются желтой связкой, а задние остистые отростки — межостистыми связками. По наружной поверхности остистых отростков C7-S1 проходит надостистая связка. Ножки позвонков не соединены связками, в результате образуются межпозвонковые отверстия, через которые выходят спинномозговые нервы.
Желтая связка состоит из двух листков, сращенных по средней линии под острым углом. В связи с этим она как бы натянута в виде «тента». В шейном и грудном отделах желтая связка может быть не сращена по средней линии, что вызывает проблемы при идентификации ЭП по тесту потери сопротивления. Желтая связка тоньше по средней линии (2-3 мм) и толще по краям (5-6 мм). В целом она имеет наибольшую толщину и плотность на поясничном (5-6 мм) и грудном уровнях (3-6 мм), и наименьшую в шейном отделе (1,53 мм). Вместе с дужками позвонков желтая связка формирует заднюю стенку позвоночного канала.
При проведении иглы срединным доступом она должна пройти сквозь надостистые и межостистые связки, а затем сквозь желтую связку. При парамедиальном доступе игла минует надостистую и межостистую связки, сразу достигая желтой связки. Желтая связка плотнее других (на 80% состоит из эластических волокон), поэтому возрастание сопротивления при прохождении ее иглой, с последующей его потерей, как известно, используют для идентификации ЭП.
Расстояние между желтой связкой и твердой мозговой оболочкой в поясничном отделе не превышает 5-6 мм и зависит от таких факторов, как артериальное и венозное давление, давление в спинномозговом канале, давление в брюшной полости (беременность, абдоминальный компартмент-синдром и т. д.) и полости грудной клетки (ИВЛ).
С возрастом желтая связка уплотняется (оссифицируется), что затрудняет проведение через нее иглы. Данный процесс наиболее выражен на уровне нижних грудных сегментов.
Оболочки спинного мозга
Спинномозговой канал имеет три соединительно-тканных оболочки, защищающих спинной мозг: твердую мозговую оболочку, паутинную (арахноидальную) оболочку и мягкую мозговую оболочку. Эти оболочки участвуют в формировании трех пространств: эпидурального, субдурального и субарахноидального. Непосредственно спинной мозг (СМ) и корешки укрывает хорошо васкуляризированная мягкая мозговая оболочка, субарахноидальное пространство ограничено двумя прилегающими друг к другу оболочками — паутинной и твердой мозговой.
Все три оболочки СМ продолжаются и в латеральном направлении, формируя соединительнотканное покрытие спинномозговых корешков и смешанных спинномозговых нервов (эндоневрий, периневрий и эпиневрий). Субарахноидальное пространство тоже на коротком протяжении распространяется вдоль корешков и спинномозговых нервов, заканчиваясь на уровне межпозвонковых отверстий.
В отдельных случаях манжеты, образованные твердой мозговой оболочкой, удлиняются на сантиметр и более (в редких случаях на 6-7 см) вдоль смешанных спинномозговых нервов и значительно выходят за пределы межпозвонковых отверстий. Этот факт необходимо учитывать при выполнении блокады плечевого сплетения из надключичных доступов, поскольку в этих случаях даже при правильной ориентации иглы возможно интратекальное введение местного анестетика с развитием тотального спинального блока.
Твердая мозговая оболочка (ТМО) представляет собой листок соединительной ткани, состоящей из коллагеновых волокон, ориентированных как поперечно, так и продольно, а также некоторого количества эластических волокон, ориентированных в продольном направлении.
На протяжении длительного времени считали, что волокна ТМО имеют преимущественно продольную ориентацию. В связи с этим рекомендовали при пункции субарахноидального пространства ориентировать срез спинальной иглы с режущим кончиком вертикально, чтобы он не пересекал волокна, а как бы их раздвигал. Позднее при помощи электронной микроскопии выявили достаточно беспорядочное расположение волокон ТМО — продольное, поперечное и частично циркулярное. Толщина ТМО вариабельна (от 0,5 до 2 мм) и может отличаться на разных уровнях у одного и того же пациента. Чем толще ТМО, тем выше ее способность к ретракции (стягиванию) дефекта.
ТМО, наиболее толстая из всех оболочек СМ, на протяжении длительного времени рассматривалась как наиболее значимый барьер между ЭП и подлежащими тканями. В действительности это не так. Экспериментальные исследования с морфином и альфентанилом, выполненные на животных, показали, что ТМО является наиболее проницаемой оболочкой СМ (Bernards C., Hill H., 1990).
Ложное умозаключение о ведущей барьерной функции ТМО на пути диффузии привело к неправильной трактовке ее роли в генезе постпункционной головной боли (ППГБ). Если предположить, что ППГБ обусловлена подтеканием спинномозговой жидкости (СМЖ) через пункционный дефект в оболочках СМ, мы должны сделать правильный вывод о том, какая из них ответственна за эту утечку.
Поскольку СМЖ находится под паутинной оболочкой, то именно дефект этой оболочки, а не ТМО играет роль в механизмах ППГБ. В настоящее время нет доказательных данных, свидетельствующих о том, что именно дефект оболочек СМ, а значит его форма и размер, а также скорость потерь СМЖ (а значит, размер и форма кончика иглы) оказывают влияние на развитие ППГБ.
Это вовсе не означает, что некорректными являются клинические наблюдения, свидетельствующие, что использование тонких игл, игл типа «pencil-point», а также вертикальная ориентация среза игл типа Quincke снижают частоту ППГБ. Однако некорректны объяснения данного эффекта, в частности, утверждения, что при вертикальной ориентации среза игла не пересекает волокна ТМО, а «раздвигает» их. Данные заявления полностью игнорируют современные представления об анатомии ТМО, состоящей из беспорядочно расположенных волокон, а не ориентированных вертикально. В то же время клетки паутинной оболочки имеют цефало-каудальную ориентацию. В связи с этим при продольной ориентации среза игла оставляет в ней узкое щелевидное отверстие, повреждая меньшее количество клеток, чем при перпендикулярной ориентации. Однако это только предположение, требующее серьезных экспериментальных подтверждений.
Паутинная оболочка
Паутинная оболочка состоит из расположенных в одной плоскости и перекрывающих друг друга 6-8 слоев плоских эпителиально-подобных клеток, плотно соединенных между собой и имеющих продольную ориентацию. Паутинная оболочка является не просто пассивным резервуаром для СМЖ, она активно участвует в транспорте различных веществ.
Не так давно было установлено, что в паутинной оболочке вырабатываются метаболические энзимы, которые могут оказывать воздействие на метаболизм отдельных веществ (например, адреналина) и нейротрансмиттеры (ацетилхолин), имеющие значение для реализации механизмов спинальной анестезии. Активный транспорт веществ через паутинную оболочку осуществляется в области манжет спинномозговых корешков. Здесь происходит одностороннее перемещение веществ из СМЖ в ЭП, что увеличивает клиренс введенных в СП местных анестетиков. Пластинчатое строение паутинной оболочки способствует ее легкому отделению от ТМО при спинальной пункции.
Тонкая паутинная оболочка, на самом деле, обеспечивает более 90% резистентности на пути диффузии препаратов из ЭП в СМЖ. Дело в том, что дистанция между беспорядочно ориентированными коллагеновыми волокнами ТМО достаточно велика для того, чтобы создавать барьер на пути молекул лекарственных средств. Клеточная архитектоника паутинной оболочки, напротив, обеспечивает наибольшее препятствие диффузии и объясняет тот факт, что СМЖ находится в субарахноидальном пространстве, но отсутствует в субдуральном.
Осознание роли паутинной оболочки, как основного барьера на пути диффузии из ЭП в СМЖ, позволяет по-новому взглянуть на зависимость диффузионной способности препаратов от их способности растворяться в жирах. Традиционно принято считать, что более липофильные препараты характеризуются большей диффузионной способностью. На этом основаны рекомендации предпочтительного использования для ЭА липофильных опиоидов (фентанил), обеспечивающих быстро развивающуюся сегментарную анальгезию. В то же время в экспериментальных исследованиях установлено, что проницаемость гидрофильного морфина через оболочки спинного мозга существенно не отличается от таковой фентанила (Bernards C., Hill H., 1992). Установлено, что спустя 60 мин после эпидуральной инъекции 5 мг морфина на уровне L3-4 определяются в ликворе уже на уровне шейных сегментов (Angst M. et al., 2000).
Объяснением этому является тот факт, что диффузия из эпидурального в субарахноидальное пространство осуществляется непосредственно сквозь клетки паутинной оболочки, поскольку межклеточные связи настолько плотны, что исключают возможность проникновения молекул между клетками. В процессе диффузии препарат должен проникнуть в клетку через двойную липидную мембрану, а затем, еще раз преодолев мембрану, попасть в СП. Паутинная оболочка состоит из 6-8 слоев клеток. Таким образом, в процессе диффузии вышеуказанный процесс повторяется 12-16 раз.
Препараты с высокой жирорастворимостью термодинамически более стабильны в двойном липидном слое, чем в водном внутри- или внеклеточном пространстве, в связи с этим, им «труднее» покинуть мембрану клетки и переместиться во внеклеточное пространство. Таким образом, замедляется их диффузия сквозь паутинную оболочку. Препараты с плохой растворимостью в жирах имеют противоположную проблему — они стабильны в водной среде, но с трудом проникают в липидную мембрану, что тоже замедляет их диффузию.
Препараты, с промежуточной способностью растворяться в жирах, в наименьшей степени подвержены вышеуказанным водно-липидным взаимодействиям.
В то же время способность проникать через оболочки СМ не является единственным фактором, определяющим фармакокинетику препаратов, введенных в ЭП. Другим важным фактором (который зачастую игнорируется) является объем их поглощения (секвестрации) жировой клетчаткой ЭП. В частности, установлено, что длительность пребывания опиоидов в ЭП линейно зависит от их способности растворяться в жирах, поскольку эта способность определяет объем секвестрации препарата в жировой клетчатке. За счет этого затрудняется проникновение липофильных опиоидов (фентанил, суфентанил) к СМ. Имеются веские основания полагать, что при непрерывной эпидуральной инфузии этих препаратов анальгетический эффект достигается преимущественно за счет их абсорбции в кровоток и супрасегментарного (центрального) действия. В отличие от этого, при болюсном введении анальгетический эффект фентанила обусловлен в основном его действием на сегментарном уровне.
Таким образом, распространенное представление о том, что препараты с большей способностью растворяться в жирах после эпидурального введения быстрее и проще проникают в СМ, является не совсем корректным.
Эпидуральное пространство
ЭП является частью спинномозгового канала между его наружной стенкой и ТМО, простирается от большого затылочного отверстия до крестцово-копчиковой связки. ТМО прикрепляется к большому затылочному отверстию, а также к 1-му и 2-му шейным позвонкам, в связи с этим растворы, введенные в ЭП, не могут подняться выше этого уровня. ЭП расположено кпереди от пластины, с боков ограничено ножками, а спереди телом позвонка.
- жировую клетчатку,
- спинномозговые нервы, выходящие из спинномозгового канала через межпозвонковые отверстия,
- кровеносные сосуды, питающие позвонки и спинной мозг.
Сосуды ЭП в основном представлены эпидуральными венами, формирующими мощные венозные сплетения с преимущественно продольным расположением сосудов в боковых частях ЭП и множеством анастомотических веточек. ЭП имеет минимальное наполнение в шейном и грудном отделах позвоночника, максимальное — в поясничном отделе, где эпидуральные вены имеют максимальный диаметр.
Описания анатомии ЭП в большинстве руководств по регионарной анестезии представляют жировую клетчатку в виде однородного слоя, прилегающего к ТМО и заполняющего ЭП. Вены ЭП обычно изображают в виде сплошной сети (венозное сплетение Батсона), прилегающей к СМ на всем его протяжении. Хотя еще в 1982 г. были опубликованы данные исследований, выполненных с использованием КТ и контрастирования вен ЭП (Meijenghorst G., 1982). Согласно этим данным, эпидуральные вены располагаются преимущественно в переднем и отчасти в боковых отделах ЭП. Позднее эти сведения были подтверждены в работах Hogan Q. (1991), показавшего, кроме того, что жировая клетчатка в ЭП скомпонована в виде отдельных «пакетов», располагающихся в основном в заднем и боковых отделах ЭП, т. е. не имеет характера сплошного слоя.
Переднезадний размер ЭП прогрессивно сужается с поясничного уровня (5-6 мм) к грудному (3-4 мм) и становится минимальным на уровне С3-6.
В обычных условиях давление в ЭП имеет отрицательное значение. Наиболее низким оно является в шейном и грудном отделах. Увеличение давления в грудной клетке при кашле, пробе Вальсальвы приводит к повышению давления в ЭП. Введение жидкости в ЭП повышает давление в нем, величина этого повышения зависит от скорости и объема введенного раствора. Параллельно увеличивается давление и в СП.
Давление в ЭП становится положительным в поздних сроках беременности за счет повышения внутрибрюшного давления (через межпозвонковые отверстия передается в ЭП) и расширения эпидуральных вен. Уменьшение объема ЭП способствует более широкому распространению местного анестетика.
Непреложным является факт, что препарат, введенный в ЭП, попадает в СМЖ и СМ. Менее изученным является вопрос — каким образом он туда попадает? В ряде руководств по регионарной анестезии описывается латеральное распространение препаратов, введенных в ЭП с последующей их диффузией через манжеты спинномозговых корешков в СМЖ (Cousins M., Bridenbaugh P., 1998).
Данная концепция логически обосновывается несколькими фактами. Во-первых, в манжетах спинномозговых корешков имеются паутинные грануляции (ворсинки), аналогичные таковым в головном мозге. Через эти ворсинки осуществляется секреция СМЖ в субарахноидальное пространство. Во-вторых, еще в конце XIX в. в экспериментальных исследованиях Key и Retzius было установлено, что вещества, введенные в СП животных, позднее обнаруживались в ЭП. В-третьих, было выявлено, что эритроциты удаляются из СМЖ путем пассажа через те же паутинные ворсинки. Эти три факта логически были объединены, и сделан вывод, что молекулы лекарственных веществ, размер которых меньше, чем размер эритроцитов, также могут проникать из ЭП в субарахноидальное через паутинные ворсинки. Этот вывод, конечно, привлекателен, но он является ложным, построен на умозрительных заключениях и не подкреплен ни одним экспериментальным или клиническим исследованием.
Между тем при помощи экспериментальных нейрофизиологических исследований установлено, что транспорт любых веществ через паутинные ворсинки осуществляется путем микропиноцитоза и только в одном направлении — из СМЖ наружу (Yamashima T. et al., 1988 и др.). Если бы это было не так, то любая молекула из венозного кровотока (большинство ворсинок омывается венозной кровью) могла бы легко проникнуть в СМЖ, обходя, таким образом, гематоэнцефалический барьер.
Существует еще одна распространенная теория, объясняющая проникновение препаратов из ЭП в СМ. Согласно этой теории, препараты с высокой способностью растворяться в жирах (а точнее, неионизированные формы их молекул) диффундируют через стенку корешковой артерии, проходящей в ЭП, и с током крови попадают в СМ. Данный механизм также не имеет никаких подтверждающих данных.
В экспериментальных исследованиях на животных изучена скорость проникновения в СМ фентанила, введенного в ЭП, при интактных корешковых артериях и после наложения зажима на аорту, блокирующего кровоток в этих артериях (Bernards S., Sorkin L., 1994). Не выявлено различий в скорости проникновения фентанила в СМ, однако выявлена замедленная элиминацию фентанила из СМ при отсутствии кровотока по корешковым артериям. Таким образом, корешковые артерии играют важную роль лишь в «вымывании» препаратов из СМ. Тем не менее опровергнутая «артериальная» теория транспорта препаратов из ЭП в СМ продолжает упоминаться в специальных руководствах.
Таким образом, в настоящее время экспериментально подтвержден лишь один механизм проникновения лекарственных препаратов из ЭП в СМЖ/СМ — диффузия через оболочки СМ (см. выше).
Новые данные по анатомии эпидурального пространства
Большинство ранних исследований анатомии ЭП были выполнены с помощью введения рентгеноконтрастных растворов или при аутопсии. Во всех этих случаях исследователи сталкивались с искажением нормальных анатомических соотношений, обусловленных смещением компонентов ЭП относительно друг друга.
Интересные данные были получены в последние годы при помощи компьютерной томографии и эпидуроскопической техники, позволяющей изучать функциональную анатомию ЭП в непосредственной связи с техникой эпидуральной анестезии. Например, при помощи компьютерной томографии было подтверждено, что спинальный канал выше поясничного отдела имеет овальную форму, а в нижних сегментах – треугольную.
С помощью 0,7 мм эндоскопа, введенного через иглу Туохи 16G, было установлено, что объем ЭП увеличивается при глубоком дыхании, что может облегчить его катетеризацию (Igarashi, 1999). По данным КТ, жировая ткань преимущественно сконцентрирована под желтой связкой и в области межпозвонковых отверстий. Жировая клетчатка практически полностью отсутствует на уровнях С7-Тh2, при этом твердая оболочка непосредственно соприкасается с желтой связкой. Жир эпидурального пространства скомпонован в ячейки, покрытые тонкой мембраной. На уровне грудных сегментов жир фиксирован к стенке канала только по задней средней линии, а в ряде случаев рыхло прикрепляется к твердой оболочке. Это наблюдение может частично объяснить случаи асимметрического распределения растворов МА.
При отсутствии дегенеративных заболеваний позвоночника, межпозвонковые отверстия обычно открыты, независимо от возраста, что позволяет введенным растворам свободно покидать ЭП.
При помощи магнитно-резонансной томографии были получены новые данные об анатомии каудальной (сакральной) части ЭП. Расчеты, выполненные на костном скелете, свидетельствовали о том, что его средний объем составляет 30 мл (12-65 мл). Исследования, выполненные с применением МРТ, позволили учесть объем ткани, заполняющей каудальное пространство, и установить, что его истинный объем не превышает 14,4 мл (9,5-26,6 мл) (Crighton, 1997). В той же работе было подтверждено, что дуральный мешок заканчивается на уровне средней трети сегмента S2.
Воспалительные заболевания и ранее перенесенные операции искажают нормальную анатомию ЭП.
Субдуральное пространство
С внутренней стороны к ТМО очень близко прилежит паутинная оболочка, которая тем не менее с ней не соединяется. Пространство, образуемое этими оболочками, называют субдуральным.
Термин «субдуральная анестезия» является некорректным и не идентичным термину «субарахноидальная анестезия». Случайное введение анестетика между паутинной и твердой мозговой оболочками может явиться причиной неадекватной спинальной анестезии.
Субарахноидальное пространство
Начинается от большого затылочного отверстия (где переходит в интракраниальное субарахноидальное пространство) и продолжается приблизительно до уровня второго крестцового сегмента, ограничивается паутинной и мягкой мозговой оболочками. Оно включает в себя СМ, спинномозговые корешки и спинномозговую жидкость.
Ширина спинального канала составляет около 25 мм на шейном уровне, на грудном он сужается до 17 мм, на поясничном (L1) расширяется до 22 мм, а еще ниже — до 27 мм. Переднезадний размер на всем протяжении составляет 15-16 мм.
Внутри спинального канала располагаются СМ и конский хвост, СМЖ, а также кровеносные сосуды, питающие СМ. Окончание СМ (conus medullaris) находится на уровне L1-2. Ниже конуса СМ трансформируется в пучок нервных корешков (конский хвост), свободно «плавающих» в СМЖ в пределах дурального мешка. В настоящее время рекомендуется осуществлять пункцию субарахноидального пространства в межпозвонковом промежутке L3-4, чтобы снизить до минимума вероятность травмы иглой СМ. Корешки конского хвоста достаточно мобильны, и опасность их травмирования иглой крайне мала.
Спинной мозг
Располагается на протяжении от большого затылочного отверстия до верхнего края второго (очень редко третьего) поясничного позвонка. Его средняя протяженность составляет 45 см. У большинства людей СМ заканчивается на уровне L2, в редких случаях достигая нижнего края 3-го поясничного позвонка.
Кровоснабжение спинного мозга
СМ снабжается спинальными ветвями позвоночной, глубокой шейной, межреберных и поясничной артерий. Передние корешковые артерии входят в спинной мозг поочередно — то справа, то слева (чаще слева). Задние спинальные артерии являются ориентированными вверх и вниз продолжениями задних корешковых артерий. Ветви задних спинальных артерий соединяются анастомозами с аналогичными ветвями передней спинальной артерии, образуя многочисленные сосудистые сплетения в мягкой мозговой оболочке (пиальную сосудистую сеть).
Тип кровоснабжения СМ зависит от уровня вхождения в спинномозговой канал самой большой по диаметру корешковой (радикуломедулярной) артерии — так называемой артерии Адамкевича. Возможны различные анатомические варианты кровоснабжения СМ, в том числе такой, при котором все сегменты ниже Th3-3 питаются из одной артерии Адамкевича (вариант а, около 21% всех людей).
В других случаях возможны:
б) нижняя дополнительная радикуломедуллярная артерия, сопровождающая один из поясничных или 1-й крестцовый корешок,
в) верхняя дополнительная артерия, сопровождающая один из грудных корешков,
г) рассыпной тип питания СМ (три и более передних радикуломедуллярных артерии).
Как в варианте а, так и в варианте в, нижняя половина СМ снабжается только одной артерией Адамкевича. Повреждение данной артерии, компрессия ее эпидуральной гематомой или эпидуральным абсцессом способны вызвать тяжкие и необратимые неврологические последствия.
От СМ кровь оттекает через извилистое венозное сплетение, которое также располагается в мягкой оболочке и состоит из шести продольно ориентированных сосудов. Это сплетение сообщается с внутренним позвоночным сплетением ЭП из которого кровь оттекает через межпозвонковые вены в системы непарной и полунепарной вен.
Вся венозная система ЭП не имеет клапанов, поэтому она может служить дополнительной системой оттока венозной крови, например, у беременных при аорто-кавальной компрессии. Переполнение кровью эпидуральных вен повышает риск их повреждения при пункции и катетеризации ЭП, в том числе увеличивается вероятность случайного внутрисосудистого введения местных анестетиков.
Спинномозговая жидкость
Спинной мозг омывается СМЖ, которая играет амортизирующую роль, защищая его от травм. СМЖ представляет собой ультрафильтрат крови (прозрачная бесцветная жидкость), который образуется хориоидальным сплетением в боковом, третьем и четвертом желудочках головного мозга. Скорость продукции СМЖ составляет около 500 мл в день, поэтому даже потеря ее значительного объема быстро компенсируется.
СМЖ содержит протеины и электролиты (в основном Na+ и Cl-) и при 37° С имеет удельный вес 1,003-1,009.
Арахноидальные (пахионовы) грануляции, расположенные в венозных синусах головного мозга, дренируют большую часть СМЖ. Скорость абсорбции СМЖ зависит от давления в СП. Когда это давление превышает давление в венозном синусе, открываются тонкие трубочки в пахионовых грануляциях, которые пропускают СМЖ в синус. После того как давление выравнивается, просвет трубочек закрывается. Таким образом, имеет место медленная циркуляция СМЖ из желудочков в СП и далее, в венозные синусы. Небольшая часть СМЖ абсорбируется венами СП и лимфатическими сосудами, поэтому в позвоночном субарахноидальном пространстве происходит некоторая локальная циркуляция СМЖ. Абсорбция СМЖ эквивалентна ее продукции, поэтому общий объем СМЖ обычно находится в пределах 130-150 мл.
Возможны индивидуальные различия объема СМЖ в люмбосакральных отделах спинального канала, которые могут оказывать влияние на распределение МА. Исследования при помощи ЯМР выявили вариабельность объемов СМЖ люмбосакрального отдела в объемах от 42 до 81 мл (Carpenter R., 1998). Интересно отметить, что люди с избыточным весом имеют меньший объем СМЖ. Наблюдается отчетливая корреляция между объемом СМЖ и эффектом спинальной анестезии, в частности, максимальной распространенностью блока и скоростью его регрессии.
Корешки спинного мозга и спинномозговые нервы
Каждый нерв образуется за счет соединения переднего и заднего корешка СМ. Задние корешки имеют утолщения — ганглии задних корешков, которые содержат тела нервных клеток соматических и вегетативных сенсорных нервов. Передние и задние корешки по отдельности проходят латерально через паутинную и ТМО прежде, чем объединиться на уровне межпозвоночных отверстий, формируя смешанные спинномозговые нервы. Всего существует 31 пара спинномозговых нервов: 8 шейных, 12 грудных, 5 поясничных, 5 крестцовых и одна копчиковая.
СМ растет медленнее позвоночного столба, поэтому он короче позвоночника. В результате этого сегменты и позвонки не находятся в одной горизонтальной плоскости. Поскольку сегменты СМ короче соответствующих позвонков, то в направлении от шейных сегментов к крестцовым постепенно увеличивается расстояние, которое необходимо преодолеть спинномозговому нерву, чтобы достичь «своего» межпозвоночного отверстия. На уровне крестца это расстояние составляет 10-12 см. Поэтому нижние поясничные корешки удлиняются и загибаются каудально, формируя вместе с крестцовыми и копчиковыми корешками конский хвост.
В пределах субарахноидального пространства корешки покрыты только слоем мягкой мозговой оболочки. Это является отличием от ЭП, где они становятся большими смешанными нервами со значительным количеством соединительной ткани как внутри, так и снаружи нерва. Это обстоятельство является объяснением того, что для спинальной анестезии требуются намного меньшие дозы местного анестетика, в сравнении с таковыми для эпидуральной блокады.
Индивидуальные особенности анатомии спинальных корешков могут определять вариабельность эффектов спинальной и эпидуральной анестезии. Размеры нервных корешков у различных людей могут значительно варьировать. В частности, диаметр корешка L5 может колебаться от 2,3 до 7,7 мм. Задние корешки имеют больший размер по сравнению с передними, но состоят из трабекул, достаточно легко отделимых друг от друга. За счет этого они обладают большей поверхностью соприкосновения и большей проницаемостью для местных анестетиков по сравнению с тонкими и не имеющими трабекулярной структуры передними корешками. Эти анатомические особенности отчасти объясняют более легкое достижение сенсорного блока по сравнению с моторным.
источник
Эпидуральное пространство
1. Малая медицинская энциклопедия. — М.: Медицинская энциклопедия. 1991—96 гг. 2. Первая медицинская помощь. — М.: Большая Российская Энциклопедия. 1994 г. 3. Энциклопедический словарь медицинских терминов. — М.: Советская энциклопедия. — 1982—1984 гг .
Смотреть что такое «Эпидуральное пространство» в других словарях:
эпидуральное пространство — (cavum ep >Большой медицинский словарь
Кровоизлияние эпидуральное — Кровоизлияние в пространство между костями черепа и твердой мозговой оболочкой. Обычно посттравматическое, может быть острым, подострым или хроническим. Возможно формирование эпидуральной гематомы … Энциклопедический словарь по психологии и педагогике
эпидурография — (эпидуральное пространство + греч. grapho писать, изображать; син. перидурография) рентгенологическое исследование эпидурального пространства после введения в него водорастворимого контрастного вещества путем пункции … Большой медицинский словарь
Эпидурографи́я — (Эпидуральное пространство + греч. graphō писать, изображать; син. перидурография) рентгенологическое исследование эпидурального пространства после введения в него водорастворимого контрастного вещества путем пункции … Медицинская энциклопедия
Эпидуральная анестезия — Эпидуральный катетер в месте введения. Операционное поле обработано йодом. Видны метки глубины на катетере Эпидуральная анестезия, она же «перидуральная» один из методов регионарной анестезии, при котором лекарственные препараты вводятся в… … Википедия
Мозговы́е оболо́чки — (meninges) соединительнотканные структуры, покрывающие головной и спинной мозг. Различают твердую оболочку (dura mater, pachymeninx), паутинную (arachno >Медицинская энциклопедия
Перидуралка — Эпидуральная анестезия, она же «перидуральная», жаргонно называемая «эпидуралкой» или «перидуралкой» один из методов местной анестезии, при котором лекарственные препараты вводятся в эпидуральное пространство позвоночника через катетер. Инъекция… … Википедия
Перидуральная анестезия — Эпидуральная анестезия, она же «перидуральная», жаргонно называемая «эпидуралкой» или «перидуралкой» один из методов местной анестезии, при котором лекарственные препараты вводятся в эпидуральное пространство позвоночника через катетер. Инъекция… … Википедия
Эпидуралка — Эпидуральная анестезия, она же «перидуральная», жаргонно называемая «эпидуралкой» или «перидуралкой» один из методов местной анестезии, при котором лекарственные препараты вводятся в эпидуральное пространство позвоночника через катетер. Инъекция… … Википедия
Анестези́я эпидура́льная — (греч. epi на, поверх + анатомическое dura [mater] твердая мозговая оболочка) разновидность региональной анестезии, которая обеспечивается введением в эпидуральное пространство местноанестезирующих средств. Анестезия при этом обусловлена блокадой … Медицинская энциклопедия
Спинной мозг — (medulla spinalis) (рис. 254, 258, 260, 275) представляет собой тяж мозговой ткани, располагающийся в позвоночном канале. Его длина у взрослого человека достигает 41 45 см, а ширина 1 1,5 см. Верхний отдел спинного мозга плавно переходит в… … Атлас анатомии человека
источник
Переднее эпидуральное пространство позвоночника
Переднее эпидуральное пространство позвоночника
В переднем эпидуральном пространстве задняя продольная связка не фиксирована на всем протяжении позвоночного столба, а прикрепляется только к фиброзному кольцу межпозвоночных дисков. В передних отделах твердая мозговая оболочка достаточно плотно спаяна с задней продольной связкой и образуемое переднее эпидуральное пространство находится между задней продольной связкой и передней поверхностью твердой мозговой оболочки с одной стороны и периостом тел позвонков — с другой.
Таким образом, оно разделено на вертикальные отделы на каждом уровне позвонка. Кроме этого, в большинстве случаев оно еще разделяется на две латеральные половины.
В нижнем поясничном отделе, начиная с уровня L4-L5, размеры дурального мешка постепенно уменьшаются, поэтому передняя поверхность твердой мозговой оболочки спинного мозга и задняя продольная связка постепенно расходятся, и это пространство заполняется жировой клетчаткой, количество которой постепенно увеличивается в каудальном направлении.
В передних отделах эпидурального пространства располагается хорошо выраженное венозное сплетение, которое на уровне Th20-L2 принимает базилярно-позвоночные вены, идущие вглубь тела позвонков. Эпидуральные вены — бесклапанные сосуды, соединяющиеся в краниальном направлении с синусами головного мозга, каудально — с подвздошными венами посредством крестцового венозного сплетения, а также с брюшными и грудными венами.

Наличие прямого сообщения эпидуральных вен с синусами головного мозга может быть причиной попадания лекарственных препаратов, воздуха, химических веществ непосредственно в головной мозг и сердце. На рисунке схематично представлены венозные сплетения позвоночника.
В задних отделах эпидуральная клетчатка под желтой связкой распространяется на пластины позвонков и в этих местах ограничивает прилегание твердой мозговой оболочки и периоста пластин позвонков. Такие анатомические особенности заднего отдела эпидурального пространства могут быть причиной скручивания дистального конца эндоскопа и затруднять его дальнейшее продвижение при эпидуроскопии. Ширина заднего эпидурального пространства в поясничном отделе в переднезаднем направлении по средней линии порядка 5-6 мм.
В грудном отделе размеры его несколько меньше, чем в поясничном, но здесь оно становится непрерывным. Тонкий слой эпидуральной клетчатки распространяется между пластинами позвонков и твердой мозговой оболочкой. Эндоскоп, продвигаемый в грудном отделе эпидурального пространства, обычно идет легко, не встречая препятствий на своем пути.
В каудальном направлении клетчатка постепенно истончается и в верхнегрудном и нижнешейном отделах она уже практически отсутствует. Твердая мозговая оболочка тесно прилежит к периосту пластин позвонков.
Рыхлая жировая клетчатка покрыта тонкой и гладкой капсулой. Жировая ткань в эпидуральном пространстве лежит достаточно свободно, однако, в некоторых случаях, может быть плотно фиксирована к твердой мозговой оболочке и нервным корешкам.
В латеральном отделе эпидурального пространства, которое имеет свободное сообщение с паравертебральным пространством через межпозвоночное отверстие, располагаются корешки и сопровождающие их сосуды, окруженные жировой тканью. Наличие вышеописанного сообщения с паравертебральным пространством имеет практическое значение, так как через него происходит «естественная потеря» введенных эпидурально лекарственных веществ.
При развитии дегенеративно-дистрофических процессов, сопровождающихся сужением межпозвоночного отверстия, и с возрастом «потери» будут уменьшаться, что надо учитывать при проведении эпидуроскопии с введением лекарств.
Все три оболочки спинного мозга сопровождают корешки нервов в направлении межпозвоночного отверстия, где твердая мозговая оболочка постепенно истончаясь, соединяется с периневрием спинномозгового нерва и окружающей его жировой клетчаткой.
Наличие достаточно выраженной жировой ткани в эпидуральном пространстве обеспечивает высокую адсорбцию введенных медикаментов и различных химических веществ. Этим объясняется продолжительный период действия лекарственных препаратов, введенных эпидурально.
источник
Клиническая анатомия позвоночника и спинного мозга
 Уважаемые коллеги, предлагаемый вам материал в свое время был подготовлен автором для главы руководства по нейроаксиальной анестезии, которое, в силу ряда причин, не было завершено и не вышло в свет. Мы полагаем, что представленная ниже информация будет интересна не только начинающим анестезиологам, но и опытным специалистам, поскольку она отражает наиболее современные представления об анатомии позвоночника, эпидурального и субарахноидального пространств с точки зрения анестезиолога.
Уважаемые коллеги, предлагаемый вам материал в свое время был подготовлен автором для главы руководства по нейроаксиальной анестезии, которое, в силу ряда причин, не было завершено и не вышло в свет. Мы полагаем, что представленная ниже информация будет интересна не только начинающим анестезиологам, но и опытным специалистам, поскольку она отражает наиболее современные представления об анатомии позвоночника, эпидурального и субарахноидального пространств с точки зрения анестезиолога. Анатомия позвоночника
Как известно, позвоночный столб состоит из 7 шейных, 12 грудных и 5 поясничных позвонков с прилегающими к ним крестцом и копчиком. Он имеет несколько клинически значимых изгибов. Наибольшие изгибы кпереди (лордоз) расположены на уровнях С5 и L4-5, кзади — на уровнях Th5 и S5. Эти анатомические особенности в совокупности с баричностью местных анестетиков играют важную роль в сегментарном распределении уровня спинального блока.
Особенности отдельных позвонков оказывают влияние на технику, в первую очередь, эпидуральной пункции. Остистые отростки отходят под различными углами на разных уровнях позвоночника. В шейном и поясничном отделах они располагаются почти горизонтально по отношению к пластине, что облегчает срединный доступ при перпендикулярном расположении иглы к оси позвоночника. На средне-грудном уровне (Th5-9) остистые отростки отходят под достаточно острыми углами, что делает предпочтительным парамедиальный доступ. Отростки верхних грудных (Th2-4) и нижних грудных (Th20-12) позвонков ориентированы промежуточно по сравнению с двумя вышеуказанными особенностями. На этих уровнях ни один из доступов не имеет преимуществ перед другим.
Доступ к эпидуральному (ЭП) и субарахноидальному пространству (СП) осуществляется между пластинами (интерламинарно). Верхние и нижние суставные отростки формируют фасеточные суставы, которые играют важную роль в правильном размещении пациента перед пункцией ЭП. Правильное расположение пациента перед пункцией ЭП определяется ориентацией фасеточных суставов. Поскольку фасеточные суставы поясничных позвонков ориентированы в сагиттальной плоскости и обеспечивают сгибание вперед-назад, то максимальное сгибание позвоночника (поза эмбриона) увеличивает интерламинарные пространства между поясничными позвонками.
Фасеточные суставы грудных позвонков ориентированы горизонтально и обеспечивают ротационные движения позвоночника. Следовательно, избыточное сгибание позвоночника не дает дополнительных преимуществ при пункции ЭП на грудном уровне.
Анатомические костные ориентиры
Идентификация необходимого межпозвонкового промежутка является залогом успеха эпидуральной и спинальной анестезии, а также необходимым условием безопасности пациента.
В клинических условиях выбор уровня пункции осуществляется анестезиологом посредством пальпации с целью выявления определенных костных ориентиров. Известно, что 7-й шейный позвонок имеет наиболее выраженный остистый отросток. В то же время необходимо учитывать, что у пациентов со сколиозом наиболее выступающим может быть остистый отросток 1-го грудного позвонка (примерно у ⅓ пациентов).
Линия, соединяющая нижние углы лопаток, проходит через остистый отросток 7-го грудного позвонка, а линия, соединяющая гребни подвздошных костей (линия Тюффье), проходит через 4-й поясничный позвонок (L4).
Идентификация необходимого межпозвонкового промежутка при помощи костных ориентиров далеко не всегда является корректной. Известны результаты исследования Broadbent и соавт. (2000), в котором один из анестезиологов при помощи маркера отмечал определенный межпозвонковый промежуток на поясничном уровне и пытался идентифицировать его уровень в положении больного сидя, второй совершал ту же попытку в положении пациента на боку. Затем над сделанной отметкой прикрепляли контрастный маркер и проводили магнитно-резонансную томографию.
Чаще всего истинный уровень, на котором была сделана отметка, находился от одного до четырех сегментов ниже, по сравнению с теми значениями, которые были указаны анестезиологами, участвовавшими в исследовании. Правильно идентифицировать межпозвонковый промежуток удалось лишь в 29% случаев. Точность определения не зависела от положения пациента, но ухудшалась у пациентов с избыточным весом. Кстати говоря, спинной мозг заканчивался на уровне L1 только у 19% пациентов (у остальных на уровне L2), что создавало угрозу его повреждения при ошибочном выборе высокого уровня пункции. Что затрудняет правильный выбор межпозвонкового промежутка?
Есть данные о том, что линия Тюффье соответствует уровню L4 лишь у 35% людей (Reynolds F., 2000). Для остальных 65% эта линия расположена на уровне от L3-4 до L5-S1.
Необходимо отметить, что ошибка на 1-2 сегмента при выборе уровня пункции эпидурального пространства, как правило, не сказывается на эффективности эпидуральной анестезии и анальгезии.
Связки позвоночника
По передней поверхности тел позвонков от черепа до крестца проходит передняя продольная связка, которая жестко фиксирована к межпозвонковым дискам и краям тел позвонков. Задняя продольная связка соединяет задние поверхности тел позвонков и образует переднюю стенку позвоночного канала.
Пластины позвонков соединяются желтой связкой, а задние остистые отростки — межостистыми связками. По наружной поверхности остистых отростков C7-S1 проходит надостистая связка. Ножки позвонков не соединены связками, в результате образуются межпозвонковые отверстия, через которые выходят спинномозговые нервы.
Желтая связка состоит из двух листков, сращенных по средней линии под острым углом. В связи с этим она как бы натянута в виде «тента». В шейном и грудном отделах желтая связка может быть не сращена по средней линии, что вызывает проблемы при идентификации ЭП по тесту потери сопротивления. Желтая связка тоньше по средней линии (2-3 мм) и толще по краям (5-6 мм). В целом она имеет наибольшую толщину и плотность на поясничном (5-6 мм) и грудном уровнях (3-6 мм), и наименьшую в шейном отделе (1,53 мм). Вместе с дужками позвонков желтая связка формирует заднюю стенку позвоночного канала.
При проведении иглы срединным доступом она должна пройти сквозь надостистые и межостистые связки, а затем сквозь желтую связку. При парамедиальном доступе игла минует надостистую и межостистую связки, сразу достигая желтой связки. Желтая связка плотнее других (на 80% состоит из эластических волокон), поэтому возрастание сопротивления при прохождении ее иглой, с последующей его потерей, как известно, используют для идентификации ЭП.
Расстояние между желтой связкой и твердой мозговой оболочкой в поясничном отделе не превышает 5-6 мм и зависит от таких факторов, как артериальное и венозное давление, давление в спинномозговом канале, давление в брюшной полости (беременность, абдоминальный компартмент-синдром и т. д.) и полости грудной клетки (ИВЛ).
С возрастом желтая связка уплотняется (оссифицируется), что затрудняет проведение через нее иглы. Данный процесс наиболее выражен на уровне нижних грудных сегментов.
Оболочки спинного мозга
Спинномозговой канал имеет три соединительно-тканных оболочки, защищающих спинной мозг: твердую мозговую оболочку, паутинную (арахноидальную) оболочку и мягкую мозговую оболочку. Эти оболочки участвуют в формировании трех пространств: эпидурального, субдурального и субарахноидального. Непосредственно спинной мозг (СМ) и корешки укрывает хорошо васкуляризированная мягкая мозговая оболочка, субарахноидальное пространство ограничено двумя прилегающими друг к другу оболочками — паутинной и твердой мозговой.
Все три оболочки СМ продолжаются и в латеральном направлении, формируя соединительнотканное покрытие спинномозговых корешков и смешанных спинномозговых нервов (эндоневрий, периневрий и эпиневрий). Субарахноидальное пространство тоже на коротком протяжении распространяется вдоль корешков и спинномозговых нервов, заканчиваясь на уровне межпозвонковых отверстий.
В отдельных случаях манжеты, образованные твердой мозговой оболочкой, удлиняются на сантиметр и более (в редких случаях на 6-7 см) вдоль смешанных спинномозговых нервов и значительно выходят за пределы межпозвонковых отверстий. Этот факт необходимо учитывать при выполнении блокады плечевого сплетения из надключичных доступов, поскольку в этих случаях даже при правильной ориентации иглы возможно интратекальное введение местного анестетика с развитием тотального спинального блока.
Твердая мозговая оболочка (ТМО) представляет собой листок соединительной ткани, состоящей из коллагеновых волокон, ориентированных как поперечно, так и продольно, а также некоторого количества эластических волокон, ориентированных в продольном направлении.
На протяжении длительного времени считали, что волокна ТМО имеют преимущественно продольную ориентацию. В связи с этим рекомендовали при пункции субарахноидального пространства ориентировать срез спинальной иглы с режущим кончиком вертикально, чтобы он не пересекал волокна, а как бы их раздвигал. Позднее при помощи электронной микроскопии выявили достаточно беспорядочное расположение волокон ТМО — продольное, поперечное и частично циркулярное. Толщина ТМО вариабельна (от 0,5 до 2 мм) и может отличаться на разных уровнях у одного и того же пациента. Чем толще ТМО, тем выше ее способность к ретракции (стягиванию) дефекта.
ТМО, наиболее толстая из всех оболочек СМ, на протяжении длительного времени рассматривалась как наиболее значимый барьер между ЭП и подлежащими тканями. В действительности это не так. Экспериментальные исследования с морфином и альфентанилом, выполненные на животных, показали, что ТМО является наиболее проницаемой оболочкой СМ (Bernards C., Hill H., 1990).
Ложное умозаключение о ведущей барьерной функции ТМО на пути диффузии привело к неправильной трактовке ее роли в генезе постпункционной головной боли (ППГБ). Если предположить, что ППГБ обусловлена подтеканием спинномозговой жидкости (СМЖ) через пункционный дефект в оболочках СМ, мы должны сделать правильный вывод о том, какая из них ответственна за эту утечку.
Поскольку СМЖ находится под паутинной оболочкой, то именно дефект этой оболочки, а не ТМО играет роль в механизмах ППГБ. В настоящее время нет доказательных данных, свидетельствующих о том, что именно дефект оболочек СМ, а значит его форма и размер, а также скорость потерь СМЖ (а значит, размер и форма кончика иглы) оказывают влияние на развитие ППГБ.
Это вовсе не означает, что некорректными являются клинические наблюдения, свидетельствующие, что использование тонких игл, игл типа «pencil-point», а также вертикальная ориентация среза игл типа Quincke снижают частоту ППГБ. Однако некорректны объяснения данного эффекта, в частности, утверждения, что при вертикальной ориентации среза игла не пересекает волокна ТМО, а «раздвигает» их. Данные заявления полностью игнорируют современные представления об анатомии ТМО, состоящей из беспорядочно расположенных волокон, а не ориентированных вертикально. В то же время клетки паутинной оболочки имеют цефало-каудальную ориентацию. В связи с этим при продольной ориентации среза игла оставляет в ней узкое щелевидное отверстие, повреждая меньшее количество клеток, чем при перпендикулярной ориентации. Однако это только предположение, требующее серьезных экспериментальных подтверждений.
Паутинная оболочка
Паутинная оболочка состоит из расположенных в одной плоскости и перекрывающих друг друга 6-8 слоев плоских эпителиально-подобных клеток, плотно соединенных между собой и имеющих продольную ориентацию. Паутинная оболочка является не просто пассивным резервуаром для СМЖ, она активно участвует в транспорте различных веществ.
Не так давно было установлено, что в паутинной оболочке вырабатываются метаболические энзимы, которые могут оказывать воздействие на метаболизм отдельных веществ (например, адреналина) и нейротрансмиттеры (ацетилхолин), имеющие значение для реализации механизмов спинальной анестезии. Активный транспорт веществ через паутинную оболочку осуществляется в области манжет спинномозговых корешков. Здесь происходит одностороннее перемещение веществ из СМЖ в ЭП, что увеличивает клиренс введенных в СП местных анестетиков. Пластинчатое строение паутинной оболочки способствует ее легкому отделению от ТМО при спинальной пункции.
Тонкая паутинная оболочка, на самом деле, обеспечивает более 90% резистентности на пути диффузии препаратов из ЭП в СМЖ. Дело в том, что дистанция между беспорядочно ориентированными коллагеновыми волокнами ТМО достаточно велика для того, чтобы создавать барьер на пути молекул лекарственных средств. Клеточная архитектоника паутинной оболочки, напротив, обеспечивает наибольшее препятствие диффузии и объясняет тот факт, что СМЖ находится в субарахноидальном пространстве, но отсутствует в субдуральном.
Осознание роли паутинной оболочки, как основного барьера на пути диффузии из ЭП в СМЖ, позволяет по-новому взглянуть на зависимость диффузионной способности препаратов от их способности растворяться в жирах. Традиционно принято считать, что более липофильные препараты характеризуются большей диффузионной способностью. На этом основаны рекомендации предпочтительного использования для ЭА липофильных опиоидов (фентанил), обеспечивающих быстро развивающуюся сегментарную анальгезию. В то же время в экспериментальных исследованиях установлено, что проницаемость гидрофильного морфина через оболочки спинного мозга существенно не отличается от таковой фентанила (Bernards C., Hill H., 1992). Установлено, что спустя 60 мин после эпидуральной инъекции 5 мг морфина на уровне L3-4 определяются в ликворе уже на уровне шейных сегментов (Angst M. et al., 2000).
Объяснением этому является тот факт, что диффузия из эпидурального в субарахноидальное пространство осуществляется непосредственно сквозь клетки паутинной оболочки, поскольку межклеточные связи настолько плотны, что исключают возможность проникновения молекул между клетками. В процессе диффузии препарат должен проникнуть в клетку через двойную липидную мембрану, а затем, еще раз преодолев мембрану, попасть в СП. Паутинная оболочка состоит из 6-8 слоев клеток. Таким образом, в процессе диффузии вышеуказанный процесс повторяется 12-16 раз.
Препараты с высокой жирорастворимостью термодинамически более стабильны в двойном липидном слое, чем в водном внутри- или внеклеточном пространстве, в связи с этим, им «труднее» покинуть мембрану клетки и переместиться во внеклеточное пространство. Таким образом, замедляется их диффузия сквозь паутинную оболочку. Препараты с плохой растворимостью в жирах имеют противоположную проблему — они стабильны в водной среде, но с трудом проникают в липидную мембрану, что тоже замедляет их диффузию.
Препараты, с промежуточной способностью растворяться в жирах, в наименьшей степени подвержены вышеуказанным водно-липидным взаимодействиям.
В то же время способность проникать через оболочки СМ не является единственным фактором, определяющим фармакокинетику препаратов, введенных в ЭП. Другим важным фактором (который зачастую игнорируется) является объем их поглощения (секвестрации) жировой клетчаткой ЭП. В частности, установлено, что длительность пребывания опиоидов в ЭП линейно зависит от их способности растворяться в жирах, поскольку эта способность определяет объем секвестрации препарата в жировой клетчатке. За счет этого затрудняется проникновение липофильных опиоидов (фентанил, суфентанил) к СМ. Имеются веские основания полагать, что при непрерывной эпидуральной инфузии этих препаратов анальгетический эффект достигается преимущественно за счет их абсорбции в кровоток и супрасегментарного (центрального) действия. В отличие от этого, при болюсном введении анальгетический эффект фентанила обусловлен в основном его действием на сегментарном уровне.
Таким образом, распространенное представление о том, что препараты с большей способностью растворяться в жирах после эпидурального введения быстрее и проще проникают в СМ, является не совсем корректным.
Эпидуральное пространство
ЭП является частью спинномозгового канала между его наружной стенкой и ТМО, простирается от большого затылочного отверстия до крестцово-копчиковой связки. ТМО прикрепляется к большому затылочному отверстию, а также к 1-му и 2-му шейным позвонкам, в связи с этим растворы, введенные в ЭП, не могут подняться выше этого уровня. ЭП расположено кпереди от пластины, с боков ограничено ножками, а спереди телом позвонка.
- жировую клетчатку,
- спинномозговые нервы, выходящие из спинномозгового канала через межпозвонковые отверстия,
- кровеносные сосуды, питающие позвонки и спинной мозг.
Сосуды ЭП в основном представлены эпидуральными венами, формирующими мощные венозные сплетения с преимущественно продольным расположением сосудов в боковых частях ЭП и множеством анастомотических веточек. ЭП имеет минимальное наполнение в шейном и грудном отделах позвоночника, максимальное — в поясничном отделе, где эпидуральные вены имеют максимальный диаметр.
Описания анатомии ЭП в большинстве руководств по регионарной анестезии представляют жировую клетчатку в виде однородного слоя, прилегающего к ТМО и заполняющего ЭП. Вены ЭП обычно изображают в виде сплошной сети (венозное сплетение Батсона), прилегающей к СМ на всем его протяжении. Хотя еще в 1982 г. были опубликованы данные исследований, выполненных с использованием КТ и контрастирования вен ЭП (Meijenghorst G., 1982). Согласно этим данным, эпидуральные вены располагаются преимущественно в переднем и отчасти в боковых отделах ЭП. Позднее эти сведения были подтверждены в работах Hogan Q. (1991), показавшего, кроме того, что жировая клетчатка в ЭП скомпонована в виде отдельных «пакетов», располагающихся в основном в заднем и боковых отделах ЭП, т. е. не имеет характера сплошного слоя.
Переднезадний размер ЭП прогрессивно сужается с поясничного уровня (5-6 мм) к грудному (3-4 мм) и становится минимальным на уровне С3-6.
В обычных условиях давление в ЭП имеет отрицательное значение. Наиболее низким оно является в шейном и грудном отделах. Увеличение давления в грудной клетке при кашле, пробе Вальсальвы приводит к повышению давления в ЭП. Введение жидкости в ЭП повышает давление в нем, величина этого повышения зависит от скорости и объема введенного раствора. Параллельно увеличивается давление и в СП.
Давление в ЭП становится положительным в поздних сроках беременности за счет повышения внутрибрюшного давления (через межпозвонковые отверстия передается в ЭП) и расширения эпидуральных вен. Уменьшение объема ЭП способствует более широкому распространению местного анестетика.
Непреложным является факт, что препарат, введенный в ЭП, попадает в СМЖ и СМ. Менее изученным является вопрос — каким образом он туда попадает? В ряде руководств по регионарной анестезии описывается латеральное распространение препаратов, введенных в ЭП с последующей их диффузией через манжеты спинномозговых корешков в СМЖ (Cousins M., Bridenbaugh P., 1998).
Данная концепция логически обосновывается несколькими фактами. Во-первых, в манжетах спинномозговых корешков имеются паутинные грануляции (ворсинки), аналогичные таковым в головном мозге. Через эти ворсинки осуществляется секреция СМЖ в субарахноидальное пространство. Во-вторых, еще в конце XIX в. в экспериментальных исследованиях Key и Retzius было установлено, что вещества, введенные в СП животных, позднее обнаруживались в ЭП. В-третьих, было выявлено, что эритроциты удаляются из СМЖ путем пассажа через те же паутинные ворсинки. Эти три факта логически были объединены, и сделан вывод, что молекулы лекарственных веществ, размер которых меньше, чем размер эритроцитов, также могут проникать из ЭП в субарахноидальное через паутинные ворсинки. Этот вывод, конечно, привлекателен, но он является ложным, построен на умозрительных заключениях и не подкреплен ни одним экспериментальным или клиническим исследованием.
Между тем при помощи экспериментальных нейрофизиологических исследований установлено, что транспорт любых веществ через паутинные ворсинки осуществляется путем микропиноцитоза и только в одном направлении — из СМЖ наружу (Yamashima T. et al., 1988 и др.). Если бы это было не так, то любая молекула из венозного кровотока (большинство ворсинок омывается венозной кровью) могла бы легко проникнуть в СМЖ, обходя, таким образом, гематоэнцефалический барьер.
Существует еще одна распространенная теория, объясняющая проникновение препаратов из ЭП в СМ. Согласно этой теории, препараты с высокой способностью растворяться в жирах (а точнее, неионизированные формы их молекул) диффундируют через стенку корешковой артерии, проходящей в ЭП, и с током крови попадают в СМ. Данный механизм также не имеет никаких подтверждающих данных.
В экспериментальных исследованиях на животных изучена скорость проникновения в СМ фентанила, введенного в ЭП, при интактных корешковых артериях и после наложения зажима на аорту, блокирующего кровоток в этих артериях (Bernards S., Sorkin L., 1994). Не выявлено различий в скорости проникновения фентанила в СМ, однако выявлена замедленная элиминацию фентанила из СМ при отсутствии кровотока по корешковым артериям. Таким образом, корешковые артерии играют важную роль лишь в «вымывании» препаратов из СМ. Тем не менее опровергнутая «артериальная» теория транспорта препаратов из ЭП в СМ продолжает упоминаться в специальных руководствах.
Таким образом, в настоящее время экспериментально подтвержден лишь один механизм проникновения лекарственных препаратов из ЭП в СМЖ/СМ — диффузия через оболочки СМ (см. выше).
Новые данные по анатомии эпидурального пространства
Большинство ранних исследований анатомии ЭП были выполнены с помощью введения рентгеноконтрастных растворов или при аутопсии. Во всех этих случаях исследователи сталкивались с искажением нормальных анатомических соотношений, обусловленных смещением компонентов ЭП относительно друг друга.
Интересные данные были получены в последние годы при помощи компьютерной томографии и эпидуроскопической техники, позволяющей изучать функциональную анатомию ЭП в непосредственной связи с техникой эпидуральной анестезии. Например, при помощи компьютерной томографии было подтверждено, что спинальный канал выше поясничного отдела имеет овальную форму, а в нижних сегментах – треугольную.
С помощью 0,7 мм эндоскопа, введенного через иглу Туохи 16G, было установлено, что объем ЭП увеличивается при глубоком дыхании, что может облегчить его катетеризацию (Igarashi, 1999). По данным КТ, жировая ткань преимущественно сконцентрирована под желтой связкой и в области межпозвонковых отверстий. Жировая клетчатка практически полностью отсутствует на уровнях С7-Тh2, при этом твердая оболочка непосредственно соприкасается с желтой связкой. Жир эпидурального пространства скомпонован в ячейки, покрытые тонкой мембраной. На уровне грудных сегментов жир фиксирован к стенке канала только по задней средней линии, а в ряде случаев рыхло прикрепляется к твердой оболочке. Это наблюдение может частично объяснить случаи асимметрического распределения растворов МА.
При отсутствии дегенеративных заболеваний позвоночника, межпозвонковые отверстия обычно открыты, независимо от возраста, что позволяет введенным растворам свободно покидать ЭП.
При помощи магнитно-резонансной томографии были получены новые данные об анатомии каудальной (сакральной) части ЭП. Расчеты, выполненные на костном скелете, свидетельствовали о том, что его средний объем составляет 30 мл (12-65 мл). Исследования, выполненные с применением МРТ, позволили учесть объем ткани, заполняющей каудальное пространство, и установить, что его истинный объем не превышает 14,4 мл (9,5-26,6 мл) (Crighton, 1997). В той же работе было подтверждено, что дуральный мешок заканчивается на уровне средней трети сегмента S2.
Воспалительные заболевания и ранее перенесенные операции искажают нормальную анатомию ЭП.
Субдуральное пространство
С внутренней стороны к ТМО очень близко прилежит паутинная оболочка, которая тем не менее с ней не соединяется. Пространство, образуемое этими оболочками, называют субдуральным.
Термин «субдуральная анестезия» является некорректным и не идентичным термину «субарахноидальная анестезия». Случайное введение анестетика между паутинной и твердой мозговой оболочками может явиться причиной неадекватной спинальной анестезии.
Субарахноидальное пространство
Начинается от большого затылочного отверстия (где переходит в интракраниальное субарахноидальное пространство) и продолжается приблизительно до уровня второго крестцового сегмента, ограничивается паутинной и мягкой мозговой оболочками. Оно включает в себя СМ, спинномозговые корешки и спинномозговую жидкость.
Ширина спинального канала составляет около 25 мм на шейном уровне, на грудном он сужается до 17 мм, на поясничном (L1) расширяется до 22 мм, а еще ниже — до 27 мм. Переднезадний размер на всем протяжении составляет 15-16 мм.
Внутри спинального канала располагаются СМ и конский хвост, СМЖ, а также кровеносные сосуды, питающие СМ. Окончание СМ (conus medullaris) находится на уровне L1-2. Ниже конуса СМ трансформируется в пучок нервных корешков (конский хвост), свободно «плавающих» в СМЖ в пределах дурального мешка. В настоящее время рекомендуется осуществлять пункцию субарахноидального пространства в межпозвонковом промежутке L3-4, чтобы снизить до минимума вероятность травмы иглой СМ. Корешки конского хвоста достаточно мобильны, и опасность их травмирования иглой крайне мала.
Спинной мозг
Располагается на протяжении от большого затылочного отверстия до верхнего края второго (очень редко третьего) поясничного позвонка. Его средняя протяженность составляет 45 см. У большинства людей СМ заканчивается на уровне L2, в редких случаях достигая нижнего края 3-го поясничного позвонка.
Кровоснабжение спинного мозга
СМ снабжается спинальными ветвями позвоночной, глубокой шейной, межреберных и поясничной артерий. Передние корешковые артерии входят в спинной мозг поочередно — то справа, то слева (чаще слева). Задние спинальные артерии являются ориентированными вверх и вниз продолжениями задних корешковых артерий. Ветви задних спинальных артерий соединяются анастомозами с аналогичными ветвями передней спинальной артерии, образуя многочисленные сосудистые сплетения в мягкой мозговой оболочке (пиальную сосудистую сеть).
Тип кровоснабжения СМ зависит от уровня вхождения в спинномозговой канал самой большой по диаметру корешковой (радикуломедулярной) артерии — так называемой артерии Адамкевича. Возможны различные анатомические варианты кровоснабжения СМ, в том числе такой, при котором все сегменты ниже Th3-3 питаются из одной артерии Адамкевича (вариант а, около 21% всех людей).
В других случаях возможны:
б) нижняя дополнительная радикуломедуллярная артерия, сопровождающая один из поясничных или 1-й крестцовый корешок,
в) верхняя дополнительная артерия, сопровождающая один из грудных корешков,
г) рассыпной тип питания СМ (три и более передних радикуломедуллярных артерии).
Как в варианте а, так и в варианте в, нижняя половина СМ снабжается только одной артерией Адамкевича. Повреждение данной артерии, компрессия ее эпидуральной гематомой или эпидуральным абсцессом способны вызвать тяжкие и необратимые неврологические последствия.
От СМ кровь оттекает через извилистое венозное сплетение, которое также располагается в мягкой оболочке и состоит из шести продольно ориентированных сосудов. Это сплетение сообщается с внутренним позвоночным сплетением ЭП из которого кровь оттекает через межпозвонковые вены в системы непарной и полунепарной вен.
Вся венозная система ЭП не имеет клапанов, поэтому она может служить дополнительной системой оттока венозной крови, например, у беременных при аорто-кавальной компрессии. Переполнение кровью эпидуральных вен повышает риск их повреждения при пункции и катетеризации ЭП, в том числе увеличивается вероятность случайного внутрисосудистого введения местных анестетиков.
Спинномозговая жидкость
Спинной мозг омывается СМЖ, которая играет амортизирующую роль, защищая его от травм. СМЖ представляет собой ультрафильтрат крови (прозрачная бесцветная жидкость), который образуется хориоидальным сплетением в боковом, третьем и четвертом желудочках головного мозга. Скорость продукции СМЖ составляет около 500 мл в день, поэтому даже потеря ее значительного объема быстро компенсируется.
СМЖ содержит протеины и электролиты (в основном Na+ и Cl-) и при 37° С имеет удельный вес 1,003-1,009.
Арахноидальные (пахионовы) грануляции, расположенные в венозных синусах головного мозга, дренируют большую часть СМЖ. Скорость абсорбции СМЖ зависит от давления в СП. Когда это давление превышает давление в венозном синусе, открываются тонкие трубочки в пахионовых грануляциях, которые пропускают СМЖ в синус. После того как давление выравнивается, просвет трубочек закрывается. Таким образом, имеет место медленная циркуляция СМЖ из желудочков в СП и далее, в венозные синусы. Небольшая часть СМЖ абсорбируется венами СП и лимфатическими сосудами, поэтому в позвоночном субарахноидальном пространстве происходит некоторая локальная циркуляция СМЖ. Абсорбция СМЖ эквивалентна ее продукции, поэтому общий объем СМЖ обычно находится в пределах 130-150 мл.
Возможны индивидуальные различия объема СМЖ в люмбосакральных отделах спинального канала, которые могут оказывать влияние на распределение МА. Исследования при помощи ЯМР выявили вариабельность объемов СМЖ люмбосакрального отдела в объемах от 42 до 81 мл (Carpenter R., 1998). Интересно отметить, что люди с избыточным весом имеют меньший объем СМЖ. Наблюдается отчетливая корреляция между объемом СМЖ и эффектом спинальной анестезии, в частности, максимальной распространенностью блока и скоростью его регрессии.
Корешки спинного мозга и спинномозговые нервы
Каждый нерв образуется за счет соединения переднего и заднего корешка СМ. Задние корешки имеют утолщения — ганглии задних корешков, которые содержат тела нервных клеток соматических и вегетативных сенсорных нервов. Передние и задние корешки по отдельности проходят латерально через паутинную и ТМО прежде, чем объединиться на уровне межпозвоночных отверстий, формируя смешанные спинномозговые нервы. Всего существует 31 пара спинномозговых нервов: 8 шейных, 12 грудных, 5 поясничных, 5 крестцовых и одна копчиковая.
СМ растет медленнее позвоночного столба, поэтому он короче позвоночника. В результате этого сегменты и позвонки не находятся в одной горизонтальной плоскости. Поскольку сегменты СМ короче соответствующих позвонков, то в направлении от шейных сегментов к крестцовым постепенно увеличивается расстояние, которое необходимо преодолеть спинномозговому нерву, чтобы достичь «своего» межпозвоночного отверстия. На уровне крестца это расстояние составляет 10-12 см. Поэтому нижние поясничные корешки удлиняются и загибаются каудально, формируя вместе с крестцовыми и копчиковыми корешками конский хвост.
В пределах субарахноидального пространства корешки покрыты только слоем мягкой мозговой оболочки. Это является отличием от ЭП, где они становятся большими смешанными нервами со значительным количеством соединительной ткани как внутри, так и снаружи нерва. Это обстоятельство является объяснением того, что для спинальной анестезии требуются намного меньшие дозы местного анестетика, в сравнении с таковыми для эпидуральной блокады.
Индивидуальные особенности анатомии спинальных корешков могут определять вариабельность эффектов спинальной и эпидуральной анестезии. Размеры нервных корешков у различных людей могут значительно варьировать. В частности, диаметр корешка L5 может колебаться от 2,3 до 7,7 мм. Задние корешки имеют больший размер по сравнению с передними, но состоят из трабекул, достаточно легко отделимых друг от друга. За счет этого они обладают большей поверхностью соприкосновения и большей проницаемостью для местных анестетиков по сравнению с тонкими и не имеющими трабекулярной структуры передними корешками. Эти анатомические особенности отчасти объясняют более легкое достижение сенсорного блока по сравнению с моторным.
источник
Эпидуральное пространство - это... Что такое Эпидуральное пространство?
- Эпидуральное пространство
- пространство между твердой оболочкой спинного мозга и надкостницей позвонков, содержащее соединительную ткань и венозные сплетения.
1. Малая медицинская энциклопедия. — М.: Медицинская энциклопедия. 1991—96 гг. 2. Первая медицинская помощь. — М.: Большая Российская Энциклопедия. 1994 г. 3. Энциклопедический словарь медицинских терминов. — М.: Советская энциклопедия. — 1982—1984 гг.
- Эпидидимэктоми́я
- Эпидурит
Смотреть что такое "Эпидуральное пространство" в других словарях:
эпидуральное пространство — (cavum epidurale, PNA, BNA; cavum extradurale, JNA; эпи + анат. dura mater твердая мозговая оболочка) пространство между твердой оболочкой спинного мозга и надкостницей позвонков, содержащее соединительную ткань и венозные сплетения … Большой медицинский словарь
Кровоизлияние эпидуральное — Кровоизлияние в пространство между костями черепа и твердой мозговой оболочкой. Обычно посттравматическое, может быть острым, подострым или хроническим. Возможно формирование эпидуральной гематомы … Энциклопедический словарь по психологии и педагогике
эпидурография — (эпидуральное пространство + греч. grapho писать, изображать; син. перидурография) рентгенологическое исследование эпидурального пространства после введения в него водорастворимого контрастного вещества путем пункции … Большой медицинский словарь
Эпидурографи́я — (Эпидуральное пространство + греч. graphō писать, изображать; син. перидурография) рентгенологическое исследование эпидурального пространства после введения в него водорастворимого контрастного вещества путем пункции … Медицинская энциклопедия
Эпидуральная анестезия — Эпидуральный катетер в месте введения. Операционное поле обработано йодом. Видны метки глубины на катетере Эпидуральная анестезия, она же «перидуральная» один из методов регионарной анестезии, при котором лекарственные препараты вводятся в… … Википедия
Мозговы́е оболо́чки — (meninges) соединительнотканные структуры, покрывающие головной и спинной мозг. Различают твердую оболочку (dura mater, pachymeninx), паутинную (arachnoidea) и сосудистую, или мягкую (vasculosa, pia mater). Паутинную и мягкую оболочки объединяют… … Медицинская энциклопедия
Перидуралка — Эпидуральная анестезия, она же «перидуральная», жаргонно называемая «эпидуралкой» или «перидуралкой» один из методов местной анестезии, при котором лекарственные препараты вводятся в эпидуральное пространство позвоночника через катетер. Инъекция… … Википедия
Перидуральная анестезия — Эпидуральная анестезия, она же «перидуральная», жаргонно называемая «эпидуралкой» или «перидуралкой» один из методов местной анестезии, при котором лекарственные препараты вводятся в эпидуральное пространство позвоночника через катетер. Инъекция… … Википедия
Эпидуралка — Эпидуральная анестезия, она же «перидуральная», жаргонно называемая «эпидуралкой» или «перидуралкой» один из методов местной анестезии, при котором лекарственные препараты вводятся в эпидуральное пространство позвоночника через катетер. Инъекция… … Википедия
Анестези́я эпидура́льная — (греч. epi на, поверх + анатомическое dura [mater] твердая мозговая оболочка) разновидность региональной анестезии, которая обеспечивается введением в эпидуральное пространство местноанестезирующих средств. Анестезия при этом обусловлена блокадой … Медицинская энциклопедия
Спинной мозг — (medulla spinalis) (рис. 254, 258, 260, 275) представляет собой тяж мозговой ткани, располагающийся в позвоночном канале. Его длина у взрослого человека достигает 41 45 см, а ширина 1 1,5 см. Верхний отдел спинного мозга плавно переходит в… … Атлас анатомии человека
Эпидуральное пространство позвоночника — Все о детях
История
Впервые метод эпидуральной анестезии был использован в клинике в 1921 г. (Ф. Паже). Он вызвал значительный интерес у хирургов лишь после того, как в 1931 г. Долиотти описал детально разработанную технику его выполнения. В России первым применил эпидуральную анестезию Б. Н. Хольцов в 1933 г. Практическое значение этого метода стало быстро возрастать после разработки техники катетеризации эпидурального пространства. Успешное использование эпидурального и спинального методов анестезии предусматривает обязательное знание врачом соответствующих разделов анатомии, в частности, позвоночника и спинного мозга.
Техника выполнения
Техника выполнения эпидурального метода анестезии. Эпидуральный и спинальный методы анестезии в подготовке к проведению и технике их выполнения имеют много общего. При определении премедикации нужно исходить из необходимости надежной профилактики выраженного психического напряжения больных, снижению которого способствует должная психологическая подготовка в ходе предоперационного осмотра анестезиологом. Наряду с этим, непосредственная медикаментозная подготовка должна в какой-то мере повышать эффективность анестезии. В достижении цели важная роль принадлежит бензодиазепинам.
Важным условием при проведении эпидурального и спинального методов анестезии является заранее подготовленная стерильная укладка. В нее должны входить: несколько больших и маленьких салфеток, марлевые шарики, резиновые перчатки, стаканчики для раствора анестетика и поискового раствора, два пинцета, набор для эпидуральной (спинальной) анестезии, шприцы и иглы для анестезии кожи, подкожной клетчатки и введения основного анестетика.
В связи с тем, что при данном методе анестезии нельзя исключить возможность осложнений в виде тяжелых нарушений дыхания и кровообращения, нужно предусмотреть все необходимое для устранения этих расстройств.
Пункцию эпидурального пространства осуществляют в положении больного сидя или на боку. Последнее положение используют чаще. Спина больного должна быть максимально согнута, голова приведена к груди, бедра подтянуты к животу. Кожу в области пункции обрабатывают так же тщательно, как для операции, после чего обкладывают стерильным бельем. Существует два доступа в эпидуральное пространство: срединный и боковой (парамедиальный). При первом — иглу вводят в промежутке между остистыми отростками с учетом угла, образуемого ими по отношению к оси позвоночника. При этом доступе вводимая игла, пройдя кожу и подкожную клетчатку, встречает сопротивление сначала надостистой, а затем межостистой связок. У пожилых и престарелых пациентов указанные связки обычно бывают очень плотными и даже кальцинированными. В таких случаях предпочтителен парамедиальный доступ.
При парамедиальном доступе иглу вводят из точки, находящейся на 1,5-2 см от линии остистых отростков. Иглу направляют несколько медиально с таким расчетом, чтобы острием ее выйти к междужковому промежутку по средней линии.
После анестезии кожи и подкожной клетчатки двумя пальцами левой руки фиксируют межостистый промежуток с натяжением кожи. Эпидуральную иглу вводят строго по средней линии в сагиттальном направлении в толщу межостистой связки на глубину 3-4 см. Удаляют мандрен и присоединяют шприц, наполненный физиологическим раствором или 0,25% раствором новокаина с пузырьком воздуха. Дальнейшее безопасное продвижение иглы в эпидуральное пространство обеспечивается синхронной работой двух рук. Левая кисть, опираясь своей тыльной поверхностью на спину пациента, большим и указательным пальцами страхует от провала иглы после преодоления желтой связки. Основаниями указательного и среднего пальцев правой руки прочно удерживают шприц и продвигают иглу. Большой палец правой кисти осуществляет легкое давление на поршень шприца. Внедрение кончика иглы в желтую связку ощущается как тугоэластичное сопротивление продвижению иглы со сдавлением пузырька воздуха. Как только просвет иглы оказывается в эпидуральном пространстве, пузырек расправляется и ощущается отсутствие сопротивления вводимой жидкости. Помимо этого свидетельства правильного положения иглы, имеет значение проверка на отсутствие поступления через иглу спинномозговой жидкости после проверки проходимости иглы мандреном и выполнения аспирационной пробы. Целесообразно также выполнить пробу с подвешенной к павильону иглы каплей раствора. При правильном положении иглы капля при вдохе обычно втягивается в ее просвет. Хотя каждый из рассмотренных признаков не является в отдельности абсолютным, в совокупности они позволяют надежно удостовериться в правильном положении иглы.
Парамедиальный доступ к эпидуральному пространству является приоритетным для выполнении пункции в грудном отделе позвоночника: сокращается расстояние от кожи до желтой связки; отсутствуют костные препятствия в виде черепицеобразно лежащих остистых отростков, которые при срединном доступе существенно затрудняют продвижение иглы. В поясничном отделе может применяться при выраженной оссификации межостистых промежутков.
Методика пункции эпидурального пространства из парамедиального доступа в грудном отделе позвоночника. После идентификации межостных промежутков на уровне нижнего края остистого отростка вышележащего позвонка, отступя 2-3 см от него выполняется анестезия мягких тканей от кожи до дужек позвонков. Иглу Туохи с мандреном вводят почти перпендикулярно коже, под углом 10-15° к срединной линии к месту соединения остистых отростков с дужками позвонков до контакта с костными структурами. Затем, повернув иглу срезом вверх, оттянув и перемещая ее в краниальном или каудальном направлении, находят участок эластичного сопротивления тканей. Этим участком является желтая связка. Удаляют мандрен и присоединяют шприц с поисковым раствором. В дальнейшем техника пункции не отличается от таковой при срединном доступе.
Катетеризация эпидурального пространства при правильной технике ее выполнения существенных трудностей не представляет. Просвет иглы Туохи должен быть обращен краниально, за исключением катетеризации в поясничной области, когда, по показаниям, катетер может быть направлен каудально. После того как выбран катетер и проверена проходимость, приступают к продвижению его через иглу. Катетер следует вводить в эпидуральное пространство на глубину около 5 см. Такое положение катетера обезопасит от самопроизвольного выхода его наружу при смещении мягких тканей, особенно у тучных пациентов. На уровне выхода катетера из просвета иглы в эпидуральное пространство ощущается более или менее выраженное сопротивление. Непреодолимое препятствие продвижению катетера на уровне, соответствующем длине иглы, чаще всего свидетельствует о выходе иглы из эпидурального пространства и требует его повторной идентификации. Если препятствие возникает после некоторого продвижения катетера в эпидуральное пространство, нужно через катетер ввести около 5 мл физиологического раствора с целью расширения эпидурального пространства в месте продвижения катетера. Следует иметь в виду, что извлечение катетера обратно при безуспешных попытках его продвинуть связано с опасностью отсечения краем острия иглы той его части, которая находится за пределами просвета иглы. Недопустимо изменение положения иглы, в том числе и вращение ее, при наличии катетера в ЭДП. Извлечение катетера через иглу недопустимо! При наличии малейшего сопротивления необходимо извлечь катетер вместе с иглой. Достигнув намеченного уровня введения катетера, иглу постепенно извлекают и по мере выведения продвигают в ее просвет катетер. Как только дистальный конец иглы вышел наружу, катетер фиксируют пальцами или пинцетом, а иглу удаляют. Не следует оставлять катетер в эпидуральном пространстве в состоянии упора в препятствие. Его может создавать вена, при постоянном давлении на нее велика вероятность развития пролежня в ее стенке. После удаления иглы катетер необходимо подтянуть на 0,5-1 см. Катетер фиксируют к коже, и место его выхода закрывают стерильной наклейкой или бактерицидным пластырем. Затем катетер выводят на переднюю поверхность тела, фиксируя на всем протяжении к коже лентой липкого пластыря. Убедившись в том, что из катетера не поступает спинномозговая жидкость или кровь и он проходим, вводят медленно в качестве пробной дозы 3—5 мл 2% раствора лидокаина или тримекаина. При внутрисосудистом введении анестетика наблюдается преходящее чувство дезориентации, отмечается снижение частоты сердечных сокращений и артериального давления. Не следует вводить в качестве пробной дозы раствор маркаина, внутрисосудистое попадание которого грозит развитием выраженной депрессии миокарда. Субарахноидальное положение катетера приведет к развитию спинальной анестезии через 5-7 мин. При предполагаемой перфорации твердой мозговой оболочки в ходе пункции период наблюдения до введения основной дозы следует продлить до 20 мин, когда могут проявиться признаки субарахноидальной блокады вследствие проникновения анестетика из эпидурального пространства через перфорационное отверстие. При отсутствии симптомов спинальной анестезии вводят расчетную дозу анестетика. Конец катетера содержат в строго асептических условиях.
Раствор анестетика, вводимый в эпидуральное пространство, распространяется по нему вверх, вниз и частично через боковые межпозвонковые отверстия в паравертебральную клетчатку. Зона анестезии тем больше, чем больше объем вводимого раствора анестетика, его концентрация и скорость введения. Людям среднего возраста для обезболивания в пределах одного сегмента необходимо ввести около 2 мл, а пожилым и престарелым 1 —1,5 мл раствора анестетика. Максимальный объем однократно вводимого анестетика не должен превышать 25 мл. Для эпидуральной анестезии можно использовать 2 % раствор лидокаина (тримекаина), 0,5% раствор маркаина (ропивакаина) и 0,2% раствор дикаина.
Уровень введения анестетика в эпидуральное пространство зависит от области планируемой операции, а количество вводимого раствора — от ее объема (табл.1.).
Таблица 1. Уровень введения иглы в эпидуральное пространство в зависимости от операционной области
| Объем операции | Уровень пункции |
| Легкие, трахея, бронхи | Th4 — Th5 |
| Желудок, печень, поджелудочная железа | Th6 — Th8 |
| Слепая и восходящая толстая кишки | Th8 — Th21 |
| Нисходящая толстая и сигмовидная кишки | L1 — L3 |
| Почки и мочеточники | Th8 — L2 |
| Матка | L1 — L 2 |
| Нижние конечности | L2 — L4 |
Эпидуральная и спинальная анестезия имеет много общего не только в технике выполнения и проявлении обезболивающею эффекта, но и во влиянии на и функциональные системы организма. При том и другом методе анестетик оказывает специфическое действие в основном на корешки спинного мозга. Поскольку заключенные в них волокна полиморфны, импульсация по ним прерывается неодномоментно. Сначала блокируются тонкие вегетативные волокна, а затем последовательно выключается температурная, болевая, тактильная чувствительность и блокируются двигательные волокна. В связи с тем что в эпидуральном пространстве в отличие от субдурального корешки покрыты плотной оболочкой, действие анестетиков в нем развивается медленнее и для блокады необходима более высокая концентрация их растворов.
Существенное значение имеют особенности распространения анестетика в центральном канале спинного мозга при эпидуральной и спинальной анестезиях. В эпидуральном пространстве, которое заполнено клетчаткой, по понятным причинам движение раствора от места введения в краниальном и каудальном направлениях происходит в весьма ограниченных пределах. В субарахноидальном пространстве раствор анестетика, смешиваясь с цереброспинальной жидкостью, может проникать сравнительно далеко от места инъекции. При этом зона его низкой концентрации, блокирующей лишь тонкие, в частности симпатические, волокна, оказывается шире зоны выключения болевой чувствительности на 3—4 сегмента. При эпидуральной анестезии этого не происходит, но при ней больше проявляется разница между зоной выключения болевой чувствительности и зоной блокады двигательных волокон. На сердечно-сосудистую систему при этих методах анестезии оказывает влияние ряд факторов. Основное значение имеет блокада симпатической иннервации в области действия анестетика на корешки спинного мозга. Результатом этого являются:
-
расширение кровеносных сосудов в области анестезии, что приводит к увеличению общей емкости сосудистого русла;
-
при анестезии на уровне I—IV грудных позвонков блокируются эфферентные симпатические волокна, обеспечивающие стимуляцию деятельности сердца;
-
рефлекс Бейнбриджа, вызываемый уменьшением притока крови к сердцу на фоне возросшей емкости сосудистого русла. Помимо этого, могут иметь значение торможение бета-адренорецепторов сердца вследствие резорбтивного действия анестетика, а также влияние на функцию сердца и тонус сосудов добавляемого к раствору анестетика адреналина.
Таким образом, сердечно-сосудистая система при эпидуральной и спинальной анестезии испытывает влияния, которые в основном тормозят ее функцию. При этом вероятность неблагоприятных изменений гемодинамики больше при спинальной анестезии, что связано с более широкой, чем при эпидуральной анестезии, зоной действия анестетика на симпатическую иннервацию. Немаловажное значение имеет также относительно быстрое наступление блокирующего эффекта при спинальной анестезии, что не позволяет организму своевременно включить адаптивные механизмы сердечно-сосудистой системы.
Отмеченные моменты диктуют необходимость соответствующих профилактических мер, а также внимательного контроля за состоянием кровообращения в ближайшем периоде после введения анестетика и неотложной коррекции нарушений гемодинамики, если они возникают.
На внешнее дыхание эпидуральная и спинальная анестезия в условиях стабильной гемодинамики обычно не оказывает неблагоприятного влияния. Однако нужно иметь в виду, что при распространении анестетика до уровня шейных позвонков может произойти блокада диафрагмальных нервов, что ведет к значительному ограничению дыхательных экскурсий. Важно также учитывать, что при широкой анестезии в грудном отделе иннервация межреберных мышц блокируется в большей или меньшей части сегментов. Если при этом функция диафрагмальных нервов сохранена, то дыхательная недостаточность обычно не возникает.
Влияние эпидуральной и спинальной анестезий на функцию желудочно-кишечного тракта связано с преобладанием тонуса парасимпатической нервной системы и характеризуется усилением перистальтики и секреции желез. Предполагают, что это может быть причиной тошноты и рвоты, возникающей иногда при рассматриваемых видах анестезии.
Неудачи, осложнения и их профилактика. Техника эпидуральной и спинальной анестезии относительно сложна, поэтому не исключены трудности и даже неудачи, особенно в практике врачей, имеющих недостаточный опыт. В большей мере это относится к эпидуральной анестезии. В одних случаях оказывается трудным доступ к спинномозговому каналу, что чаще бывает в среднегрудном отделе, в других — сложно идентифицировать эпидуральное пространство и ввести в него катетер. В преодолении трудностей большое значение имеет правильное и неторопливое выполнение всех предусмотренных элементов техники. Поспешность и недостаточно скрупулезное следование общепринятой методике при многократных попытках достичь цели могут привести к повреждению твердой мозговой оболочки, сосудов эпидурального пространства, спинного мозга или его корешков, что иногда имеет серьезные последствия.
Наиболее опасным осложнением, возможным в ближайшем периоде после осуществления эпидуральной и спинальной анестезии, является глубокий коллапс. Вероятность возникновения его при правильной оценке исходного состояния больных, за редким исключением, можно предвидеть и успешно предупредить соответствующими мерами. Однако бывают случаи, когда это осложнение развивается неожиданно.
При эпидуральной анестезии причинами тяжелого коллапса чаще служат незамеченное повреждение твердой мозговой оболочки и проникновение значительного или всего количества местного анестетика в субарахноидальное пространство. В результате в значительной части тела блокируется симпатическая иннервация, соответственно снижаются тонус сосудов, периферическое сосудистое сопротивление и увеличивается объем сосудистого русла, что быстро ведет к развитию тяжелой гипотензии.
Опасная гипотензия может возникнуть и при технически правильно выполненной анестезии. Это происходит в случаях введения относительно большой дозы анестетика в расчете на обеспечение анестезии в широкой зоне. К резкому снижению артериального давления предрасположены больные в преклонном возрасте, ослабленные, истощенные, с исходной гиповолемией, т.е. тогда, когда снижены компенсаторные возможности сердечно-сосудистой системы. При анестезии в верхнегрудных сегментах дополнительным неблагоприятным фактором является блокада симпатических нервов, иннервирующих сердце.
Следует иметь в виду, что на фоне эпидуральной анестезии значительная гипотензия, иногда создающая опасность остановки сердца, может возникать при резком изменении положения тела больного на операционном столе, а также при передозировке анестетика или случайном введении основной дозы его в одну из вен эпидурального пространства.
Связанные с эпидуральной анестезией тяжелые нарушения кровообращения требуют оперативной и рациональной коррекции. Первоочередным, быстро выполняемым и довольно эффективным приемом является придание операционному столу положения с опущенным головным концом. Таким путем очень быстро достигается увеличение притока крови к сердцу. Наряду с этим важное значение имеют интенсивная инфузия растворов, введение кальция хлорида и вазопрессора. Поскольку глубокий коллапс нередко сопровождается резким угнетением или прекращением дыхания, необходима перевести больного на ИВЛ. В случаях остановки сердца предпринимаются реанимационное меры по общепринятой методике.
В послеоперационном периоде также возможны осложнения. Редким, но очень опасным осложнением является развитие гнойно-воспалительного процесса в центральном канале спинного мозга в виде эпидурита и менингита. Причиной их обычно является нарушение асептики на каком-то этапе анестезии.
Ранняя диагностика этого осложнения затруднена. Для распознавания его имеют значение нарастающая боль в области пункции или введенного катетера, симптомы раздражения мозговых оболочек, общие проявления гнойной инфекции. Лечение обычно начинают с введения больших доз антибиотиков. Иногда прибегают к дренированию эпидурального пространства на соответствующем уровне. Аналогичную операцию, причем в неотложном порядке, предпринимают в случаях развития в эпидуральном пространстве гематомы, проявляющейся отчетливыми симптомами сдавления спинного мозга.
Показания к эпидуральной и спинальной анестезии. Показания и противопоказания к рассматриваемым методам анестезии во многом аналогичны. Однако к выбору того или другого из них подходят неодинаково. Значение спинальной анестезии в анестезиологическом обеспечении хирургических вмешательств за последние десятилетия существенно не изменилось, в то время как эпидуральная анестезия приобрела очень широкое распространение. Преимущества ее отчетливо проявились после введения в практику катетеризации эпидурального пространства.
Возрастающее значение эпидуральной и спинальной анестезии объясняется убедительными данными, свидетельствующими о том, что блокада ноцицептивной импульсации из области операции на сегментарном уровне более избирательна и эффективна по сравнению с тем, что достигается общей анестезией.
Эпидуральную и спинальную анестезию применяют как отдельно, так и в сочетании с общей анестезией. Первый вариант используют преимущественно при операциях на нижних конечностях, в области таза и промежности. На фоне сильной премедикации во многих случаях он обеспечивает хорошие условия и для операций на органах брюшной полости при спонтанном дыхании больного. Для торакальных операций и при больших вмешательствах на органах брюшной полости более приемлемо сочетание общей анестезии с эпидуральной или с эпидуральной аналгезией морфином.
По мере того как анестезиологи овладевают техникой эпидуральной и спинальной анестезии, обнаруживается, что некоторые ранее установленные противопоказания недостаточно обоснованы. В частности, это относится к некоторым категориям больных с патологией сердечно-сосудистой и дыхательной систем, а также к больным с ожирением. В настоящее время абсолютными противопоказаниями считают воспалительные процессы в различных тканях спины, значительные деформации позвоночника, перенесенные повреждения его или заболевания ЦНС, тяжелый травматический и геморрагический шок, повышенную чувствительность к местным анестетикам. Относительными противопоказаниями являются резкое истощение, недостаточно компенсированная кровопотеря, резко выраженная сердечно-сосудистая недостаточность. Все отмеченные выше состояния не являются противопоказанием к проведению эпидуральной аналгезии морфином.
Source: StudFiles.net
Читайте также
РЕГИОНАЛЬНЫЕ И ВОЗРАСТНЫЕ ОСОБЕННОСТИ СТРОЕНИЯ СОЕДИНИТЕЛЬНОТКАННЫХ СТРУКТУР ЭПИДУРАЛЬНОГО ПРОСТРАНСТВА СПИННОГО МОЗГА ЧЕЛОВЕКА Текст научной статьи по специальности «Клиническая медицина»
оригинальные исследования
Морфология
© Коллектив авторов, 2019 УДК 611.819.59-053.2
DOI - https://doi.org/10.14300/mnnc.2019.14169 ISSN - 2073-8137
РЕГИОНАЛЬНЫЕ И ВОЗРАСТНЫЕ ОСОБЕННОСТИ СТРОЕНИЯ СОЕДИНИТЕЛЬНОТКАННЫХ СТРУКТУР ЭПИДУРАЛЬНОГО ПРОСТРАНСТВА СПИННОГО МОЗГА ЧЕЛОВЕКА
И. В. Гайворонский 1 2, А. А. Родионов \ А. И. Гайворонский 1 2, Г. Г. Булыщенко 2
1 Санкт-Петербургский государственный университет, Российская Федерация
2 Военно-медицинская академия им. С. М. Кирова, Санкт-Петербург, Российская Федерация
REGIONAL AND AGE FEATURES OF THE STRUCTURE OF CONNECTIVE TISSUES STRUCTURES OF THE EPIDURAL SPACE OF THE HUMAN SPINAL CORD
Gaivoronsky I. V. 1 2, Rodionov A. A. 1, Gaivoronsky A. I. 1 2, Bulyshchenko G. G. 2
1 St. Petersburg State University, Russian Federation
2 Military Medical Academy name after S. M. Kirov, St. Petersburg, Russian Federation
На 56 препаратах позвоночника плодов и взрослых людей, в анамнезе у которых не было заболеваний, связанных с патологией позвоночного столба, изучены с использованием гистологических и анатомических методик строение, количественная анатомия и топография соединительнотканных структур эпидурального пространства в различных его отделах. Впервые представлена обоснованная классификация конструктивных составных элементов соединительнотканных структур эпидурального пространства (простые трабекулы, простые пластинки, сложные трабекулярные комплексы, сложные пластинчатые комплексы, комбинированные комплексы и связки). Описаны их морфологические признаки. Указанные структуры распределены по величине (длинные и узкие, короткие и широкие, промежуточные) и по локализации (пристеночные и центральные). Представлена количественная оценка центральных эпидуральных структур в различных отделах (шейном, грудном, поясничном и крестцовом) в пределах одного сегмента эпидурального пространства. Изучены собственные связки твердой мозговой оболочки (передние, боковые, задние). Различные по форме и локализации соединительнотканные структуры в совокупности составляют понятие стромы эпидурального пространства спинного мозга. Стромальные элементы по количественному составу существенно отличаются в различных отделах позвоночного канала.
Ключевые слова: эпидуральное пространство, соединительнотканная строма, строение, твердая оболочка спинного мозга
On 56 preparations of the spine of the fetuses and adults, which had no diseases associated with the pathology of the spinal column in the anamnesis, the structure, quantitative anatomy and topography of the connective tissue structures of the epidural space in its various parts were studied using histological and anatomical methods. For the first time, a reasonable classification of the structural components of the connective tissue structures of the epidural space (simple trabeculae, simple plates, complex trabecular complexes, complex lamellar complexes, combined complexes and ligaments) is presented. Their morphological features are described. These structures are distributed by size (long and narrow, short and wide, intermediate) and by location (parietal and central). A quantitative assessment of the central epidural structures in different parts (cervical, thoracic, lumbar and sacral) within the same segment of the epidural space is presented. The ligaments of the dura mater (anterior, lateral, posterior) have been studied. The connective tissue structures of various shapes and localizations together constitute the concept of the stroma of the epidural space of the spinal cord. The stromal elements in quantitative composition differ significantly in different parts of the spinal canal.
Keywords: epidural space, connective tissue stroma, structure, dura mater of spinal cord
Для цитирования: Гайворонский И. В., Родионов А. А., Гайворонский А. И., Булыщенко Г. Г. РЕГИОНАЛЬНЫЕ И ВОЗРАСТНЫЕ ОСОБЕННОСТИ СТРОЕНИЯ СОЕДИНИТЕЛЬНОТКАННЫХ СТРУКТУР ЭПИДУРАЛЬНОГО ПРОСТРАНСТВА СПИННОГО МОЗГА ЧЕЛОВЕКА. Медицинский вестник Северного Кавказа. 2019;14(4):686-690. DOI - https://doi.org/10.14300/mnnc.2019.14169
For citation: Gaivoronsky I. V., Rodionov A. A., Gaivoronsky A. I., Bulyshchenko G. G. REGIONAL AND AGE FEATURES OF THE STRUCTURE OF CONNECTIVE TISSUES STRUCTURES OF THE EPIDURAL SPACE OF THE HUMAN SPINAL CORD. Medical News of North Caucasus. 2019;14(4):686-690. DOI - https://doi.org/10.14300/mnnc.2019.14169 (In Russ.)
медицинским вестник северного кавказа
2019. Т. 14. № 4
medical news of north caucasus 2019. Vol. 14. Iss. 4
В международной анатомической номенклатуре отсутствует понятие о соединительнотканных трабекулярных структурах эпидурально-го пространства. Кроме того, нет и общепринятой терминологии связочного аппарата твердой оболочки спинного мозга.
Согласно данным M. Hamid с соавт. [1], S. Fyneface-Oganetal [2], начиная с периода эмбрионального развития в эпидуральном пространстве обнаруживаются многочисленные соединительнотканные образования, имеющие вид тяжей, пучков, связок и пластин, фиксирующие твердую оболочку спинного мозга к стенкам позвоночного канала.
S. Wadhwani с соавт. [3] и G. G. Tardieu с соавт. [4] считают, что указанный соединительнотканный аппарат выполняет опорную и защитную функции. Вместе с тем L. L. Wiltse [5] и S. Wadhwani с соавт. [3] отмечают, что в ряде случаев он может вносить определенный вклад в патогенез ишиалгии, являясь фактором фиксации и компрессии невральных структур позвоночного канала. Кроме того, эти структуры могут препятствовать распространению лекарственных препаратов при эпидуральных инъекциях [6, 7].
Большее количество соединительнотканных структур различных форм находятся в наиболее подвижных отделах позвоночника [8]. Полагают [9], что соединительнотканные тяжи между надкостницей и твердой оболочкой спинного мозга характерны только для людей пожилого возраста. По мнению M. Lüdinghausen [8], эти тяжи в пожилом возрасте, наоборот, постепенно истончаются и исчезают.
Некоторые исследователи [10-14] считают, что соединительнотканные структуры эпидурального пространства являются признаком дегенеративно-дистрофических заболеваний позвоночника и последствием оперативных вмешательств, могут служить причиной боли в спине и конечностях. Систематический обзор и мета-анализ S. Helm с соавт. [15] и ряд других исследований [6, 16] продемонстрировали высокую эффективность чрескожного и эндоскопического эпидурального адгезиолиза в купировании болевого синдрома.
Изучение заднего эпидурального пространства поясничного отдела позвоночника взрослых людей без признаков его заболеваний и предшествующих операций выявило наличие соединительнотканных связок различной формы между дорсальной поверхностью твердой мозговой оболочки и желтой связкой [17]. Существует мнение [18], что твердая оболочка спинного мозга плотно прикреплена с помощью соединительнотканных структур только к задней продольной связке и при этом не имеет других связей со стенками позвоночного канала.
Таким образом, в литературе нет единого мнения о наличии, строении функции, региональных и возрастных особенностях соединительнотканных структур эпидурального пространства. Отсутствует их классификация. Эти вопросы и явились целью исследования.
Материал и методы. Исследование проведено на 56 препаратах позвоночника плодов и взрослых людей, в анамнезе у которых отсутствовали заболевания позвоночного столба и спинного мозга. Изучены объекты из фонда учебно-материальной базы кафедры нормальной анатомии Военно-медицинской академии им. С. М. Кирова (плоды 4 мес. -3, плоды 7 мес. - 2, взрослые люди первого периода зрелого возраста - 5, второго периода зрелого возраста - 12, пожилого возраста - 18, старческого возраста - 16).
В качестве материала исследования использовали фрагменты позвоночного столба (выпиливали) с содержащимся в позвоночном канале участком спинного мозга и его оболочками. Фрагмент позвоночного столба, изъятый в разных отделах у плодов, окрашивали гистологическими методиками (гематоксилином-эозином и по Ван-Гизону).
На трупах взрослых людей предварительно проводили видеоэндоскопию эпидурального пространства фиброволоконным эпидуроскопом диаметром 2 мм с углом обзора 0-30° (рис.). Затем извлекали эпидуральный комплекс с надкостницей позвонка и проводили такие же гистологические исследования. На гистологических препаратах оценивали форму соединительнотканных структур и их количественную характеристику в строго определенных местах (3, 6, 9 и 12 часов по циферблату).
СПС
1
• ч
ЯЙ
Рис. Поствитальная поясничная эпидуроскопия: а) угол обзора 0°: 1 - эпидуральное пространство, 2 - дуральный мешок, СТС - сложная трабекулярная
структура; б) угол обзора 25°: 1 - эпидуральное пространство, 2 - дуральный мешок, Т - трабекула, СПС - сложная пластинчатая структура
оригинальные исследования
Морфология
Полученный цифровой материал обработан по общепринятой методике, с использованием вариационной статистики и критерия Стьюдента (р<0,05).
Результаты. Анализ соединительнотканных структур эпидуральных пространств спинного мозга показал разнообразие их форм. По форме эпи-дуральные структуры можно классифицировать на 6 групп: простые трабекулы, простые пластинки, сложные трабекулярные комплексы, сложные пластинчатые комплексы, комбинированные комплексы и связки. Под термином «трабекулы» мы понимаем соединительнотканные цилиндрические тяжи, состоящие из коллагеновых и эластических волокон, имеющие концы, посредством которых трабекулы прикрепляются с одной стороны к твердой оболочке спинного мозга, а с другой - к стенке позвоночного канала.
Пластинки - это плоские соединительнотканные тяжи, боковой контур которых напоминает различные геометрические фигуры (прямоугольник, квадрат, трапецию и т. п.). Как и трабекулы, они своими основаниями прикрепляются к стенкам эпидураль-ного пространства. По внешнему виду пластинки неодинаковы. Можно выделить два их основных вида: а) пластинки трабекулярного типа с отношением длины к ширине профиля поперечного сечения как 1:3, 1:6, с локализацией в пределах одного сегмента позвоночного столба; б) пластинки фасциального типа, для которых это соотношение составляет 1:25, с локализацией в пределах нескольких сегментов.
К сложным комплексам следует относить структуры, состоящие из соединенных между собой однотипных компонентов, либо только трабекул (трабекуляр-ный вариант), либо только пластинок (пластинчатый вариант). Сложные трабекулярные соединительнотканные эпидуральные структуры представлены пучками нитевидных трабекул, отходящих от одного или ряда оснований и ориентированных в одной или нескольких плоскостях. В ряде случаев они формируют сети, по виду напоминающие перекладины губчатого вещества кости. Сложные трабекулярные формы являются наиболее распространенными структурами эпидурально-го пространства, которые обнаруживаются во всех его отделах. В количественном отношении трабекулярные формы составляют до 70 % всех соединительнотканных образований эпидурального пространства. Они имеют наименьшую механическую прочность, так как в составе содержатся диффузно расположенные пучки. Сложные пластинчатые эпидуральные структуры состоят из 2, 3 и более пластинок. Среди них различают одноплоскостные и многоплоскостные формы. Наиболее типичным их местоположением являются передние, боковые и заднебоковые отделы эпидурального пространства. Биомеханические свойства пластинчатых структур значительно выше, чем трабекулярных, в связи с содержанием в составе многочисленных кол-лагеновых и эластических волокон, которые в отдельных случаях собраны в пучки.
К комбинированным соединительнотканным конструкциям эпидурального пространства отнесены сочетания трабекулярных и пластинчатых структур. Комбинированные соединительнотканные эпиду-ральные структуры отличаются широким разнообразием внешнего вида.
Связки - образования, возникшие в результате слияния двух или более пластинок, ориентированных в одной плоскости, представляют собой довольно прочные соединительнотканные тяжи пластинчатого типа, содержащие в своем составе большое количество коллагеновых и эластических волокон,
прочно фиксированных на стенках эпидурального пространства. Эпидуральные соединительнотканные образования можно подразделить на длинные и узкие, короткие и широкие, а также промежуточные. В зависимости от точек фиксации эпидуральных образований можно выделить два вида - оболочечно-надкостничные и пристеночные. Оболочечно-над-костничные эпидуральные соединительнотканные структуры своими основаниями фиксированы на противоположных стенках эпидурального пространства (на внутренней поверхности надкостницы позвонков и наружной поверхности твердой мозговой оболочки). Пристеночные образования прикреплены на одной стенке эпидурального пространства, наружной или внутренней.
Трабекулярные и пластинчатые оболочечно-надкостничные структуры могут быть подразделены на передние, задние и боковые. Пластинчатые структуры по отделам эпидурального пространства распределены неравномерно. Так, если все их количество принять за 100 %, то на шейный отдел приходится 22,6 %, на грудной - 46,4 %, поясничный - 22,3 %, крестцовый - всего 9,7 %. Неравномерность распределения пластинчатых структур прослеживается даже в пределах одного сегмента эпидурального пространства (табл.). Наибольшее их количество находится в его передних (на цифрах 5, 6 и 7 по циферблату), в боковых (на цифрах 2, 3, 4 и 8, 9, 10) и задних отделах (на 12). С возрастом количество пластинчатых структур в боковых отделах эпидурального пространства увеличивается, и они, наряду с рукавами твердой оболочки спинного мозга и уплотненными жировыми дольками, участвуют в формировании «фронтальной перегородки», затрудняющей переход контрастного вещества из передних отделов эпидурального пространства в задние и наоборот.
В передних отделах эпидурального пространства между твердой оболочкой и передней стенкой позвоночного канала залегает пластинка фасциального типа, которая начинается на краях большого затылочного отверстия и прослеживается вплоть до крестцовых сегментов. Ее нижняя граница варьирует в широких пределах - от L2 до S2.
Пристеночные соединительнотканные структуры располагаются преимущественно в боковых отделах эпидурального пространства. Часть из них идет от корня дуг к телу позвонка и принимает участие в фиксации внутренних позвоночных венозных сплетений. Другая группа пристеночных образований сконцентрирована вокруг межпозвоночных отверстий и участвует в структурном оформлении сводов эпидурального пространства. В то же время пристеночные соединительнотканные структуры никогда не складываются в сплошную перегородку.
Собственные связки твердой оболочки спинного мозга, соединяющие ее со стенками позвоночного канала, мы подразделяем на передние, боковые и задние. Передние связки имеются на всем протяжении и фиксируют оболочку к задней продольной связке. Менее всего эта связь выражена в области верхнегрудных сегментов. Среди передних связок особое место принадлежит передней крестцовой связке твердой оболочки спинного мозга, которая совместно с концевой нитью обеспечивает фиксацию кау-дальных отделов мешка твердой оболочки. Наиболее часто начало этой связки приходится на уровень L2, а ее окончание - на S2. Связка проходит не только между мешком твердой оболочки и стенкой канала, но и продолжается до уровня Sз, S4 по ходу ее концевой
медицинский вестник северного кавказа
2019. Т. 14. № 4
medical news of north caucasus 2019. Vol. 14. Iss. 4
нити. Передняя крестцовая связка, как правило, пронизана отверстиями и не представляет сплошной перегородки, ограничивающей правые и левые отделы эпидурального пространства. С возрастом уровень начала и окончания этой связки смещается в краниальном направлении.
Боковые связки идут от боковых отделов твердой оболочки спинного мозга на участках между ее рукавами и прикрепляются к боковым участкам дуг позвонков. При этом они проходят между продольными стволами передних и задних внутренних позвоночных венозных сплетений, в адвентицию которых вплетается часть волокон.
Задние связки, как правило, парные, идут от задних парамедианных отделов твердой оболочки к дугам позвонков. Эти связки непостоянны. Наиболее частым местом их присутствия являются следующие отделы эпидурального пространства: шейный (С! и С3-С4), верхнегрудной (ТИ3-ТИ4), нижнегрудной (ТИю-ТИ12), поясничный и верхнекрестцовый - S1.
Твердая оболочка спинного мозга посредством своих передних, боковых и задних связок наиболее прочно фиксирована к стенкам позвоночного канала на уровне С! и С2, в результате чего при движениях в атлантозатылочном и атлантоаксиальном суставах не происходит прогибания ее вовнутрь.
Одной из характерных черт трабекулярных и пластинчатых структур является их выраженная способность к упруго-эластической амортизации. При отодвигании пинцетом твердой оболочки спинного мозга эти структуры натягиваются, внешняя форма их несколько меняется, после устранения деформирующего фактора они вновь принимают первоначальное состояние. Это свойство сохраняется в определенных пределах. При деформации трабекул или пластинок более чем на 1/3 их основания отделяются от твердой оболочки. Рассматриваемые соединительнотканные структуры, наряду с единичными соединительнотканными волокнами, пронизывающими жировую клетчатку в разных направлениях, складываются в единый «собственный» опорный каркас или строму эпидурального пространства. В отдельных трабеку-лах и пластинках содержатся мелкие артериальные сосуды, идущие внутрь от стенок позвоночного канала к твердой оболочке спинного мозга.
Закладка соединительнотканного трабекулярно-го аппарата происходит в раннем плодном периоде. У новорожденных имеются уже все формы трабекулярных и пластинчатых образований. Окончательное оформление этих структур происходит к первому периоду зрелого возраста, после чего их количество и размеры практически не меняются до пожилого возраста. В дальнейшем в связи с возрастным ограничением подвижности позвоночника и уменьшением
AMTepaTypa/References
1. Hamid M., Fallet-Bianco C., Delmas V., Plaisant O. The human lumbar anterior epidural space: morphological comparison in adult and fetal specimens. Surgical and Radiologic Anatomy. 2002;24(3-4):194-200. https://doi.org/10.1007/s00276-002-0041-6
2. Fyneface-Ogan S. Anatomy and clinical importance of the epidural space Epidural Analgesia-Current Views and Approaches. Crotia: In Tech, 2012.
3. Wadhwani S., Loughenbury P., Soames R. The anterior dural (Hofmann) ligaments. Spine. 2004;29(6):623-627. https://doi.org/10.1097/01.BRS.0000115129.59484.24
4. Tardieu G. G., Fisahn C., Loukas M., Moisi M., Chapman J. [et al.] The epidural ligaments (of Hofmann): a comprehensive review of the literature. Cureus. 2016;8(9):e779. https://doi.org/10.7759/cureus.779
размеров эпидурального пространства численность указанных структур и их размеры незначительно уменьшаются.
Таким образом, совокупность трабекул, пластинок, связок и комбинированных соединительнотканных структур составляет понятие стромы эпи-дурального пространства. В основе образования оформленных соединительнотканных конструкций эпидурального пространства, по нашему мнению, лежат два формообразующих фактора: 1) боковое давление стенок футляра твердой оболочки спинного мозга на окружающую соединительную ткань, приводящее к формированию пластинок фасциаль-ного типа со «скользящими» свойствами; 2) смещение футляра твердой оболочки спинного мозга относительно стенок позвоночного канала, что создает растягивающий эффект и способствует развитию соединительнотканных структур, группирующихся в трабекулы, пластинки и связки с поперечной (ради-арной) и косой (продольной) ориентацией, то есть расположенных в направлении действия силы. При этом трабекулы, пластинки и связки развиваются из тех участков соединительной ткани эпидурального пространства, которая локализована на его стенках и фиксирована к ним. Форма и протяженность связок зависит от расстояния между стенками футляра твердой оболочки спинного мозга и позвоночного канала, а также от величины и вектора тензионных сил.
Выводы
1. Структуры соединительнотканной стромы эпи-дурального пространства спинного мозга имеют форму трабекул, пластинок, сплошных трабекулярных комплексов, сплошных пластинчатых комплексов и связок.
2. В зависимости от точек фиксации к надкостнице позвонков и твердой оболочке головного мозга можно выделить два вида данных соединительнотканных структур - оболочечно-надкостничные и пристеночные. Оболочечно-надкостничные структуры по локализации являются передними, боковыми и задними.
3. Наибольшее количество стромальных структур эпидурального пространства спинного мозга отмечается в грудном отделе позвоночного канала, наименьшее - в крестцовом отделе.
4. Закладка соединительнотканных структур тра-бекулярного аппарата происходит уже в раннем плодном периоде, затем он конструкционно усложняется и окончательно формируется только к периоду первого зрелого возраста. В пожилом и старческом возрастах количество структур трабекулярного аппарата уменьшается.
Авторы заявляют об отсутствии конфликта интересов.
5. Wiltse L. L. Anatomy of the extradural compartments of the lumbar spinal canal: Peridural membrane and circumneu-ral sheath. Radiologic Clinics. 2000;38(6):1177-1206.
6. Racz G. B., Heavner J. E., Trescot A. Percutaneous lysis of epidural adhesions-evidence for safety and efficacy. Pain Practice. 2008;8(4):277-286.
7. Westbrook J. L. Anatomy of the epidural space. Anaesthesia & Intensive Care Medicine. 2012;13(11):551-554. https://doi.org/10.1016/j.mpaic.2012.08.020
8. Ludinghausen M. Die Bander und das Fettgewebe des Epiduralzaumes. Anat. Anz. 1967;121(3):294-312.
9. Cheng P. A. The anatomical and chemical aspects of epidural anesthesia. Anesth. Analg. Curr. Res. 1963;42(3):398-415.
10. Kimmell K. T., Dayoub H., Shakir H., Sincoff E. H. Spinal dural attachments to the vertebral column: an anatomic
оригинальные исследования
Морфология
report and review of the literature. Surgical Neurology International. 2011;2(97). Available at: www.surgicalneuro-loguint.com. Accessed April 13, 2019.
11. Richardson J., McGurgan P., Cheema S., Prasad R., Gupta S. Spinal endoscopy in chronic low back pain with radiculopathy A prospective case series. Anaesthesia. 2001;56(5):454-460.
https://doi.org/10.1046/j.1365-2044.2001.01524-3.x
12. Sayhan H., Beyaz S. G. Epiduroscopy (Epidural Endoscopy). Pain Management. Crotia: In Tech, 2016.
13. Choi Y. K. Spinal epiduroscopy as an educational tool. The Korean Journal of Pain. 2018;31(2):132-134. https://doi.org/10.3344/kjp.2018.31.2.132
14. Helm S., Knezevic N. N. A review of the role of epidural percutaneous neuroplasty. Pain Management. 2018;9(1):53-62. https://doi.org/10.2217/pmt-2018-0042
15. Helm S., Racz G. B., Gerdesmeyer L., Justiz R., Hayek S. M. [et al.]. Percutaneous and endoscopic adhesiolysis in managing low back and lower extremity pain: a systematic review and meta-analysis. Pain Physician. 2016;19:245-281.
16. Manchikanti L., Heavner J. E., Racz G. B. Percutaneous Adhesiolysis Essentials of Interventional Techniques in Managing Chronic Pain. Cham: Springer, 2018.
17. Connor M. J., Nawaz S., Prasad V., Mahir S., Rattan R. [et al.]. The Posterior Epidural Ligaments: A Cadaveric and Histological Investigation in the Lumbar Region. ISRN Anatomy. 2013:1-4. https://doi.org/10.5402/2013/424058
18. Husemeyer R. P., White D. C. Topography of the lumbar epidural space: a study in cadavers using injected polyester resin. Anaesthesia. 1980;35(1):7-11.
Сведения об авторах:
Гайворонский Иван Васильевич, доктор медицинских наук, профессор, заведующий кафедрой морфологии, заведующий кафедрой нормальной анатомии; тел.: 89119179993; e-mail: [email protected]
Родионов Анатолий Антонович, доктор медицинских наук, профессор, профессор кафедры морфологии; тел.: 89817489732; е-mail: [email protected]
Гайворонский Алексей Иванович, доктор медицинских наук, доцент, старший преподаватель кафедры нейрохирургии, доцент кафедры морфологии; тел.: 89119175345; е-mail: [email protected]
Булыщенко Генадий Геннадьевич, кандидат медицинских наук, преподаватель кафедры нейрохирургии; тел.: 89811530303; е-mail: [email protected]
© Коллектив авторов, 2019 УДК 611.986:681.3:618.2
DOI - https://doi.org/10.14300/mnnc.2019.14170 ISSN - 2073-8137
СРАВНИТЕЛЬНЫЙ АНАЛИЗ УГЛОВЫХ И ЛИНЕЙНЫХ ПАРАМЕТРОВ СТОП ЖЕНЩИН ПЕРВОГО И ВТОРОГО ТРИМЕСТРА БЕРЕМЕННОСТИ ПРИ ВЫПОЛНЕНИИ КОМПЬЮТЕРНОЙ ПЛАНТОГРАФИИ
Е. В. Власова, А. И. Перепелкин, В. Б. Мандриков, А. И. Краюшкин, В. Б. Барканов, Н. А. Мураева
Волгоградский государственный медицинский университет, Российская Федерация
COMPARATIVE ANALYSIS OF THE ANGULAR AND LINEAR PARAMETERS OF THE WOMEN FEET AT THE FIRST AND SECOND TRIMESTER OF PREGNANCY BY PERFORMING COMPUTER PLANTOGRAPHY
Vlasova E. V., Perepelkin A. I., Mandrikov V. B., Krayushkin A. I., Barkanov V. B., Muraeva N. A.
Volgograd State Medical University, Russian Federation
Получены и определены угловые и линейные параметры стоп женщин 17-27 лет первого и второго триместров беременности с использованием метода компьютерной плантографии с графоаналитической расшифровкой изображения стопы и системного анализа. Произведен сравнительный анализ полученных данных.
Ключевые слова: стопа, плантография, беременность, первый и второй триместр
The angular and linear parameters of the feet of women aged 17-27 years of the first and second trimesters of pregnancy were obtained and determined using the method of computer plantography with graphoanalytic decoding of the image of the foot and system analysis. A comparative analysis of the data obtained is carried out.
Keywords: foot, plantography, pregnancy, first and second trimester
Для цитирования: Власова Е. В., Перепелкин А. И., Мандриков В. Б., Краюшкин А. И., Барканов В. Б., Мураева Н. А. СРАВНИТЕЛЬНЫЙ АНАЛИЗ УГЛОВЫХ И ЛИНЕЙНЫХ ПАРАМЕТРОВ СТОП ЖЕНЩИН ПЕРВОГО И ВТОРОГО ТРИМЕСТРА БЕРЕМЕННОСТИ ПРИ ВЫПОЛНЕНИИ КОМПЬЮТЕРНОЙ ПЛАНТОГРАФИИ. Медицинский вестник Северного Кавказа. 2019;14(4):690-692. DOI - https://doi.org/10.14300/mnnc.2019.14170
Различия спинальной и эпидуральной анестезии - запись пользователя Синди (LybovZla) в сообществе Я ФАНАТКА своего ребёнка в категории Фанатичная беременность
http://onarkoze.ru/vazhnoje-o-narkoze/716-otlichije-spinalnoj-ot-epiduralnoj.html
Различия спинальной и эпидуральной анестезииВведение
Какие основные отличия спинальной и эпидуральной анестезии? Если анестезиолог предлагает сделать выбор, то, какое решение будет правильным? Дать однозначный ответ на эти вопросы не просто, ведь выбор анестезии во многом определяется особенностями операции и состоянием здоровья пациента. Тем не менее, иногда альтернатива всё-таки существует, однако для того чтобы сделать оптимальный выбор, необходимо знать суть предлагаемых видов анестезии. В этой статье излагаются основные различия эпидуральной и спинальной анестезии.
Определение терминов
Первое отличие спинальной анестезии от эпидуральной заключается в самом названии этих терминов.
В названии «спинальной анестезии» заключена анатомическая область, в которую вводится лекарство, вызывающее анестезию. Эта область называется спинальным пространством (синонимы: спинномозговое пространство, субарахноидальное пространство).
Термин «эпидуральная анестезия» также происходит от области, в которую вводится анестезирующий препарат. Данная анатомическая область называется эпидуральным пространством.
Спинальное и эпидуральное пространства являются структурами спинного мозга, точнее окружающими его анатомическими образованиями. Эпидуральное и спинальное пространство, а также спинной мозг располагаются внутри позвоночника.
Механизм действия
Особенности механизма действия спинальной и эпидуральной анестезии являются тем краеугольным камнем, который и обуславливает все различия в клинических эффектах и осложнениях этих видов анестезии. Механизм действия спинальной и эпидуральной анестезии различен. Он обусловлен особенностями строения тех анатомических областей, в которые вводится раствор местного анестетика – особенностями спинального и эпидурального пространства.
Для точного понимая следующего материала, предлагаем Вам сначала ознакомиться со статьёй «Как действует наркоз и анестезия», в которой раскрыты основы механизма анестезии, физиологии боли и анатомии спинного мозга.
Спинной мозг – это, по сути, анатомическая структура, состоящая из нервов. Можно сказать и так: спинной мозг образуют нервы, или спинной мозг - это пучок из нервов. Ориентировочно, длина спинного мозга равна длине позвоночника. Как известно, позвоночник состоит из отдельных позвонков (от 33 до 35). Между двумя соседними позвонками есть промежутки, в которые входят нервы. Причём нервы входят в спинной мозг (образуют его) на всём его протяжении, начиная от копчика и заканчивая основанием черепа. Важно запомнить, что при вхождении нервов в спинной мозг соблюдается принцип соответствия – нервы ног входят в пояснично-крестцовом отделе позвоночника, нервы живота – в поясничном отделе, нервы грудной клетки – в грудном, а нервы верхних конечностей – в шейном отделе позвоночника.
Прежде чем нервы попадают в спинной мозг, на своём пути они проходят большое количество анатомических образований, конечным из которых является эпидуральное пространство. Эпидуральное пространство очень узкое (2-5 мм) и очень длинное – его протяженность соответствует длине спинного мозга. Кроме нервов через эпидуральное пространство проходят и кровеносные сосуды. Заполнено же эпидуральное пространство жировой тканью.
После эпидурального пространства нервы попадают в спинальное пространство, продолжением которого является спинной мозг. Спинальное пространство такое же узкое и длинное, как и эпидуральное. Заполнено спинальное пространство прозрачной бесцветной жидкостью – ликвором (синоним: спинномозговая жидкость).
При спинальной анестезии местный анестетик вводится в спинальное пространство, вызывая блокаду находящегося рядом участка спинного мозга. То есть механизм действия спинальной анестезии заключается в блокаде спинного мозга, а не конечных участков нервов, как при эпидуральном обезболивании. В большинстве случае спинальная анестезия проводится на уровне поясничного отдела позвоночника, поэтому из работы выключается спинной мозг от поясницы и ниже – тот участок спинного мозга, который сформирован нервами нижних конечностей, промежности и живота.
При эпидуральной анестезии раствор анестетика вводится в эпидуральное пространство, которое, как мы помним, содержит нервы. То есть механизм действия эпидуральной анестезии основан на блокаде группы нервов, а не спинного мозга. Уровень проведения эпидуральной анестезии (поясничный или грудной отдел позвоночника) определяется местом оперативного вмешательства. Если это операция на сердце, то укол делается в грудном отделе позвоночника, если это операция на животе – в поясничном отделе.
Различия спинальной и эпидуральной анестезии
Техника выполненияВсе технические моменты по выполнению спинальной и эпидуральной анестезии прекрасно освещены в иллюстрированных статьях «Техника спинальной анестезии» и «Техника эпидуральной анестезии», поэтому мы не будем останавливаться на этих нюансах. Остановимся лишь на основных технических отличиях спинальной анестезии, от эпидуральной:
- Аксессуары. Для эпидуральной анестезии используется очень толстая игла, а для спинальной анестезии, наоборот, самая тонкая иголка.
- Место прокола. Эпидуральная анестезия – любой отдел позвоночника (чаще поясничный или грудной), спинальная – только поясница.
- Глубина введения игры. Эпидуральная анестезия – эпидуральное пространство. Спинальная анестезия – спинальное (субарахноидальное) пространство.
- Время процедуры. Эпидуральная анестезия: 10-30 минут. Спинальная анестезия: 5-10 минут.
Клинические эффекты
Клинические эффекты спинальной и эпидуральной анестезии очень схожи – это блокада ощущения боли и расслабление мышц. Протяженность «заморозки» определяется количеством заблокированных нервов (или идущих отдельно, как в случае с эпидуральной анестезией, или идущих в составе спинного мозга, как при спинальной анестезии).
Из клинических различий спинальной и эпидуральной анестезии можно выделить следующие:
- Время наступления анестезии
При спинальной анестезии полное обезболивание наступает через 5-10 минут, при эпидуральной анестезии – через 20-30 минут.
Значение: этот нюанс играет роль при экстренных оперативных вмешательствах, когда начинать операцию необходимо как можно быстрее. В данной ситуации эпидуральная анестезия будет плохим выбором. В случае же плановой операции этот факт никакого значения не имеет.
- Выраженность побочных реакций
Самая частая побочная реакция спинальной/эпидуральной анестезии – снижение артериального давления, проявляющееся слабостью, головокружением, тошнотой. При эпидуральной анестезии эти симптомы встречаются редко и носят невыраженный характер, так как время развития эффекта этой анестезии относительно длительное (20-30 минут) и организм пациента успевает справиться с этой ситуацией. Можно сказать, что эпидуральная анестезия работает несколько мягче, чем спинальная. При спинальной же анестезии описанные выше побочные эффекты развиваются быстро и носят выраженный характер. Это может принести пациенту некоторый временный дискомфорт (слабость, тошноту), однако анестезиолог, как правило, в течение нескольких минут стабилизирует и восстанавливает состояние пациента.
Значение: этот факт может иметь значение лишь у сильно ослабленных пациентов, имеющих тяжелые сердечно-сосудистые заболевания. Этим пациентам может быть показано проведение эпидуральной, а не спинальной анестезии. Однако с появлением нового оборудования и лекарств это правило утрачивает свою актуальность. Спинальная анестезия вполне безопасно может быть выполнена и пациентам с тяжелыми заболеваниями сердца, при условии, что анестезиолог обладает всем необходимым оборудованием и лекарствами.
Осложнения
Пожалуй, этот пункт является самым главным в нашем повествовании. Ведь при выборе обезболивания анестезиолог, в первую очередь, проводит соизмерение факторов риска, выбирая для пациента именно тот вид анестезии, который для него наиболее безопасен (в плане вероятности развития тяжелых осложнений анестезии).
Спинальная и эпидуральная анестезия имеют примерно одинаковый спектр осложнений, а вот частота встречаемости этих осложнений сильно разнится. Наиболее актуальными являются следующие виды осложнений:
«Неудавшаяся» анестезия
Неудавшаяся анестезия представляет собой ситуацию, когда анестезия не привела к ожидаемому обезболиванию. При спинальной анестезии такое развитие событий встречается в менее 1%, при эпидуральной анестезии в 5% случаев.
Головная боль
Постпункционная головная боль является частым спутником не только спинальной, но и эпидуральной анестезии. Частота встречаемости головной боли после спинальной анестезии варьирует от 2-10% (в зависимости от типа применяемой спинальной иглы). При эпидуральной анестезии головная боль встречается гораздо реже (около 1% случаев), однако эта головная боль более выраженная и мучительная. Меньшая вероятность головной боли обусловлено тем, что эпидуральная игла вводится только в эпидуральное пространство (при спинальной анестезии игла вводится в спинальное пространство, после её извлечения в мозговой оболочке остаётся отверстие, через которое изливается спинномозговая жидкость, что и приводит к головной боли). Однако иногда эпидуральная игла вызывает непреднамеренную перфорацию мозговой оболочки и «заходит» в спинальное пространство, это и является главной причиной головной боли при эпидуральной анестезии. Случается такая ситуация редко, поэтому и вероятность возникновения головной боли после эпидуральной анестезии меньше, чем после спинальной. Однако следует заметить, что головная боль после эпидуральной анестезии имеет большую выраженность и силу – она более мучительная и неприятная. Это обусловлено различиями в диаметре игл, применяемых для спинальной и эпидуральной анестезии. Эпидуральная игла оставляет в мозговой оболочке большее отверстие, чем тонкая спинальная игла; спинномозговая жидкость теряется в больших количествах, поэтому и голова болит больше.
Неврологические осложнения
Неврологические осложнения – редкие спутники спинальной/эпидуральной анестезии, развиваются они примерно в 0,04% случаев. Статистические данные показывают, что неврологические осложнения встречаются примерно в 2 раза чаще при спинальной анестезии, чем при эпидуральном обезболивании. Большинство неврологических расстройств носят временный характер и проходят в течение нескольких дней или месяцев.
Частота возникновения тяжелых неврологических осложнений очень редка – около 0,006%. Большая часть этих осложнений обусловлена или развитием инфекции эпидурального пространства, или скоплением крови в эпидуральном/спинальном пространстве. Интересно, что риск скопления крови (гематомы) в 1,5 раза выше при эпидуральной анестезии, чем при спинальной анестезии. Кроме того, большинство случаев инфицирования эпидурального пространства связано с применением эпидуральной, а не спинальной анестезии.
Как скопление крови в спинальном/эпидуральном пространстве, так и инфекция эпидурального пространства требуют быстрой диагностики и проведения экстренной операции. Всё это большинству российских больниц не доступно, это однозначный факт. Поэтому, относительно российских реалий, более безопасной, в плане неврологических осложнений, является спинальная, а не эпидуральная анестезия.
Фатальная остановка сердца
Вероятность остановки сердца во время спинальной/эпидуральной анестезии составляет около 1,8 эпизода на 10 тысяч анестезий, причём в 80% случаев всё заканчивается благополучно – сердечную деятельность удается восстановить и пациент выписывается из больницы без каких-либо значимых нарушений. Однако примерно в 0,0036% случаев случившаяся после спинальной/эпидуральной анестезии остановка сердца приводит к смерти.
Остановка сердца случается в 3 раза чаще во время спинальной анестезии, чем при эпидуральной анестезии, поэтому в ракурсе смертельных осложнений эпидуральная анестезия представляется более безопасной, чем спинальная.
Заключение
На самом деле, сделать какой-нибудь однозначный вывод о том, какая всё-таки анестезия является лучшей – спинальная или эпидуральная - достаточно сложно. Каждая из этих анестезий имеет свои преимущества и недостатки. Для каждой анестезии существуют свои показания и противопоказания. Существующие отличия спинальной и эпидуральной анестезии достаточно условны. Скорее всего, наиболее безопасной и оптимальной является та анестезия, которая проведена опытным и квалифицированным анестезиологом, и выбор вида анестезии здесь занимает несущественное и второстепенное значение.
тошнота головокружение слабость боль в животе причиныАнатомия эпидурального пространства - стр. 48
Анатомия эпидурального пространства
Границы эпидурального пространства схематически представлены на рис. 16-2А. Вентрально пространство ограничено твердой мозговой оболочкой, а дорсально — желтой связкой. В кранио-каудальном направлении пространство распространяется от большого затылочного отверстия до крестцовой щели.
Эпидуральное пространство заполнено рыхлой соединительной тканью, которая окружает эпидуральные вены и корешки спинномозговых нервов. Соединительная ткань обеспечивает сопротивление во время инъекции и противодействие при введении большого объема. У пожилых пациентов сопротивление соединительной ткани при введении раствора может быть неожиданно высоким.
Эпидуральные венозные сплетения сосредоточены главным образом вентрально и латерально, в дорсально-срединных отделах они представлены незначительно. Вверху сплетения сообщаются с синусами твердой мозговой оболочки головного мозга, внизу — с крестцовым сплетением, вентрально — с системами верхней и нижней полой вены и непарной вены. Любое препятствие венозному оттоку в системе полой вены вызовет застой в непарной вене и набухание эпидуральных венозных сплетений. Это случается при ожирении, беременности и при других состояниях, сопровождающихся повышенным внутрибрюшным давлением (например, асцит). Лучший способ избежать кровотечения или установки иглы (катетера) в вену эпи-дуралъного сплетения — это прекратить продвижение иглы сразу после попадания в эпидуралъное пространство по срединной линии. В эпидуральном пространстве нет артерий, но крупные артериальные коллатерали проходят по самой его латеральной границе рядом с муфтами твердой мозговой оболочки (рис. 16-8), и при отклонении иглы от срединной линии их можно повредить. Следует напомнить, что верхние грудные и поясничные сегменты спинного мозга кровоснабжаются из артерии Адамкевича (рис. 16-9), которая также может быть повреждена иглой при отклонении от срединной линии.
В самых латеральных отделах эпидурального пространства находятся муфты твердой мозговой оболочки, окружающие места выхода спинномозговых нервов. Твердая мозговая оболочка муфт истончена, через нее местный анестетик диффундирует в цереброспинальную жидкость, что и обеспечивает эпидуральную анестезию. Таким образом, при эпидуральной методике анестетик не доставляется непосредственно к нервной ткани, необходима его диффузия из места инъекции. При эпидуральной анестезии общая доза вводимого анестетика на сегмент спинного мозга значительно выше, чем при спинномозговой анестезии.
Самые крупные спинномозговые нервы L5 и S1 труднее всего поддаются блокаде при эпидуральной анестезии, поэтому при хирургических вмешательствах в зоне их иннервации следует использовать другие методы регионарной анестезии.
Прикладная физиология эпидуральной анестезии
Физиологические реакции при эпидуральной анестезии подобны изменениям при спинномозговой анестезии; некоторые отличия рассмотрены ниже.
Дифференциальная блокада и сегментарная блокада
Так как можно провести эпидуральную анестезию на уровне спинного мозга (а не исключительно ниже него, как спинномозговую), а также использовать различные концентрации местных анестетиков, то существует возможность блокады части сегментов спинного мозга. Например, при эпидуральной аналгезии в акушерстве концентрация анестетика подбирается так, чтобы получить главным образом симпатическую и сенсорную блокаду в отсутствие двигательной (дифференциальная блокада). Боль в первом периоде родов воспринимается нервами сегментов TX-LI и эффективно устраняется при сенсорной и симпатической блокаде нижнегрудного и поясничного отдела спинного мозга. Эта блокада позволяет избавить рожениц от боли до тех пор, пока первый период родов не перейдет во второй. Если возникает необходимость в полной сенсорной и двигательной блокаде промежности, то ее можно обеспечить, введя более концентрированный раствор анестетика в эпидуральное пространство на поясничном или крестцовом уровне (табл. 16-5). Например, при использовании бупивакаина для такой мощной анестезии необходимо ввести 0,5 % раствор, в то время как концентрация менее 0,25 % обеспечивает только аналгезию и незначительную моторную блокаду.
Как пример сегментарной блокады можно привести пункцию и установку эпидурального катетера в среднегрудном отделе для обеспечения анестезии при операциях на верхнем этаже брюшной полости (например, холецистэктомия). Введение небольших доз анестетика позволяет обеспечить сенсорную блокаду в верхних отделах брюшной полости без выраженной блокады в нижних конечностях. В этом случае местный анестетик поступает в эпидуральное пространство селективно на избранном уровне и не возникает необходимости заполнять пространство снизу вверх, как было бы необходимо при пункции на поясничном уровне.
Предоперационная подготовка
А. Информированное согласие. Процедура согласия на эпидуральную анестезию аналогична таковой для спинномозговой, включая информацию о возможной головной боли. Обязательно следует отметить, что риск непреднамеренного прокола твердой мозговой оболочки в опытных руках относительно низок (
Б. Анамнез и физикальное обследование. Предоперационное обследование соответствует принципам, описанным для спинномозговой анестезии. При эпидуральной анестезии некоторые сопутствующие заболевания требуют проведения особо тщательного физикального и лабораторного обследования. Например, у рожениц с преэклампси-ей высока вероятность коагулопатии (что распознается по удлинению протромбинового или частичного тромбопластинового времени) и тром-боцитопении, поэтому они представляют группу повышенного риска сосудистых осложнений, обусловленных введением эпидуральной иглы и установкой катетера; следовательно, преэкламп-сия — показание для исследования тромбоцитов и коагулограммы.
При таких пороках сердца, как аортальный стеноз или идиопатический гипертрофический субаортальный стеноз, больные не переносят резкого снижения общего периферического сосудистого сопротивления. В таких случаях либо отказываются от эпидуральной анестезии, либо вводят анестетик очень медленно.
Характер планируемой операции также влияет на выбор методики эпидуральной анестезии. Эпидуральная анестезия показана при операциях на нижних конечностях, промежности, органах малого таза, тазобедренных суставах, органах нижнего (а иногда и верхнего) этажа брюшной полости: эти анатомические области соответствуют тем уровням спинного мозга, которые могут быть адекватно блокированы при эпидуральном введении анестетика. Вместе с тем эпидуральная анестезия не всегда обеспечивает полноценную блокаду наиболее крупных нервных корешков, поэтому ее использование не рекомендуется при вмешательствах в области дер-матомов L5 и S1 (голень и стопа). При кратковременных вмешательствах на голени и стопе в случае наличия противопоказаний к общей анестезии следует предпочесть спинномозговую анестезию.
В. Лабораторное исследование. Аналогично лабораторному исследованию перед спинномозговой анестезией.
Г. Премедикация. Премедикация перед эпидуральной анестезией фактически идентична премедикации перед спинномозговой. Одновременно роль премедикации возрастает, потому что используется игла большего диаметра. Кроме того, эпиду-ральное пространство пунктировать труднее, чем субарахноидальное. Перед пункцией необходимо получить информированное согласие, добиться хорошего взаимопонимания с больным, ввести ан-ксиолитики и, возможно, аналгетики. Если больной недоступен контакту или возбужден, то высок риск непреднамеренной пункции твердой мозговой оболочки и даже повреждения структур ЦНС.
Оборудование и безопасность
Безопасность
Эпидуральную анестезию можно выполнять только при условии полного обеспечения оборудованием и лекарственными средствами, необходимыми для лечения возможных осложнений — от легкой артериальной гипотонии до остановки кровообращения. Эпидуральную анестезию можно выполнять поэтапно. Первый этап, проведение которого допускается вне ";анестезиологической территории";, включает пункцию эпидурального пространства и введение катетера без инъекции тест-дозы и, разумеется, полной дозы. Даже этот этап следует проводить в обстановке, обеспечивающей хотя бы ми-
нимальный уровень безопасности, так как возможны аллергические реакции на местный анестетик, которым инфильтрировали кожу, а также усиление активности блуждающего нерва в ответ на боль. Такие меры предосторожности особенно оправданы в акушерстве, поскольку нарушения кровообращения и дыхания быстро вызывают декомпенсацию как матери, так и плода.
Перед инъекцией необходимо удостовериться, какой препарат вводят в эпидуральное пространство. Эпидуральный катетер следует четко маркировать и не вводить в него неидентифицированных препаратов.
Оборудование
А. Иглы для эпидуральной пункции (рис. 16-14). Стандартные иглы для эпидуральной пункции обычно имеют размер 16-18 G, длину 3 дюйма (около 7,5 см), короткий скос, изогнутый конец небольшой кривизны (15-30°). Тупой срез и кривизна позволяют игле проходить через желтую связку, но препятствуют перфорации твердой мозговой оболочки — игла скорее отодвигает ее. Наиболее распространенный вариант известен как игла Туохи, а изогнутый конец получил название изгиб Губера. Некоторые клиницисты рекомендуют новичкам для первых попыток использовать иглу с концом Губера, потому что применение иглы без изогнутого конца увеличивает риск пункции твердой мозговой оболочки.
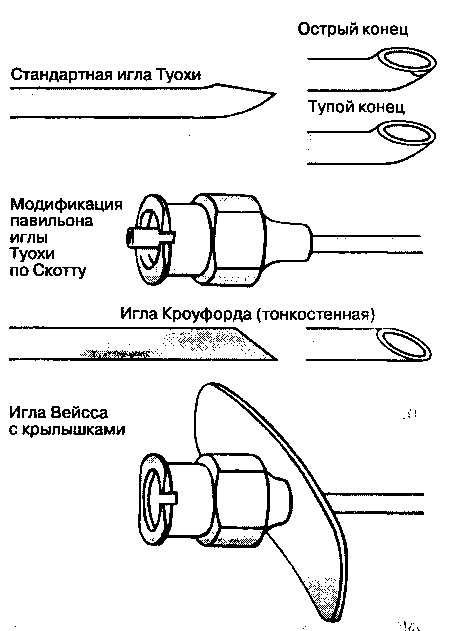
Рис. 16-14. Иглы для эпидуральной пункции (эпидуральные иглы)
Другая распространенная эпидуральная игла — это игла Кроуфорда, тонкостенная, с коротким тупым концом, без изгиба Губера. Катетер проходит прямо через иглу, не изгибаясь. Иглу Кроуфорда следует использовать в том случае, если существуют затруднения в проведении катетера в эпиду-ральное пространство.
Павильоны эпидуральных игл новых одноразовых модификаций имеют втулки, которые облегчают введение катетера. Иглы, которые впервые были изготовлены с этими втулками, получили название игл Скотта.
К последним разработкам относятся одноразовые иглы конфигурации Туохи-Губера, снабженные щитком (крылышками) в месте соединения стержня иглы с павильоном. Щиток облегчает анестезиологу восприятие тактильных ощущений, необходимое для контроля положения иглы. Прототип известен как игла Вейсса.
Методика эпидуральной анестезии
А. Идентификация эпидурального пространства.
Игла попадает в эпидуральное пространство, как только ее конец проходит через желтую связку, отодвигая твердую мозговую оболочку. Возникающее отрицательное давление подтверждает то мнение, что эпидуральное пространство представляет собой лишь потенциально существующий канал. Точная идентификация момента попадания иглы в эпидуральное пространство снижает риск повреждения твердой мозговой оболочки. Методы идентификации эпидурального пространства делятся на две основные категории: методика ";утраты сопротивления"; и методика ";висячей капли";. 1. Методика ";утраты сопротивления"; — наиболее распространенный способ идентификации эпидурального пространства. Проведение иглы через кожу в межостистую связку ощущается как значительное сопротивление. Когда конец иглы входит в толщу межостистой связки, мандрен извлекают и к игле присоединяют шприц, заполненный воздухом или изотоническим раствором натрия хлорида. Если попытка ввести раствор встретит значительное сопротивление или будет невозможна, то конец иглы действительно находится в толще межостистой связки и ее можно продвигать вперед.
Контролировать продвижение иглы можно двумя способами. Один состоит в том, что иглу с подсоединенным шприцем медленно непрерывно продвигают вперед левой рукой, а правой постоянно оказывают давление на поршень шприца. При попадании конца иглы в эпидуральное пространство резко снижается сопротивление и поршень внезапно легко продвигается вперед. Второй способ заключается в том, что иглу продвигают поступательными движениями, за один раз подавая ее вперед на несколько миллиметров, после чего останавливаются и осторожно надавливают на поршень шприца, пытаясь определить по ощущениям — находится ли игла еще в толще связок, или же сопротивление уже утрачено и она попала в эпидуральное пространство. Второй способ быстрее и практичнее, но требует некоторого опыта, чтобы вовремя остановиться и избежать перфорации твердой мозговой оболочки.
Используя методику ";утраты сопротивления";, можно вводить изотонический раствор натрия хлорида или воздух в зависимости от предпочтений анестезиолога. Имеются сообщения о том, что пузырьки воздуха могут быть причиной неполной или мозаичной блокады, но это возможно лишь при введении значительных объемов воздуха. Изотонический раствор натрия хлорида легко спутать с цереброспинальной жидкостью, что создает затруднения при подозрении на непреднамеренную пункцию твердой мозговой оболочки.
2. Методика ";висячей капли";. Иглу (лучше со щитком) вводят глубоко в межостистую связку, после чего удаляют мандрен. К павильону иглы подвешивают каплю жидкости — чаще всего изотонического раствора натрия хлорида. Пока игла продвигается через плотные связки, капля не смещается. После пункции желтой связки и попадания конца иглы в эпидуральное пространство ";висячая капля"; исчезает в просвете иглы под воздействием отрицательного давления. Однако, если игла окажется обтурированной, то капля не будет втягиваться из павильона в просвет иглы, и ее будут продвигать вперед вплоть до того момента, когда истечение цереброспинальной жидкости засвидетельствует перфорацию твердой мозговой оболочки. Следует отметить, что методику ";висячей капли"; применяют только очень опытные анестезиологи. Также данная методика используется для околосрединного доступа.
Б. Уровень пункции эпидурального пространства. Эпидуральная пункция может выполняться на уровне всех четырех отделов позвоночника: шейном, грудном, поясничном, крестцовом. Эпидуральную анестезию на уровне крестца называют каудальной, она будет рассмотрена отдельно.
1. Эпидуральная анестезия на поясничном уровне выполняется с использованием срединного или околосрединного доступа.
а. Срединный доступ (рис. 16-15). Больного укладывают, обрабатывают область пункции раствором антисептика и укрывают стерильным операционным бельем. Межостистый промежуток LIV-LV находится на уровне линии, соединяющей гребни подвздошных костей. Легче всего пальпировать промежутки между LIII-LIV и LIV-LV Кожу инфильтрируют раствором местного анестетика и затем перфорируют иглой размером 18 G. В образовавшееся отверстие вводят иглу для эпидуральной пункции и продвигают ее вперед и параллельно выше расположенному остистому отростку (т. е. в слегка краниальном направлении). При попадании в связочные структуры по срединной линии к павильону иглы присоединяют шприц, и при подаче раствора следует удостовериться в ощущении сопротивления. Очень важно ощутить сопротивление связок именно в этот момент, так как в противном случае может возникнуть ошибочное ощущение утраты сопротивления при случайном попадании иглы в мышечные ткани или жировые отложения, что приведет к инъекции анестетика не в эпидуральное пространство, и блокада не состоится. После ощущения сопротивления связок иглу продвигают вперед до входа в эпидуральное пространство, которое идентифицируют по утрате сопротивления (методику см. выше).
б. Околосрединный доступ (рис. 16-16). К околосрединному (парамедианному) доступу прибегают в тех случаях, когда предшествующее хирургическое вмешательство или дегенеративные изменения позвоночника серьезно затрудняют использование срединного доступа. Эта методика сложнее для начинающих, потому что игла проходит через мышечные ткани, минуя надостистую и межостистую связки, и ощущение сопротивления возникает только во время пункции желтой связки.
Больного укладывают, обрабатывают область пункции раствором антисептика и укрывают стерильным операционным бельем — все как для срединного доступа. Кожу инфильтрируют раствором местного анестетика на 2-4 см латеральнее нижней точки вышерасположенного остистого отростка. Толстой иглой перфорируют кожу, в образовавшееся отверстие вводят эпидуральную иглу и направляют ее к срединной линии в слегка краниальном направлении. Продвигать иглу следует с таким расчетом, чтобы она пересекла воображаемую срединную линию на глубине 4-6 см от поверхности. После того как игла пройдет через кожу, к ней присоединяют шприц; по мере прохождения через мышечные ткани будет ощущаться некоторое сопротивление подаваемому из шприца раствору. Это незначительное сопротивление следует верифицировать неоднократно, пока внезапное возрастание сопротивления не засвидетельствует попадание в желтую связку.
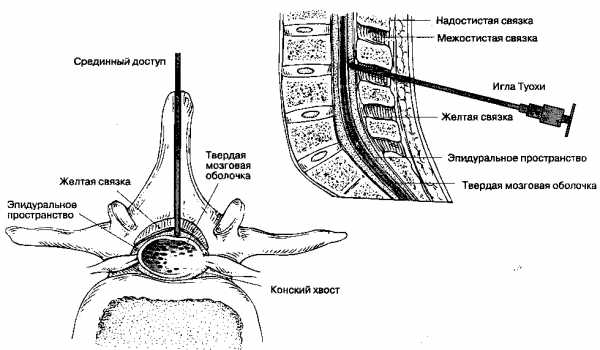
Рис. 16-15. Эпидуральная анестезия на поясничном уровне: срединный доступ
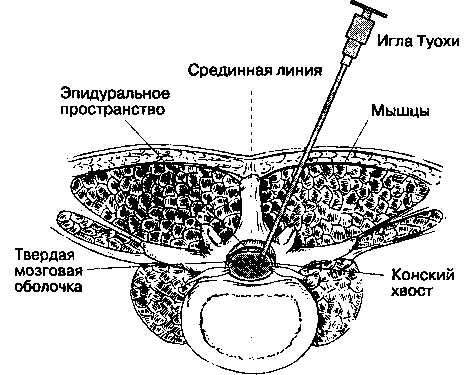
Рис. 16-16. Эпидуральная анестезия на поясничном уровне: парамедианный (околосрединный) доступ
Помимо сопротивления, попадание в желтую связку вызывает характерное ощущение чего-то жесткого, грубого. Неожиданное ощущение потери сопротивления по мере продвижения через желтую связку означает, что игла попала в эпиду-ральное пространство. Трудности, связанные с проведением стандартного эпидурального катетера через иглу Туохи, могут быть обусловлены сочетанием изогнутого конца иглы с углом околосрединного доступа, что придает слишком косое направление продвижению катетера. Учитывая эти факторы, некоторые анестезиологи предпочитают использовать при околосрединном доступе на поясничном уровне прямую иглу Кроуфорда.
2. Эпидуральная анестезия на грудном уровне технически сложнее, чем на поясничном, а риск повреждения спинного мозга выше. Поэтому очень важно, чтобы до проведения торакальной эпидуральной анестезии анестезиолог в совершенстве овладел срединным и околосрединным доступом для пункции эпидурального пространства на поясничном уровне. Так как остистые отростки грудных позвонков наклонены вниз и частично перекрывают друг друга, эпидуральную анестезию в грудном отделе чаще выполняют с помощью околосрединного доступа, хотя иногда используют и срединный.
а. Срединный доступ (рис. 16-17). Оба доступа для торакальной эпидуральной анестезии обеспечивают блокаду дерматомов, соответствующих сегментам спинного мозга в области введения анестетика. Межостистые промежутки в этом отделе лучше всего идентифицируются в положении больного сидя. В верхнем грудном отделе остистые отростки позвонков наклонены под более острым углом, поэтому иглу здесъ следует направлять более краниалъно. Толщина надостистой и межостистой связки значительно меньше, чем в поясничном отделе, так что желтая связка здесь обычно находится на глубине не более чем 3-4 см от поверхности кожи. Внезапная утрата сопротивления свидетельствует о попадании в эпидуральное пространство. При пункции эпидуральной) пространства крани-альнее поясничного отдела возможен прямой контакт со спинным мозгом. Если при попытке пункции эпидуралъного пространства возникла интенсивная жгучая болъ, следует подумать прежде всего о прямом контакте иглы со спинным мозгом и рекомендуется немедленно извлечь иглу. Повторные контакты с костью без попадания в связки или эпидуральное пространство являются показанием к использованию околосрединного доступа.
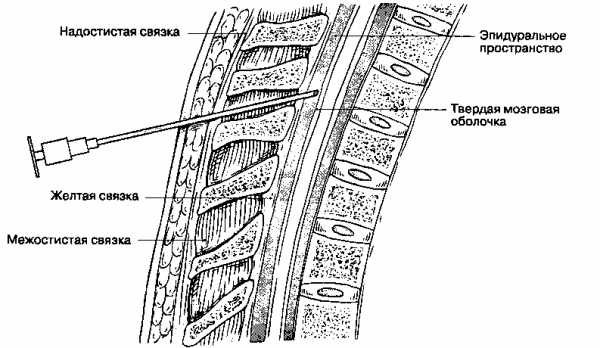
Рис. 16-17. Эпидуральная анестезия на грудном уровне: срединный доступ
б. Околосрединный доступ (рис. 16-18). Идентифицируются межостистые промежутки, кожу инфильтрируют раствором местного анестетика на 2 см латеральнее нижней точки вышерасположенного остистого отростка. Иглу вводят почти перпендикулярно к коже, под небольшим углом к срединной линии (10-15°) до контакта с пластинкой или ножкой позвонка. После этого иглу оттягивают назад и направляют немного краниаль-нее в попытке избежать контакта с пластинкой позвонка. Если это получается, то конец иглы должен находиться в контакте с желтой связкой. К игле присоединяют шприц и ее продвигают вперед, используют методику потери сопротивления или висячей капли. В отличие от околосрединного доступа в поясничном отделе, расстояние, которое должна преодолеть игла в грудном отделе до пересечения желтой связки, гораздо короче, эпидуральное пространство достигается быстрее.
3. Эпидуральная анестезия на шейном уровне (рис. 16-19). На уровне шейного отдела позвоночника эпидуральную пункцию выполняют в положении больного сидя с согнутой шеей. Эпидуральную иглу вводят по средней линии, как правило, в межостистом промежутке CV-CVI или CVI-CVII, и продвигают почти горизонтально в эпидуральное пространство, которое идентифицируют с помощью методики ";утраты сопротивления"; или, чаще, ";висячей капли";.
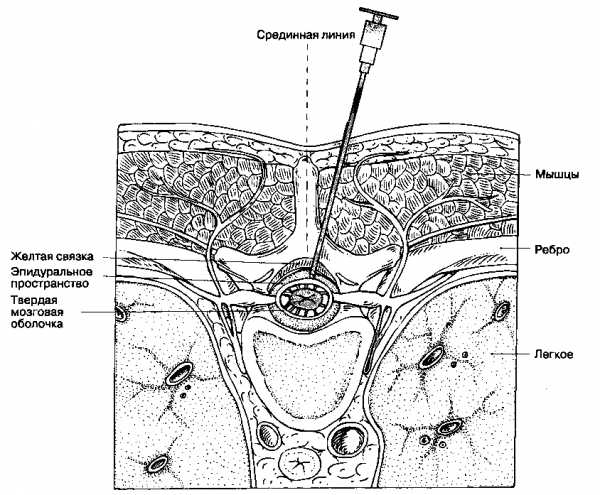
Рис. 16-18. Эпидуральная анестезия на грудном уровне: парамедианный (околосрединный) доступ
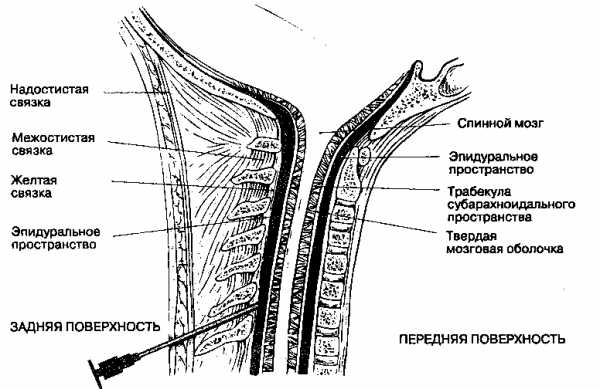
Рис. 16-19. Эпидуральная анестезия на шейном уровне: срединный доступ
Стратегия инъекции местного анестетика в эпидуральное пространство
Введение местного анестетика в эпидуральное пространство неизменно начинается с инъекции тест-дозы. С этой целью обычно применяют 3— 5 мл местного анестетика (например, лидокаина) в сочетании с адреналином в пропорции 1: 200 000. Тест-дозу можно вводить как через пункционную иглу, так и через катетер. Теоретически предварительная инъекция местного анестетика через иглу несколько растягивает эпидуральное пространство, что облегчает проведение катетера. С другой стороны, не исключено, что предварительное введение анестетика через иглу может завуалировать парестезии во время проведения катетера. Клинический опыт показывает, что тест-дозу можно вводить как через иглу, так и через катетер, обе тактики характеризуются высокой степенью удачной установки катетера и минимальным риском повреждения нервных структур. Если тест-доза попала в кровеносный сосуд, то спустя 30-60 с частота сердечных сокращений увеличится на 20 %. При инъекции в субарахноидалъное пространство в течение 3 мин разовьются симптомы спинномозговой анестезии.
Введение местного анестетика дробными дозами - важная мера безопасности при эпидуральной анестезии. Многие анестезиологи считают, что после тест-дозы следует вводить не более 5 мл анестетика одномоментно, и каждая последующая инъекция должна выполняться после предварительной аспирационной пробы, чтобы не пропустить случайного повреждения твердой мозговой оболочки или сосуда. Уменьшение разовой дозы до 5 мл и соблюдение интервала между инъекциями не менее 3-5 мин значительно уменьшает выраженность осложнений при непреднамеренном введении местного анестетика в субарахноидальное пространство или кровеносный сосуд. Попадание 5 мл анестетика в субарахноидальное пространство может привести к относительно высокой суб-арахноидальной блокаде, но в любом случае это предпочтительней, чем продолжительная тотальная спинномозговая блокада при случайном введении всей расчетной дозы.