Сульфит натрия формула
Сульфит натрия — Википедия
| Сульфит натрия | |||
|---|---|---|---|
| |||
({{{изображение}}}) | |||
| Хим. формула | Na2SO3 | ||
| Молярная масса | 126,037 г/моль | ||
| Плотность | 2,633 г/см³ | ||
| Температура | |||
| • плавления | 500 °C[1] | ||
| • разложения | 600 °C[1] | ||
| Растворимость | |||
| • в воде | 14,29 г/100 мл (0 °С) 26,10 г/100 мл (20 °С) 36,99 г/100 мл (40 °С) 29,20 г/100 мл (80 °С) | ||
| Рег. номер CAS | 7757-83-7 | ||
| PubChem | 24437 | ||
| Рег. номер EINECS | 231-821-4 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E221 | ||
| RTECS | WE2150000 | ||
| ChEBI | 86477 | ||
| ChemSpider | 22845 | ||
| Токсичность | умеренная | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
Сульфи́т на́трия (сернистокислый натрий) — неорганическое соединение, соль натрия и сернистой кислоты с формулой Na2SO3. Применяют в фотографии, при изготовлении тканей и вискозного волокна, при обработке руд цветных металлов и для обезвреживания сточных вод.
В фотографии впервые было использовано в 1882 году Х. Б. Беркли для пирогаллоловых проявителей с целью уменьшить пятна, возникающие на фотоматериале в процессе обработки. С 1882 года многие составы включали в себя сульфитные ионы, как правило с целями защиты проявителя от окисления, но в целом роль этих ионов была малопонятна и только спустя годы исследований удалось выявить значительный ряд функций этого соединения в составе проявляющих растворов [2].
Соединение имеет вид бесцветных кристаллов гексагональной сингонии с параметрами: a=0,5459 нм, с=0,6160 нм, z=2, пространственная группа C3. Плотность 2,633 г/см3. Растворим в воде, при этом с ростом температуры растворимость сначала растет (в 100 г воды): 14,29 г (при 0 °C), 26,10 г (при 20 °C), 36,99 г (при 40 °C), дальше падает: 29,20 г (при 80 °C). Предел температуры, после которой начинается уменьшение растворимости и начало кристаллизации — 33,4 °C[3].
Образует гептагидрат Na2SO3·7H2O при кристаллизации из водных растворов ниже 33,4 °C. Гептагидрат сульфита натрия имеет плотность 1,539 г/см3[3].
Сульфит натрия устойчив на воздухе при комнатной температуре, но при нагревании разлагается с образованием сульфата натрия и сульфида натрия, при этом при температуре выше 800 °C разложение идет до образования оксида натрия и диоксида серы[3].
Гептагидрат сульфита натрия во влажном воздухе легко окисляется до сульфата натрия, для замедления окисления используют ингибиторы — гидрохинон, пирогаллол, 1,4-фенилендиамин. В сухом воздухе гептагидрат не окисляется, но частично теряет кристаллизационную воду, полностью обезвоживаясь при температуре 150—160 °C [3].
Водные растворы сульфита натрия имеют щелочную реакцию, при их подкислении происходит выделение диоксида серы[4].
Сульфит натрия является сильным восстановителем. В водных растворах находится в частично гидролизованном состоянии, легко окисляется кислородом воздуха, перманганатом калия, бихроматом калия, бромом, иодом и другими окислителями до сульфата натрия. Растворы сульфита натрия поглощают диоксид серы, образуя гидросульфит натрия, а при кипячении присоединяют серу с образованием тиосульфата натрия. В кислых растворах хлорида титана (III), двуххлористого олова и хлорида железа (II) восстанавливается до дитионита натрия или до сульфида натрия[3].
Фотографические свойства[править | править код]
Многочисленные исследования свойств сульфита натрия в составе проявляющих растворов показали, что действие этого соединения не ограничивается узкой областью снижения количества пятен на эмульсии, образующихся в процессе обработки в некоторых окрашивающих проявителях, для чего это соединение было предложено изначально. Практически сразу сульфит натрия стал использоваться в своей роли основного универсального сохраняющего вещества, что было вызвано его многоаспектным действием на фотографические составы при всех этапах проявления и хранения растворов [5].
Антиоксидант[править | править код]
| Зависимость скорости окисления водного раствора смеси сульфита и метола при pH 6,6[6]. Ось X — доля сульфита в смеси; Ось Y — скорость поглощения O2, см3/мин. |
Основная роль сульфита натрия в составе фотографических проявляющих растворов заключается в защите органических проявляющих веществ от окисления кислородом воздуха. При высоком значении pH раствора проявляющее вещество в отсутствии сульфита быстро окисляется, становясь фотографически неактивным. Например, гидрохинон сначала превращается в хинон, вследствие чего раствор приобретает жёлтую окраску, а затем в фотографически неактивный оксихинон, окрашивающий раствор в тёмно-коричневый цвет. Небольшое количество сульфита натрия резко замедляет этот процесс за счет того, что вместо гидрохинона с кислородом в первую очередь будет реагировать сам сульфит с образованием сульфата натрия. Присутствие же органического проявляющего вещества, в свою очередь, является ингибитором процесса окисления сульфита кислородом [7].
Точный механизм ингибирования окисления органических проявляющих веществ неизвестен, но предполагается, что он обусловлен связыванием сульфитом натрия окрашенных окисленных форм проявляющих веществ, которые в несвязанном состоянии катализируют дальнейшее окисление своей неокисленной формы[7].
Окисление гидрохинона кислородом воздуха в растворах, содержащих сульфит натрия, будет происходить уже не с образованием хинона и оксихинона, а с образованием бесцветного добезилата натрия, который также является проявляющим веществом[7]:
- + O2 + 2 Na2SO3→h3O{\displaystyle {\ce {->[H_{2}O]}}} + Na2SO4 + NaOH
Разрыв цепи полимеризации[править | править код]
При проявлении гидрохиноном и его производными в растворе образуются семихиноны — высокоактивные и нестабильные соединения. Они имеют тенденцию к полимеризации в гуминовые кислоты, цепи которых в типичных условиях для фотографического проявления образуются из порядка 10 молекул окисленных остатков гидрохинона и имеют тёмную окраску. Так как на стадии образования семихинона сульфит реагирует с ним, то полимеризации, как правило, не происходит, а следовательно, не будет и каталитического воздействия данных полимерных соединений на неокисленную форму проявляющего вещества. Тем не менее, для пирогаллола сульфит не способен взаимодействовать с нерастворимыми окрашенными продуктами окисления, аналогично и для слабоокрашенных продуктов окисления фенидона и L-аскорбиновой кислоты[5].
Гуминовая кислота, образующаяся из 10 молекул гидроксигидрохинона в безсульфитных проявителях по Х. Тилю и Х. Кеттнеру[5]Обесцвечивающий агент[править | править код]
Сульфит натрия в описанном выше процессе связывания окрашенных форм образует бесцветные соединения, вместо сильноокрашенных, тем самым снижая нежелательные пятна и окраску результирующего изображения[5].
Поддержание активности проявления[править | править код]
Окисленные остатки проявляющего вещества в растворе, хотя и непосредственно не реагируют с галогенидом серебра в эмульсии, но изменяют pH среды и другие её показатели, что может вести либо к нарастанию скорости проявления, либо к её спаду. Лишь немногие проявляющие вещества не дают подобного эффекта. Рост активности наблюдается в проработавших растворах проявляющих веществ, имеющих активные гидроксогруппы, например у глицина-фото. Если же проявляющее вещество имеет только аминогруппы, то скорость проявления будет падать. Превращение окисленных форм в сульфонаты при реакции с сульфитом стабилизирует и поддерживает активность, тем самым позволяя избегнуть нежелательного пере- или недопроявления[5].
Сульфит натрия получают:
- взаимодействием растворов Na2CO3 с SO2:
- Na2CO3+SO2→Na2SO3+CO2{\displaystyle {\mathsf {Na_{2}CO_{3}+SO_{2}\rightarrow Na_{2}SO_{3}+CO_{2}}}}
- NaHSO3+NaOH→Na2SO3+h3O{\displaystyle {\mathsf {NaHSO_{3}+NaOH\rightarrow Na_{2}SO_{3}+H_{2}O}}}
- 2NaOH+SO2→Na2SO3+h3O{\displaystyle {\mathsf {2NaOH+SO_{2}\rightarrow Na_{2}SO_{3}+H_{2}O}}}
Безводную соль:
- 2NaHSO3+Ca(OH)2⟶CaSO3↓+Na2SO3+2h3O{\displaystyle {\ce {2NaHSO3 + Ca(OH)2 -> CaSO3v + Na2SO3 + 2h3O}}}
Применяют для удаления следов хлора после отбеливания тканей, для удаления серы из вискозного волокна после формования, как флотореагент для руд цветных металлов, в производстве пестицидов, для обезвреживания сточных вод, содержащих хром[3].
В фотографии используют как основное сохраняющее вещество в проявителях, входит в состав фиксажей и других растворов[8][3].
Временно допустимая концентрация в воздухе 0,1 мг/м3[3].
- ↑ 1 2 SODIUM SULFITE
- ↑ Haist, 1979, с. 220.
- ↑ 1 2 3 4 5 6 7 8 Белоусова, 1992.
- ↑ Стасиневич, 1964.
- ↑ 1 2 3 4 5 Haist, 1979, с. 220—229.
- ↑ Редько, 2006, с. 857.
- ↑ 1 2 3 Редько, 2006, с. 856.
- ↑ Гурлев, 1988, с. 296.
- Белоусова А. П. Натрия сульфит : статья // Химическая энциклопедия / Гл. ред. Кнунянц И. Л. — М. : Большая Российская энциклопедия, 1992. — Т. 3: Меди — Полимерные. — С. 186. — 639 с. — ISBN 5-85270-039-8.
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988. — ISBN 5-335-00125-4.
- Редько А. В. Химия фотографических процессов. — СПб. : НПО "Профессионал", 2006. — С. 837—954. — 1464 с. — (Новый справочник химика и технолога / ред. Москвин А. В. ; вып. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии.). — ISBN 978-5-91259-013-9.
- Стасиневич Д. С. Натрия сульфит : статья // Краткая химическая энциклопедия / Редкол.: Кнунянц И. Л. (отв. ред.) и др.. — М. : Советская энциклопедия, 1964. — Т. 3: Мальтаза—Пиролиз. — С. 384.
- Haist G. M. Modern Photographic Processing. — New York, Chichester, Brisbane, Toronto: John Whiley and sons, 1979. — Т. 1. — (Photographic science and technology and graphic arts). — ISBN 0-471-02228-4.
Сульфит натрия, характеристика, свойства и получение, химические реакции
Сульфит натрия, характеристика, свойства и получение, химические реакции.
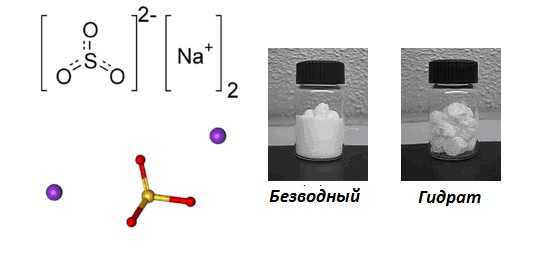
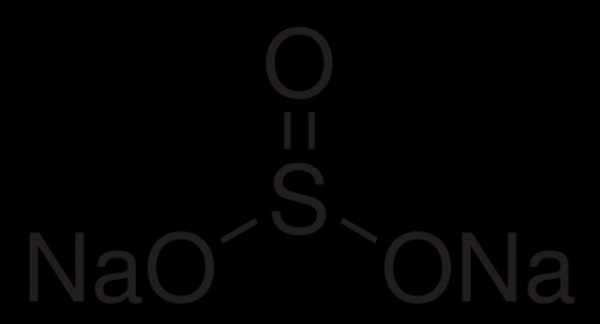
Сульфит натрия – неорганическое вещество, имеет химическую формулу Na2SO3.
Краткая характеристика сульфита натрия
Физические свойства сульфита натрия
Получение сульфита натрия
Химические свойства сульфита натрия
Химические реакции сульфита натрия
Применение и использование сульфита натрия
Краткая характеристика сульфита натрия:
Сульфит натрия – неорганическое вещество белого цвета.
Химическая формула сульфита натрия Na2SO3.
Сульфит натрия – неорганическое химическое соединение, соль сернистой кислоты и натрия.
Хорошо растворяется в воде.
Сульфит натрия образует с водой кристаллогидрат – гептагидрат Na2SO3·7H2O.
Устойчив на воздухе при комнатной температуре.
Сульфит натрия пожаро- и взрывобезопасен. Является умеренно токсичным веществом. Относится к веществам 3-го класса опасности по ГОСТ 12.1.007.
Физические свойства сульфита натрия:
| Наименование параметра: | Значение: |
| Химическая формула | Na2SO3 |
| Синонимы и названия иностранном языке | sodium sulfite (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные гексагональные кристаллы |
| Цвет | белый, бесцветный |
| Вкус | —* |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2633 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,633 |
| Температура разложения, °C | 600 |
| Температура плавления, °C | 500 |
| Молярная масса, г/моль | 126,037 |
| Растворимость в воде (20 oС), г/100 г | 26,10 |
* Примечание:
— нет данных.
Получение сульфита натрия:
Сульфит натрия получают в результате следующих химических реакций:
- 1. взаимодействия гидросульфита натрия и гидроксида натрия:
NaHSO3 + NaOH → Na2SO3 + H2O.
В ходе реакции используется концентрированный раствор гидроксида натрия.
- 2. взаимодействия карбоната натрия и оксида серы:
SO2 + Na2CO3 → Na2SO3 + CO2.
В ходе реакции используется концентрированный раствор карбоната натрия. Реакция протекает при комнатной температуре.
- 3. взаимодействия гидроксида натрия и оксида серы:
SO2 + 2NaOH → Na2SO3 + H2O.
В ходе реакции используется концентрированный раствор гидроксида натрия.
- 4. реакции термического разложения гидросульфита натрия:
2NaHSO3 → Na2SO3 + SO2 + H2O (t > 25 °C).
- 5. взаимодействия пероксида натрия и серы:
2Na2O2 + S → Na2SO3 + Na2O (t = 100 °C).
- 6. взаимодействия сульфата натрия и гидроксида бария:
Na2SO4 + Ba(OH)2 → BaSO4 + 2NaOH.
- 7. взаимодействия сульфата натрия и хлорида бария:
Na2SO4 + BaCl2 = BaSO4 + 2NaCl.
- 8. взаимодействия сульфата натрия и нитрата бария:
Na2SO4 + Ba(NO3)2 → 2NaNO3 + BaSO4.
- 9. взаимодействия гидроксида бария и оксида серы:
Ba(OH)2 + SO3 → BaSO4 + H2O.
- 10. взаимодействия гидросульфита натрия и гидроксида кальция:
2NaHSO3 + Ca(OH)2 → Na2SO3 + CaSO3 + H2O.
Химические свойства сульфита натрия. Химические реакции сульфита натрия:
Химические свойства сульфита натрия аналогичны свойствам сульфитов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция взаимодействия сульфита натрия и кислорода:
2Na2SO3 + O2 → 2Na2SO4.
В результате реакции образуется сульфат натрия.
2. реакция взаимодействия сульфита натрия и пероксида водорода:
Na2SO3 + H2O2 → Na2SO4 + H2O.
В результате реакции образуются сульфат натрия и вода.
3. реакция взаимодействия сульфита натрия и сероводорода:
Na2SO3 + 2H2S → 3S + 3H2O + 2Na.
В результате реакции образуются сера, вода и натрий.
4. реакция взаимодействия сульфита натрия и азотной кислоты:
Na2SO3 + 2HNO3 → Na2SO4 + 2NO2 + H2O (t°).
В результате реакции образуются сульфат натрия, оксид азота и вода. При этом в ходе реакции азотная кислота используется в виде горячего концентрированного раствора.
Аналогичным образом сульфит натрия реагирует и с другими минеральными кислотами.
5. реакция взаимодействия сульфита натрия и нитрата серебра:
2AgNO3 + Na2SO3 → Ag2SO3 + 2NaNO3.
В результате реакции образуются сульфит серебра и нитрит натрия.
6. реакция взаимодействия сульфита натрия и сульфата меди:
Na2SO3 + CuSO4 → CuSO3 + Na2SO4.
В результате реакции образуются сульфит меди и сульфат натрия.
7. реакция термического разложения сульфита натрия:
4Na2SO3 → 3Na2SO4 + Na2S (t = 600 °C).
В результате реакции образуются сульфат натрия и сульфид натрия.
8. реакция термического разложения гептагидрата сульфита натрия:
Na2SO3•7H2O → Na2SO3 + 7H2O (t = 150 °C).
В результате реакции образуются сульфит натрия и вода.
Применение и использование сульфита натрия:
Сульфит натрия используется во множестве отраслей промышленности и для бытовых нужд:
– в текстильной промышленности для удаления следов хлора после отбеливания тканей, удаления серы из вискозного волокна после формования и в качестве отбеливателя;
– для очистки сточных вод, содержащих хром;
– в целлюлозно-бумажной промышленности при очистке воды в качестве агента-поглотителя кислорода;
– в фотографии как основное сохраняющее вещество в проявителях, в составе фиксажей и других растворах;
– в химическом производстве как сульфирующее и сульфометилирующее вещество.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
сульфит натрия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие сульфита натрия
реакции
Коэффициент востребованности 1 075
Формула сульфита натрия в химии
Определение и формула сульфита натрия
Формула –
Молярная масса равна г/моль.
Физические свойства – белое кристаллическое вещество, плавится без разложения под воздействием избыточного давления.
Данная соль образует кристаллогидрат с формулой .
Насыщенный водный раствор соли имеет . При выдержке его на воздухе, в конечном итоге он окисляется до сульфата натрия. Если сульфит натрия оставить кристаллизоваться из водного раствора при комнатной температуре или ниже, он превращается в кристаллогидрат. Безводная форма значительно устойчивее к окислению воздухом.
Получение
Сульфит натрия может быть получен в лабораторных условиях путем химического взаимодействия гидроксида натрия с диоксидом серы:
Химические свойства сульфита натрия
Применение
Сульфит натрия в основном используется в целлюлозно-бумажной промышленности. Он находит применение в обработке воды в качестве кислород очищающего агента, для очистки воды, подаваемой в паровые котлы, для избежания проблем с коррозией, в фотографической промышленности для защиты решений разработчиков от окисления, в текстильной промышленности в качестве отбеливающего, обессеривающего и дехлорирующего агента. Он используется в химическом производстве как сульфирующий и сульфометилирующий агент. Он применяется в производстве тиосульфата натрия.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Сульфит натрия - это... Что такое Сульфит натрия?
Натрия сульфит (сернисто-кислый натрий) — бесцветные кристаллы; соль. Химическая формула — Na2SO3.
Свойства
Натрия сульфит — сильный восстановитель. При обычной температуре из водных растворов кристаллизуется Na2SO3×7H2O. В водных растворах легко окисляется кислородом воздуха. В водных растворах Na2SO3 присоединяет при нагревании серу с образованием тиосульфата натрия.
Получение
Натрия сульфит получают:
- взаимодействием растворов Na2CO3 с SO2:
Na2CO3 + SO2 → Na2SO3 + CO2↑
- нейтрализацией раствора NaHSO3 раствором соды при 38—40 °C с последующим охлаждением и кристаллизацией гептагидрата.
NaHSO3 + NaOH → Na2SO3 + H2O
2NaOH + SO2 → Na2SO3 + H2O
Безводную соль:
- выделяют кристаллизацией при 95—100 °C или обезвоживанием гептагидрата;
- получают реакцией NaHSO3 с Са(ОН)2;
- получают как побочный продукт при производстве фенола из бензолсульфокислоты.
После проведения следующей реакции получим сульфит натрия:
Применение
Натрия сульфит применяют как компонент фиксажей и проявителей в фотографии, для удаления следов хлора после отбеливания тканей, для удаления S из вискозного волокна после формования, как флотореагент для руд цветных металлов, в производстве пестицидов, для обезвреживания сточных вод, содержащих Сr, входит в состав фотографических проявителей. Временно допустимая концентрация в воздухе 0,1 мг/м³.
Ссылки
- ГОСТ 5644-75 Сульфит натрия безводный. Технические условия
| Растворимость кислот, оснований и солей в воде | |
|---|---|
| {| border="0" cellpadding="0" cellspacing="1" |- | | | |H+ | |Li+ | |K+ | |Na+ | |NH4+ | |Ba2+ | |Ca2+ | |Mg2+ | |Sr2+ | |Al3+ | |Cr3+ | |Fe2+ | |Fe3+ | |Ni2+ | |Co2+ | |Mn2+ | |Zn2+ | |Ag+ | |Hg2+ | |Hg22+ | |Pb2+ | |Sn2+ | |Cu+ | |Cu2+ |- | OH− | | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н |- | |F− | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |- | |Cl− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |- | |Br− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |- | |I− | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |- | |S2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | — | Н | Н | Н | Н |- | |SO32− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |- | |SO42− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |- | |NO3− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |- | |NO2− | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |- | |PO43− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |- | |CO32− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |- | |CH3COO− | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |- | |CN− | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |- | |SiO32− | H | Н | P | P | Силикат аммония| ? | Н | Н | Н | Н | Силикат алюминия(III)|? | Силикат хрома(III)|? | Н | Силикат железа(III)|? | Силикат никеля|? | Силикат кобальта(II)|? | Н | Н | Силикат серебра(I)|? | Силикат ртути(II)|? | ? | Н | Силикат олова(II)|? | Силикат меди(I)|? | Силикат меди(II)|? |} |
Сульфит натрия — Википедия
| Сульфит натрия | |
| < | |
| Общие | |
|---|---|
| Хим. формула | Na2SO3 |
| Физические свойства | |
| Молярная масса | 126,037 г/моль |
| Плотность | 2,633 г/см³ |
| Химические свойства | |
| Растворимость в воде | 14,29 г/100 мл (0 °С) 26,10 г/100 мл (20 °С) 36,99 г/100 мл (40 °С) 29,20 г/100 мл (80 °С) |
| Классификация | |
| Рег. номер CAS | 7757-83-7 |
| PubChem | 24437 |
| Рег. номер EINECS | 231-821-4 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E221 |
| RTECS | WE2150000 |
| ChEBI | 86477 |
| ChemSpider | 22845 |
| Безопасность | |
| Токсичность | умеренная |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Сульфи́т на́трия (сернистокислый натрий) — неорганическое соединение, соль натрия и сернистой кислоты с формулой Na2SO3. Применяют в фотографии, при изготовлении тканей и вискозного волокна, при обработке руд цветных металлов и для обезвреживания сточных вод.
Физические свойства
Соединение имеет вид бесцветных кристаллов гексагональной сингонии с параметрами: a=0,5459 нм, с=0,6160 нм, z=2, пространственная группа C3. Плотность 2,633 г/см3. Растворим в воде, при этом с ростом температуры растворимость сначала растет (в 100 г воды): 14,29 г (при 0 °C), 26,10 г (при 20 °C), 36,99 г (при 40 °C), дальше падает: 29,20 г (при 80 °C). Предел температуры, после которой начинается уменьшение растворимости и начало кристаллизации — 33,4 °C[1].
Образует гептагидрат Na2SO3·7H2O при кристаллизации из водных растворов ниже 33,4 °C. Гептагидрат сульфита натрия имеет плотность 1,539 г/см3[1].
Химические свойства
Сульфит натрия устойчив на воздухе при комнатной температуре, но при нагревании разлагается с образованием сульфата натрия и сульфида натрия, при этом при температуре выше 800 °C разложение идет до образования оксида натрия и диоксида серы[1].
Гептагидрат сульфита натрия во влажном воздухе легко окисляется до сульфата натрия, для замедления окисления используют ингибиторы — гидрохинон, пирогаллол, 1,4-фенилендиамин. В сухом воздухе гептагидрат не окисляется, но частично теряет кристаллизационную воду, полностью обезвоживаясь при температуре 150—160 °C[1].
Сульфит натрия является сильным восстановителем. В водных растворах находится в частично гидролизованном состоянии, легко окисляется кислородом воздуха, перманганатом калия, бихроматом калия, бромом, иодом и другими окислителями до сульфата натрия. Растворы сульфита натрия поглощают диоксид серы, образуя гидросульфит натрия, а при кипячении присоединяют серу с образованием тиосульфата натрия. В кислых растворах хлорида титана (III), двуххлористого олова и хлорида железа (II) восстанавливается до дитионита натрия или до сульфида натрия[1]. Реагирует с перекисью водорода(реакция экзотермическая)
Na2SO3+h3O2 → Na2SO4+h3O+15°C
Фотографические свойства
| Зависимость скорости окисления водного раствора смеси сульфита и метола при pH 6,6[2]. Ось X — доля сульфита в смеси; Ось Y — скорость поглощения O2, см3/мин. |
Основная роль сульфита натрия в составе фотографических проявляющих растворов заключается в защите органических проявляющих веществ от окисления кислородом воздуха. При высоком значении pH раствора проявляющее вещество в отсутствии сульфита быстро окисляется, становясь фотографически неактивным. Например, гидрохинон сначала превращается в хинон, вследствии чего раствор приобретает жёлтую окраску, а затем в фотографически неактивный оксихинон, окрашивающий раствор в тёмно-коричневый цвет. Небольшое количество сульфита натрия резко замедляет этот процесс за счет того, что вместо гидрохинона с кислородом в первую очередь будет реагировать сам сульфит с образованием сульфата натрия. Присутствие же органического проявляющего вещества, в свою очередь, является ингибитором процесса окисления сульфита кислородом[3].
Точный механизм ингибирования окисления органических проявляющих веществ неизвестен, но предполагается, что он обусловлен связыванием сульфитом натрия окрашенных окисленных форм проявляющих веществ, которые в несвязанном состоянии катализируют дальнейшее окисление своей неокисленной формы[3].
Окисление гидрохинона кислородом воздуха в растворах, содержащих сульфит натрия, будет происходить уже не с образованием хинона и оксихинона, а с образованием бесцветного добезилата натрия, который также является проявляющим веществом[3]:
- + O2 + 2 Na2SO3→h3O{\displaystyle {\ce {->[H_{2}O]}}} + Na2SO4 + NaOH
Получение
Сульфит натрия получают:
- взаимодействием растворов Na2CO3 с SO2:
- Na2CO3+SO2→Na2SO3+CO2{\displaystyle {\mathsf {Na_{2}CO_{3}+SO_{2}\rightarrow Na_{2}SO_{3}+CO_{2}}}}
- NaHSO3+NaOH→Na2SO3+h3O{\displaystyle {\mathsf {NaHSO_{3}+NaOH\rightarrow Na_{2}SO_{3}+H_{2}O}}}
- 2NaOH+SO2→Na2SO3+h3O{\displaystyle {\mathsf {2NaOH+SO_{2}\rightarrow Na_{2}SO_{3}+H_{2}O}}}
Безводную соль:
- 2NaHSO3+Ca(OH)2⟶CaSO3↓+Na2SO3+2h3O{\displaystyle {\ce {2NaHSO3 + Ca(OH)2 -> CaSO3v + Na2SO3 + 2h3O}}}
Применение
Применяют для удаления следов хлора после отбеливания тканей, для удаления серы из вискозного волокна после формования, как флотореагент для руд цветных металлов, в производстве пестицидов, для обезвреживания сточных вод, содержащих хром.
В фотографии используют как основное сохраняющее вещество в проявителях, входит в состав других растворов[4].
Безопасность
Временно допустимая концентрация в воздухе 0,1 мг/м3[1].
Примечания
Литература
- Белоусова А. П. Натрия сульфит : статья // Химическая энциклопедия / Гл. ред. Кнунянц И. Л. — М. : Большая Российская энциклопедия, 1992. — Т. 3: Меди — Полимерные. — С. 186. — 639 с. — ISBN 5-85270-039-8.
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988. — ISBN 5-335-00125-4.
- Редько А. В. Химия фотографических процессов. — СПб. : НПО "Профессионал", 2006. — С. 837—954. — 1464 с. — (Новый справочник химика и технолога / ред. Москвин А. В. ; вып. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии.). — ISBN 978-5-91259-013-9.
Ссылки
- ГОСТ 5644-75 Сульфит натрия безводный. Технические условия
Общая характеристика cульфита натрия
Синонимы: сернистокислый натрий, Sodium sulfite, Na2SO3.Сульфит натрия представляет собой растворимую натриевую соль серной кислоты. Это продукт очистки газа (десульфурации дымовых газов). Он также используется как консервант для предотвращения изменения цвета сухофруктов для сохранения мяса. Используется таким же образом, как тиосульфат натрия для преобразования элементарных галогенов в их соответствующие галогенводородные кислоты. Применяется в фотографии и для снижения концентрации хлора в бассейнах.
Сульфит натрия разлагает даже слабые кислоты, отдавая газообразный диоксид серы:
Na2SO3 + 2 H+ → 2 Na+ + H2O + SO2
Насыщенный водный раствор имеет рН ~ 9. Водный раствор на воздухе, в конечном итоге окисляется до сульфата натрия. Если сульфит натрия оставляют для кристаллизации из водного раствора при комнатной температуре или ниже, то он преобразовывается в гептагидрат. Кристаллы-гептагидраты выветриваются на теплом сухом воздухе и окисляются с образованием сульфата. Безводная форма гораздо более устойчива к окислению на воздухе.
Получение cульфита натрия
Сульфит натрия может быть получен в лаборатории путем взаимодействия раствора гидроксида натрия с диоксидом серы:2NaOH+ SO2 → Na2SO3 + H2O
Выделиние SO2 добавлением нескольких капель концентрированной соляной кислоты укажет, что гидроксида натрия почти нет, так как он превратился в водный раствор сульфита натрия:
Na2SO3 + 2 HCl → 2 NaCl + SO2 + H2O
Сульфит натрия производится в промышленных масштабах взаимодействием диоксида серы с раствором карбоната натрия. Начальные комбинации генерируют бисульфит натрия (NaHSO3), который превращает в сульфит реакцией с гидроксидом натрия или карбонатом натрия:
Общая реакция:
SO2 + H2O + Na2CO3 → Na2SO3 + CO2
Применение cульфита натрия
Сульфит натрия в основном используется в целлюлозно-бумажной промышленности. Он применяется при очистке воды в качестве агента-поглотителя кислорода. В фотографической промышленности для защиты разработчиком растворов от окисления и (как гипопрозрачный раствор), чтобы вымыть фиксатор (тиосульфат натрия) из фотопленки, фотобумаги, эмульсии. В текстильной промышленности в качестве отбеливателя. Как дехлорирующей агент, а в кожаной торговли для сульфуризации дубильных экстрактов. Он используется для очистки TNT (тринитротолуол) для военных целей. Он применяется в производстве тиосульфата натрия.Характеристики cульфита натрия
| Характеристики | Показатели |
| CAS - номер | 7757-83-7 |
| Молекулярная формула | Na2SO3 |
| Молекулярный вес , г/моль | 126,037 |
| Плотность, г/см3 | 2,63 |
| Температура плавления, °C | 500 |
| Растворимость в воде (КТ), г/л | 678 |
Автор: Виктор Епифанов
Раствор сульфита натрия - применение, свойства, вред
Сульфит натрия – это синтетически созданный консервант, применяющийся в пищевой, фармацевтической и легкой промышленности.
На этикетках пищевых продуктов сульфит натрия значится как Е221. Еще одно распространенное название консерванта – это Sodium Sulphite. Химическая формула сульфита натрия – Na2SO3.
Добавку сульфит натрия официально разрешено использовать в пищевой промышленности в странах Европейского Союза, в России, Украине. Обязательное условие – применение консерванта в допустимых нормах.
В России суточная норма потребления сульфита натрия составляет 0,7 мг/кг веса человека.
В чистом виде сульфит натрия выглядит как порошок белого цвета. Он растворяется в воде и спирте. В жирах Е221 не растворяется.
Применение сульфита натрия в пищевой промышленности
Прежде всего, сульфит натрия – это консервант, но в пищевой промышленности его используют также в качестве отбеливателя, антиоксиданта, хладагента, восстановителя.
Е221 незаменим для производства в большом объеме мармелада, зефира, варенья, пастилы, повидла, джема, соков и пюре из фруктов и ягод, ягодных полуфабрикатов, овощного пюре.
Раствор сульфита натрия используют для обработки целых и порезанных фруктов, сухофруктов при подготовке их к реализации.
Добавку используют также производители полуфабрикатов из грибов и картофеля, фруктов и овощей, фруктовых экстрактов с желирующим действием, мороженных, консервированных и сухих фруктов и овощей.
 Сульфит натрия применяют для производства повидла с минимальным содержанием сахара, кондитерских изделий, конфет, консервов из соленой, вяленой рыбы и ракообразных головоногих, колбасных изделий.
Сульфит натрия применяют для производства повидла с минимальным содержанием сахара, кондитерских изделий, конфет, консервов из соленой, вяленой рыбы и ракообразных головоногих, колбасных изделий.
Применение сульфита натрия помогает предотвратить потемнение фруктов и овощей, появление бактерий в сырье для производства пищевой продукции.
Активно используется сульфит натрия и виноделами. Добавка Е221 улучшает устойчивость алкогольного напитка к воздействию патогенных микроорганизмов, сохраняет окраску исходного сырья, улучшает восстановительный и окислительный потенциал готового вина.
Вред сульфита натрия
Сульфит натрия в большом количестве, превышающем норму, опасен для человека. Добавку Е221 в чистом виде нежелательно вдыхать, глотать, наносить на кожу и глаза.
Известны случаи, когда передозировка и индивидуальная непереносимость сульфита натрия приводила к почечной недостаточности, развитию астматического приступа, нарушению водно-солевого обмена, появлению аллергической реакции, заболеваниям ЖКТ.
При систематическом применении сульфита натрия человек лишается витаминов В1 и Е.
Детям нежелательно давать продукты, обработанные или содержащие сульфит натрия.
Также следует учитывать, что под действием кислот сульфит натрия превращается в диоксид серы, который относят к веществам третьего класса опасности для человеческого организма.
Сульфит натрия — Википедия
| Сульфит натрия | |
|---|---|
| < | |
| Хим. формула | Na2SO3 |
| Молярная масса | 126,037 г/моль |
| Плотность | 2,633 г/см³ |
| Т. плав. | 500 °C[1] |
| 600 °C[1] | |
| Растворимость в воде | 14,29 г/100 мл (0 °С) 26,10 г/100 мл (20 °С) 36,99 г/100 мл (40 °С) 29,20 г/100 мл (80 °С) |
| Рег. номер CAS | 7757-83-7 |
| PubChem | 24437 |
| Рег. номер EINECS | 231-821-4 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E221 |
| RTECS | WE2150000 |
| ChEBI | 86477 |
| ChemSpider | 22845 |
| Токсичность | умеренная |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Сульфи́т на́трия (сернистокислый натрий) — неорганическое соединение, соль натрия и сернистой кислоты с формулой Na2SO3. Применяют в фотографии, при изготовлении тканей и вискозного волокна, при обработке руд цветных металлов и для обезвреживания сточных вод.
История
В фотографии впервые было использовано в 1882 году Х. Б. Беркли для пирогаллоловых проявителей с целью уменьшить пятна, возникающие на фотоматериале в процессе обработки. С 1882 года многие составы включали в себя сульфитные ионы, как правило с целями защиты проявителя от окисления, но в целом роль этих ионов была малопонятна и только спустя годы исследований удалось выявить значительный ряд функций этого соединения в составе проявляющих растворов[2].
Физические свойства
Соединение имеет вид бесцветных кристаллов гексагональной сингонии с параметрами: a=0,5459 нм, с=0,6160 нм, z=2, пространственная группа C3. Плотность 2,633 г/см3. Растворим в воде, при этом с ростом температуры растворимость сначала растет (в 100 г воды): 14,29 г (при 0 °C), 26,10 г (при 20 °C), 36,99 г (при 40 °C), дальше падает: 29,20 г (при 80 °C). Предел температуры, после которой начинается уменьшение растворимости и начало кристаллизации — 33,4 °C[3].
Образует гептагидрат Na2SO3·7H2O при кристаллизации из водных растворов ниже 33,4 °C. Гептагидрат сульфита натрия имеет плотность 1,539 г/см3[3].
Химические свойства
Сульфит натрия устойчив на воздухе при комнатной температуре, но при нагревании разлагается с образованием сульфата натрия и сульфида натрия, при этом при температуре выше 800 °C разложение идет до образования оксида натрия и диоксида серы[3].
Гептагидрат сульфита натрия во влажном воздухе легко окисляется до сульфата натрия, для замедления окисления используют ингибиторы — гидрохинон, пирогаллол, 1,4-фенилендиамин. В сухом воздухе гептагидрат не окисляется, но частично теряет кристаллизационную воду, полностью обезвоживаясь при температуре 150—160 °C[3].
Водные растворы сульфита натрия имеют щелочную реакцию, при их подкислении происходит выделение диоксида серы[4].
Сульфит натрия является сильным восстановителем. В водных растворах находится в частично гидролизованном состоянии, легко окисляется кислородом воздуха, перманганатом калия, бихроматом калия, бромом, иодом и другими окислителями до сульфата натрия. Растворы сульфита натрия поглощают диоксид серы, образуя гидросульфит натрия, а при кипячении присоединяют серу с образованием тиосульфата натрия. В кислых растворах хлорида титана (III), двуххлористого олова и хлорида железа (II) восстанавливается до дитионита натрия или до сульфида натрия[3].
Фотографические свойства
Многочисленные исследования свойств сульфита натрия в составе проявляющих растворов показали, что действие этого соединения не ограничивается узкой областью снижения количества пятен на эмульсии, образующихся в процессе обработки в некоторых окрашивающих проявителях, для чего это соединение было предложено изначально. Практически сразу сульфит натрия стал использоваться в своей роли основного универсального сохраняющего вещества, что было вызвано его многоаспектным действием на фотографические составы при всех этапах проявления и хранения растворов[5].
Антиоксидант
| Зависимость скорости окисления водного раствора смеси сульфита и метола при pH 6,6[6]. Ось X — доля сульфита в смеси; Ось Y — скорость поглощения O2, см3/мин. |
Основная роль сульфита натрия в составе фотографических проявляющих растворов заключается в защите органических проявляющих веществ от окисления кислородом воздуха. При высоком значении pH раствора проявляющее вещество в отсутствии сульфита быстро окисляется, становясь фотографически неактивным. Например, гидрохинон сначала превращается в хинон, вследствии чего раствор приобретает жёлтую окраску, а затем в фотографически неактивный оксихинон, окрашивающий раствор в тёмно-коричневый цвет. Небольшое количество сульфита натрия резко замедляет этот процесс за счет того, что вместо гидрохинона с кислородом в первую очередь будет реагировать сам сульфит с образованием сульфата натрия. Присутствие же органического проявляющего вещества, в свою очередь, является ингибитором процесса окисления сульфита кислородом[7].
Точный механизм ингибирования окисления органических проявляющих веществ неизвестен, но предполагается, что он обусловлен связыванием сульфитом натрия окрашенных окисленных форм проявляющих веществ, которые в несвязанном состоянии катализируют дальнейшее окисление своей неокисленной формы[7].
Окисление гидрохинона кислородом воздуха в растворах, содержащих сульфит натрия, будет происходить уже не с образованием хинона и оксихинона, а с образованием бесцветного добезилата натрия, который также является проявляющим веществом[7]:
- + O2 + 2 Na2SO3→h3O{\displaystyle {\ce {->[H_{2}O]}}} + Na2SO4 + NaOH
Разрыв цепи полимеризации
При проявлении гидрохиноном и его производными в растворе образуются семихиноны — высокоактивные и нестабильные соединения. Они имеют тенденцию к полимеризации в гуминовые кислоты, цепи которых в типичных условиях для фотографического проявления образуются из порядка 10 молекул окисленных остатков гидрохинона и имеют тёмную окраску. Так как на стадии образования семихинона сульфит реагирует с ним, то полимеризации, как правило, не происходит, а следовательно, не будет и каталитического воздействия данных полимерных соединений на неокисленную форму проявляющего вещества. Тем не менее, для пирогаллола сульфит не способен взаимодействовать с нерастворимыми окрашенными продуктами окисления, аналогично и для слабоокрашенных продуктов окисления фенидона и L-аскорбиновой кислоты[5].
Гуминовая кислота, образующаяся из 10 молекул гидроксигидрохинона в безсульфитных проявителях по Х. Тилю и Х. Кеттнеру[5]Обесцвечивающий агент
Сульфит натрия в описанном выше процессе связывания окрашенных форм образует бесцветные соединения, вместо сильноокрашенных, тем самым снижая нежелательные пятна и окраску результирующего изображения[5].
Поддержание активности проявления
Окисленные остатки проявляющего вещества в растворе, хотя и непосредственно не реагируют с галогенидом серебра в эмульсии, но изменяют pH среды и другие её показатели, что может вести либо к нарастанию скорости проявления, либо к её спаду. Лишь немногие проявляющие вещества не дают подобного эффекта. Рост активности наблюдается в проработавших растворах проявляющих веществ, имеющих активные гидроксогруппы, например у глицина-фото. Если же проявляющее вещество имеет только аминогруппы, то скорость проявления будет падать. Превращение окисленных форм в сульфонаты при реакции с сульфитом стабилизирует и поддерживает активность, тем самым позволяя избегнуть нежелательного пере- или недопроявления[5].
Получение
Сульфит натрия получают:
- взаимодействием растворов Na2CO3 с SO2:
- Na2CO3+SO2→Na2SO3+CO2{\displaystyle {\mathsf {Na_{2}CO_{3}+SO_{2}\rightarrow Na_{2}SO_{3}+CO_{2}}}}
- NaHSO3+NaOH→Na2SO3+h3O{\displaystyle {\mathsf {NaHSO_{3}+NaOH\rightarrow Na_{2}SO_{3}+H_{2}O}}}
- 2NaOH+SO2→Na2SO3+h3O{\displaystyle {\mathsf {2NaOH+SO_{2}\rightarrow Na_{2}SO_{3}+H_{2}O}}}
Безводную соль:
- 2NaHSO3+Ca(OH)2⟶CaSO3↓+Na2SO3+2h3O{\displaystyle {\ce {2NaHSO3 + Ca(OH)2 -> CaSO3v + Na2SO3 + 2h3O}}}
Применение
Применяют для удаления следов хлора после отбеливания тканей, для удаления серы из вискозного волокна после формования, как флотореагент для руд цветных металлов, в производстве пестицидов, для обезвреживания сточных вод, содержащих хром[3].
В фотографии используют как основное сохраняющее вещество в проявителях, входит в состав фиксажей и других растворов[8][3].
Безопасность
Временно допустимая концентрация в воздухе 0,1 мг/м3[3].
Примечания
- ↑ 1 2 SODIUM SULFITE
- ↑ Haist, 1979, с. 220.
- ↑ 1 2 3 4 5 6 7 8 Белоусова, 1992.
- ↑ Стасиневич, 1964.
- ↑ 1 2 3 4 5 Haist, 1979, с. 220—229.
- ↑ Редько, 2006, с. 857.
- ↑ 1 2 3 Редько, 2006, с. 856.
- ↑ Гурлев, 1988, с. 296.
Литература
- Белоусова А. П. Натрия сульфит : статья // Химическая энциклопедия / Гл. ред. Кнунянц И. Л. — М. : Большая Российская энциклопедия, 1992. — Т. 3: Меди — Полимерные. — С. 186. — 639 с. — ISBN 5-85270-039-8.
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988. — ISBN 5-335-00125-4.
- Редько А. В. Химия фотографических процессов. — СПб. : НПО "Профессионал", 2006. — С. 837—954. — 1464 с. — (Новый справочник химика и технолога / ред. Москвин А. В. ; вып. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии.). — ISBN 978-5-91259-013-9.
- Стасиневич Д. С. Натрия сульфит : статья // Краткая химическая энциклопедия / Редкол.: Кнунянц И. Л. (отв. ред.) и др.. — М. : Советская энциклопедия, 1964. — Т. 3: Мальтаза—Пиролиз. — С. 384.
- Haist G. M. Modern Photographic Processing. — New York, Chichester, Brisbane, Toronto: John Whiley and sons, 1979. — Т. 1. — (Photographic science and technology and graphic arts). — ISBN 0-471-02228-4.
Ссылки
сульфит натрия - Sodium sulfite
| |||
| имена | |||
|---|---|---|---|
| название IUPAC сульфит натрия | |||
| Другие имена Hypo ясно (фотография) | |||
| Идентификаторы | |||
| 3D модель ( JSmol ) | |||
| ChEBI | |||
| ChemSpider | |||
| ИКГВ InfoCard | 100.028.929 | ||
| Номер EC | 231-821-4 | ||
| номер E | E221 (консерванты) | ||
| номер RTECS | WE2150000 | ||
| UNII | |||
| |||
| |||
| свойства | |||
| Na 2 SO 3 | |||
| Молярная масса | 126,043 г / моль | ||
| Внешность | твердое вещество белого цвета | ||
| запах | непахнущий | ||
| плотность | 2,633 г / см 3 (безводный) 1,561 г / см 3 (гептагидрат) | ||
| Температура плавления | 33,4 ° С (92,1 ° F, 306,5 К) (дегидратация гептагидрата) 500 ° С (безводный) | ||
| Точка кипения | разлагается | ||
| 27,0 г / 100 мл воды (20 ° С) | |||
| Растворимость | Растворимые в глицерине Нерастворимо в аммиак , хлор , | ||
| войти P | -4 | ||
| Кислотность (р К ) | ~ 9 (гептагидрат) | ||
| 1,565 | |||
| Состав | |||
| Шестигранный (безводный) моноклинный (гептагидрат) | |||
| опасности | |||
| Паспорт безопасности | ICSC 1200 | ||
| NFPA 704 | |||
| точка возгорания | Негорючий | ||
| Родственные соединения | |||
| селенит натрия | |||
| Калий сульфита | |||
| Родственные соединения | Бисульфит натрия метабисульфит натрия сульфат натрия | ||
| За исключением случаев, когда указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| N проверить ( что ?) YN | |||
| ссылки Infobox | |||
Сульфита натрия ( сульфитный натрия ) представляет собой растворимый натрия соль из сернистой кислоты ( сульфитной ) с химической формулой Na 2 SO 3 . Он также используется в качестве консерванта , чтобы предотвратить сухофрукты от обесцвечивать, а также для сохранения мяса, и используется таким же образом , как тиосульфат натрия , чтобы превратить элементарные галогены в их соответствующие галогенводородных кислоты, в фотографии и для уменьшения хлора уровней в бассейнах. В системах с котлом, сульфит и бисульфит являются наиболее часто используемыми поглотителями кислорода , используемые для предотвращения точечной коррозии. Сульфит натрия является также побочным продуктом двуокиси серы промывки, частью десульфуризации дымовых газов процесса.
подготовка
Сульфита натрия может быть получена в лаборатории путем реакции гидроксида натрия раствора с газообразным диоксидом серы:
- 2 NaOH + СО 2 → Na 2 SO 3 + H 2 O
Эволюция SO 2 , добавив несколько капель концентрированной соляной кислоты будет указывать , если гидроксид натрия почти нет, обратилась к водному раствору сульфита натрия:
- Na 2 SO 3 + 2 HCl → 2 NaCl + SO 2 + Н 2 О
Сульфита натрия производится в промышленности путем взаимодействия диоксида серы с раствором карбоната натрия. Исходная комбинация формирует бисульфит натрия (NaHSO 3 ), который превращает в сульфит путем реакции с гидроксидом натрия или карбонатом натрия.
Общая реакция:
- SO 2 + Na 2 CO 3 → Na 2 SO 3 + CO 2
Приложения
Сульфит натрия в основном используется в целлюлозно-бумажной промышленности . Он используется при обработке воды в качестве поглотителя агента кислорода, для очистки воды, подаваемой в паровые котлы , чтобы избежать проблем коррозии, в фотографической промышленности , чтобы защитить решения для разработчиков от окисления и (как гипо- прозрачного раствора) , чтобы вымыть закрепитель ( тиосульфат натрия ) из кино и фото-бумага эмульсии, в текстильной промышленности в качестве отбеливающего, десульфурации и дехлорирующего агента и в кожаной торговле для сульфирования дубильных экстрактов. Он используется для очистки тротила для использования в военных целях. Он используется в химическом производстве в качестве сульфирования и sulfomethylation агента. Он используется в производстве тиосульфата натрия . Он используется в других приложениях, в том числе пенной флотации руд, извлечения нефти , пищевых консервантов , и делает красители .
Реакции
Сульфита натрия образует бисульфит аддукта с альдегидами , так и с кетонами образует сульфоновый кислоту . Он используется для очистки или выделения альдегидов и кетонов.
Описательная химия
Сульфит натрия разлагается даже слабых кислот, отказавшись от диоксида серы газа.
- Na 2 SO 3 + 2 Н + → 2 Na + + H 2 O + SO 2
Насыщенный водный раствор имеет рН ~ 9. Растворы подвергаются воздействию воздуха, в конечном итоге окисляется до сульфата натрия . Если сульфит натрия оставляют кристаллизоваться из водного раствора при комнатной температуре или ниже, он делает это как гептагидрат. Кристаллы гептагидрата высолов в теплом сухом воздухе. Гептагидрат кристаллы также окисляются на воздухе с образованием сульфата. Безводная форма является гораздо более устойчивы к окислению воздуха.
Рекомендации
<img src="https://en.wikipedia.org//en.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1x1" alt="" title="">Пиросульфит натрия — Википедия
Материал из Википедии — свободной энциклопедии
| Пиросульфит натрия | |
|---|---|
| ( {{{картинка}}}) | |
| Систематическое наименование | метабисульфит натрия |
| Сокращения | E 223 |
| Традиционные названия | пиросульфит натрия |
| Хим. формула | Na2(SO2SO3) |
| Состояние | твердое |
| Молярная масса | 190,11 г/моль |
| Плотность | 2,36 г/см³ |
| Температура | |
| • плавления | 150 °C |
| • разложения | 302 ± 1 °F[1] |
| Растворимость | |
| • в воде | 54,0 - 65,0 г/100 мл |
| Рег. номер CAS | 7681-57-4 |
| PubChem | 656671 |
| Рег. номер EINECS | 231-673-0 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E223 |
| RTECS | UX8225000 |
| ChEBI | 114786 |
| ChemSpider | 571015 |
| Пиктограммы ECB | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Пиросульфит натрия (Na2S2O5), или метабисульфит натрия, или натрий пиросернистокислый — соль пиросернистой кислоты, белый или желтоватый кристаллический порошок с резким запахом. Иногда называют также бисульфит натрия, натрий пиросульфит, натрий метабисульфит.
В воде легко происходит гидролиз с превращением в гидросульфит натрия:
- Na2S2O5+h3O⇌2NaHSO3{\displaystyle {\mathsf {Na_{2}S_{2}O_{5}+H_{2}O\rightleftharpoons 2NaHSO_{3}}}}
При нагревании соли происходит термическое разложение с выделением диоксида серы (SO2):
- Na2S2O5→TNa2SO3+SO2{\displaystyle {\mathsf {Na_{2}S_{2}O_{5}{\xrightarrow {T}}Na_{2}SO_{3}+SO_{2}}}}
- Пищевая промышленность: применяется как консервант, антиоксидант, отбеливатель и разрыхлитель, используется при производстве фруктовых соков, сладостей, вина и пива. Безопасная ежедневная норма до 0.7 мг на килограмм веса тела. В печени окисляется до безопасных сульфатов и выводится с мочой. Способен вызвать реакцию у аллергиков.
- Фармацевтическая промышленность: применяется в качестве наполнителя в некоторых таблетках, вспомогательного вещества в инъекционных лекарственных препаратах, системах фильтрации воды, для дезинфекции оборудования.
- Химическая промышленность.
- Сельское хозяйство: используется для удаления пней.
Пиросульфит натрия является трудногорючим и взрывобезопасным веществом, по степени воздействия на организм относится к веществам 3-го класса опасности. Опасности по ГН-98 отсутствуют.
Пиросульфит натрия вреден при попадании внутрь организма и в глаза. Работать с ним нужно в очках, маске и перчатках. При попадании в глаза их необходимо промыть большим количеством воды и обратиться к врачу.
При взаимодействии с водой и кислотами или нагревании выше температуры 65 °C выделяет токсичный газ — сернистый ангидрид SO2.
Пиросульфит натрия (метабисульфит натрия) получают взаимодействием сернистого ангидрида с содово-сульфитным раствором.
• Пиросульфит натрия технический. ГОСТ 11683-76[2]
Сульфит натрия: применение — Секретница

Содержание статьи
Сульфит натрия – это растворимое натриевое соединение.
Сульфит натрия – формула

Химическая формула вещества – Na2SO3.
Сульфит натрия – это растворимая натриевая соль сернистой кислоты с молекулярной массой 126,04.
Сульфит взаимодействует с раствором карбоната натрия и диоксидом серы. Процесс сжигания серы завершается образованием двуокиси серы или газа SO2.
Продукт очистки SO2 входит в процесс десульфуризации дымовых газов. Сгенерированный газ SO2 вводят в раствор карбоната натрия в абсорбере, и, контролируя pH и режим работы кристаллизатора, получают сульфит натрия.
Потребление угля для производства сульфита значительно сокращается, когда оптимизированный процесс получения вещества заменяется традиционным процессом.
Содержание сульфита определяют реакцией образца с избытком йода (освобожденным от реакции йода калия в кислых условиях).
Применение сульфита натрия
Сульфит натрия в основном используется для получения целлюлозы, картона, бумаги (выполняет отбеливающую функцию бумажной продукции).
Сульфитом очищают воду (используют в качестве реагента, который забирает кислород). Дехлорирование хлорированных вод осуществляется путем добавления таблеток, содержащих 90% сульфита натрия.
Вещество используют как гипопрозрачный раствор для мытья фиксированных приборов, и как средство, защищающее специальные растворы против окислительных процессов в фото индустрии.
Сульфит сохраняет сухофруктам яркость цвета (не дает поблекнуть), участвует в консервировании мясных продуктов. В косметике вещество добавляют в отбеливатели и красители для волос, в некоторые средства гигиены – гели для душа, крема для тела.
Сульфит, бисульфит натрия и метабисульфит натрия функционируют как антиоксиданты, существенно продлевая срок годности и улучшая косметики.
Почему дехлорируют воду
Смертельная концентрация гипохлорита натрия (хлора) для радужной форели составляет приблизительно 0,2 мг/л, а для дафнии пулекс около 0,03 мг/л.
Это означает, что пул (совокупность) имеет 2 ppm (мг/л) хлора, и может загрязнять водоем в 10-100 раз по размеру, если добавить такое количество хлора в воду.
Программы гидрантов по очистке от дехлорирования могут отправлять 10000 галлонов или более при 0,2 ppm на один гидрант в окружающую среду. При отправке этих объемов воды в штормовой сток очень важно, чтобы хлор чистили.
Таблетки дехлорирования сульфита натрия EnvitroREDITM обеспечивают постоянный уровень дехлорирования в местах, где воздействие хлорированной воды на окружающую среду вызывает беспокойство.
Продукт используется в основном для муниципальных программ гидрантовой промывки для дехлорирования воды и обеспечивает защиту рыбы от вредного воздействия хлора.
Сравнение с другими натриевыми сульфитными таблетками
Некоторые натриевые сульфитные таблетки содержат максимум 82% сульфита натрия и не менее 18% нерастворимых неорганических соединений. Эти таблетки первоначально высвобождают 10,25 мг/л сульфита натрия с пониженной эффективностью 5 мг/л.
Доза сульфита натрия недостаточна для соответствия нормативным требованиям, и в некоторых случаях требует использования нескольких заполненных подающих трубок или вторичного смесительного бака.
Нерастворимые компоненты следует оценивать, поскольку, некоторые таблетки для удаления хлора увеличивают содержание взвешенных твердых веществ в сточных водах, а при передозировке повышается CBOD5 (углеродная биохимическая потребность в кислороде).
С этой статьей читают:
Гуаровая камедь: что это
Что такое каротин
Кумарин: польза и вред
Мой мир
Вконтакте
Одноклассники