Строение хеликобактер пилори
Характеристики Helicobacter pylori, морфология, среда обитания, патология / биология | Thpanorama
Helicobacter pylori является грамотрицательной спиральной бактерией, участвующей в развитии гастрита, язвенной болезни и связанной с раком желудка. Он был открыт в 1983 году австралийскими патологами Робином Уорреном и Барри Маршаллом при исследовании слизистых оболочек желудка человека..
Даже Маршалл экспериментировал с самим собой, проглатывая материал, зараженный бактериями, где он обнаружил, что он вызывает гастрит, и смог проверить наличие бактерий в его собственной биопсии желудка. Он также обнаружил, что он ответил на лечение антибиотиками.
Это разрушило старые теории, которые утверждали, что гастрит был вызван употреблением острой пищи или стресса. По этой причине в 2005 году Уоррен и маршал были удостоены Нобелевской премии по медицине..
индекс
- 1 Общая характеристика
- 2 Среда обитания
- 3 Факторы вирулентности
- 3.1 Жгутики
- 3.2 Клеи
- 3.3 Липополисахариды (ЛПС)
- 3.4 Мочевина
- 3.5 вакуолизирующий цитотоксин (VacA)
- 3.6 Цитотоксин (CagA)
- 3.7 Супероксиддисмутаза и каталаза
- 3.8. Индуцируемая синтаза оксида азота (iNOS):
- 3.9 Фосфолипазы, липазы и муциназы
- 4 Таксономия
- 5 Морфология
- 6 Диагноз
- 6.1 - Инвазивные методы
- 6.2 Неинвазивные методы
- 7 Жизненный цикл
- 8 Патогенез
- 8.1 Воспалительный инфильтрат
- 9 Патология
- 10 клинических проявлений
- 11 Заражение
- 12 Лечение
- 13 ссылок
Общие характеристики
Из-за его большого сходства с родом Campylobacter, он изначально назывался Campylobacter pyloridis и позже Кампилобактер пилори, но тогда это было реклассифицировано в новый жанр.
Заражение Helicobacter pylori Он широко распространен во многих слаборазвитых странах и является одной из самых частых инфекций у человека, которая обычно происходит с детства..
Считается, что после того, как микроорганизм был приобретен впервые, он может сохраняться годами или на всю жизнь, в некоторых случаях протекает бессимптомно..
С другой стороны, желудок не является единственным местом, где можно разместить микроорганизм, считается, что H. pylori может быть консолидирован во рту перед колонизацией желудка.
Также возможно, что H. pylori Присутствующий в полости рта может повторно заразить желудок после лечения. Это подтверждается тем фактом, что некоторые бессимптомные дети были изолированы от зубного налета..
Тем не менее, хотя инфекция Helicobacter pylori Бессимптомное течение у некоторых людей, это не безвредно, оно было связано с 95% язв двенадцатиперстной кишки, 70% язвенной болезни желудка и 100% хронического гастрита антрального локализации.
также, Helicobacter pylori Международным агентством по исследованию рака был классифицирован как канцероген I класса из-за его связи между инфекцией и раком желудка.
среда обитания
Helicobacter pylori был найден в следующих гостях: человек, обезьяна и кошки.
Эта бактерия требует микроаэрофильной атмосферы (10% СО)2, 5% О2 и 85% N2) для выращивания, железо является важным элементом для его роста и обмена веществ.
Оптимальная температура роста составляет от 35 до 37 ºC, хотя некоторые штаммы способны развиваться при 42 ºC. Кроме того, определенная степень влажности способствует его росту.
Helicobacter pylori В лаборатории он растет медленно, для того чтобы колония находилась посередине, требуется от 3 до 5 дней и даже до 7 дней.
Для его культивирования можно использовать неселективные среды, дополненные кровью..
С другой стороны, Helicobacter pylori Он характеризуется подвижностью и благодаря своей спиральной форме позволяет ему перемещаться по спирали, как если бы он был прикручен. Это помогает вам мобилизоваться через желудочную слизь.
Он также является каталазой и оксидазой и является крупным продуцентом уреазы, последняя играет жизненно важную роль для микроорганизма. Уреаза позволяет ему выживать в средах с кислым pH, генерируя аммиак, который помогает подщелачивать pH.
Для размножения микроорганизму необходим рН от 6 до 7. Для этого, помимо использования уреазы, она установлена ниже уровня слизистой оболочки желудка, где слизь желудка защищает ее от крайней кислотности просвета желудка (рН 1,0-2,0).
С другой стороны, протеазы, которые выделяют бактерии, модифицируют слизь желудка, уменьшая вероятность того, что кислота диффундирует через слизь..
Факторы вирулентности
бичи
Движение бактерий представляет собой фактор вирулентности, поскольку он помогает колонизировать слизистую оболочку желудка..
адгезин
Бактерия представляет пилимис и фимбриальный гемагглютинин, которые влияют на прилипание микроорганизма к клеткам желудка и двенадцатиперстной кишки..
Адгезия - это стратегия бактерий, направленная на сопротивление перистальтике слизистого слоя, в котором они находятся, для последующей миграции в эпителиальные клетки..
С другой стороны, специфические гемагглютинины сиаловой кислоты на поверхности слизистой оболочки задерживают адгезию и проглатывание H. pylori.
Липополисахариды (ЛПС)
Он эндотоксичен, как и ЛПС других грамотрицательных бактерий. Очищенный антиген может вызывать апоптоз.
уреазы
Бактерия использует производство уреазы для разложения мочевины в аммиаке и углекислом газе..
Это действие позволяет ему поддерживать щелочной pH вокруг него и таким образом избежать разрушения соляной кислотой в желудке, гарантируя его выживание.
Это свойство кодируется геном Ura A.
Вакуолизирующий цитотоксин (VacA)
Это белок, который вызы
Helicobacter — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 30 декабря 2019; проверки требует 21 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 30 декабря 2019; проверки требует 21 правка.| Helicobacter | |||
|---|---|---|---|
| |||
| Helicobacter Goodwin et al. 1989 emend. Vandamme et al. 1991[1] | |||
Хеликобактерии[2] (лат. Helicobacter) — род грамотрицательных бактерий, обладающих характерной спиралевидной формой. Изначально считалось, что бактерии данного вида принадлежат к роду Campylobacter, однако в 1989 году было опубликовано достаточно сведений, чтобы вывести Helicobacter в отдельный род[3]. В род включают около 35 видов.[4].
Некоторые виды хеликобактерий обнаружены в слизистой оболочке верхних отделов желудочно-кишечного тракта, а также в печени некоторых млекопитающих и птиц. Наиболее известным представителем рода является Helicobacter pylori, который поражает до 50 % человеческой популяции. Штаммы H. pylori являются патогенными для человека, так как являются основной причиной язв желудка и двенадцатиперстной кишки, хронических гастритов, дуоденитов, и рака желудка.
Бактерии рода Helicobacter способны жить в кислом содержимом желудка млекопитающих, вырабатывая в больших количествах фермент уреазу, который повышает pH от 2 до более биологически совместимого диапазона от 6 до 7[5]. Бактерии этого рода восприимчивы к таким антибиотикам как пенициллин, также бактерии этого вида являются микроаэрофильными (оптимальная концентрация кислорода от 5 до 14 %) и капнофильными, а также очень быстро передвигаются с помощью своих жгутиков.[6]
В род включают следующие виды:
Helicobacter pylori — Медицинская википедия
Helicobacter pylori (лат. - спиралевидная бактерия, обитающая в привратнике желудка, традиционная транскрипция — Х(Г)еликоба́ктер пило́ри,) — спиралевидная грамотрицательная бактерия, которая инфицирует различные области желудка и двенадцатиперстной кишки. Многие случаи язв желудка и двенадцатиперстной кишки, гастритов, дуоденитов, рака желудка и, возможно, некоторые случаи лимфом желудка этиологически связаны с инфекцией Helicobacter pylori. Однако у большинства (до 90 %) инфицированных носителей Helicobacter pylori не обнаруживается никаких симптомов заболеваний.
Спиральная форма бактерии, от которой произошло родовое название Helicobacter, как полагают, определяет способность этого микроорганизма проникать в слизистую оболочку желудка и двенадцатиперстной кишки и облегчает движение бактерии в слизистом геле, покрывающем слизистую желудка.
История открытия
В 1875 году немецкие учёные обнаружили спиралевидную бактерию в слизистой оболочке желудка человека. Бактерия не росла в культуре (на известных в то время искусственных питательных средах), и это случайное открытие было забыто.
В 1886 году профессор Валерий Яворский из Ягеллонского университета в Кракове, исследуя осадок из промывных вод желудка человека, обнаружил помимо бактерий, напоминавших по форме хворостины, также некоторое количество бактерий характерной спиралеобразной формы. Он назвал обнаруженную им бактерию Vibrio rugula. Он был первым, кто предположил возможную этиологическую роль этого микроорганизма в патогенезе заболеваний желудка. Его работа на эту тему была включена в польское «Руководство по заболеваниям желудка» и опубликована в 1899 году. Однако эта работа не имела большого влияния на остальной врачебный и научный мир, поскольку была написана на польском языке.
В 1893 году итальянский исследователь Джулио Бидзодзеро описал похожую спиралевидную бактерию, живущую в кислом содержимом желудка собак.
В 1974 году профессор И. А. Морозов из Москвы обнаружил спиралевидные бактерии в материале больных после ваготомии во внутриклеточных канальцах клеток желудка, а также у больных язвой, которым не делали ваготомию. Однако способ выращивания этих бактерий не был известен микробиологам, и обнаруженные бактерии были забыты ещё на десять лет.
Бактерия была вновь открыта в 1979 году австралийским патологом Робином Уорреном, который затем провёл дальнейшие исследования её вместе с Барри Маршаллом, начиная с 1981 года. Уоррену и Маршаллу удалось выделить и изолировать этот микроорганизм из проб слизистой оболочки желудка человека. Они также были первыми, кому удалось культивировать этот микроорганизм на искусственных питательных средах. В оригинальной публикации Уоррен и Маршалл высказали предположение, что большинство язв желудка и гастритов у человека вызываются инфицированием микроорганизмом Helicobacter pylori, а не стрессом или острой пищей, как предполагалось ранее.
Медицинское и научное сообщество медленно и неохотно признавало патогенетическую роль этой бактерии в развитии язв желудка и двенадцатиперстной кишки и гастритов, вследствие распространённого в то время убеждения, что никакой микроорганизм не в состоянии выжить сколько-нибудь длительное время в кислом содержимом желудка. Признание научным сообществом этиологической роли этого микроба в развитии заболеваний желудка начало постепенно приходить лишь после того, как были проведены дополнительные исследования. Один из наиболее убедительных экспериментов в этой области был поставлен Барри Маршаллом: он сознательно выпил содержимое чашки Петри с культурой бактерии H. pylori, после чего у него развился гастрит. Бактерия была обнаружена в слизистой его желудка, тем самым были выполнены три из четырёх постулатов Коха. Четвёртый постулат был выполнен, когда на второй эндоскопии, спустя 10 дней после преднамеренного заражения, были обнаружены признаки гастрита и присутствие H. pylori. Затем Маршалл сумел продемонстрировать, что он в состоянии излечить свой геликобактерный гастрит с помощью 14-дневного курса лечения солями висмута и метронидазолом. Маршалл и Уоррен затем пошли дальше и сумели показать, что антибиотики эффективны в лечении многих, если не большинства, случаев гастрита и язв желудка и двенадцатиперстной кишки.
В 1994 году Национальный институт здравоохранения США опубликовал экспертное мнение, в котором утверждалось, что большинство рецидивирующих язв желудка и гастритов с повышенной кислотностью вызываются инфицированием микробом H. pylori, и рекомендовал включать антибиотики в терапевтические режимы при лечении язвенной болезни желудка, а также гастритов с повышенной кислотностью. Постепенно накапливались данные также о том, что язвы двенадцатиперстной кишки и дуодениты также ассоциированы с инфицированием H. pylori.
В 2005 году первооткрыватели медицинского значения бактерии Робин Уоррен и Барри Маршалл были удостоены Нобелевской премии по медицине.
До того как стала понятна роль инфекции H. pylori в развитии язвенной болезни желудка и двенадцатиперстной кишки и гастритов, язвы и гастриты обычно лечили лекарствами, которые нейтрализуют кислоту (антациды) или снижают её продукцию в желудке (ингибиторы протонного насоса, блокаторы h3-гистаминовых рецепторов, М-холинолитики и др.). Хотя такое лечение в ряде случаев бывало эффективным, язвы и гастриты весьма часто рецидивировали после прекращения лечения. Весьма часто используемым препаратом для лечения гастритов и язвенной болезни желудка и двенадцатиперстной кишки был субсалицилат висмута (пепто-бисмол). Он часто был эффективен, но вышел из употребления, поскольку его механизм действия оставался непонятным. Теперь стало ясно, что эффект пепто-бисмола был обусловлен тем, что соли висмута действуют на H. pylori как антибиотик. Сегодня большинство случаев язв желудка и двенадцатиперстной кишки, некоторых форм гастритов с доказанной лабораторными тестами геликобактерной этиологией, особенно в развитых странах, лечат антибиотиками в совокупности с ингибиторами протонной помпы, эффективными против H. pylori. По последним уточненным данным на долю язвенной болезни, связанной с инфекцией H. pylori, приходится 38 % язв желудка и 56 % язв двенадцатиперстной кишки во всем мире.
Хотя H. pylori остаётся наиболее медицински значимой бактерией, способной обитать в желудке человека, у других млекопитающих и некоторых птиц были найдены другие представители рода Helicobacter. Некоторые из них могут заражать и человека. Виды рода Helicobacter были также обнаружены в печени некоторых млекопитающих, причём они способны вызывать поражения и заболевания печени.
Систематика
Бактерия была вначале названа Campylobacter pyloridis в 1985 году, затем название было исправлено в соответствии с правилами латинской грамматики на Campylobacter pylori в 1987 году, и только в 1989 году, после того, как анализ последовательностей ДНК этой бактерии показал, что в действительности она не принадлежит к роду Campylobacter, её и близкие ей виды выделили в отдельный род, Helicobacter Goodwin et al. 1989. Слово pylōri в названии является формой родительного падежа от «pylōrus» (привратник желудка, циркулярный жом, перекрывающий проход из желудка в двенадцатиперстную кишку), которое, в свою очередь, происходит от др.-греч. πυλωρός, означающего буквально «привратник».
Многие виды рода Helicobacter являются патогенными для человека и животных и обитают в ротовой полости, желудке, различных отделах кишечника человека и животных (патогенными для человека и животных кроме H. pylori являются также виды H. nemestrinae, H. acinonychis, H. felis, H. bizzozeronii и H. salomonis)). Наибольший уровень сходства по результатам ДНК-ДНК гибридизации отмечен между видами H. pylori и H. mustelae.
Виды рода Helicobacter являются единственными известными на сегодняшний день микроорганизмами, способными длительно выживать в чрезвычайно кислом содержимом желудка и даже колонизировать его слизистую.
Разработано много методов определения как внутривидовой дифференциации штаммов H. pylori, так и для дифференцировки от других видов рода Helicobacter, такие как биотипические, и серологические методы, методы определения уреазной активности и токсинообразования, так и молекулярные — белковый электрофорез клеточного лизата, метод определения полиморфизма длин рестрикционных фрагментов (ПДРФ), полимеразная цепная реакция (ПЦР), секвенирование 16S рибосомальной РНК Показан высокий уровень внутривидового полиморфизма штаммов H. pylori по сравнению с крайне близким видом H. mustelae, проявляющим высокий уровень консерватизма. Полиморфизм заключается в однонуклеотидных заменах, а также крупных внутригеномных перестройках, и высоких частотах трансформации.
Типовые штаммы H. pylori: ATCC 43504, DSM 4867, JCM 7653, LMG 7539, NCTC 11637.
Строение
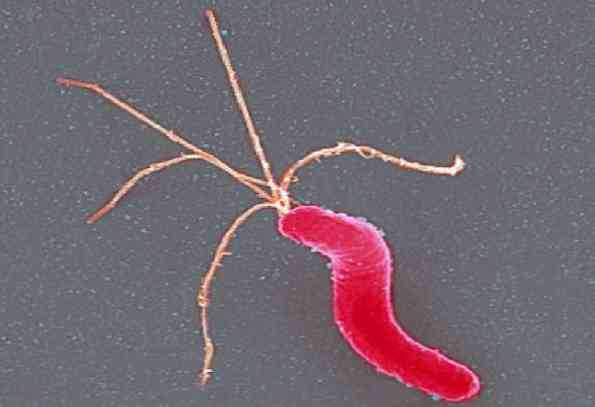
Helicobacter pylori — спиралевидная грамотрицательная бактерия, около 3 мкм в длину, диаметром около 0,5 мкм. Она обладает 4—6 жгутиками и способностью чрезвычайно быстро двигаться даже в густой слизи или агаре. Она микроаэрофильна, то есть требует для своего развития наличия кислорода, но в значительно меньших концентрациях, чем содержащиеся в атмосфере.
Бактерия содержит гидрогеназу, которая может использоваться для получения энергии путём окисления молекулярного водорода, продуцируемого другими кишечными бактериями. Бактерия также вырабатывает оксидазу, каталазу и уреазу.
Helicobacter pylori обладает способностью формировать биоплёнки, способствующие невосприимчивости бактерии к антибиотикотерапии и защищающие клетки бактерий от иммунного ответа хозяина. Предполагают, что это увеличивает её выживаемость в кислой и агрессивной среде желудка.
В неблагоприятных условиях, а также в «зрелых» или старых культурах Helicobacter pylori обладает способностью превращаться из спиралевидной в круглую или шарообразную кокковидную форму. Это благоприятствует её выживанию и может являться важным фактором в эпидемиологии и распространении бактерии. Кокковидная форма бактерии не поддаётся культивированию на искусственных питательных средах (хотя может спонтанно возникать по мере «старения» культур), но была обнаружена в водных источниках в США и других странах. Кокковидная форма бактерии также обладает способностью к адгезии к клеткам эпителия желудка in vitro.
Кокковидные клетки отличаются деталями строения клеточной стенки (преобладанием N-ацетил-D-глюкозаминил-β(1,4)-N-ацетилмурамил-L-Ала-D-Глю мотива в пептидогликане клеточной стенки (GM-дипептида)), изменение строения клеточной стенки приводит к неузнаванию бактерии иммунной системой хозяина (бактериальная мимикрия).
Известно несколько штаммов Helicobacter pylori, и геном трех из них полностью секвенирован.
Геном штамма «26695» представлен кольцевой двуцепочечной молекулой ДНК размером 1667867 пар оснований, и содержит 1630 генов, из которых 1576 кодируют белки, доля Г+Ц пар составляет 38 моль %. Геном штамма «J99» представлен кольцевой двуцепочечной молекулой ДНК размером 1643831 пар оснований, и содержит 1535 генов, из которых 1489 кодируют белки, доля Г+Ц пар составляет 39 моль %. Два изученных штамма демонстрируют значительные генетические различия, до 6 % нуклеотидов у них различны.
Изучение генома H. pylori ведётся в основном с целью улучшить наше понимание патогенеза гастритов и язвенной болезни желудка, причин способности этого микроорганизма вызывать заболевание. На данный момент в базе данных генома Helicobacter pylori 62 гена отнесены к категории «генов патогенных» (то есть их наличие у бактерии коррелирует с её патогенностью). Оба изученных штамма имеют общий «остров патогенности» (общую последовательность генов, имеющих отношение к вирулентности и патогенности H. pylori) длиной около 40 Кб, так называемый Cag. Этот участок содержит более 40 генов. Он обычно отсутствует у штаммов, которые выделены от людей, являющихся бессимптомными носителями H. pylori.
Ген cagA кодирует один из важнейших белков вирулентности H. pylori. Штаммы, имеющие ген cagA ассоциированны со способностью вызывать тяжёлые формы язвы желудка. Ген cagA кодирует белок длиной 1186 аминокислотных остатка. Белок cagA транспортируется внутрь клеток, где он нарушает нормальное функционирование цитоскелета. Остров патогенности Cag состоит из примерно 30 генов, кодирующих сложную систему секреции типа IV.. После адгезии H.pylori к клеткам эпителия желудка, cagA впрыскивается в клетку посредством системы секреции типа IV. Белок cagA фосфолирируется тирозиновыми протеинкиназами клетки и взаимодействует с фосфатазой Src, изменяя морфологию клеток. Вирулентные штаммы H. pylori способны активировать рецептор эпидермального фактора роста (epidermal growth factor receptor, EGFR), мембранный белок с тирозинкиназным доменом. Активация EGFR H. pylori ассоциирована с изменённой сигнальной трансдукцией и изменением профиля экспрессии генов клетки хозяина, что может влиять на течение патологического процесса.
Показана синергетичность действия генов babA2, cagA, и s1 vacA при патологическом процессе, вовлечённом в метаплазии кишечника. Продукты генов cagA и babA2 идентифицируются иммуногистохимически, гистологически и при помощи in situ гибридизации при метаплазии кишечника и злокачественных новообразованиях желудка, ассоциированных с геликобактерной инфекцией и могут служить возможными диагностическими маркерами.
Также идентифицированы некоторые гены, ассоциированные со способностью к колонизации эпителия желудка, такие как flg, flh, tlp (отвечают за наличие жгутиков и хемотаксис), ureA, nixA, amiE (гены, отвечающие за синтез уреазы и продукцию аммиака), fur, pfr, fecA, frpB (гены, отвечающие за метаболизм железа), sod, hptG (ответ на стресс), и algA, rfaJ, lpxB (гены, отвечающие за биосинтез липополисахарида и экзополисахарида). Показана роль в реакциях Helicobacter pylori на внешние раздражители продукта гена tlpD, предположительно кодирующего сенсорный белок.
Факторы вирулентности
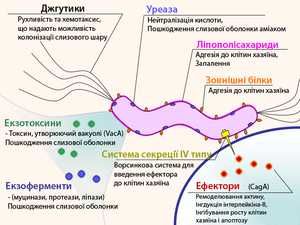
Способность H. pylori колонизировать слизистую желудка и вызывать гастрит либо язву желудка зависит не только от состояния иммунитета организма хозяина, но и от индивидуальных особенностей конкретного штамма бактерии.
Одним из важных факторов вирулентности геликобактера является наличие у него жгутиков, благодаря которым обеспечивается быстрое движение микроорганизма в слое густой слизи, защищающей слизистую желудка от воздействия кислоты, её хемотаксис в места скопления других бактерий этого вида и быстрая колонизация слизистой.
Липополисахариды и белки наружной оболочки бактерии обладают свойством адгезии к наружной оболочке мембран клеток слизистой желудка. Кроме того, липополисахариды наружной оболочки H. pylori вызывают иммунный ответ организма хозяина и развитие воспаления слизистой.
Секретируемые бактерией во внешнюю среду литические ферменты — муциназа, протеаза, липаза — вызывают деполимеризацию и растворение защитной слизи (состоящей в основном из муцина) и повреждение слизистой желудка.
Очень важную роль в вирулентности бактерии и в её способности выживать в кислом содержимом желудка играет секреция бактерией уреазы — фермента, расщепляющего мочевину с образованием аммиака. Аммиак нейтрализует соляную кислоту желудка и обеспечивает бактерии локальное поддержание комфортного для неё pH (около 6-7). Одновременно с этим аммиак вызывает химическое раздражение и воспаление, а впоследствии и гибель, клеток слизистой желудка.
Продукция геликобактером различных экзотоксинов, в частности, вакуолизирующего экзотоксина (продукта гена vacA), также вызывает вакуолизацию, повреждение и гибель клеток слизистой желудка.
Специальная «инжекционная система», имеющаяся у H. pylori, предназначена для непосредственного впрыскивания в клетки слизистой оболочки желудка различных эффекторных белков (в частности, продуктов гена cagA), вызывающих воспаление, повышение продукции интерлейкина-8, угнетение апоптоза и избыточный рост определённых типов клеток. Полагают, что именно этим обусловлена наблюдающаяся при инфицировании геликобактером гиперплазия париетальных (кислотообразующих) клеток желудка, гиперсекреция соляной кислоты и пепсина, и в конечном итоге повышение вероятности рака желудка.
Штаммы H. pylori, выделенные от больных с язвой желудка или двенадцатиперстной кишки, как правило, проявляют большую биохимическую агрессивность, чем штаммы, выделенные от больных с гастритом, а штаммы, выделенные от больных с гастритом, обычно более агрессивны и вирулентны, чем штаммы, выделенные от бессимптомных носителей. В частности, штаммы, выделенные от больных с язвенной болезнью, чаще бывают cagA-положительными (то есть продуцирующими cagA эффекторные белки). Штаммы, выделенные от больных с гастритом, чаще продуцируют экзотоксин vacA, чем штаммы, выделенные от бессимптомных носителей.
Патогенетические механизмы
На начальном этапе после попадания в желудок H. pylori, быстро двигаясь при помощи жгутиков, преодолевает защитный слой слизи и колонизирует слизистую оболочку желудка. Закрепившись на поверхности слизистой, бактерия начинает вырабатывать уреазу, благодаря чему в слизистой оболочке и слое защитной слизи поблизости от растущей колонии растёт концентрация аммиака и повышается pH. По механизму отрицательной обратной связи это вызывает повышение секреции гастрина клетками слизистой желудка и компенсаторное повышение секреции соляной кислоты и пепсина, с одновременным снижением секреции бикарбонатов.
Муциназа, протеаза и липаза, вырабатываемые бактерией, вызывают деполимеризацию и растворение защитной слизи желудка, в результате чего соляная кислота и пепсин получают непосредственный доступ к оголённой слизистой желудка и начинают её разъедать, вызывая химический ожог, воспаление и изъязвление слизистой оболочки.
Эндотоксин VacA, вырабатываемый бактерией, вызывают вакуолизацию и гибель клеток эпителия желудка. Продукты гена cagA вызывают дегенерацию клеток эпителия желудка, вызывая изменения фенотипа клеток (клетки становятся удлинёнными, приобретая так называемый «колибри фенотип»). Привлечённые воспалением (в частности, секрецией интерлейкина-8 клетками слизистой желудка) лейкоциты вырабатывают различные медиаторы воспаления, что приводит к прогрессированию воспаления и изъязвления слизистой, бактерия также вызывает окислительный стресс и запускает механизм программируемой клеточной смерти клеток эпителия желудка.
Диагностика инфекции
Диагностика геликобактерной инфекции обычно производится путём опроса больного на наличие диспептических жалоб и симптомов и затем выполнения тестов, подтверждающих или опровергающих наличие инфекции.
Неинвазивные (не требующие эндоскопии) тесты на наличие геликобактерной инфекции включают определение титра антител в крови к антигенам H. pylori, определение наличия антигенов H. pylori в кале, а также уреазный дыхательный тест, состоящий в том, что пациент выпивает раствор меченной углеродом 14C- или 13C мочевины, которую бактерия расщепляет с образованием, соответственно, 14C- или 13C-двуокиси углерода, которую затем обнаруживают в выдыхаемом воздухе при помощи масс-спектрометрии или диодной лазерной спектроскопии.
Существуют также уреазные дыхательные тесты, основанные на определении концентрации аммиака в выдыхаемом воздухе. Данные методы предполагают приём пациентом мочевины нормального изотопного состава и последующее измерение концентрации аммиака с помощью газоанализатора. К достоинствам метода можно отнести невысокую стоимость обследования, скорость получения результатов, высокую чувствительность (96 %), значительно меньшую стоимость оборудования по сравнению с масс-спектрографами. Однако этот метод диагностики не прошёл достаточные клинические испытания. Обладает высоким процентом ложноположительных результатов и не применяется за пределами постсоветского пространства.
Однако самым надёжным и «референсным» методом диагностики геликобактерной инфекции остаётся биопсия, производимая во время эндоскопического обследования желудка и двенадцатиперстной кишки. Взятую при биопсии ткань слизистой подвергают быстрому тестированию на наличие уреазы и антигенов H. pylori, гистологическому исследованию, а также культуральному исследованию с выделением возбудителя на искусственных питательных средах.
Ни один из методов диагностики инфекции не является полностью достоверным и защищённым от диагностических ошибок и неудач. В частности, результативность биопсии в диагностике геликобактерной инфекции зависит от места взятия биоптата, поэтому при эндоскопическом исследовании обязательно взятие биоптатов из разных мест слизистой желудка. Тесты на наличие антител к антигенам H. pylori имеют чувствительность всего лишь от 76 % до 84 %. Некоторые лекарства могут повлиять на активность уреазы, продуцируемой геликобактером, в результате чего при исследовании уреазной активности при помощи меченой мочевины могут получиться ложноотрицательные результаты.
Заражение H. pylori может сопровождаться симптомами или протекать бессимптомно (без каких-либо жалоб со стороны инфицированного). Предполагается, что до 70 % случаев инфекции протекают бессимптомно и что около 2/3 населения Земли инфицированы геликобактером, что делает эту инфекцию самой распространённой в мире. Истинная частота встречаемости бессимптомного носительства геликобактера варьирует от страны к стране. В развитых странах Запада (Западная Европа, США, Австралия) эта частота составляет примерно 25 %; она значительно выше в странах так называемого «третьего мира», а также в посткоммунистических странах Восточной Европы и в особенности в странах бывшего Советского Союза. В странах третьего мира и в посткоммунистических странах, вследствие сравнительно низких санитарных стандартов и условий не редкостью является обнаружение геликобактерной инфекции у детей и подростков. В Соединённых Штатах и Западной Европе геликобактер чаще всего выявляется в старших возрастных категориях (около 50 % у лиц старше 60 лет, по сравнению с 20 % у лиц моложе 40 лет) и в наиболее бедных социально-экономических слоях.
Разница в частоте встречаемости геликобактерной инфекции в развитых странах Запада и в странах «третьего мира» приписывается более строгому соблюдению гигиенических стандартов и широкому использованию антибиотиков. Однако со временем стала проявляться проблема антибиотикоустойчивости H. pylori. В настоящее время многие штаммы в Европе, США и даже в развивающихся странах уже устойчивы к метронидазолу.
Геликобактер был выделен из кала, слюны и зубного налёта инфицированных пациентов, что объясняет возможные пути передачи инфекции — фекально-оральный или орально-оральный (например, при поцелуях, пользовании общей посудой, общими столовыми приборами, общей зубной щёткой. Возможно (и весьма часто встречается) заражение геликобактером в учреждениях общественного питания. Иногда возможно заражение через инфицированные эндоскопы при проведении диагностической гастроскопии.
Считается, что в отсутствие лечения H. pylori, однажды колонизовав слизистую желудка, может существовать в течение всей жизни человека несмотря на иммунный ответ хозяина. Однако у пожилых людей, а также у больных с давно существующим гастритом, геликобактерная инфекция, вероятно, может самостоятельно исчезать, поскольку с возрастом или с давностью заболевания гастритом слизистая желудка становится всё более атрофичной, истончённой и менее благоприятной для обитания этого микроба. Вместе с тем, атрофический гастрит у пожилых или гастрит, перешедший в стадию атрофического гастрита после многих лет болезни, поддаётся лечению гораздо труднее, чем геликобактерные гастриты.
Процент острых геликобактерных инфекций, которые переходят в хроническую персистирующую форму, точно неизвестен, однако в нескольких исследованиях, в которых изучалось естественное течение болезни без лечения в человеческих популяциях, сообщалось о возможности спонтанного самоизлечения (спонтанной элиминации микроба-возбудителя).
Лечение Helicobacter pylori-ассоциированных заболеваний
У пациентов с язвой желудка, язвой двенадцатиперстной кишки, атрофическим гастритом, MALT-омой, состоянием после резекции желудка, близким родством с больными, страдающими раком желудка с доказанной геликобактерной этиологией обязательным является эрадикация Helicobacter pylori, то есть лечебный режим, направленный на полное уничтожение этого микроба в желудке. В то же время, уничтожение доказанной инфекции H. pylori в отсутствие перечисленных выше заболеваний (состояний) не всегда целесообразна, так как возможный вред от приема антибиотиков может перевесить возможную пользу от эрадикации. Некоторые источники к числу обязательных для эрадикации H. pylori заболеваний (при наличии инфекции H. pylori) относят только язвенную болезнь.
Австралийский гастроэнтеролог Томас Бороди в 1987 году ввёл первый известный режим «трёхкомпонентной терапии» (англ. triple therapy).
Возрастающая резистентность H. pylori к «стандартным» антибиотикам, необходимость уменьшить побочные эффекты от приёма антибиотиков, а также понизить стоимость лечения стимулировали создание новых схем эрадикации. За последние десятилетия были разработаны различные варианты эрадикационной терапии, направленные на использование других антимикробных средств, а также более современных ингибиторов протонного насоса.
Отмечены случаи непродуктивности антибиотикотерапии геликобактерной инфекции, связанные как с антибиотикорезистентностью, так и с наличием зон в желудочно-кишечном тракте, в которых бактерии защищены от действия антибиотиков. Отмечено появление полирезистентных к антибиотикам изолятов H. pylori, в том числе и кларитромицин-резистентных штаммов. Также отмечены случаи появления хинолон-резистентных штаммов H. pylori.
Также ведутся исследования по поиску и синтезу более эффективных и менее токсичных препаратов, направленных на эрадикацию H. pylori, показана эффективность in vitro препарата TG44, препарат NE-2001 в опытах in vitro проявлял высокую селективность по отношению к H. pylori. Показана эффективность пероральной вакцинации клеточным лизатом H. pylori на мышиной модели.
Маастрихтские консенсусы
Для выработки оптимальных подходов к диагностике и лечению Helicobacter pylori-ассоциированных заболеваний в 1987 году была создана Европейская группа по изучению Helicobacter pylori (англ. European Helicobacter Study Group) (EHSG), которая периодически публикует рекомендации, называемые Маастрихтскими консенсусами или «Маастрихтами» (от названия голландского города Маастрихта, в котором были проведена первая согласительная конференция EHSG). Каждый следующий «Маастрихт» является обновлением предыдущего. Были опубликованы следующие «Маастрихты»:
- «Маастрихт-I» — в 1997 году (согласительная конференция состоялась в 1996 году в Маастрихте)
- «Маастрихт-II» — в 2000 году
- «Маастрихт-III» — в 2005 году (конференция «Маастрихт-III» состоялась в 2005 году во Флоренции)
- «Маастрихт-IV» — в 2012 году (конференция «Маастрихт-IV» состоялась в 2010 году во Флоренции).
Однако некоторые гастроэнтерологи считают, что EHSG «монополизировала право определять стратегию и тактику анти-НР-терапии» и допускает при этом ряд просчётов, результатом которых является распространение резистентных к антимикробным средствам штаммов бактерий.
Критика теории решающей роли Helicobacter pylori в возникновении и развитии язвенной болезни желудка и двенадцатиперстной кишки
Скептически настроенные в отношении инфекционной теории язвы желудка и двенадцатиперстной кишки специалисты приводят следующие аргументы:
- Ни сам Барри Маршалл, ни его последователи после самозаражения H. pylori ни разу не заболели язвенной болезнью, а только гастритом.
- Как правило, язвенные дефекты встречаются в виде одиночных образований, хотя инфекция H. pylori может затрагивать значительную часть органа.
- Инфекционная теория не объясняет цикличность заболевания: «рецидив-ремиссия-рецидив».
- Процент заражённых H. pylori при тяжёлых формах язвенной болезни значительно меньше, чем при неосложнённых. Некоторые исследователи называют такие цифры: если при неосложнённой язвенной болезни двенадцатиперстной кишки инфицированные H. pylori составляют около 95 %, инфицированные H. pylori при неосложнённой язве желудка — 75—80 %, то при осложнённой рубцово-язвенным пилородуоденальным суб- и декомпенсированным стенозом язве, H. pylori имеются только у 50 % больных, осложнённых кровотечением — у 40 %, перфорацией — у 40—70 %.
- Инфекционная теория не объясняет сезонность обострений язвенной болезни.
- Имеются исследования, доказывающие на большом статистическом материале, что полная эрадикация H. pylori почти в два раза увеличивает вероятность развития рефлюкс-эзофагита, пищевода Баррета и кардиоэзофагеальной аденокарциномы, а также то, что наличие H. pylori в теле желудка снижает риск развития онкологических заболеваний кардиального отдела желудка.
- Инфекционная теория не объясняет и не учитывает известные факты о нарушении секреции мелатонина у язвенных больных.
Отмечается, что в связи с большим числом носителей H. pylori (в России — до 75 % населения) после эрадикации отсутствуют какие-либо гарантии отсутствия реинфекции, более того, она весьма вероятна. Критики инфекционной теории обычно подходят к язвенной болезни, как к системному гастроэнтерологическому заболеванию, в развитии которого играют важнейшую роль, в том числе, психосоматические и психосоциальные факторы.
В последние годы было установлено, что кроме H. pylori в желудке многих здоровых людей обитают другие микроорганизмы, в частности лактобактерии L. gastricus, L. antri, L. kalixensis, L. ultunensis, стрептококки, стафилококки, грибы Candida, бактероиды, коринебактерии и другие.
Некоторые исследователи акцентируют внимание на следующем:
- многолетнее применение антигеликобактерной терапии H. pylori-ассоциированных заболеваний не привело к их снижению и стало одной из причин развития дисбактериоза;
- рецидивы язвенной болезни и обострение хронического гастрита сопровождаются дисбиозом гастродуоденальной зоны, усиливающим язвообразование и воспалительные процессы в слизистой оболочке. При этом H. pylori не имеют самостоятельного значения в развитии этих заболеваний.
Высказывается гипотеза, что до начала эры антибиотиков H. pylori сосуществовали с человеком, не причиняя ему никакого вреда и только после начала их тотального уничтожения антибактериальными препаратами часть из них в результате мутаций приобрела резистентность к антибиотикам, а часть — «островки патогенности» содержащие гены цитотоксичности (CagA, VacA, IceA и другие), и стала угрожать здоровью человека.
После успешной эрадикации H. pylori через 3 года вновь заражаются этой бактерией около 32 % пациентов, через 5 лет — 82-87 %, а через 7 лет — примерно 90 %.
<indicator name="ga">Эта статья входит в число хороших статей</indicator>
Что такое хеликобактер, откуда он взялся?
Это очень интересная тема!
Сегодня в статье мы попытаемся простым языком подробно рассказать вам о том, кто и что такое Хеликобактер Пилори и откуда они появились. Как они влияют на наш организм. Какие из этих бактерий уживаются в нашем организме, а какие бунтуют и причиняют уйму неприятностей.
Впервые о бактерии хеликобактер пилори начали говорить в 1979 году, когда австралийский ученый Робин Уоррен обнаружил спиралевидную бактерию, обитающую на слизистой оболочке желудка. Дальнейшие исследования это подтвердили. Хеликобактер действительно вызывает воспаление слизистой желудка и 12-перстной кишки. Чтобы доказать это, коллега Уоррена Барри Маршалл взял в руки сосуд с жидкостью и мужественно проглотил все то, что там было, раствор с хеликобактер пилори. Вот отсюда и начинается все самое интересное! Через несколько дней у него появились первые признаки острого гастрита. Робин Уоррен и Барри Маршал первые, кто доказал, что в большинстве случаев язва желудка бывает вызвана именно Хеликобактер Пилори.
Хеликобактер пилори - это спиралевидная бактерия, которая инфецирует различные области нашего желудка и двенадцатиперстной кишки. Многие случаи язв, гастритов, доуденитов и рака этиологически связаны с инфекцией Хеликобактер.
Бактерия Хеликобактер пилори живет в желудке у половины человечества планеты. Это относительно новые данные.
Так как же это существо может выживать в столь неблагоприятных условиях нашего организма, где полости наполнены кислым содержимым и разрушенными ферментами?
Хеликобактер этим не удивишь! У этой хитрой бактерии есть две стратегии ее поведения что бы сохранить лидирующие позиции и обрести популярность в выбранном отеле кишечника.
Первая стратегия: Хеликобактер пилори способна синтезировать компоненты, обладающие щелочной реакцией, ЗА СЧЕТ ЭТОГО БАКТЕРИЯ СПОСОБНА НЕЙТРАЛИЗИРОВАТЬ КИСЛОТЫ В НЕПОСРЕДСТВЕННОЙ ОТ СЕБЯ БЛИЗОСТИ!
Вторая стратегия: Микроорганизм способен проникать под слизистую, которая защищает слои желудка от кислоты. Слизистая под воздействием хеликобактер пилори становится более подвижна и беззащитна.
Ученые выяснили, что хеликобактер пилори провоцирует воспаление слизистой и формирует язвы на ее поверхности. До этого считалось, что подобные изменения лежали в основе стресса.
Маршалл опроверг это заблуждение, что кислая среда не может быть средой для живых микроорганизмов. Так же ученые доказали, что бактерии которые не являются источниками инфекции могут стать причиной всевозможных патологий другого характера.
Существует несколько методов диагностики этой инфекции. Один из них это дыхательный тест. Для этого не нужно брать образцы крови, используется состав выдыхаемого воздуха. Для проведения теста нужно принять специальный раствор, и, если в полости желудка присутствует хеликобактер пилори, наблюдается расщепление компонентов этой самой жидкости с выделением газа, который выходит в ротовую полость и фиксируется. Результат можно получить уже через 12 минут!
Как и где можно заразиться хеликобактер пилори:
- Плохо вымытые фрукты и овощи
- Грязные руки
- Заражённая вода
- Слюна больного. Это наиболее частый путь передачи инфекции в семье (между супругами, от матери к маленькому ребенку).
Но вот странность, не у каждого носителя хеликобактер пилори могут развиваться проблемы с желудком. Причиной этого является то, что различные типы хеликобактер имеют разную степень агрессивности.
Есть два отличительных признака у хеликобактер пилори, склонных к атаке слизистой желудка.
Первый признак: Наличие антигена CagA, который похож на шприц, который впрыскивает определенные вещества в клетки слизистой желудка.
Второй признак: Антиген VacA, имеет способность бактерии присоединятся к клеткам слизистой за счет чего и достигается быстрое ее разрушение.
Если эти два признака отсутствуют, то бактерия вполне спокойный обитатель нашего желудка.
Плохие черты хеликобактер пилори
Большой минус в том, что возбудитель крепится к клеткам желудка, хаотично распределяясь по его поверхности, ослабляя тем самым защитный барьер слизистой. Таким образом получается что соляная кислота переваривает не только пищу но и собственные клетки желудка. Отсюда и появляется язва желудка. Решением проблемы в данном случае являются антибиотики.
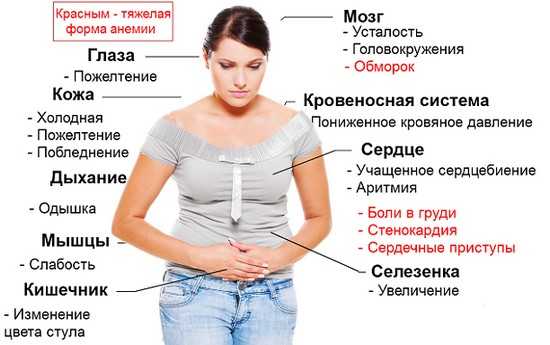
Симптомы хеликобактериоза:
- Частые поносы или запоры
- Ломкость ногтей
- Грибковые заболевания
- Неприятный запах изо рта
- Сильное выпадение волос
- Переодически возникающие боли в желудке которые прекращаются после приема пищи
- Изжога
- Рвота или тошнота
- Тяжесть в животе
! Интересный факт! Альтернативой антибиотику может быть вещество сульфорафан, оно содержится в брокколи. А максимальное количество этого вещества находится в приростках брокколи. Тот, кто хочет испробовать данный факт на себе, должен через две недели показаться врачу и проверить, удалось ли победить вредный микроорганизм.
Катализаторами к размножению хеликобактер являются все тот же стресс, ангина, снижение иммунитета и резкое изменение рациона питания.
Хеликобактер манипулирует нашими защитными барьерами, раздражает и разрушает клетки слизистой нашего желудка, синтезирует яды, способные нарушать работу всего организма. Так почему же наш организм так толерантен к этой бактерии?
Хорошие черты хеликобактер пилори
Если говорить простыми словами, то у всех бывают свои плюсы и минусы, у этой бактерии они тоже есть. В ходе масштабных исследований, было выявлено, что опасный штамм бактерий несет для нас некоторые преимущества.
За 12 лет наблюдай и 10 000 испытуемых было отмечено что у носителей хеликобактер повышен риск заболеванием рака но при этом! риск возникновения рака легких или инсульта значительно снижен!
Эксперимент на мышах показал, что хеликобактер в детстве предотвращает развитие астмы. Как только мышам ввели антибиотик от хеликобактер пилори у них пропала устойчивость к развитию астмы, и мышки заболевали. Хеликобактер пилори пробуждает некоторые клетки нашей иммунной системы.
Воспалительные заболевания кишечника, являются давольно острыми вопросами сегодняшнего времени, возможно, потому, что мы не понимая многого, стремительно уничтожаем то, что защищало нас в течении веков.
Небольшая сноска про антибиотики.
"Антибиотики являются незаменимыми средствами в наше время, которые спасли миллионы жизней. Но сейчас, ими стали злоупотреблять. Врачи официальной медицины сразу назначают антибиотики даже в тех случая, где можно было бы обойтись без них. Или для болезней, который вообще невозможно вылечить антибиотиками (вирусные заболевания). К антибиотикам нужно обращаться только в крайних случая. Когда от других лекарств помощи уже не ждать. Ну и конечно не стоит забывать, что антибиотик убивает все, и хорошее и плохое!
И так подведем итог.
Хеликобактер пилори - это бактерия, обладающая множеством свойств. Она и не хорошая и не плохая. Все зависит от ее типа, синтезирует она яды или же защищает наш организм. Какую роль играют средства, раздражающие нашу слизистую, например анальгетики, алкоголь, кофе или сильный стресс? Может быть мы сами создаем эти факторы, неблагоприятные для существования нашего "домашнего зверька» и он начинает вести себя агрессивно?
Какая должна быть профилактика против заражения хеликобактер?
- Нужно придерживаться правильного питания
- Отказаться от алкоголя и курения.
- Следить за личной гигиеной
- Мыть начисто посуду
- Поддерживать иммунитет
Надеюсь статья получилась интересная! И у нас всегда один совет - не провоцируйте свой организм к бунту!:))
Helicobacter pylori — Вікіпедія
Helicobacter pylori (вимовляється гелікоба́ктер піло́рі) — спіралеподібна паличкоподібна грамнегативна бактерія, що інфікує різні області шлунка і дванадцятипалої кишки. Більшість випадків виразкової хвороби шлунку і дванадцятипалої кишки, гастритів, дуоденітів і деякі випадки лімфом шлунку і раку шлунку етіологічно пов'язані з інфікуванням Helicobacter pylori. Проте, хоча значна частина населення інфікована цією бактерією, більшість заражених не проявляють жодних ознак хвороби.
Види роду Helicobacter є ацидофільними екстремофілами, єдиними відомими на сьогодні мікрорганізмами, здатними тривало виживати в надзвичайно кислому, майже анаеробному середовищі шлунка і колонізувати його слизову оболонку. Спіралеподібна форма бактерії, від якої походить родова назва Helicobacter, як вважається, пов'язана з розвитком у цієї бактерії здатності проникати в слизову оболонку шлунку і дванадцятипалої кишки, оскільки така форма полегшує її рух у слизовому гелі, що покриває стінки травного тракту[1].
У 1875 році група німецьких вчених виявила спіралеподібну бактерію в слизовій оболонці шлунку людини. Як це часто буває, бактерія не росла в культурі (на відомих у той час штучних поживних середовищах), і це випадкове відкриття було зрештою забуте[2].
У 1893 році італійський дослідник Джуліо Біззоцеро описав схожу спіралеподібну бактерію, що живе в кислому вмісті шлунку собак[3].
У 1899 році польський професор Валерій Яворський з Ягеллонського університету в Кракові, досліджуючи осад з промивних вод шлунку людини, виявив крім бактерій, що нагадували за формою лозини, також деяку кількість бактерій характерної спіралеподібної форми. Він назвав виявлену ним бактерію Vibrio rugula. Яворський був першим, хто припустив можливу етіологічну роль цього мікроорганізму в патогенезі захворювань шлунка. Його робота на цю тему була включена в польський «Посібник із захворювань шлунку». Проте ця робота не мала великого впливу на решту медичного і наукового світу, оскільки була написана польською мовою[4].
Бактерія була знов відкрита в 1979 році австралійським патологом Робіном Ворреном, який потім, починаючи з 1981 року, провів подальші її дослідження разом з Баррі Маршаллом. Воррену і Маршаллу вдалося виділити й ізолювати цей організм з проб слизової оболонки шлунка людини. Вони також були першими, кому вдалося культивувати цей організм на штучних поживних середовищах[5]. В оригінальній публікації[6] Воррен і Маршалл висловили припущення, що більшість виразок шлунку і гастритів людини викликаються інфікуванням цією бактерією, а не стресом або гострою їжею, як вважалося раніше[7].
Медичне і наукове співтовариства повільно і неохоче визнавали патогенетичну роль цієї бактерії в розвитку виразкової хвороби шлунку і дванадцятипалої кишки та гастритів, унаслідок поширеного на той час переконання, що жоден мікроорганізм нездатний вижити скільки-небудь тривалий час в кислому середовищі шлунка. Визнання науковим співтовариством етіологічної ролі цього мікроба в розвитку захворювань шлунку почало поступово приходити лише після того, як були проведені додаткові дослідження. Одним з найпереконливіших експериментів в цій області був поставлений Баррі Маршаллом: він свідомо випив вміст чашки Петрі з культурою бактерії H. pylori, після чого у нього розвинувся гастрит. Бактерія була виявлена в слизовій оболонці його шлунку, тим самим були виконані три з чотирьох постулатів Коха. Четвертий постулат був виконаний, коли на другій ендоскопії, через 10 днів після навмисного зараження, були виявлені ознаки гастриту і присутність H. pylori. Потім Маршалл зумів продемонструвати, що він може вилікувати свій гелікобактерний гастрит за допомогою 14-денного курсу лікування солями вісмуту і метронідазолом. Маршалл і Воррен потім пішли далі й зуміли показати, що антибіотики ефективні в лікуванні багатьох, якщо не більшості, випадків гастриту й виразкової хвороби шлунку та дванадцятипалої кишки.
У 1994 році американський Національний інститут охорони здоров'я опублікував експертну думку, в якій затверджувалося, що більшість рецидивних виразок шлунку і гастритів з підвищеною кислотністю викликаються інфекцією бактерією H. pylori, і рекомендував включати антибіотики в терапевтичні режими при лікуванні цих хвороб[8]. Поступово накопичувалися дані також про те, що виразки дванадцятипалої кишки і дуоденіти також пов'язані з інфікуванням H. pylori[9][10]. У 2005 році першовідкривачі бактерії Робін Воррен і Баррі Маршалл були удостоєні Нобелівської премії з фізіології і медицини[11].
До того, як стала зрозуміла роль інфекції Helicobacter pylori в розвитку виразок шлунку і дванадцятипалої кишки та гастритів, ці хвороби зазвичай лікували ліками, що нейтралізують кислотність (антациди) або знижують її продукцію в шлунку (інгібітори протонного насосу, антагоністи H2-гістамінових рецепторів, холінолітики та ін.). Хоча таке лікування у ряді випадків бувало ефективним, виразки і гастрити вельми часто рецидивували після припинення лікування. Дуже поширеним препаратом для лікування гастритів і пептичних виразок шлунку і дванадцятипалої кишки був субсаліцилат вісмуту (пепто-бісмол). Хоча він часто був ефективним, цей препарат вийшов з вживання, оскільки його механізм дії залишався незрозумілим. Сьогодні відомо, що ефект пепто-бісмола був обумовлений тим, що солі вісмуту діють на Helicobacter pylori як антибіотик. Сьогодні більшість випадків виразок лікують антибіотиками, ефективними проти H. pylori.
Бактерія була спочатку названа Campylobacter pyloridis, потім Campylobacter pylori (після корекції назви відповідно до латинської граматики), і лише в 1989 році, після того, як аналіз послідовностей ДНК цієї бактерії показав, що насправді вона не належить до роду Campylobacter, її і близькі нею види виділили в окремий рід, Helicobacter. Назва pylori походить від слова «pylōri» (тобто той, що належить до pilorus — циркулярного жому, що перекриває прохід з шлунку в дванадцятипалу кишку), яке, у свою чергу, походить від грецького слова πυλωρός, що буквально означає «сторож».
Хоча H. pylori і залишається найбільш медично значимою бактерією, що населяє шлунок людини, у інших ссавців і деяких птахів були знайдені інші представники роду Helicobacter. Деякі з них здатні заражати і людину[12]. Види роду Helicobacter були також виявлені в печінці деяких ссавців, причому вони здатні викликати ураження і захворювання печінки[13].
Розміри і схематична будова H. pyloriHelicobacter pylori — спіралеподібна грамнегативна бактерія, близько 3 мікронів у довжину, діаметром близько 0,5 мікрона. Вона має 4-6 джгутиків і здатна надзвичайно швидко рухатися навіть в густому слизі або агарі. Вона мікроаерофільна, тобто вимагає для свого розвитку наявність кисню, але в значно менших концентраціях, ніж атмосферні.
Бактерія містить гідрогеназу, фермент, що може використовуватися для отримання енергії шляхом окиснення молекулярного водню, що виділяється іншими кишечними бактеріями[14]. Бактерія також виробляє оксидазу, каталазу і уреазу.
Helicobacter pylori має здатність формувати біоплівки, в яких внутрішні шари захищені від дії кислоти та інших шкідливих чинників зовнішнім шаром слизу і бактерій[15] та переходу від спіральної до кокової форми[16]. Ймовірно, обидва фактори збільшують здатність її виживання в кислому й агресивному середовищі шлунку. Кокову форму поки-що не вдалося культивувати на штучних поживних середовищах, хоча вона може спонтанно виникати в міру «старіння» культур і була виявлена в деяких водних джерелах в США та інших країнах. Кокова форма бактерії також володіє здібністю до адгезії до клітин епітелію шлунка in vitro.
Фактори вірулентності[ред. | ред. код]
Здатність H. pylori колонізувати слизову оболонку шлунку і викликати гастрит або виразку залежить не тільки від стану імунітету організму хазяїна, але і від наявності і кількості у конкретного штаму бактерії специфічних факторів вірулентності, що визначають її специфічну взаємодію з організмом хазяїна і її патогенність[17].
Важливими факторами вірулентності Helicobacter є наявність у неї джгутиків, завдяки яким забезпечується швидкий рух мікроорганізму в шарі густого слизу, що захищає слизову оболонку шлунку від дії кислоти, її можливість здійснювати хемотаксис в місця скупчення інших бактерій цього виду і, в результаті, швидка колонізація слизової оболонки[18].
Деякі ліпополісахариди і білки зовнішньої мембрани бактерії мають властивість адгезії до зовнішньої оболонки мембран клітин слизової оболонки шлунку. Крім того, ліпополісахариди зовнішньої оболонки H. pylori викликають імунну відповідь організму хазяїна і розвиток запалення слизової оболонки.
Літичні ферменти, що секретуються бактерією в зовнішнє середовище, — муциназа, протеази, ліпаза — викликають деполімерізацию і розчинення захисного слизу (що складається в основному з муцину) і пошкодження власне клітин слизової оболонки шлунку.
Молекулярна модель уреази H. pyloriДуже важливу роль у вірулентності бактерії і в її здатності виживати в кислому вмісті шлунку грає секреція бактерією уреази — ферменту, що розщеплює сечовину з утворенням аміаку. Аміак нейтралізує соляну кислоту шлунку і забезпечує бактерії локальну підтримку комфортного для неї pH (близько 6-7). Одночасно з цим аміак викликає хімічне подразнення і запалення, а згодом і загибель клітин слизової оболонки шлунку.
Продукція бактерією різних екзотоксинів, зокрема, вакуолізуючого екзотоксину (продукту гена vacA), також викликає вакуолізацію, пошкодження і загибель клітин слизової оболонки шлунку[19].
Система секреції IV типу, що використовує ін'єкцію речовин через порожні ворсинки[20], може використовуватися для безпосереднього вприскування в клітки слизової оболонки шлунку різних ефекторних білків (зокрема, продуктів гена cagA), що викликають запалення, підвищення продукції інтерлейкіну-8, інгібування апоптозу і надмірний ріст певних типів клітин. Вважають, що саме цим зумовлена гіперплазія парієнтальних (кислотоутворюючих) клітин шлунку, що спостерігається при гелікобактерній інфекції, гіперсекреція соляної кислоти і пепсину, і, зрештою, підвищення ймовірності раку шлунку[21].
Штами H. pylori, виділені від хворих з виразкою шлунку або дванадцятипалої кишки, як правило, проявляють більшу біохімічну агресивність, ніж штами, виділені від хворих з гастритом, а штами, виділені від хворих з гастритом, зазвичай агресивніші і вірулентніші, ніж штами, виділені від безсимптомних носіїв. Зокрема, штами, виділені від хворих з виразковою хворобою, частіше бувають CagA-позитивними (тобто продукують ефекторний білок CagA). Штами, виділені від хворих з гастритом, частіше продукують екзотоксин VacA, ніж штами, виділені від безсимптомних носіїв. У патогенних штамів також вища продукція уреази, муцинази, протеаз, ліпази — відповідно вища продукція аміаку і здатність розчиняти й ушкоджувати слизову оболонку шлунку.
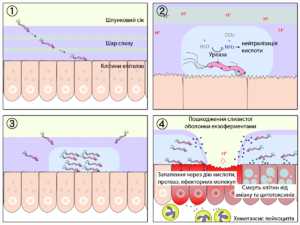 Схематичне зображення патогенезу виразки шлунку
Схематичне зображення патогенезу виразки шлунку 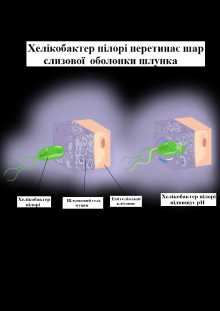 H. pylori проникає у шлунок
H. pylori проникає у шлунок На початковому етапі після попадання в шлунок H. pylori, швидко рухаючись за допомогою джгутиків, долає захисний шар слизу і колонізує слизову оболонку шлунку. Закріпившись на поверхні слизової оболонки, бактерія починає виробляти уреазу, завдяки чому в слизовій оболонці і шарі захисного слизу поблизу від зростаючої колонії збільшується концентрація аміаку і підвищується pH. По механізму негативного зворотного зв'язку це викликає підвищення секреції гастрину клітинами слизової оболонки шлунку і компенсаторне підвищення секреції соляної кислоти і пепсину, з одночасним зниженням секреції бікарбонатів. Крім цього, аміак надає безпосередню дратівливу і роз'їдальну дію на слизову оболонку шлунку, спричинює хімічний опік і запалення.
Муциназа, протеаза і ліпаза, що виробляються бактерією, викликають деполімерізацию і розчинення захисного слизу шлунку, внаслідок чого соляна кислота і пепсин дістають безпосередній доступ до клітин епітелію шлунку і починають роз'їдати їх, викликаючи хімічний опік, запалення і виразку слизової оболонки. Екзотоксини, що виробляються бактерією, викликають вакуолізацию і загибель клітин слизової оболонки. Протеази і ефекторні білки (зокрема, CagA) додатково підсилюють запалення і загибель клітин. Привернуті запаленням (зокрема, секрецією інтерлейкіна-8 клітинами слизової оболонки) лейкоцити виробляють різні медіатори запалення і хімічно агресивні речовини (зокрема перекис водню), що приводить до прогресу запалення і росту виразки[22].
Імуногістохімічне забарвлення H. pylori в біоптаті слизової оболонки шлунка.Діагностика гелікобактерної інфекції зазвичай проводиться шляхом опитування хворого на наявність диспептичних скарг і проявів, а потім виконання тестів, які можуть допомогти підтвердити або спростувати факт наявності гелікобактерної інфекції.
Неінвазивні (без застосування ендоскопії) тести на наявність бактерії включають визначення титру антитіл в крові до антигенів H. pylori, визначення наявності антигенів H. pylori в калі, а також уреазний дихальний тест, що полягає в тому, що пацієнт випиває розчин міченої 14C- або 13C-вуглецем сечовини, яку бактерія розщеплює з утворенням міченого 14C- або 13C- двоокису вуглецю, який потім може бути виявлений в повітрі, що видихається, за допомогою вимірювання радіоактивності (у випадку мічення радіоактивним ізотопом вуглецю C-14) або мас-спектрометрії (у випадку мічення стабільним ізотопом вуглецю C-13).
Проте найнадійнішим методом діагностики інфекції цією бактерією залишається біопсія, що проводиться під час ендоскопічного обстеження шлунка і дванадцятипалої кишки. Узяту при біопсії тканину слизової оболонки піддають швидкому тестуванню на наявність уреази і антигенів H. pylori, гістологічному дослідженню, а також культуральному дослідженню з виділенням бактерії на штучних живильних середовищах.
Жоден з методів діагностики інфекції H. pylori не є повністю достовірним і захищеним від діагностичних помилок чи невдач. Зокрема, результативність біопсії в діагностиці гелікобактерної інфекції залежить від місця взяття біоптата, тому при ендоскопічному дослідженні обов'язкове взяття біоптатів з різних місць слизової оболонки шлунку. Тести на наявність антитіл до антигенів бактерії мають чутливість всього лише від 76 % до 84 %. Деякі ліки можуть впливати на активність уреази, що виділяється H. pylori, внаслідок чого при дослідженні уреазної активності за допомогою міченої сечовини можуть вийти помилково негативні результати.
H. pylori в слизовій оболонці шлунку. Забарвлення за Романовським-Гімзе.Гелікобактерна інфекція може супроводжуватися симптомами або протікати безсимптомно (без будь-яких скарг з боку інфікованого). Передбачається, що до 70 % випадків гелікобактерної інфекції протікають безсимптомно і що від 1/2 до 2/3 людської популяції у світовому масштабі інфіковано H. pylori. Дійсна кількість безсимптомних носіїв бактерії варіює від країни до країни. У розвинених країнах Заходу (Західна Європа, США, Канада, Австралія) ця частка становить приблизно 25 %, проте вона значно вища в країнах так званого «третього світу» та в посткомуністичних країнах Східної Європи і особливо в країнах колишнього Радянського Союзу. У країнах третього світу і в посткомуністичних країнах, унаслідок порівняно низьких санітарних стандартів і умов, не рідкісні випадки виявлення інфекції H. pylori у дітей і підлітків.
Різниця в частоті гелікобактерної інфекції в розвинених країнах Заходу і в країнах «третього світу» пояснюється суворішим дотриманням гігієнічних стандартів і широким використанням антибіотиків. Проте з часом стала виявлятися проблема резистентності до антибіотиків деяких штамів H. pylori[23]. В наш час[коли?] багато штамів цієї бактерії в Європі, США і навіть в країнах, що розвиваються, вже стійкі до метронідазолу.
H. pylori була виділена з калу, слини і зубного нальоту інфікованих пацієнтів, що пояснює можливі шляхи передачі інфекції — фекально-оральний або оральний-оральний (наприклад, при поцілунках, користуванні спільним посудом, спільними столовими приладами, спільними зубними щітками). Можливе (і вельми часто зустрічається) зараження бактерією в установах громадського харчування. Іноді можливе зараження через інфіковані ендоскопи при проведенні діагностичної гастроскопії.
H. pylori в слизовій оболонці шлунку. Забарвлення гематоксилін-еозіном.Вважається, що при відсутності лікування гелікобактерна інфекція, одного разу колонізувавши слизову оболонку шлунку, може існувати протягом всього життя людини. Проте у літніх людей, а також у хворих з давнім гастритом, гелікобактерна інфекція, ймовірно, може самостійно зникати, оскільки з віком або з давністю захворювання гастритом слизова оболонка шлунку стає дедалі атрофічною, тонкішою і менш придатною для колонізації бактерією. Разом з тим, атрофічний гастрит у немолодих, або гастрит, що перейшов в стадію атрофічного гастриту після багатьох років хвороби, піддається лікуванню набагато важче, ніж гелікобактерні гастрити. Тому не слід відкладати лікування хворих з гострим або хронічним гелікобактерним гастритом в надії, що інфекція «пройде сама».
Відсоток гострих гелікобактерних інфекцій, які переходять в хронічну форму, точно не відомий, проте, в декількох дослідженнях, в яких вивчався природний перебіг хвороби без лікування в людських популяціях, повідомлялося про можливість спонтанного самовилікування (спонтанного усунення мікроба-збудника)[24][25].
У пацієнтів з пептичною виразкою шлунка, у яких діагностована гелікобактерна інфекція, стандартним протоколом лікування є «ерадикація Helicobacter pylori», тобто лікувальний режим, направлений на повне знищення цього мікроорганізму в шлунку з метою забезпечити умови для загоєння виразки.
Стандартною терапією при гелікобактерній інфекції сьогодні є так звана «однотижнева потрійна терапія». Австралійський гастроентеролог Томас Бороді ввів перший відомий режим «потрійної терапії» в 1987 році[26]. Сьогодні стандартною «потрійною терапією» є комбінація амоксициліну, кларітроміцину й інгібітора протонного насоса, такого, як омепразол[27]. За останні десятиліття були розроблені різні варіанти «подвійної» або «потрійної» терапії, зокрема такі, що використовують інші, сучасніші й потужніші інгібітори протонної помпи, наприклад, езомепразолу, пантопразолу, лансопразолу, рабепразолу, або використовують метронідазол замість амоксициліну або замість кларітроміцину для хворих з алергією до похідних пеніциліну чи до макролідів[28][29].
Ці види терапії значно підвищили ефективність лікування пептичних виразок і зробили можливим лікування хвороби, тоді як раніше єдиною можливістю були традиційні методи симптоматичного лікування за допомогою антацидів, антагоністів H2-рецепторів або використання окремо інгібіторів протонної помпи[30][31].
Аналіз клінічних випробувань також пропонує додаткове використання пробіотиків, що здатні підвищити темпи ерадикації H. pylori й зменшити побічні ефекти[32].
На жаль, дедалі більше число хворих нині інфіковані штамами, резистентними до деяких антибіотиків. Як наслідок, перше лікування може закінчитися невдало, після чого потрібне повторне лікування новою комбінацією ліків. Наприклад, для лікування штамів, резистентних до кларитоміцину, рекомендується використання в складі терапії левофлоксацину. Сполуки вісмуту також часто бувають ефективними в комбінації з деякими із згаданих препаратів.
Деякі дослідження показують ефективність лікувальних препаратів рослинного походження, наприклад броколі інгібує ріст H. pylori[33] за допомогою сульфорафану, що міститься в ній[34]. Інші дослідження показують ефективність зеленого чаю у стриманні росту H. pylori[35] та інгібуванні адгезії бактерії до епітеліальних клітин[36]. Зазвичай, проте, використання виключно рослинних препаратів недостатнє для ерадикації H. pylori.
Нині частота інфекції H. pylori знижується в розвинених країнах[37][38], ймовірно через покращення санітарії та збільшення використання антибіотиків, це зниження корелює з тим фактом, що в США кількість хворих на виразкову хворобу шлунка та дванадцятипалої кишки скоротилося на 80 % з 1900 до 2000 року. Подібна кореляція також простежується в епідеміологічному зв'язку між H. pylori і раком. Детальніше, як рак шлунку, так і лімфома лімфоїдної тканини, асоційованої зі слизом, пов'язані з H. pylori, а бактерія категоризується як канцероген I групи Міжнародним агентством з дослідження раку (IARC). Попри ці дані, прямого причинно-наслідкового зв'язку не було продемонстровано. Однак, з-поміж бактерій H. pylori вважається найнебезпечнішим канцерогеном.
Нині досліджуються два пов'язаних між собою механізми, за допомогою яких H. pylori може викликати рак. Один механізм стосується збільшення виділення «вільних» радикалів в районі колонії H. pylori, та, як наслідок, збільшення мутацій клітин хазяїна. Інший механізм називається «перигенетичним» шляхом[39]. Він стосується транформації фенотипу клітин за рахунок зміни деяких білків, таких як білки клітинної адгезії. Існує гіпотеза, що ці зміни пов'язані із запаленням, викликаним H. pylori, та збільшенням рівнів фактора некрозу пухлин альфа і інтерлейкіну 6. За цією гіпотезою зміни в адгезії призводять до полегшення міграції мутантних епітеліальних клітин без необхідності додаткових мутацій[39].
Генетичні дослідження[ред. | ред. код]
Електронна мікрофотографія H. pyloriВідомі кілька штамів Helicobacter pylori, і геном двох з них повністю секвенований[40][41]. Геном штаму 26695 складається з приблизно 1,7 мільйона пар основ та містить близько 1550 генів. Два досліджені штами демонструють значні генетичні відмінності, до 6 % послідовності у них різні.
Вивчення генома H. pylori ведеться в основному з метою поліпшити розуміння патогенезу гастритів і виразкової хвороби шлунку, причин здатності цього мікроорганізму викликати ці захворювання. У наш час в базі даних геному Helicobacter pylori 62 гени віднесено до категорії «патогенних» (тобто їх наявність у бактерії корелює з її патогенністю). Обидва досліджені штами мають загальний «патогенний острівець» (загальну послідовність генів, що мають відношення до вірулентності і патогенності цієї бактерії) завдовжки близько 40 kbp, так званий Cag. Цей острівець зазвичай відсутній у штамів, виділених з людей, що є безсимптомними носіями H. pylori. Ген cagA кодує один з головних факторів вірулентності H. pylori. Бактеральні штами, що мають ген cagA, пов'язані із здатністю викликати найбільш тяжкі виразки. Цей ген кодує відносно довгий (1186 амінокислоти) білок. Продукт гена, CagA, потрапляє до людських клітин, де може руйнувати нормальне функціонування цитоскелету. Острівець патогенності Cag містить близько 30 генів, що кодують комплекс системи секреції IV типу. Після приєднання H.pylori до епітеліальних клітин, білок CagA вприскується до них за допомогою цієї системи. Патогенні штами H. pylori активують рецептор епідермального фактора росту (EGFR), мембранний білок з активністю тирозинової кінази. Ця активація пов'язана зі змінами сигнальних систем клітин і експресії генів в епітеліальних клітинах хазяїна, що, ймовірно, сприяє патогенезу. Також відомо, що C-термінальний регіон CagA (амінокислоти 873—1002) може регулювати транскрипцію генів клітини незалежно від фосфорилювання тирозину. Через низький вміст GC гену cagA порівняно з рештою геному, вважається, що він був отриманий від іншого виду бактерій за допомогою горизонтального переносу генів.
Джерела[ред. | ред. код]
- ↑ Розділ 23: Campylobacter and Helicobacter в книзі Samuel Baron, ред. (1996). Medical Microbiology (вид. 4th). ISBN 0963117211.
- ↑ Blaser MJ (2005). An Endangered Species in the Stomach. Scientific American 292 (2): 38–45. PMID 15715390. PMID 15715390.
- ↑ Bizzozero, Giulio (1893). Ueber die schlauchförmigen Drüsen des Magendarmkanals und die Beziehungen ihres Epitheles zu dem Oberflächenepithel der Schleimhaut. Archiv für mikroskopische Anatomie 42: 82–152.
- ↑ Konturek JW (2003 Dec). Discovery by Jaworski of Helicobacter pylori and its pathogenetic role in peptic ulcer, gastritis and gastric cancer. J Physiol Pharmacol. 54 Suppl 3: 23–41. PMID 15075463. Архів оригіналу за 28 серпень 2006. Процитовано 9 лютий 2008.
- ↑ Barry Marshall biography. The Tall Poppy Campaign. Архів оригіналу за 2006-08-19. Процитовано 2006-09-09.
- ↑ Marshall BJ (1983). Unidentified curved bacillus on gastric epithelium in active chronic gastritis. Lancet 1 (8336): 1273–1275. PMID 6134060.
- ↑ Marshall BJ, Warren JR (1984). Unidentified curved bacilli in the stomach patients with gastritis and peptic ulceration. Lancet 1 (8390): 1311–1315. PMID 6145023.
- ↑ Helicobacter pylori in peptic ulcer disease. NIH Consensus Statement Online Jan 7–9;12(1):1-23. Архів оригіналу за 2013-06-21. Процитовано 2004-12-21.
- ↑ Pietroiusti A, Luzzi I, Gomez MJ, Magrini A, Bergamaschi A, Forlini A, Galante A. (April 2005). Helicobacter pylori duodenal colonization is a strong risk factor for the development of duodenal ulcer. PMID 15801926.
- ↑ Ohkusa T, Okayasu I, Miwa H, Ohtaka K, Endo S, Sato N. (2003). Helicobacter pylori infection induces duodenitis and superficial duodenal ulcer in Mongolian gerbils. Gut 52 (6): 797–803. PMID 12740333.
- ↑ The Nobel Prize in Physiology or Medicine 2005 awarded to Barry J. Marshall and J. Robin Warren «for their discovery of the bacterium Helicobacter pylori and its role in gastritis and peptic ulcer disease». Беб-сайт Нобелівського комітету. Архів оригіналу за 2013-06-21. Процитовано 2008-02-09.
- ↑ Mobley, Harry L. T.; George L. Mendz, Stuart L. Hazell (2001). Helicobacter Pylori: Physiology and Genetics. ASM Press. ISBN 1555812139.
- ↑ Starzyñska T, Malfertheiner P (2006). Helicobacter and digestive malignancies. Helicobacter. 11 Suppl 1: 32–5. PMID 16925609.
- ↑ Jonathan W. Olson and Robert J. Maier. (2002). Molecular Hydrogen as an energy source for Helicobacter pylori. Science 298 (5599): 1788–1790. PMID 12459589.
- ↑ Stark RM, Gerwig GJ, Pitman RS, Potts LF, Williams NA, Greenman J, Weinzweig IP, Hirst TR, Millar MR (1999). Biofilm formation by Helicobacter pylori. PMID 10063642.
- ↑ Chan WY, Hui PK, Leung KM, Chow J, Kwok F, Ng CS (1994). Coccoid forms of Helicobacter pylori in the human stomach. PMID 7524304.
- ↑ Amieva MR, El-Omar EM (2008). Host-bacterial interactions in Helicobacter pylori infection. Gastroenterology 134 (1): 306–323. PMID 18166359.
- ↑ O'Toole PW, Lane MC, Porwollik S (2000). Helicobacter pylori motility. Microbes Infect. 2 (10): 1207–1214. PMID 11008110.
- ↑ Purification and characterization of the vacuolating toxin from Helicobacter pylori. J Biol Chem. 267 (15): 10570–10475. 1992. PMID 1587837.
- ↑ Andrzejewska J, Lee SK, Olbermann P, Lotzing N, Katzowitsch E, Linz B, Achtman M, Kado CI, Suerbaum S, Josenhans C (2006). Characterization of the pilin ortholog of the Helicobacter pylori type IV cag pathogenicity apparatus, a surface-associated protein expressed during infection.. J Bacteriol. 188 (16): 5865–5877. PMID 16885455.
- ↑ Hatakeyama M (2008). SagA of CagA in Helicobacter pylori pathogenesis. Curr Opin Microbiol. [Epub ahead of print]. PMID 18243773.
- ↑ Andersen LP (2007). Colonization and infection by Helicobacter pylori in humans. Helicobacter. 12 Suppl 2: 12–15. PMID 17991171.
- ↑ Mégraud F (2004). H pylori antibiotic resistance: prevalence, importance, and advances in testing. Gut 53: 1374–1384. PMID 15306603.
- ↑ Goodman K, Orourke K, Day R, Wang C, Nurgalieva Z, Phillips C, Aragaki C, Campos A, de la Rosa J (2005). Dynamics of Helicobacter pylori infection in a US-Mexico cohort during the first two years of life. Int J Epidemiol 34 (6): 1348–55. PMID 16076858.
- ↑ Goodman K, Cockburn M (2001). The role of epidemiology in understanding the health effects of Helicobacter pylori. Epidemiology 12 (2): 266–71. PMID 11246592.
- ↑ Borody, Thomas J.; P. Cole, S. Noonan, A. Morgan, J. Lenne, L. Hyland, S. Brandl, E. G. Borody, and L. L. George (16 жовтня, 1989). Recurrence of duodenal ulcer and Campylobacter pylori infection after eradication. Medical Journal of Australia 151 (8): 431–435. PMID 2687668.
Биологические свойства Helicobacter pylori Текст научной статьи по специальности «Ветеринарные науки»
жести структурных изменений слизистой пищевода отмечалось увеличение времени экспозиции соляной кислоты в пищеводе. Вместе с тем, эрадикация Н. pylori не оказала существенного влияния на время ацидификации и клиренсную функцию пищевода.
Одним из доминантных факторов в патогенезе ГЭРБ у пациентов с язвенной болезнью может быть повышенная интрагастральная кислотность, которая существенно не менялась с увеличением срока после эрадикации Н. pylori. Возможным объяснением этого может быть увеличение массы париетальных клеток вследствие длительной гипергастри-немии в ответ на персистирование Н. pylori в слизистой желудка, что может являться морфологической основой гиперпродукции соляной кислоты у больных язвенной болезнью даже после ликвидации Hp-инфекции и нормализации уровня гастрина в крови [6].
Наши наблюдения позволяют заключить, что эрадикация Н. pylori не вызывает роста частоты и не отягощает течение ГЭРБ у больных язвенной болезнью. Поэтому лечение язвенной болезни, независимо от сопутствующей ГЭРБ, должно проводиться по общепринятым стандартам. Независимо от Hp-статуса, повышенная интрагастральная кислотность является одним из доминантных факторов в патогенезе ГЭРБ у пациентов с язвенной болезнью, что требует адекватной антисекреторной терапии у данной категории больных.
ЛИТЕРАТУРА
1. Аруин Л.И., Григорьев П.Я., Исаков В.А., Яковенко Э.П. Хронический гастрит. - Амстердам, 1993. - 362 с.
2. Логинов А. С., Васильев Ю. В. // Рос. гастроэнтерол. журн. - 1998. - №2. -С. 5-9.
3. Colin R. //Aliment. Pharmacol. Ther. - 2002. - V. 16, No. 6. - P. 1157-1162.
4. Fallone C.A., Barkun A.N., Friedman G. et al. // Am. J. Gastroenterol. - 2000. -V. 95. - P. 914-920.
5. Gudmundsson K., Johnsson F., Joelsson B. // Scand. J. Gastroenterol. - 1988. - V. 23. - P. 75-79.
6. McColl К. E., Fullarton G. M., Chittajalu R. et al. // Scand. J. Gastroenterol. - 1991. -V. 26, No. 3. - P. 339-346.
7. MuraiT., Miwa H., Ohkura R. etal. //Aliment. Pharmacol. Ther. - 2000. -V. 14. -P. 161-165.
БИОЛОГИЧЕСКИЕ СВОЙСТВА HELICOBACTER PYLORI
JI.B. Кудрявцева
НПФ «ЛИТЕХ»
Выделенные в 1985 г. из биоптатов слизистой оболочки желудка больных антральным гастритом спиральные и изогнутые бактерии первоначально были классифицированы как С. pylori. К бактериям рода Campylobacter они были отнесены на основе морфологической (изогнутые, подвижные, грамотрицательные микроорганизмы), физиологической
(микроаэрофилы, асахаролитические, муколитические) и экологической (адаптированы к жизни в слизистой желудка) характеристик.
Дальнейшие исследования в области ультраструктуры С. pylori отчетливо показали значительные отличия их от рода Campylobacter по следующим параметрам: последовательность аминокислотных остатков в 16S РНК, состав дыхательных хинонов и высших жирных кислот клетки, структура белков наружной мембраны, степень гомологии ДНК и особенности чувствительности к антибактериальным препаратам [6,11,12,13, 20]. Изучение фенотипических и ультраструктурных критериев С. pylori и другого - тесно связанного с ним рода - Wolinella также выявило значительные отличия по профилю клеточных жирных кислот, ростовым характеристикам и ферментативным возможностям (табл. 1). На основании этого был образован новый род, получивший название Helicobacter (helix - спираль, bacter - палочка), а изучаемый микроорганизм был назван Helicobacter pylori [14, 16].
Таблица 1
Сравнительная биохимическая и культуральная характеристика Н. pylori, Н. mustelae Н. cinaedi
Свойства Н. pylori Н. mustelae Н. cinaedi
Оксидаза + + +
Каталаза + + +
Уреаза + + +
Гидролиз гиппурата - - -
Редукция нитратов - + -
Продукция НгЭ - - -
Гаммаглютаилтранспептидаза + + -
Щелочная фосфатаза + + +/-
Подвижность в бульоне + + +
Подвижность на агаре - - +
Рост в микроаэрофильных условиях: +25°С
+30°С + + +
+37°С + + +
+42°С - + -
Рост при содержании в атмосфере 10% С02 + - +
Рост в анаэробных условиях - +/- +/-
Толерантность к 3,5% ЫаС1 - - -
Толерантность к 0,5% глицина - + -
Толерантность к 1% глицина - + -
Толерантность к 1% желчи - - -
Чувствительность к налидиксовой кислоте R S R
Чувствительность к цефалотину S R R
Чувствительность к метронидазолу S R R
Примечание: + положительная реакция; - отрицательная; +/- слабая; Э - чувствительны; Я - устойчивы.
В настоящее время описано 23 вида хеликобактеров, некоторые из них ранее были известны под другими наименованиями. Ниже указаны виды хеликобактеров и источники их выделения.
Helicobacter pylori - мелкие, грамотрицательные, неспорообразующие, микроаэрофильные бактерии, в форме изогнутой S-образной или слегка спиральной формы. Стареющие бактериальные клетки, утрачивая типичную спиралевидную форму, способны переходить в кокковую форму (1-й тип). Дегенеративные изменения в кокковую форму (2-й тип) могут происходить и при неблагоприятных воздействиях факторов внешней среды (изменение температуры или рН) либо при неправильном применении антибактериальных препаратов. Кокковые формы 2-го типа теряют ферментативную активность и репродуктивную способность, у них редуцируется обмен веществ, что создает благоприятные условия для их сохранения в кишечнике и во внешней среде, откуда они могут передаваться человеку фекально-оральным путём. Попав в желудок, такие формы Н. pylori могут вновь трансформироваться в спиралевидные активные формы, способные колонизировать слизистую оболочку желудка. Толщина бактерии составляет 0,5-1,0 мкм, длина - 2,5-3,5 мкм. Бактериальная клетка покрыта гладкой оболочкой, на одном из полюсов имеется 1-6 мономерных жгутиков [7, 8].
Наличие жгутиков гладкой клеточной оболочки и спиралевидной формы позволяет этому микроорганизму передвигаться в толще слизи вдоль градиента рН и служит одним из факторов его вирулентности. Кроме того, жгутики способствуют агрегации Н. pylori для колонизации их на эпителиальной поверхности слизистой оболочки желудка.
Клеточная стенка Н. pylori гладкая, кнаружи от ее мембраны определяется электронноплотный гликокаликс (капсулоподобная оболочка) толщиной более 40 нм с радиальной цикличностью около 14 нм. В состав
Helicobacter pylori............................
H.acinonx........................................
H.nemestrinae.................................
Gastrospirollum hominis 1 (H.heilmanii) Gastrospirollum hominis 2 (H.heilmanii)
H.bizzozeronii..................................
H.felis............................................
H.pullorum......................................
H.CLO-3.........................................
H.fenneliae......................................
H.sp.strain Mainz..............................
H.cinaedi........................................
H.bilis.............................................
H.rappini.........................................
H.canis...........................................
H.muridarum...................................
H.hepaticus.....................................
H.paratensis....................................
H.sp.Bird-B......................................
H.sp.Bird-C.....................................
H.mustelae.....................................
Человек, приматы, свиньи
Гепард
Приматы
Человек
Человек
Собаки
Собаки, кошки
Домашние птицы
Человек
Человек
Человек
Человек, хорьки
Грызуны (мыши)
Человек, овцы, грызуны (мыши)
Собаки
Грызуны (крысы) Грызуны (мыши) Птицы, свиньи Птицы Птицы
Хорьки, норки
гликокаликса входят углеводсодержащие полимеры, необходимые для адгезии Н. pylori на поверхности эпителиоцитов.
Наиболее прочно Н. pylori связывается с экстрактом глицеролипидов (сульфатированным алколацилглицеролипидом) эпителиальных клеток антрального отдела слизистой оболочки желудка, являющимся специфическим рецептором для Н.pylori, что объясняет его родство к пилоричес-кому отделу желудка.
Наиболее благоприятными условиями для жизни, роста и размножения микроорганизма считаются температура +37°С и pH среды 4,0-6,0, хотя они выживают и при pH 2,5. В ходе эволюции бактериальная клетка приобрела жизненно важные физиологические свойства, позволяющие ей активно функционировать при «неблагоприятных» условиях.
Н. pylori имеет довольно широкий набор факторов патогенности, большинство из которых хорошо адаптированы к условиям паразитизма этого микроорганизма в желудке, что обеспечивает ему выживание в кислой среде желудочного содержимого и колонизацию слизистой оболочки.
Н. pylori продуцируют высокоактивные ферменты-уреазу, каталазу, муциназу, оксидазу, гемолизин, щелочную фосфатазу, гамма-глутамил-трансферазу, алкогольдегидрогеназу, глюкосульфосфатазу, протеазу, фосфолипазу, белок - ингибитор секреции соляной кислоты, многочисленные адгезины (к цитоскелету, клеточной мембране, ламинину, холес-теролу), цитотоксины белковой природы и др. [1, 5, 6].
При столь широком спектре ферментативной активности Н. pylori не содержит ферментов, метаболизирующих углеводы. Метаболизм бактериальной клетки обеспечивается энергией, освобождающейся при утилизации трикарбоновых кислот и/или аминокислот, но не углеводов, к окислению которых он не способен.
Исследования in vitro показали, что Н.pylori имеет природную резистентность к следующим антибактериальным препаратам: ванкомицину, триметоприму, цефсулоидину, сульфаниламидам, налидиксовой кислоте и полимиксину В [3]. Эти антибактериальные препараты в настоящее время с успехом применяются в микробиологии для создания транспортных и селективных питательных сред.
При использовании антибактериальных препаратов в клинической практике для лечения Hp-инфекции отмечено, что их действие на Н. pylori ограничено способностью обитания этого микроорганизма в подслизис-том пространстве. Попадая в желудок, антибактериальный препарат остается там короткое время, которого, как правило, недостаточно для проявления его активности в отношении Н. pylori, а это, в свою очередь, зачастую приводит к возникновению устойчивости этого микроорганизма к данному антибактериальному препарату. Поэтому для лечения Нр-ин-фекции было предложено использовать комплексную терапию.
Первоначально в состав этой терапии, помимо антибактериальных перепаратов, входили соли висмута, которые обладают ингибирующим действием на Н. pylori. Для увеличения эффективности противохелико-бактерной терапии группа исследователей предложила ввести в схемы
лечения блокаторы протонной помпы-омепразол или ланзопразол. Бло-каторы протонной помпы, увеличивая pH среды желудка, способствуют активации действия антибактериальных препаратов. Использование в клинической практике схем противохеликобактерной терапии на основе блокаторов протонной помпы позволило увеличить уровень эрадикации до 100% [23, 25].
При исследованиях чувствительности Н. pylori in vitro было выявлено, что понижение pH среды с 7,5 до 5,5 приводит к изменению минимальной ингибирующей концентрации (МИК) антибактериальных препаратов, и только у нитроимидазолов, тетрациклинов и нитрофуранов показатели МИК при изменении pH среды практически не изменялись [2] (табл. 2).
Таблица 2
МИК антибактериальных препаратов при различных значениях pH среды
Препарат №№ изолятов МИК, мг/мл
рН=7,5 рН=6,0 рН=5,5
Пенициллин 20 0,03 0,5 0,5
Ампициллин 20 0,06 0,025 0,5
Цефалексин 17 2 16 32
Эритромицин 20 0,06 2 8
Ципрофлоксацин 20 0,12 0,5 2
Тетрациклин 17 0,12 0,025 0,5
Нитрофурантоин 17 1 2 2
Метронидазол 15 2 2 2
Диффузия различных антибактериальных препаратов из крови в слизистую желудка также имеет диапазон различий и связана с размером молекулы антибактериального препарата и ее гидрофобностью.
Таким образом, низкое значение pH среды, а также ограниченная диффузия антибактериальных препаратов в слизистую желудка являются главными факторами, препятствующими активности антибактериальных препаратов в отношении Н. pylori.
Бесконтрольное использование антибактериальных препаратов в целом и неадекватная противохеликобактерная терапия зачастую приводят к формированию вторичной приобретенной резистентности у Н. pylori. Первичная (приобретенная) резистентность - результат приспособительных реакций Н. pylori к неблагоприятным условиям внешней среды. Она возникает в случае приема антибактериальных препаратов, не связанных с инфицированием Н. pylori. Вторичная (приобретенная) резистентность возникает непосредственно в процессе лечения инфекции, вызванной Н. pylori.
В настоящее время уже описана резистентность Н. pylori к шести группам антибактериальных препаратов: нитроимидазолам, макролидам, фторхинолонам и производным рифампицина, ß-лактамам, тетрацикли-нам и нитрофуранам.
Наибольшую тревогу у клиницистов во всем мире вызывает резистентность Н. pylori к нитроимидазолам (метронидазолу). На сегодняшний день она составляет 10-90%: наименьший уровень резистентности отмечается в Скандинавии (до 10%), наибольший - в Африке (более 80%).
Поданным Российской группы по изучению Н. pylori, в России во взрослой популяции в 1998 г. уровень резистентности Н. pylori к метронидазолу составлял 30%. К 2000 г. он достиг 56,6%. В 2005 г. уровень резистентности Н. pylori к метронидазолу составил 54,8%.
Столь высокий уровень резистентности связан с широким использованием препаратов этой группы в хирургии и гинекологии. Еще несколько лет назад в нашей стране метронидазол в виде монотерапии применялся и в гастроэнтерологии для лечения гастритов и язвенной болезни. Сегодня этот препарат входит практически во все схемы лечения, направленные на эрадикацию Н. pylori.
Точный механизм возникновения приобретенной резистентности, также, как и сам механизм действия нитроимидазолов на Н. pylori, неизвестны. Вероятнее всего, резистентные штаммы Н. pylori появляются в результате мутаций. Недавно было обнаружено, что мутации в гене rdxA, кодирующем кислороднечувствительную нитроредуктазу, приводят к увеличению резистентности Н. pylori к 5-нитроимидазолам из-за инактивации нитроредукта-зы. Резистентность к 5-нитроимидазолам может также возникнуть из-за вставки последовательности (мини IS605) делеции в гене rdxA.
Уровень первичной резистентности Н. pylori к кларитромицину в Европе на сегодняшний день составляет 5-20% [15, 19, 20].
В отличие отданных, полученных в Европе, в России пока существенно меньше штаммов Н. pylori, резистентных к кларитромицину. Тем не менее, их количество с каждым годом увеличивается. Так, если в 1998 г. в России вообще не было зафиксировано ни одного штамма Н. pylori, резистентного к кларитромицину, в 1999 г. их было зарегистрировано 7,6%, то в 2000 г. их было уже 16,6%, а в 2005 г. уровень резистентности Н. pylori к кларитромицину составил 19,3%.
Столь высокий темп увеличения в человеческой популяции штаммов Н. pylori, резистентных к макролидам, связан с активным использованием данного препарата не только в гастроэнтерологии, но и при лечении инфекций респираторного тракта.
Макролиды блокируют синтез белка на рибосомальном уровне и таким образом осуществляют свое действие на бактериальную клетку. Недавние исследования показали, что резистентность Н. pylori к макролидам возникает в результате точечных мутаций в позиции 2142 и 2143 гена 23S РНК[3, 9,21,23].
Первые сообщения о выделении штаммов Н. pylori, резистентных к ß-лактамам (амоксициллину), появились в 1997 г. Группа исследователей под руководством М.Р. Dore выделила штамм Н. pylori, резистентный к амоксициллину, от пациента, длительно принимавшего этот препарат. Но, к сожалению, эта резистентность оказалась нестабильной и исчезла после заморозки и попытки повторной рекультивации штамма. В 1998 г. A.A. Van
Swet и в 1999 г. Российской группе по изучению Н. pylori удалось выделить от пациентов, после проведенной противохеликобактерной терапии, штаммы Н. pylori со стабильной резистентностью к амоксициллину. Совсем недавно было показано, что точечные мутации в пенициллинсвязывающем белке (РВР-1 А) могут быть частично связаны со стабильной резистентностью Н. pylori к амоксициллину.
Фторхинолоны относятся к группе резервных антибиотиков, которые используются в клинической практике только в крайних случаях для лечения тяжелых бактериальных инфекций. Препараты данной группы не получили широкого применения и для лечения инфекции, вызванной Н. pylori. Уровень первичной резистентности к ципрофлоксацину, офлок-сацину и норфлоксацину очень низок: менее 1 %.
Основной мишенью для действия фторхинолонов у грамотрицатель-ных бактерий является ДНК-гираза. Этот фермент опосредует конфор-мационные изменения в молекуле бактериальной ДНК, необходимые для ее нормальной репликации. Ген этого фермента локализован на бактериальной хромосоме. Основой формирования резистентности у Н. pylori к фторхинолонам являются мутации (аминокислотные замены) на участке между 67 и 106 аминокислотными остатками в области «хинолонового кармана» чувствительных ферментов, приводящих к снижению аффинности к фторхинолонам.
До недавнего времени считалось, что штаммы Н. pylori, резистентные к стрептомицину, рифампицину и рифаксимину, можно получить только в лабораторных условиях при инкубации микроорганизма на питательных средах, содержащих эти антибактериальные препараты.
Хотя генетические мутации у Н. pylori в отношении этих антибактериальных препаратов еще не изучены, но возможно, они аналогичны таковым у E.coli. Известно, что резистентность к рифампицину у E.coli происходит из-за мутаций в ргоВ гене, кодирующем В субъединицу РНК-полимеразы. В отношении стрептомицина у E.coli мутация происходит в гене, кодирующем субъединицу 12S рибосомальной РНК.
В настоящее время в литературе описан единственный случай резистентности Н.pylori к тетрациклину. Резистентность Н.pylori к тетрациклину обусловлена точечной мутацией в позиции 26695 в 16S РНК [3,17,18].
ЛИТЕРАТУРА
1. ДовгальС.Г. //Актуальные проблемы инфекционной патологии -Ч. 1. - СПб., 1993.- С. 21.
2. Исаков В.А. // Клин, фармакол. тер. - 2002. - №1. - С. 79-83.
3. Кудрявцева Л.В., Исаков В.А., Говорун В.М. // Рос. журн. гастроэнтерол., гепатол., колонопроктол. - 2001. - №2. - С. 54-57.
4. Кудрявцева Л.В., Несвижский Ю.В. Устойчивость // Диагностика и лечение заболеваний, ассоциированных с Helicobacter pylori. Материалы I междунар. симпозиума Российской группы по изучению Helicobacter pylori. - М., 1998. - С.11-14.
5. Рожавин М.А. // Клин. мед. - 1989. - № 11. - С. 20-24.
6. Сафонова Н.В., Жебрун А.Б. Гастрит, язвенная болезнь и хеликобактериоз. -СПб., 1995. -39с.
7. Bode G., Mauch F., Malfertheiner P. // Epydemiol. Infect. - 1993. - V. 111. -P. 483-490.
8. Cellini L., Allocati N., Angellutti D. et al. // Microbiol. Immunol. - 1994. - V. 38. -P. 834-850.
9. Debets-Ossenkopp Y., Harscheid A., Pot R. et al. // J. Antimicrob. Chemother. -1999. -V. 43, No.4. - P. 511-516.
10. Dore M., Piano A., Carta M. etal. //Aliment. Pharmacol. Ther. - 1998. - V. 12. -P. 635-663.
11. Fung W.P., Papadimitriou J.M., Matz L.R. //Am. J. Gastroenterol. - 1979. -V. 71.
- P. 269-279.
12. Fitzerald 0., Murhy P. // Ir. J. Med. Sci. - 1954. - V. 292. - P. 99-153.
13. Goodvin C.S., Armstrong J.A., ChilversT. // Int. J. Syst. Bacteriol. - 1989. -V. 39.
- P. 397.
14. Graham D.Y., Peura D.A. //Am. J. Gastroenterol. - 1994. -V. 89. - P. 1137-1139.
15. Lacey S.L., MossS.F., Taylor G.W. //J. Antimicrob. Chemother. - 1993. - V. 32, No. 3. - P. 393-400.
16. Lambert M.A., Patton C.M., Barret T.J. // J. Clin. Microbiol. - 1987. - V. 25. -P. 706-713.
17. Lee A., Megraud F. // Helicobacter pylori: techniques for clinical diagnosis and basic research. - 1996. - P. 20-21.
18. Megraud F. // Eur. J. Gastroenterol. - 1995 (Suppl. 1). - P. 49-54.
19. Noach L.A., Langenberg W.L., Bertola M.A. et al. // Scand. J. Infect. Dis. - 1994.
- V. 26, No.3. - P. 321-327.
20. Palmer E.D. // Gastroenterology. - 1954. - V. 27. - P. 218-220.
21. PilottoA., RassuM., Franceschy M., Di Mario F. // Dig. Liver Dis. - 2000.-V. 32, No. 9. - P. 763-8.
22. Unge P. //Scand. J. Gastroenterol. - 1996. -V. 215. - P.74-81.
23. Versalovic J., Osato M.S., Spakovsky K. etal. //J. Antimicrob. Chemother. - 1997. -V. 40. - P. 283-286.
24. Van der Hulst R.W., Keller J.J., Rauws E.A. et al. // Helicobactericia. - 1996. -V. 1, No. 1. - P. 6-19.
НАРУШЕНИЯ ПОЛОСТНОГО ПИЩЕВАРЕНИЯ У БОЛЬНЫХ
ЯЗВЕННОЙ БОЛЕЗНЬЮ ДВЕНАДЦАТИПЕРСТНОЙ КИШКИ И ИХ КОРРЕКЦИЯ
СОВРЕМЕННОЙ ЭРАДИКАЦИОННОЙ И ПОЛИФЕРМЕНТНОЙ ТЕРАПИЕЙ
И.В. Маев, А.А. Самсонов, Н.Н. Голубев, Е.В. Белявцева, Е.В. Жаркова
МГСУ
Двенадцатиперстная кишка является важнейшей частью тонкой кишки и центральным органом гастродуоденогепатопанкреатической зоны [11]. В ней «перекрещиваются» пищеварительные пути желудка, кишечника, печени и поджелудочной железы. При заболеваниях двенадцатиперстной кишки, особенно длительно и хронически протекающих, страдает пищеварительная и моторная функция всего региона.
Язвенная болезнь относится к числу наиболее распространенных заболеваний желудочно-кишечного тракта. Открытие Н. pylori, разработ-
Хеликобактериоз — Википедия
| Хеликобактериоз | |
|---|---|
| Иммуногистохимическая окраска Helicobacter pylori в биоптате слизистой желудка | |
| МКБ-10 | B96.81 |
| МКБ-9 | 533533 |
| DiseasesDB | 5702 |
| MedlinePlus | 000229 |
| eMedicine | med/962 |
| MeSH | D016481 |
Хеликобактериоз — инфекционное заболевание с фекально-оральным механизмом передачи возбудителя, вызываемое возбудителем роду Helicobacter. Характерно поражение желудка и двенадцатиперстной кишки. Ведет к развитию гастрита и язвы[1]. Инкубационный период инфекции около семи дней. При своевременно начатом лечении возможны полная санация, исчезновение признаков гастрита, нормализация кислотности, стойкое рубцевание язв.
- ↑ Возианова Ж. И. Инфекционные и паразитарные болезни. — Здоров'я, 2000. — ISBN 5-311-011-696.
- Исаков В. А., Домарадский И. В. Хеликобактериоз. — М.: Медпрактика-М, 2003. — 412 с. — 4018 экз. — ISBN 5-901654-47-1. (в пер.)
- Хеликобактериоз
| Это заготовка статьи по эпидемиологии. Вы можете помочь проекту, дополнив её. |