Полиорганная недостаточность патофизиология
Клиническая патофизиология полиорганной недостаточности
Полиорганная недостаточность является основной проблемой клинической реаниматологии в течение последних 2-х десятилетий.
Возникновению этого состояния, в первую очередь, способствовали успехи современной медицины, а именно — реаниматологии и интенсивной терапии, позволившие вывести из состояния клинической смерти и тяжелых стадий шока тех больных, которые ранее неминуемо были обречены. Истинной трагедией в данной ситуации является то, что у большинства больных, выведенных из терминального состояния, в течение последующих 3—5 суток наступает повторное ухудшение состояния, обусловленное поражением нескольких органов и систем — почек, легких, сердца, печени и других. Коррекция этих осложнений требует колоссальных усилий и средств; но даже при рациональной и своевременной терапии поражение 3-х и более органов или систем в большинстве случаев заканчивается летальным исходом.
При этом констатируется, что в общих отделениях интенсивной терапии, в которых лечатся терапевтические и хирургические больные, частота ПОН составляет около 15% всего числа больных (В. С. Friedman, 1989), а летальность в этой группе пациентов в значительной степени превышает 60%.
Впервые, как самостоятельная форма патологии, ПОН была описана Tilney е.а. (1973) у больных с недостаточностью органных систем на фоне септических осложнений после операции, аналогичный исход наблюдался у пациентов с политравмой и тяжелыми ожогами.
Академиком В. А. Неговским с сотрудниками (1979) впервые в мире было введено понятие о постреанимационной болезни, развивающейся после остановки сердца и успешной реанимации, когда, несмотря на стабилизацию сердечной деятельности и дыхания, может наблюдаться неполное восстановление функций центральной нервной системы.
Дальнейшее изучение патофизиологических процессов, протекающих на фоне реперфузии и реоксигенации тканей в процессе лечения шока, позволило сформулировать концепцию полиорганной недостаточности (ПОН), как одновременного или последовательного поражения жизненно важных систем организма, представляющего собой общий конечный путь развития травматологической, хирургической и внутренней патологии.
Несмотря на значительное количество научных работ, посвященных патофизиологическим аспектам ПОН, вопрос о пусковом механизме этого процесса остается дискутабельным. Однако, по мнению ряда авторов, прелюдией ПОН при сепсисе, синдроме позиционного сдавления, токсико-аллергическом дерматите, астматическом статусе, послеоперационном синдроме является синдром системного воспалительного ответа (SIRS), рассматриваемый в настоящее время как один из универсальных патологических механизмов, лежащих в основе развития критических состояний.
Основные патогенетические моменты SIRS обусловлены эффектами ряда биологически активных веществ, вырабатываемых клетками иммунореактивной системы с последующей активацией гуморальных систем и развитием органной недостаточности. Выделяют 3 стадии развития SIRS:
1 — локальная продукция цитокинов;
2 — выброс малого количества цитокинов в системный кровоток, активирующий макрофаги, тромбоциты, продукцию гормона роста, в результате чего развивается острофазовая реакция, находящаяся под контролем провоспалительных медиаторов и их эндогенных антагонистов;
3 — генерализация воспалительной реакции: при критической ситуации избыточный выброс медиаторов, измененные пути рецепторных и клеточных взаимодействий приводят не к ауторегулируемой реакции, а к тотальным нарушениям сосудистого тонуса, микроциркуляции, проницаемости, гиперметаболизму, повреждению и деструкции тканей.
SIRS — симптомокомплекс, характеризующийся воспалительной реакцией в системе эндотелиоцитов, обуславливающий направленность воспалительного ответа на повреждение.
По определению А. П. Зильбера (1997), полиорганная недостаточность — это универсальное поражение всех органов и тканей агрессивными медиаторами критического состояния с временным преобладанием симптомов той или иной органной недостаточности — легочной, сердечной, почечной и т.д.
Рассматривается несколько физиологических механизмов развития ПОН:
- медиаторный, при котором ведущую роль играет аутоиммунное поражение;
- микроциркуляторный, включающий, в том числе, и феномен реперфузии;
- инфекционно-септический механизм, рассматривающий «кишечник как недренированный абсцесс»;
- феномен «двойного удара», когда наряду с патологическими процессами факторами агрессии становятся и наши — лечебные — вмешательства.
Понимание ведущей роли медиаторного повреждения при критических состояниях стало возможным благодаря глубокому и детальному изучению функции эндотелия. Начиная с 1987 г., когда состоялся первый Международный симпозиум «Эндотелиальная биология», эндотелий рассматривается не только как механическая выстилка, отделяющая систему кровообращения от органов и тканей и играющая пассивную роль в переносе веществ из кровотока в ткани и обратно, но и как орган, с одной стороны, имеющий специфические анатомические и физиологические функциональные особенности в тканях, где он располагается, с другой — выполняющий функции в целом организме.
Выявлены следующие, ранее неизвестные, функции эндотелия:
- эндотелий активно меняет проницаемость сосудистой стенки посредством медиаторов, вырабатываемых эндотелиоцитами;
- эндотелий вырабатывает ряд вазоактивных веществ, действующих на сосудистые и гладкие мышцы, расширяющих или суживающих сосуды, и регулирует, таким образом, объем и скорость кровотока определенных участков тканей;
- в эндотелии синтезируются факторы свертывающей, анти-коагулянтной и фибринолитической систем, на его поверхности осуществляется взаимодействие этих факторов; сосудистая стенка также принимает активное участие в атерогенезе;
- взаимодействие клеток крови (лейкоцитов и тромбоцитов) — адгезия, агрегация и трансформация — осуществляется при активном участии эндотелия.
Вышеперечисленные свойства обуславливают активное участие эндотелия в иммунореактивной системе — воспалительной и пролиферативной реакциях, возникновении и распространении злокачественных опухолей, в анафилактических реакциях.
В настоящее время изучено большое количество биологически активных веществ (БАВ), секретируемых эндотелием в кровь, и ряд специфических рецепторов, экспрессируемых эндотелиоцитами, как точки приложения БАВ и межклеточных взаимодействий.
Рассмотрим некоторые БАВ, имеющие непосредственное отношение к развитию ПОН. Это необходимо, во-первых, для понимания патогенетических механизмов этого состояния и, во-вторых — для обоснованного и целенаправленного применения этих веществ и их антагонистов в терапии ПОН.
Эндотелии (или эндотелиальный стимулирующий фактор — ЭСФ) и его изоформы — эндотелин-2 и эндотелин-3 — это производные эндотелиальных клеток. При нормальной физиологии легкие являются местом разрушения эндотелина. Участие эндотелиновой системы в физиологических и патологических реакциях включает:
- регуляцию функционального состояния эндотелия, в первую очередь — интимы артерий и вен различных сосудистых регионов;
- регуляцию тонуса кровеносных сосудов и сосудов бронхиального дерева с непосредственно вазоконстрикторным влиянием;
- нейрогенную активность эдотелиоцитов, конкретные механизмы которой пока не выяснены;
- участие в рилизинге катехоламинов из хромаффинных клеток надпочечников и других физиологически значимых субстанций.
В результате нарушения «нормального» метаболизма системы эндотелинов: повышения синтеза предшественников или экспрессии рецепторов пептидов или высокой активности эндотелин-превращающего фермента (ЕСЕ) — развиваются различные патологические процессы (некоторые формы гипертонической болезни, почечной ишемии, субарахноидальные кровоизлияния, инфаркт миокарда, аритмии сердца).
Учитывая это, перспективным является создание новых препаратов — антагонистов рецепторов эндотелинов и ингибиторов ЕСЕ (О. А. Гомазков, 1998).
Серотонин — по данным А. П. Симоненкова, вырабатывается энтеро-хромаффинными клетками ЖКТ, адсорбируется тромбоцитами, которые, проходя через микрососуды, где они располагаются пристеночно, с каждым сердечным сокращением, под давлением эритроцитов выделяют серотонин. Серотонин, взаимодействуя с серотониновыми рецепторами гладкой мускулатуры, вызывает сокращение гладких мышц микроциркуляторного русла, обеспечивая механизм эндогенной вазомоторики за счет преобразования биохимической энергии в механическую.
Тромбоксан (ТхА2), являющийся продуктом арахидоновой кислоты, кроме вазоконстрикторного действия также стимулирует агрегацию тромбоцитов. Противоположными свойствами обладает простациклин (Pgl2), расслабляющий гладкую мускулатуру сосудов и угнетающий агрегацию тромбоцитов.
При распаде арахидоновой кислоты образуются также лейкотриены, взаимодействующие с фактором некроза опухоли (TNFa), стимулирующие хемотаксис нейтрофилов (LtB4), вызывающие вазоконстрикцию и бронхоконстрикцию (LtC4 и Ltl4) и, в условиях эндотоксемии, повреждающие легкие и печень.
Совокупное действие эйкосаноидов (продуктов арахидоновой кислоты) заключается в следующем:
- бронхоконстрикция;
- повышение проницаемости мембран;
- воспалительная реакция;
- микротромбоз.
Сосудорасширяющим эффектом обладает эндотелиальный расслабляющий фактор (ЭРФ), а его действующим началом является оксид азота — NO. Исследованию роли, функций и возможности применения NО посвящено огромное количество работ.
Установлено, что именно NО, образовавшийся в эндотелии под воздействием многих медиаторов (кинины, ацетилхолин и др.), вызывает локальное расслабление сосуда через систему гуанилат-циклазы и, просуществовав доли секунды, инактивируется, соединяясь с гемоглобином.
Выяснено, что действующим началом таких вазодилятаторов, как нитроглицерин и нитропруссид Na, является NО, действующий в этом случае не локально, а на все сосуды.
В последнее десятилетие успешно используется ингаляция NО в ничтожных дозах (5—20 ppm = parts per million, т.е. разведение вещества на 10‾6, или 0,000005 — 0,00002%) для снятия легочной гипертензии при лечении РДСВ, дистресс-синдрома новорожденных, ТЭЛА, после операций на сердце. NО является селективным легочным вазодилятатором, т.к. он не доходит до большого круга, быстро инактивируясь гемоглобином. Кроме того, ингаляция NО эффективно уменьшает шунтирование крови в легких при РДСВ, оказывая сосудорасширяющее действие только в вентилируемых зонах легких.
Используя лечебный эффект NО, необходимо помнить о токсичности как самого NО, так и его дериватов (NО2), способности их образовывать метгемоглобин, а также азотистую и азотную кислоту.
NО как физиологический регулятор секретируется в эндотелии и нейроцитах при участии NO-синтетазы-Т и -III (NOS-I, -III) соответственно в ничтожных количествах — пикомолях (10‾12). Но эндогенный NO может действовать не только как физиологический регулятор. При критических состояниях он секретируется не только эндотелием, но и активированными макрофагами, и другими клетками иммунореактивной системы по пути NOS-II (NO-синтетазы-Н) в 1000 раз больших количествах (10‾9). И такой NO вызывает патологическое расширение сосудов (например, при септическом шоке), когда обычные средства коррекции гемодинамики малоэффективны.
Брадикинин вызывает локальную вазодилятацию.
В большой группе медиаторов патологических реакций при ПОН одно из ведущих мест занимают цитокины — низкомолекулярные белковые вещества, синтезируемые различными клетками (эндотелием, лейкоцитами, фибробластами) в ничтожных количествах и управляющие различными функциями клеток через специфичные рецепторы, находящиеся на них.
Как правило, цитокины оказывают аутокринный или паракринный эффекты (воздействуют или непосредственно на клетку, в которой образовались или — на расположенные рядом). Только некоторые из них — интерлейкин-1 (IL-1) и фактор некроза опухоли (TNFa) оказывают общий, или дистальный эффект.
Цитокины участвуют в работе иммунореактивной системы, осуществляя реакции воспаления, регуляции роста и дифференциации, обеспечивая иммунную защиту, в т.ч. и против опухолевых клеток, участвуют в регенеративных процессах.
Однако при критических состояниях при воздействии запредельного повреждающего фактора — длительной гипоксии, эндотоксемии, массивного повреждения тканей — реакция иммунореактивной системы превращается из защитной в разрушающую. Это обусловлено:
- массивностью выброса медиаторов в кровоток;
- запуском цитокинового каскада, когда отдельный цитокин инициирует образование других;
- измененным исходным состоянием клеток, продуцирующих цитокины, и клеток-мишеней;
- большинство цитокинов имеет множество точек воздействия, т. е. плеотропны;
- одно из основных условий парадоксальной шоковой реакции — изменение места действия, что имеет место, например, при развитии септического шока: в обычных условиях эндотоксин, выделяемый бактериями в ткань, через рецепторный аппарат активирует макрофаги, которые выделяют TNFa и IL-1, запуская местную воспалительную реакцию, направленную против бактерий. Если же эндотоксин попадает в общий системный кровоток, то он активирует моноциты, являющиеся предшественниками тканевых макрофагов. Активация моноцитов и прямое повреждающее влияние эндотоксина на тромбоциты и эндотелий приводят к резкому системному ответу, выбросу в кровоток TNFa и IL-1, запуску цитокинового каскада.
В результате появления TNFa в кровотоке происходит стимуляция эндотелия и макрофагов на выделение NO по «патологическому» пути — по пути NOS-II, т. е. в 1000 раз больших количествах. TNFa вызывает отек за счет повышения проницаемости и тканевой некроз. Образование IL-1 тормозит реакцию гладкой мышцы сосуда на сосудосуживающие стимулы, оказывает пирогенное действие, обеспечивает хемотаксис нейтрофилов.
Кроме TNFa и IL-1 на выраженность воспаления влияют и другие участники иммунореактивной системы.
Интерфероны активируют эндотелиальные рецепторы ICAM-1, -2 (адгезивные молекулы) и стимулируют выработку других цитокинов, в частности — факторов роста тромбоцитов, эндотелия, фибробластов и др.
Фибронектин в его тканевой форме обеспечивает непроницаемость волокон и соединений. Циркулирующий фибронектин является опсонином — вызывает адгезию обломков клеток, фибриногена, чужеродных материалов к макрофагам и эндотелию, обеспечивая их уничтожение. Недостаточность фибронектина и опсониновой системы имеет значение в прогрессировании SIRS и ДВС-синдрома.
ФАТ (фактор активирующий тромбоциты) запускает реакцию сосудисто-тромбоцитарного гемостаза и начала ДВС-синдрома, увеличивает проницаемость.
Хемотаксические факторы стимулируют адгезию и агрегацию тромбоцитов, лейкоцитов, макрофагов и др. Эозинофильный хемотаксический фактор стимулирует выброс из эозинофилов большого количества БАВ при критических состояниях.
Описывается феномен агрегации нейтрофилов под влиянием лейкоцитарных адгезивных белков при ишемии тканей, что имеет ведущее значение для повреждения легких и для развития геморрагического шока.
При повреждении клеток активируется комплемент, из клеток освобождаются лизосомальные протеолитические ферменты, вызывающие денатурацию клеточных белков, происходит выброс в кровоток тромбопластина. В результате активируется калликреин-кининовая, свертывающая и фибринолитическая системы. Активированные лейкоциты и тромбоциты образуют агрегаты и микроэмболы, развивается ДВС-синдром.
Воздействие цитокинов на эндотелий вызывает «кислородный взрыв» клетки, нарушение баланса системы перекисного окисления липидов и антиоксидантной системы, проявляющееся увеличением циркулирующих молекул средней массы, истощением антиоксидантной защиты, иммунодепрессией. Маркером альтерации сосудистого эндотелия является возрастание уровня циркулирующих эндотелиоцитов в крови (эксфолиация эндотелиоцитов), нарушаются его регуляторные свойства, усиливается адгезия нейтрофилов к эндотелию и их миграция в ткани, повышается проницаемость сосудистой стенки. Резко увеличивается синтез метаболитов арахидоновой кислоты (простагландинов, тромбоксана, лейкотриенов). Все это приводит к развитию системного воспалительного ответа.
Лысенков С.П., Мясникова В.В., Пономарев В.В.
Неотложные состояния и анестезия в акушерстве. Клиническая патофизиология и фармакотерапия
Опубликовал Константин Моканов
СИНДРОМ ПОЛИОРГАННОЙ НЕДОСТАТОЧНОСТИ
СИНДРОМ ПОЛИОРГАННОЙ НЕДОСТАТОЧНОСТИ (ПОН).
МЕТАБОЛИЧЕСКИЕ ОСНОВЫ
(Лекция. Часть 1)
И.Н.Лейдерман
Кафедра анестезиологии и реаниматологии Уральской государственной медицинской Академии.
Городская клиническая больница скорой медицинской помощи. ГМПО "Сангвис". Екатеринбург
ПОН. Определение. Этиология. Патогенез.
Прогресс, достигнутый в медицине критических состояний к 70-м годам ХХ века, положил начало принципиально новому подходу в трактовке тяжести патологического процесса - концепции единого патогенеза и взаимообусловленного прогрессирования органной несостоятельности.
Впервые термин "полиорганная недостаточность" (ПОН) вошел в клиническую практику после публикации работы N.Тylney и сотр. (1973) "Последовательная системная недостаточность после разрыва аневризмы брюшной аорты. Нерешенная проблема послеоперационного лечения". Позже А.Baue (1975), а далее B.Eisman (1977) и D.Fry (1980-1982) окончательно сформировали особенности этого состояния и его дефиниции.
В нашей стране большой вклад в изучение патогенеза и разработку методов диагностики, профилактики и лечения ПОН внесли Е.С.Золотокрылина, Ю.Н.Шанин, А.П.Зильбер, В.Л.Кассиль, В.А. Гологорский, Б.Р.Гельфанд, О.А.Долина, Р.Н.Лебедева и другие.
Сегодня мы понимаем под ПОН тяжелую неспецифическую стресс-реакцию организма, недостаточность двух и более функциональных систем, универсальное поражение всех органов и тканей организма агрессивными медиаторами критического состояния с временным преобладанием симптомов той или иной органной недостаточности - легочной, сердечной, почечной и т. д. Основной особенностью ПОН является неудержимость развития повреждения органа жизнеобеспечения или системы до такой глубины, после достижения которой приходиться констатировать неспособность органа функционировать в интересах поддержания жизненно важных функций вообще и сохранения своей структуры, в частности. Непосредственными факторами, определяющими выраженность полиорганной дисфункции, являются различная способность органов противостоять гипоксии и снижению кровотока, характер шокового фактора и исходное функциональное состояние самого органа.
По данным северо-американских исследователей, ПОН уже в течение 20 лет остается основной причиной смерти среди пациентов палат интенсивной терапии и реанимации хирургических стационаров и занимает около 75-80 % общей летальности. При этом средняя длительность пребывания больного с ПОН в хирур-гических палатах интенсивной терапии составляет 21 день, а затраты на лечение порядка 85 000 амери-канских долларов. Общие финансовые вложения у вы-живших и прошедших реабилитацию пациентов приближаются к сумме в 300 000 американских дол-ларов. По этиологии ПОН подразделяют на два основных вида:
ПОН, возникшая в связи с утяжелением какой-либо патологии, когда одна или несколько жизненных функций повреждаются настолько ,что требуется их искусственное замещение
ятрогенная ПОН
Также можно говорить о вариантах посттравматической, постгеморрагической, cептической, панкреатогенной, постреанимационной ПОН. Однако почти 90% случаев ПОН имеют инфекционную природу , при этом уровень летальности колеблется от 35 до 75 % и более.
В развитии синдрома ПОН выделяют три основных фазы:
Индукционную фазу, результатом которой является синтез целого ряда гуморальных факторов, запускающих реакцию системного воспалительного ответа;
Каскадную фазу, сопровождающуюся развитием острого легочного повреждения, активацией каскадов калликреин-кининовой системы, системы арахидоновой кислоты, свертывающей системы крови и других;
Фазу вторичной аутоагресии, предельно выраженной органной дисфункции и стабильного гипер-метаболизма, в которую организм больного теряет способность к самостоятельной регуляции гомеостаза;
Инициирующий фактор, запускающий выброс медиаторов системного воспаления, может быть самым разным по происхождению - это инфекция, травма, ишемия, кровопотеря, ожоги. Перечисленные воздействия переводят полиморфноядерные нуклеары (нейтрофилы, базофилы, гранулоциты) и эндотелиоциты в состояние "кислородного взрыва", результатом данной трансформации является мощный хаотичный выброс этими клетками в кровоток огромного коли-чества субстанциий, обладающих разнонаправленными эффектами и являющимися медиаторами ПОН ( Табл.1.1.).
Таблица 1.1 Медиаторы ПОН Цитокины
Интерлейкин 1
Интерлейкин 2
Интерлейкин 6
Фактор, активирующий тромбоциты
Тромбоксаны
Фактор некроза опухоли
Эйкозаноиды
Простогландины (Е1,Е2)
Лейкотриены
Медиаторные амины
Гистамин / серотонин
Октопамин
Опиоиды / нейротрансмиттеры
Энкефалины
бета-эндорфины Гормональные амины / пептиды
Тироксин
Гормон роста
Инсулин
Глюкагон
Комплемент
Кинины
Фибронектин
Факторы роста
Энзимы
Протеазы
Лизосомальные ферменты
Окись азота ( NO )
Продукты ПОЛ
Супероксидные радикалы
Гидроксирадикалы
Перекиси
В настоящее время известно уже около 200 таких медиаторов. Основными из них являются:
Цитокины - низкомолекулярные белки, чья биологическая активность осуществляется через специфические рецепторы, расположенные на клеточных мембранах. Наиболее значимыми являются фактор некроза опухоли (TNF) и интерлейкины 1, 6, 10. Они способны оказывать как местное так и дистальное воздействие (на отдаленные органы и ткани). Общим для всей группы является усиление адгезии и агрегации лейкоцитов, а также гиперкатаболический и гипердинамические эффекты. Именно цитокины являются медиаторами первого ряда, которые сами способны вызывать каскады гуморальных реакций. Основными цитокинами , отвечающими за стимуляцию системного ответа в острой фазе являются интерлейкин-1, интерлейкин-6 и фактор накроза опухоли, при этом интерлейкин-6 играет доминирующую роль. Первичное действие цитокинов направлено на изменение генного ответа. TNF и интерлейкин-1 показали способность к прямому транскрипционному воздействию на продукцию интерлейкина-6. В других случаях было отмечено синергичное действие интерлейкина-1 и 6, приводящее к развитию максимального ответа на повреждение. Под воздействием высоких концентраций цитокинов фактора некроза опухоли, интерлейкинов 1 и 6, интерферона-гамма у экспериментальных животных происходили существенные изменения в общем пуле свободных аминокислот плазмы При этом установлена зависимость между уровнями цитокинов и ряда аминокислот - аргинина, орнитина, глутамина, фенилаланина, пролина, аланинa - а также выраженностью катаболизма, расстройствами кислородного транспорта, функциональными нарушениями в жизненно важных органах.
Эйкосаноиды - продукты распада арахидоновой кислоты. К ним относят тромбоксаны, лейкотриены, эпоксиды. Совокупные эффекты характеризуются раз-витием бронхоконстрикции, повышенной проницаемостью мембран, микротромбозом, адгезией, агрегацией, дегрануляцией лейкоцитов.
Оксид азота (NO) - эндотелий-расслабляющий фактор, вазодилататор, воздействующий через систему гуанилатциклазы и вызывающий вазоплегию, часто сопровождающую клинику рефрактерного шока.
Интерфероны - низкомолекулярные белки, активирующие эндотелий, способствуют выбросу других цитокинов, образованию факторов роста.
Фактор, активирующий тромбоциты - усиливает агрегацию тромбоцитов и нейтрофилов. Он способствует освобождению оксидантов, образованию продуктов цикло- и липооксигеназы в метаболизме арахидоновой кислоты. Непосредственное воздействие приводит к вазоконстрикции и дилатации, повышению проницаемости легочных и системных сосудов.
Фибронектин - белок, существующий в двух основных формах. Тканевая - обеспечивает непроницаемость волокон и соединений клеток. Циркулирующая - вызывает адгезию частиц, подлежащих уничтожению, к макрофагам и эндотелию.
Кислородные радикалы - повреждают эндотелиальную мембрану, клетки легочного интерстиция, участвуют в образовании хемотаксического липида, притягивающего лейкоциты.
Основными факторами, усугубляющими "медиаторно-цитокиновую бурю", являются гипоксия и дизоксия, глубокие нарушения микроциркуляции, аномально высокие концентрации промежуточных и конечных продуктов обмена веществ, циркулирующих имунных комплексов, биогенных аминов, продуктов перекисного окисления.
К сожалению, очень мало в современной литературе освещаются особенности морфологии различных тканей организма при развитии ПОН. Большой интерес представляют единичные исследования, показывающие универсальный характер патоморфологических изме-нений у больных, умерших от прогрессирования ПОН. Основными признаками явились дегенерация, дест-рукция, отек, геморрагии и микротромбозы в тканях основных органов у пациентов с клиникой сердечной, дыхательной, почечной, печеночной недостаточности.
Суммарные эффекты, оказываемые медиаторами повреждения, формируют генерализованную системную воспалительную реакцию или синдром системного воспалительного ответа - SIRS (ССВО). Клиническими критериями развития ССВО являются следующие:
- температура тела больше 38оС или менее 36оС;
- частота сердечных сокращений более 90 в минуту;
- частота дыханий более 20 в минуту или артериальная гипокапния менее 32 мм рт. ст;
- лейкоцитоз более 12 000 в мм или лейкопения менее 4 000 мм, или наличие более 10% незрелых
форм нейтрофилов;
Выделяют три стадии развития ССВО:
Стадия 1. Локальная продукция цитокинов в ответ на травму или инфекцию. Цитокины способны выполнять ряд защитных функций, участвуя в процессах заживления ран и защиты клеток организма от патогенных микроорганизмов.
Стадия 2. Выброс малого количества цитокинов в системный кровоток. Даже малые количества медиаторов способны активизировать макрофаги, тромбоциты, продукцию гормона роста. Развивающаяся острофазовая реакция контролируется провоспалительными медиаторами и их эндогенными антагонистами, такими как антагонисты интерлейкина-1, 10, 13; фактор некроза опухоли. За счет баланса между цитокинами, антагонистами медиаторных рецепторов и антителами в нормальных условиях создаются предпосылки для заживления ран, уничтожения патогенных микроорганизмов, поддержания гомеостаза.
Стадия 3. Генерализация воспалительной реакции. В том случае, если регулирующие системы не способны поддерживать гомеостаз, начинают доминировать деструктивные эффекты цитокинов и других медиаторов, что приводит к нарушению проницаемости и функции эндотелия капилляров, формированию отдаленных очагов системного воспаления, развитию моно- и полиорганной дисфункции.
ССВО представляет собой симптомокомплекс характеризующий выраженность воспалительной реакции в системе эндотелиоцитов, а, следовательно, и направленность воспалительного ответа на повреждение.
Ряд исследований подтвердил, что основу патогенеза ПОН составляет именно диссеминированная воспалительная реакция, сопровождающаяся активацией и выбросом большого количества биологически активных соединений.
Синдром ПОН следует рассматривать как наиболее тяжелую степень ССВО-генерализованное воспаление вызывающее повреждение органной функции.
В свете современных представлений о системной воспалительной реакции выделяют два основных пути развития ПОН. Первичная ПОН является прямым результатом воздействия определенного повреждающего фактора любой этиологии. При этом признаки органной дисфункции проявляются рано. Примером такого вида ПОН может явиться полиорганная дисфункция при политравме, тяжелых ожогах.
Вторичная ПОН развивается после латентной фазы и является результатом генерализованного системного ответа организма на повреждающий фактор. Септический вариант ПОН можно рассматривать как классическую вторичную органную недостаточность, проявление крайне тяжелого системного ответа на инфекционную инвазию.
Выявлены так называемые "маркеры выживаемости" пациентов с ПОН. Это уровни артериального лактата, билирубина и креатинина в сыворотке крови, значение коэффициента оксигенации (РаО2/FIО2) - основного критерия степени легочного повреждения. Принципиально важным прогностическим признаком является своевременная оценка количества системных дисфункций. Так, при недостаточности по одной системе летальность составляет 25-40 %, по двум - 55-60 %, по трем - 75-98 %, а при развитии дисфункции четырех и более систем летальность приближается к 100 %.
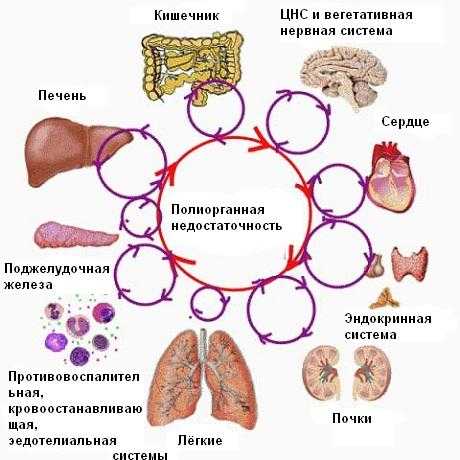
Проведенные в нашей стране и за рубежом ис-следования позволили выявить общую закономерность формирования синдрома ПОН. В большинстве случаев в самом общем виде последовательность вовлечения систем при ПОН выглядит следующим образом: синдром дыхательных расстройств -> энцефалопатия -> синдром почечной дисфункции -> синдром печеночной дисфункции -> стресс-язвы желудочно-кишечного тракта.
Исследования последних лет доказали,что кишечник играет центральную роль в патогенезе развития полиорганной недостаточности при критических состояниях. Кишечник не просто орган, отвечающий за обеспечение организма необходимыми питательными веществами. Для сохранения целостности слизистой самого кишечника необходимо наличие питательных веществ. Кишечник выполняет эндокринную, иммунную, метаболическую и механическую берьерные функции. Многие факторы участвуют в поддержании целостности и регенерации слизистого слоя желудочно-кишечного тракта. Это - желудочно-кишечные пептиды, энтероглюкагон, тироксин, жирные кислоты, гормон роста, Пейеровы бляшки, лимфоциты, макрофаги, иммуноглобулин А в желчном секрете. Стенка кишечника богато выполнена лимфоидной тканью, которая взаимодействует с бактериальной флорой кишечника и факторами питания; в норме бактерии и токсины из просвета кишечника в небольшом количестве проникают через систему портальной вены в печень, где осуществляется их клиренс Купферовскими и ретикулоэндотелиальными клетками.
Слизистая кишечника постоянно обновляется, имеет высокую степень метаболической активности и, таким образом, является более уязвимой для ишемии и атрофии. Если эпителиоциты лишены номинального притока питательных веществ, то имеет место снижение активности репродукции и миграции клеток, а также синтеза ДНК и барьерной функции кишечника.
Впервые Дж. Меакинс и Дж. Маршалл в 1986 году выдвинули гипотезу развития ПОН в результате изменения проницаемости слизистой кишечника, что приводило к транслокации бактерий и токсинов в систему циркуляции. Также этими авторами были введены два очень образных и распространенных выражения: "Кишечник - двигатель ПОН (1986)" и "Кишечник - недренированный абсцесс полиорганной недостаточности" (1993).
Высокое содержание бактерий в просвете кишечника, предрасположенность слизистой к ишемии, гипоксии и атрофии - все это служит основой гипотезы о бактериальной транслокации при критических состояниях.
Было доказано, что гипоксическое повреждение слизистой желудочно-кишечного тракта приводит к перемещению эндотоксинов и бактерий в мезентериальные лимфатические узлы, а затем в кровеносные сосуды. Транслокация эндотоксина может грубо повреждать физиологические процессы, что проявляется развитием септического состояния. В наиболее тяжелой форме это проявляется в виде синдрома ПОН.
В дополнение к бактериям и эндотоксинам, повреждение кишечника может привести к активации нейтрофилов и выбросу мощных медиаторов системного воспаления - цитокинов, эйкосаноидов и др. Это обстоятельство усугубляет расстройства органной перфузии и дисфункцию.
Начиная с 1950 года, с момента создания Д. Бароном первой энтеральной диеты ведутся исследования по возможностям раннего энтерального питания как фактора, снижающего выраженность стрессовой реакции и защищающего слизистую кишечника при критических состояниях. Разработка в 70-80 х годах новой генерации энтеральных смесей, состоящих из ди- и тримерных молекул липидов, углеводов и протеинов, дало толчок к проведению многоцентровых испытаний по оценке эффективности питания этими диетами. Первое рандомизированное исследование, проведенное в 1980 г. У. Александером, выявило снижение летальности у детей с ожоговой травмой. Позже статистически достоверно было доказано снижение частоты инфекционных осложнений, сроков ИВЛ, длительности пребывания в отделении реанимации и стационаре у пациентов с политравмой и у больных после плановых хирургических вмешательств, что значительно снижало затраты на лечение. Раннее энтеральное питание онкологических пациентов позволило добиться более быстрого прироста уровней альбумина и ретинол-связывающего протеина, повышало активность фагоцитоза по сравнению с контрольной группой. Экспериментальные работы показали снижение бактериальной транслокации, уровней глюкагона, цитокинов, лактата, С- реактивного белка у животных, получавших энтеральные среды.
Таблица 1.2 Изменения метаболизма при синдроме системного воспалительного ответа (SIRS) по Ackerman M. e. a. (1994)
Метаболизм протеинов:
Перераспределение протеинов на глюконео-генез, синтез острофазовых белков, цитокинов. Несмотря на повышенный синтез белка - преоб падает распад белковых субстанций (катаболизм) - отрицательный азотистый баланс
Метаболизм углеводов:
Толерантность клеток периферических тканей к инсулину и глюкозе
Скорость продукции глюкозы гепатоцитами возрастает с 2,5 до 4,4-5,1мг/кг/мин
Мобилизация аминокислот из миоцитов скелетной мускулатуры и висцеральных клеток на глюконеогенез
Сочетание толерантности периферических тканей к глюкозе и активного глюконеогенеза
Метаболизм липидов:
Активация липолиза
Сниженная утилизация жирных кислот иь Триглицеридов тканями
Снижение активности липопротеинлипазы
Таблица 1.3 Эффекты фактора некроза опухоли на ткани и клетки ( по Vincent J.L, 1994)
Эндотелий:
стимуляция синтеза IL-6, PAF (фактора активации тромбоцитов )
повышение прокоагулянтной активности
подавление активности протеина С
изменение электрического потенциала
мембраны эндотелиоцита
Мышечная ткань:
снижение трансмембранного потенциала клетки
активация процессов гликогенолиза
активация гексозного транспорта
усиленный выброс лактата и аминокислот из периферических тканей
активный распад протеинов
Печень:
усиление синтеза острофазовых протеинов
снижение синтеза альбумина
стимуляция липогенеза
активация глюкагон - зависимого захвата аминокислот
Мозг:
гиперпродукция простогландинов -> лихорадка
снижение активности глюкозозависимых нейронов
Гипоталамуса -> анорексия
усиление выброса АКТГ
Соединит. Ткань:
стимуляция синтеза IL-6
синтез простогландинов и коллагеназ
резорбция костной ткани и выброс кальция
выброс фактора роста фибробластов
Метаболические реакции на системное повреждение. Синдром гиперметаболизма
Расстройства обмена протеинов характеризуются перераспределением белков в организме. Ускоренный распад протеинов является донатором предшественников для активного печеночного глюконеогенеза и синтеза острофазовых белков. Однако имеющий место синтез белка не позволяет компенсировать возросший катаболизм мышечных и висцеральных протеинов, что приводит к отрицательному азотистому балансу. Притом в течение ближайших суток потери азота достигают 20 г в сутки и проявляется прогрессирующей потерей массы тела. Банальное введение белковых препаратов не позволяет корригировать имеющиеся сдвиги из-за критических нарушений в нормальных физиологических цепочках обмена белков.
Липиды являются наиболее расходуемым при критических состояниях источником энергии. Жировая ткань распадается на жирные кислоты, попадающие в системный кровоток, а затем и в печень. Неадекватная перфузия ткани тормозит липолиз. Выброс цитокинов способствует снижению утилизации жирных кислот и триглицеридов за счет подавления активности липопротеинлипазы.
Развитие синдрома системного воспалительного ответа характеризуется рядом ответных реакций - гормональной, гемодинамической и метаболической.
Впервые клинические проявления метаболического ответа на стресс-фактор (сепсис) были описаны в 1942 году и состояли из двух фаз: EBB приходится на первые 12-24 часа и характеризуется снижением кислородного транспорта, гипотермией и вазоконстрикцией. Фаза FLOW (со 2-х суток до 14-21 дня) характеризуется активацией симпатоадреналовой системы, гипердина-мией, высоким потреблением кислорода, мышечным протеолизом.
Эволюция данных взглядов позволила сформировать представление о комплексных изменениях в метабо-лизме липидов, протеинов, углеводов, возникающих при синдроме системного воспалительного ответа (ССВО – SIRS) (табл. 1.2). Наиболее часто возникающим расстройством является спонтанная гипергликемия. При этом выработка глюкозы в печени увеличивается в ответ на выброс адреналина, норадреналина, глюкагона и кортизола. На фоне гипергликемии, тем не менее, наблюдается глюконеогенез, рефрактерный к введению экзогенной глюкозы. Аминокислоты мобилизуются из скелетной мускулатуры и транспортируются в печень для синтеза глюкозы и медиаторов системного повреждения.
Важнейшую роль в развитии системных расстройств метаболизма играют медиаторные системы и, в первую очередь, цитокины. Наиболее выражены метаболические эффекты у интерлейкина-6 и фактора некроза опухоли, получившего ранее название "кахектина", то есть вызывающего истощение (кахексию) у больных. (таб.1.3). Воздействие TNF на органы и ткани во многом подобно изложенным в таблице 2 особенностям обмена веществ при системном воспалительном ответе.
Полиорганная недостаточность — Википедия
У этого термина существуют и другие значения, см. Спон.Полиорганная недостаточность (Синдром полиорганной недостаточности, СПОН, ПОН) — тяжёлая неспецифическая стресс-реакция организма, совокупность недостаточности нескольких функциональных систем, развивающаяся как терминальная стадия большинства острых заболеваний и травм. Главной особенностью полиорганной недостаточности является неудержимость развития повреждения органа или системы до такой степени, что он не способен поддерживать жизнеобеспечение организма. На долю синдрома приходится до 80 % общей летальности палат реанимации и интенсивной терапии хирургических стационаров.
Следует отличать синдром полиорганной недостаточности от терминальной поливисцеропатии, когда в результате хронического патологического процесса или старости последовательно и необратимо утрачивают функции все структурно-функциональные системы организма.
Термин «полиорганная недостаточность» впервые появился в работе N. Тylney и сотр. «Последовательная системная недостаточность после разрыва аневризмы брюшной аорты. Нерешённая проблема послеоперационного лечения» (1973). В дальнейшем другими учёными — А.Baue (1975), B.Eisman (1977) и D.Fry (1980-1982), были окончательно выделены особенности этого состояния и его дефиниции.
Полиорганная недостаточность развивается как исход тяжёлой сочетанной травмы, эклампсии, сепсиса, инфекционно-токсического и геморрагического шока, комы, вызванной диабетом, менингоэнцефалитом, отравлениями.
В основе развития синдрома лежит острое снижение обмена веществ и энергообразования в результате расстройств метаболизма и микроциркуляции в тканях, что приводит к нарушению функций и структуры органов. Этиологические факторы (тяжёлая травма, токсические агенты и др.), повреждая клеточные и сосудистые мембраны, приводят полиморфноядерные нуклеары (гранулоциты) и эндотелиоциты в состояние «кислородного взрыва», что провоцирует выброс огромного количества медиаторов полиорганной недостаточности, обладающих разнонаправленными эффектами. Всего известно более двухсот медиаторов, в том числе:
Развивается комплекс патологических изменений как в очаге поражения, так и на уровне формирования механизмов адаптации (гипофиз, гипоталамус, кора надпочечников).
Выделяют 3 фазы патологического процесса:
- Индукционная фаза — синтез ряда гуморальных факторов, запускающих реакцию системного воспалительного ответа
- Каскадная фаза — развитие острого лёгочного повреждения, активация каскадов калликреин-кининовой системы, системы арахидоновой кислоты, свёртывающей системы крови и др.
- Фаза вторичной аутоагрессии, предельно выраженной органной дисфункции и стабильного гиперметаболизма — потеря организмом способности самостоятельно поддерживать гомеостаз.
Клиника синдрома состоит из проявлений недостаточности каждой из затронутых систем организма. Кроме того, медиаторы повреждения формируют синдром системного воспалительного ответа (ССВО) — генерализованную системную воспалительную реакцию. ССВО характеризуется следующими проявлениями:
При развитии недостаточности 3 и более органов и систем прогноз неблагоприятный. Летальность по разным авторам колеблется от 35% до 70%.
Для оценки тяжести полиорганной недостаточности и прогнозирования её исхода были предложены различные системы объективной оценки тяжести больных. Одной из первых шкал, разработанных с данной целью, является шкала MOF (Multiple Organ Failure), которая оценивает недостаточность 7 систем организма – дыхательной, сердечно-сосудистой, мочевыделительной, печени, гематологической, желудочно-кишечного тракта и центральной нервной системы[1]. Возрастание количества баллов коррелирует с увеличением летальности.
Шкала MOF (Multiple Organ Failure Score)
| Система | Баллы | ||
| 0 | 1 | 2 | |
| Дыхательная | Нет ИВЛ | ИВЛ с положительным давлением в конце выдоха ≤ 10 см вод. ст. и FiO2 ≤ 0,4 | ИВЛ с положительным давлением в конце выдоха > 10 вод. ст. и/или FiO2 > 0,4 |
| Сердечно-сосудистая | Нормальное АД, нет потребности в вазоактивных препаратах | Периоды с гипотензией, требующие манипуляций, таких как введение объёмов жидкостей для поддержания АД свыше 100 мм рт. ст., инфузии дофамина гидрохлорида ≤ 10 мкг/кг/мин или нитроглицерина ≤ 20 мкг/мин | Периоды с гипотензией ниже 100 мм рт. ст., инфузии дофамина гидрохлорида > 10 мкг/кг/мин или нитроглицерина > 20 мкг/мин |
| Мочевыдели- тельная | Креатинин сыворотки < 2 мг% | Креатинин сыворотки >= 2 мг% | Необходимость в гемодиализе или перитонеальном диализе |
| Печень | АсАТ < 25 МЕ/л и общий билирубин < 2 мг% | АсАТ >= 25 МЕ/л и < 50 МЕ/л и/или общий билирубин>= 2 мг% и < 6 мг% | АсАТ >= 50 МЕ/л и/или общий билирубин >= 6 мг% |
| Гематологическая | Нормальное содержание лейкоцитов и тромбоцитов | Тромбоциты ≤ 50000 в мкл и/или лейкоциты >= 30000 и < 60000 в мкл | Геморрагический диатез и/или лейкоциты < 2500 в мкл или >= 60000 в мкл |
| ЖКТ | Нормальное функционирование | Акалькулезный холецистит или стрессовая язва | Кровотечение из стрессовой язвы, требующее трансфузии более 2 единиц крови за 24 ч, некротизирующий энтероколит, панкреатит и/или спонтанная перфорация желчного пузыря |
| ЦНС | Нормальное функционирование | Слегка сниженная ответная реакция | Сильно нарушенная реакция и/или диффузная нейропатия |
1. Первое по значимости и времени направление — устранение действия пускового фактора или заболевания, запустившего и поддерживающего агрессивное воздействие на организм больного (гнойная деструкция, тяжёлая гиповолемия, лёгочная гипоксия, высокоинвазивная инфекция и т. д.). При неустранённом этиологическом факторе любое, самое интенсивное лечение ПОН, безрезультатно.
2. Второе направление — коррекция нарушений кислородного потока, включающая восстановление кислородтранспортной функции крови, терапию гиповолемии и гемоконцентрации, купирование расстройств гемореологии.
3. Третье направление — замещение, хотя бы временное, функции повреждённого органа или системы с помощью медикаментозных и экстракоропоральных методов.
- ↑ Goris R.J.A., te Boekhorst T.P.A., Nuytinick J.K., Gimbere J.S. Multiple-organ failure // Arch. Surg. – 1985. – Vol. 120. – P. 1109-1115.
Полиорганная недостаточность - причины, симптомы, диагностика и лечение
Полиорганная недостаточность – одновременное или последовательное поражение нескольких систем с первоначальным преобладанием симптомов отказа одной из них. Определяющими признаками являются цианоз, одышка, отеки, анурия, гипотония, шоковое состояние. Диагноз устанавливается на основании клинической картины, данных лабораторного и аппаратного обследования. Специфическое лечение: поддержка дыхания и сердечной деятельности, стабилизация гемодинамики, устранение патогенетического фактора (борьба с инфекцией, коррекция метаболических нарушений, восстановление ОЦК, нормализация гемостаза), искусственная и естественная детоксикация.
Общие сведения
Полиорганная недостаточность (ПОН) – патология, возникающая преимущественно у пациентов реанимационных отделений. Как самостоятельная нозологическая единица впервые была описана в 1973 году, до этого считалась сочетанием двух и более не связанных между собой нарушений. Частота встречаемости составляет около 5-10% от общего количества больных. Смертность в этой группе приближается 60%. Чаще погибают пациенты, имеющие сбои в работе трех органов. Состояние развивается на 3-5 сутки после успешного восстановления сердечной деятельности, при тяжелых сочетанных травмах, отравлениях, эндотоксикозах. В основе развития лежит синдром системного воспалительного ответа.
Полиорганная недостаточность
Причины полиорганной недостаточности
ПОН возникает в результате патологических изменений, происходящих в организме после остановки и последующего восстановления работы сердца. Кроме того, она может формироваться на фоне тяжелой политравмы, инфекционно-токсического шока, сепсиса, перитонита. Чаще развивается, если один из органов, вовлеченных в процесс, ранее был поражен хронической патологией или изменен в результате воздействия первичного фактора (контузия легкого при ДТП, снижение сократительной способности миокарда при остром коронарном синдроме). В число этиофакторов включают:
- Воздействие медиаторов воспаления. В ответ на повреждение клетки сосудистого эндотелия начинают синтезировать биологически активные вещества: интерлейкины, цитокины, оксид азота, интерфероны, туморальный некротизирующий фактор. Под действием этих компонентов происходит изменение проницаемости сосудистой стенки, тонуса кровеносной системы, работы макрофагального иммунитета. В условиях физиологических нарушений медиаторы воспаления оказывают чрезмерное воздействие, приводят к развитию отеков, выраженной дилатации или констрикции сосудов, появлению воспалительной реакции.
- Микроциркуляторные сбои. При обширных травмах происходит секвестрация крови с формированием гиповолемии. Это становится причиной уменьшения сердечного выброса, образования микротромбов, ухудшения перфузии в тканях и органах, относительной ишемии. В развитии ПОН определенную роль также играет реперфузионный механизм, при котором возникают изменения, связанные с восстановлением адекватного кровотока (кислородный, кальциевый, ионный парадокс).
- Инфекционно-септическое воздействие. Наблюдется как при объемных бактериальных процессах, так и при любых других тяжелых заболеваниях. В первом случае сепсис становится результатом попадания флоры в кровь из очага воспаления. Во втором – микроорганизмы проникают в системный кровоток из кишечника, проницаемость стенки которого увеличивается при истощении. Происходит стимуляция выработки цитокинов и развитие системной воспалительной реакции.
- Феномен «двойного удара». Обусловлен терапевтическим воздействием на пострадавшего, приводящим к усугублению ПОН. Активная инфузия плазмозамещающих растворов является причиной реперфузионного синдрома, массивное антибактериальное воздействие, направленное на борьбу с сепсисом, усиливает токсическую нагрузку на системы экскреции. Все это негативно влияет на тяжесть состояния больного.
Патогенез
Полиорганная деструкция имеет несколько механизмов развития, основным из которых является ишемическое повреждение органов. Часть клеток отмирает, остальные переходят в анаэробный режим гликолиза. Основные повреждения возникают при восстановлении кровотока. В этот период образуется большое количество свободных радикалов, вызывающих перикисное окисление тканей. Вторым патогенетическим механизмом является интенсивное тромбообразование на начальной стадии ДВС-синдрома. Образующиеся микроэмболы нарушают проходимость капиллярной сети, что усиливает ишемию.
Отеки в результате повышенной проницаемости сосудов приводят к накоплению жидкости в брюшной полости, усилению внутриабдоминальной компрессии. Происходит механическое сжатие органов живота, подъем диафрагмы с ограничением подвижности легких. Отмечается рост внутригрудного давления, уменьшение рабочего пространства сердца. Нарушается отток крови от мозга. В процесс вовлекается центральная нервная система, развивается церебральный отек с появлением неврологической симптоматики.
Классификация
Деление ПОН на группы производится по результатам оценки деятельности органов и систем, общего состояния пациента. Для этого может быть использована шкала Apache II или Д. Маршалла, созданная в 1995 году специально для работы с больными, страдающими полиорганной недостаточностью. На практике более актуальным является метод А. Л. Левита, представленный в 2000 году. Согласно ему, каждая из систем может находиться в компенсированном, субкомпенсированном или декомпенсированном состоянии. Полиорганная недостаточность определяется как тяжелая при декомпенсации двух систем, как крайне тяжелая – при значительных изменениях в трех органах. Оценка проводится отдельно по каждому органу.
- Компенсация. Организм функционирует с незначительными отклонениями от нормы, полного отказа какой-либо системы не наступает. Изменения быстро прогрессируют. По сути, компенсаторная стадия относится не к ПОН как таковой, а к ее предвестникам. Коррекция состояния на этом этапе позволяет предотвратить тяжелое ишемическое повреждение тканей. Продолжительность этапа зависит от начального состояния пациента и может составлять от нескольких часов до 3-5 дней.
- Субкомпенсация. Умеренные изменения, требующие медикаментозной коррекции. Больные, находящиеся в этой стадии, нередко нуждаются во введении сравнительно малых доз инотропных средств, вспомогательной респираторной поддержке, однократном приеме мочегонных препаратов. При отсутствии помощи продолжительность субкомпенсаторного периода достигает 1 суток.
- Декомпенсация. Тяжелые изменения в структуре органов, полное или частичное нарушение их функции. Присутствуют признаки поражения нескольких систем. Больной находится в крайне тяжелом состоянии. Требуется интенсивная терапия с использованием высокотехнологичных методик поддержания жизнедеятельности. Показана ИВЛ, инфузия прессорных аминов, детоксикация с применением устройств типа «искусственная почка».
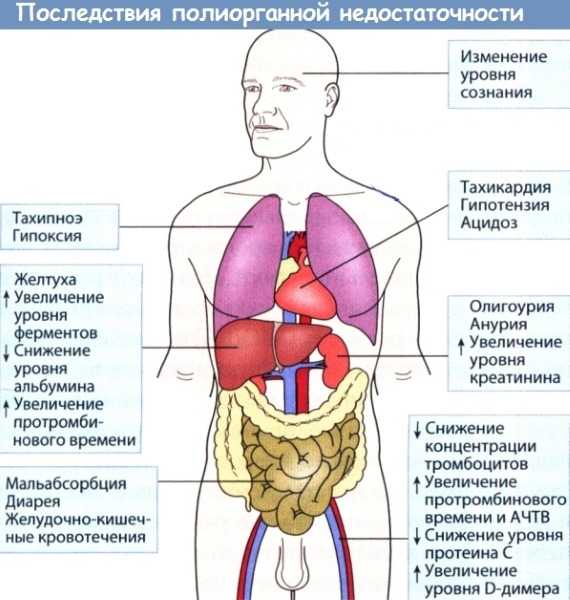
Симптомы полиорганной недостаточности
Клиническая картина зависит от наличия поражения тех или иных структур. Обычно на первый план выходят признаки изменений со стороны дыхательной системы. Отмечается одышка, диффузный цианоз, включение вспомогательной мускулатуры в процесс вдоха, потливость, психомоторное возбуждение. Пациенты, способные самостоятельно передвигаться, занимают вынужденное положение сидя с упором руками в кровать. Позднее активность сменяется заторможенностью, угнетением сознания.
Полиорганная недостаточность с поражением сердца проявляется загрудинными болями, нестабильностью гемодинамики, накоплением жидкости в мягких тканях за счет усиления пролиферации плазмы сквозь сосудистую стенку. Может возникать отек легких, сопровождающийся появлением розоватой пены изо рта. Выявляется компенсаторная тахикардия до 180 уд./мин, позднее сменяющаяся брадикардией с урежением ЧСС до 40 и ниже. На терминальной стадии происходит снижение чувствительности к инотропным средствам и альфа-адреномиметикам.
При почечно-печеночной разновидности болезни объем диуреза заметно снижается. Затем возникает анурия, требующая проведения гемодиализа. Обнаруживается гипогликемия, влекущая за собой нарушения сознания. У пациента развивается асцит, диспепсия, белковые отеки. Кожа и слизистые оболочки желтеют, возможна геморрагическая сыпь. Через несколько часов или дней обнаруживаются признаки печеночной энцефалопатии: больной не отдает себе отчет в своих действиях, не понимает, где находится, что с ним происходит.
Поражения ЖКТ характеризуются признаками обструкции, обусловленной механическим сдавлением кишечника. Определяется боль, вздутие, асимметрия передней брюшной стенки, задержка стула и газов, рвота. Отсутствует толерантность к кормлению. Возможно развитие стрессовой язвы и кишечной геморрагии, которая проявляется снижением уровня Hb, бледностью пациента, падением АД, возникновением или усилением ДВС синдрома при массивной кровопотере.
Осложнения
При успешном купировании полиорганное поражение может завершаться развитием отсроченных заболеваний. У 5% пациентов, повторно обратившихся за помощью в ЛПУ, диагностируют хроническую почечную недостаточность, примерно 2% больных испытывают симптомы ишемической болезни сердца или имеют признаки ХСН. Легочные изменения отмечаются в 3% случаев. В остром периоде осложнением является фибрилляция желудочков на фоне токсического поражения миокарда и тахикардии с ЧСС выше 160-180/мин. Возможно повреждение проводящей системы сердца с формированием СА или АВ блокады. Ишемия мозга нередко приводит к снижению умственных способностей, энцефалопатии, парезам, параличам.
Диагностика
Диагностика осуществляется по результатам клинического, лабораторного и инструментального обследования. Курировать пациентов должен анестезиолог-реаниматолог, однако провести первичный осмотр и установить предварительный диагноз для направления больного в профильное отделение может врач любой специальности, в том числе сотрудник бригады СМП. Дифференциальную диагностику проводят с сочетанной патологией нескольких систем организма, этиологически не связанной с механизмами развития рассматриваемого заболевания. Полная программа обследования включает:
- Физикальный осмотр. В ходе консультации специалист выявляет характерные внешние признаки поражения того или иного органа, определяет наличие субъективных жалоб. В большинстве случаев обнаруживаются симптомы нарушений гемодинамики, сердечной деятельности и дыхания, метаболических изменений.
- Лабораторная диагностика. В анализах отмечается снижение уровня гемоглобина до 60-80 г/л, падение глюкозы до 2,5 ммоль/л, рост АСТ, АЛТ более чем в два раза от нормальных показателей, повышение содержания билирубина ≥ 30 ммоль/литр. PaO2 находится в пределах 64-50, PaCO2 – 56-90 мм рт. ст., pH изменяется в кислую сторону (≤ 7.3).
- Аппаратное обследование. Основной метод – постоянное мониторирование жизненных функций. Показатели часто находятся в следующих границах: САД ≤ 50 мм рт. ст. (при отсутствии медикаментозной поддержки), ЧСС ≥ 180 или ≤ 40 в минуту. Центральное венозное давление ≥ 14 мм или отрицательное. ЧДД ≥ 5 или ≤ 50 (без ИВЛ и оксигенотерапии). При проведении рентгенографии легких визуализируются затемнения, при выполнении УЗИ брюшной полости выявляется уровень свободной жидкости.
Лечение полиорганной недостаточности
Терапия направлена на восстановление ОЦК, нормализацию реологических свойств крови, поддержку витальных функций, предотвращение последствий отсроченного характера. Полиорганная недостаточность должна быть купирована на стадии компенсации, это увеличивает вероятность полного восстановления. Применяются следующие лечебные воздействия на больного:
- Общережимные мероприятия: соблюдение строжайшего постельного режима, круглосуточное наблюдение с использованием анестезиологического кардиомонитора. Контролю подлежат показатели АД, ЧСС, ЧДД, сатурации, сердечного ритма. Каждые 4 часа производится забор крови на КЩС, ежедневно – на биохимию и общий анализ. Для предупреждения трофического повреждения кожи осуществляется полноценный гигиенический уход, питание назначается в соответствии с имеющимися нарушениями (щадящее, жидкое, парентеральное).
- Консервативное лечение. Показаны обильные инфузии кристаллоидных и коллоидных растворов. При гипотонии вводится допамин. При дефиците факторов свертывания и наличии ДВС-синдрома необходима трансфузия свежезамороженной плазмы. Усиленное тромбообразование требует приема ацетилсалициловой кислоты, курантила, гепарина. При выраженной симптоматике производится антимедиаторная терапия ибупрофеном, ингибиторами фактора активации тромбоцитов. Рекомендовано внутривенное введение стероидных гормонов, антибиотиков.
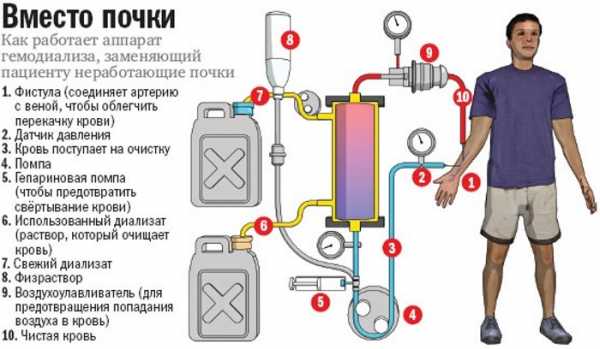
- Хирургическое лечение. К числу инвазивных процедур относят экстракорпоральную детоксикацию (гемо- и перитонеальный диализ). Открытое вмешательство может потребоваться при полном отказе или некрозе внутренних органов (печень, почки), а также при кишечной непроходимости. Для удаления асцитической жидкости выполняют лапароцентез.
Прогноз и профилактика
Полиорганная недостаточность имеет благоприятный исход при раннем начале лечения. По мере прогрессирования процесса в организме накапливаются необратимые изменения, повышающие риск возникновения осложнений. Декомпенсированная форма болезни имеет неблагоприятный прогноз, в 60% случаев приводит к гибели пациента. Профилактика заключается в предотвращении ПОН. Следует купировать очаги инфекции, при объемных травмах начинать массивную инфузию еще на догоспитальном этапе, своевременно устранять имеющиеся нарушения гемодинамики и сердечного ритма. Важным моментом является контроль диуреза пациента, находящегося на лечении в ОРИТ. Разница между употребленной и выделенной жидкостью не должна составлять более 100-200 мл в сутки.
Полиорганная недостаточность – что это такое, причины у взрослого человека, новорожденных, пожилых
При одновременной дисфункции сразу нескольких органов, физиологических систем, наблюдается полиорганная недостаточность. Как она проявляется, причины, что это такое, а также какие выделяют методы лечения, нужно изучить, прежде чем выбрать способ терапии.
Содержание записи:
Что это такое
Полиорганная недостаточность — это болезнь, представляет собой сложное патологическое состояние человека, особенность течения обусловлена дисфункцией 1 или 2 органов человека (чаще ребенка, подростка). В 80% случаях болезнь приводит к высокой смертности, особенно если пренебрегать своевременным лечением и диагностикой.
Полиорганная недостаточность характеризуется в качестве базы появления критического показателя физиологических процессов организма. Степень поражения напрямую зависит от возможностей человеческого тела противостоять патогенным факторам, микроорганизмам.
Код заболевания по МКБ-10
Всего 10 лет назад была разработана и принята по всему миру общая классификация для кодировки и распознавания медицинских диагнозов. Медицинская кодировка пока насчитывает 21 класс, в каждом из которых рубрики с болезнями и патологическими состояниями. По международной медицинской классификации вирусов и болезней, полиорганная недостаточность имеет статус – «R65.3».
Клиническая картина
Клинические проявления полиорганной недостаточности затрагивают практически каждую систему организма. При первых признаках развития полиорганной недостаточности активаторы повреждения функциональных систем затрагивают генерализованную общесистемную ответную реакцию.
В таком случае проявляются следующие клинические характеристики:
- Жар, температура от 37-38 градусов.
- Учащается пульс до 90-95 ударов в мин.
- Учащается частота вдохов более 20 раз в мин.
- Артериальная гипокапния – менее 32 мм рт. ст.
- Лейкопения – меньше 4000 мм.
- Лейкоцитоз – 12000 мм.
Полиорганная недостаточность (что это такое и как проявляется – знания, спасающие жизнь человека) начинается резко, температура повышается внезапно. В зависимости от крепости организма может наблюдаться озноб, рвота, сильные головные боли. На выраженность симптоматики влияет тот факт, какие конкретно системы затронуты болезнью.
После медицинских лабораторных анализов на наличие полиорганной недостаточности указывают следующие характеристики:
- Дисфункция гемостаза, при этом деградация фибриногена более 1\40, протромбиновый индекс менее 70%, тромбоциты – менее 150 г\л.
- Острый респираторный синдром, при котором наблюдаются билатеральные легочные инфильтраты.
- Почечная дисфункция, при которой наблюдается креатин крови более 0,176 ммоль\л, натрий в моче снижается до 40 ммоль.
- Печеночная недостаточность, при которой АСТ и АЛТ повышаются в 2 раза больше нормы.
- Нарушения работы ЦНС, диагностируются по шкале Глазго – менее 15 баллов.

Комплексная диагностика дает возможность выявить изменения состояния пациента, а также его самостоятельную способность противостоять нарушениям в организме.
Влияние инфекции
Полиорганная недостаточность: что это такое, каковы причины — возникает на фоне первичных инфекционных поражений. Первичные очаги воспаления – область органов дыхания (бронхи, легкие) и перитонит. Если при развитии полиорганной недостаточности добавляется септическая инфекция, развивающаяся в первые 2-3 суток, могут начаться серьезные осложнения со здоровьем.
Если добавляется инфекция, шансы на выздоровления и жизнь существенно снижаются, хотя при своевременном диагностировании и правильном лечении больной может выжить.
Причины возникновения заболевания у новорожденных
Полиорганная недостаточность: что это такое, какие факторы способствуют развитию важно понимать перед началом терапии. Чаще всего протекает совместно с патологическими изменениями функций органов и физиологических систем. Это может наблюдаться после травм, остро перенесенных заболеваний, шокового состояния и т.д.
К перечню причин, которые могут вызвать подобное состояния, относятся:
- Язвы и колиты.
- Серьезные травмы опасные для жизни.
- Сильные раны кожных покровов.
- Тяжелое течение инфекционных процессов.
- Большой объем потери крови.
- Сильные пищевые или алкогольные отравления.
- Шоковое состояние.
- Диабетические осложнения.
- Асистология.
- Эклампсия.

- Сепсис.
- Коматозное состояние.
- ВИЧ инфекция, СПИД.
- Период после химиотерапии.
- Несоответствие крови (фактор, группа) после переливания.
Также к факторам развития подобных проблем относятся сильнейшие стрессы, тяжелые состояния человека.
Полиорганная недостаточность занесена в ряд системных заболеваний. Различают ряд этиологических факторов, которые могут стать катализаторами.
Они такие:
- Алкогольные запои (многолетние).
- Употребление табака.
- Долгий период приема стероидов.
- Использование в терапии цитостатических лекарств.
- Неправильный рацион питания.
Нередко синдром сложной патологии возникает при условии резкого снижения защитных сил организма, после перенесенных тяжелых инфекционных заболеваниях.
Развитие болезни у пожилых
Среди пожилых людей количество больных полиорганной недостаточность в несколько раз выше. Зачастую подобное состояние протекает совместно с сопутствующими нарушениями и болезнями. Это серьезно угрожает жизни человека, требует длительного поддерживания сил и функций жизнедеятельности.
Причины развития полиорганной недостаточности у пожилых людей:
- Травмы.
- Шоковое состояние.
- Кома.
- Септические инфекции.
Полиорганная недостаточность (что это такое, как лечить в пожилом возрасте определяет врач) характеризуется длительной госпитализацией и высоким уровнем смертности.
Симптомы болезни
Факторы, которые свидетельствуют о развитии полиорганной недостаточности, могут меняться исходя из этапов развития болезни, типа и совокупности систем. Помимо этого на симптоматику оказывают влияние сопутствующие болезни, инфекции и другие факторы.
Первичные признаки развития синдрома полиорганной недостаточности:
Большинство симптомов синдрома полиорганной недостаточности схожи с другими болезнями, поэтому их несложно пропустить. Для точной картины и своевременного лечения требуется провести дополнительную диагностику в лабораторных условиях.
Например:
- Патологические нарушения органов дыхания сопровождаются затрудненным дыханием, одышкой.
- Дисфункция работы почек приводит к изменениям характеристик в анализе мочи.
- Если полиорганная недостаточность затронула печень, в анализе крови будут ярков видны изменения уровня билирубина, а также развивается желтуха.
- Когда полиорганная недостаточность затрагивает систему гемостаза, будут наблюдаться тромбоцитопения и подобные отклонения от нормы.
- Если затронуто сердце на фоне данного заболевания, наблюдается развитие гипотонии, появляется желудочковая аритмия, острая сердечная недостаточность.
- Нарушения работы ЖКТ характеризуются появлением нескольких очагов воспаления и перфорации на слизистой пищеварительного тракта.
- Поражения органов центральной нервной системы характеризуют наличие острых психозов, перевозбуждение.
Полиорганная недостаточность — это такое заболевание, которое протекает совместно с развитием дисфункции гемостаза, что обусловлено дефицитом свертываемости крови, гиперстимуляцией.
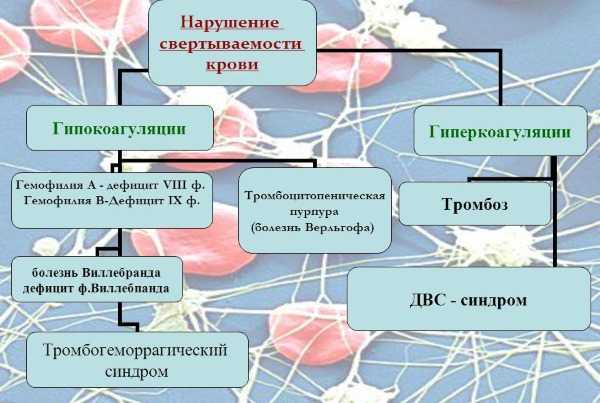
ДВС-синдром стимулирует тромботические нарушения, геморрагическую дисфункцию, торможение микроциркуляции крови. В основном при ДВС синдроме развивается нарушение работоспособности некоторых органов: подкожные гематомы, петехиально-гематомные сыпь по телу. В случае осложнений может наблюдаться шок, гипотония, сильные кровотечения.
Одним из частых проявлений данного системного заболевания является острая сердечная недостаточность. Это обусловлено тем, что у мышцы сердечной сумки резко понижается эластичность, сократительные свойства. В результате замедляется процесс кровообращения, появляются застои крови.
Без своевременного лечения данный синдром может привести к отечности органов дыхания, астматическим припадкам. Это крайне тяжелые состояния, опасные для жизни пациента.
Фазы развития
Полиорганная недостаточность (что это такое и меры профилактики важно знать до развития болезни) делится на не несколько основных этапов течения.
Они такие:
- Индукционный – проявляется в качестве синтеза биологически активных веществ в организме, за счет стимуляции медиаторов, которые обуславливают запуск ответного воспалительного процесса.
- Каскадный – протекает в форме неконтролируемого синдрома острого поражения легких, а также активация кинин-калликреиновой системы, арахидоновой кислоты. Помимо этого существенно снижается уровень фибринолиза и сопутствующих систем гемостаза.
- Вторичная аутогрессия и полная потеря гомеостаза организма. Достаточно сложное течение фазы, характеризующееся длительным лечением, высоким уровнем смертности.

Классификация по форме патогенетического механизма
Исходя из механизма патогенеза, течение синдрома полиорганной недостаточности может отличаться:
- Для 1-й однофазной формы течение синдрома характерно развитие острых патологий. Так, на протяжении 1-2 дней наблюдается нарушение метаболизма активных веществ, после добавляется почечная и печеночная недостаточность. Дисфункция органов ЦНС, нарушение работы сердечно-сосудистой системы, гемостаза. В таком случае патологические процессы предшествуют смерти или серьезным повреждениям.
- Второй этап данного синдрома на фоне механизма патогенеза обуславливает развитие двухфазного течения патологических процессов. После первого этапа больной может почувствовать резкое улучшение состояния, временную стабилизацию самочувствия. Это наблюдается до момента добавления к симптомам сепсиса и инфекции. В последствие септическая инфекция развивается несколько суток, если вовремя предпринять меры – больной может выздороветь.
В чем опасность полиорганной недостаточности
В медицине синдром является ответом организма на течение сложных, острых патологий. Несмотря на первичную этиологию, синдром сопровождается отказом функций всех важных систем жизнеобеспечения и функционирования человека. Осложнениями полиорганной недостаточности могут быть явления, которые сопровождают легочную недостаточность, тяжелые болезни почек.
Они следующие:
- Дисфункция системы кровообращения.
- Развитие гипоксии.
- Анемия.
- Слабость, обмороки.
- Дисфункция процесса формирования белков и иммуноглобулинов.
- Неконтролируемые формы гипергликемии.
- Сердечная недостаточность.
- Тромбоцитопения.
- Устранение защитного барьера стенок органов пищеварения.
Несмотря на сложность течения, полиорганная недостаточность является излечимым заболеванием. Предприняв активное и своевременное лечение, совместно с реанимационными мероприятиями можно сохранить здоровье и спасти жизнь.
Прогноз заболевания
Степень и сложность течения синдрома определяется по специально разработанной для этого шкале MOF (Multiple Organ Failure).
В таком случае оценивается 7 систем жизнеобеспечения орагнизма:
- Дыхательная.
- Мочевыделительная.
- Гематологическая.
- Центральная нервная система.
- Пищеварительная (органы ЖКТ).
- Органы печени.
- Сердечено-сосудистая.
Прогноз на будущее, выздоровление строится на основании количества и степени поврежденных органов, систем организма.
Так статистика предоставляет следующие данные:
- 1 система органов – 20% смертности.
- 2 системы органов – 25-30% смертности среди пожилых людей.
- 3 системы – боле 50% смертных случаев.
- 4 и более системы – 70-80% смертности пациентов.
Также возможны такие последствия полиорганной недостаточности, как:
- При вторичных инфекционных поражениях – высокий риск смертности (особенно у детей).
- Полный или частичный отказ функционирования внутренних органов.
- Нивелирование медицинских процедур, например, гемодиализ.
Методика лечения
Прежде чем назначать лечение, необходимо провести лабораторные анализы и исследования, которые покажет степени и область поражения синдрома. Для этого применяют в основном только лабораторные исследования.
Полиорганная недостаточность: диагноз и, непосредственно, что это такое подтверждается формированием сразу нескольких признаков прогрессирования патологии функций систем и органов. Например, повреждение гемостаза и тяжелой дыхательной недостаточности, или, к примеру, почечная и печеночная недостаточность.
Терапия синдрома происходит комплексно, включая сразу несколько основных направлений:
- Профилактика синдрома происходит по средствам своевременной диагностики и определения предела развития патологии. Это главная профилактика данного синдрома, для этого необходимо проводить функциональную оценку работоспособности тела, мониторинг и ликвидацию развития инфекций. В стационаре проводится нормализация системы кровообращения, пока патологи гемостаза не перешла критичную отметку. Также очень важно проводить восстановительные мероприятия дыхательной системы, лечение некроза, сильных травм и повреждений.
- Второй принцип качественного лечения является этапность и точная последовательность действий. Наиболее эффективная схема терапии включает искусственное медикаментозное и терапевтическое поддержание работоспособности пораженной системы. Эффективно действует замещение вышедших из строя органов. Зачастую это относится к органам дыхания и кровообращения, усиление работоспособности физиологических механизмов, лечение пораженных органов, участков. Терапия по устранению у пациента состояния шока.
- Антимедиаторное свойство, которое заключается в терапии, направленной на купирование работоспособности рецепторов эндотелиальных клеток, антагонистов их работы. Для этого в основном используют моноклональные антитела против TNFa IL-1.
- Восстановление нормального уровня энергетического баланса. Для этого используют целую схему мероприятий: изменения процесса метаболизма, создание кислотно-щелочного баланса, нормализация работоспособности ферментной системы. Также назначают питание организма с помощью специального зонда, введение витаминов, аминокислот, а также искусственное обогащение тканей кислородом. В курс терапии входит восстановление нормальной работы системы легких и кровообращения, медикаментозная антигипоксическое и антиоксидантное лечение пациента.
- Терапия устранения токсинов и их пагубного воздействия, а именно стимуляция естественной детоксикации. Для этого используют интра- и экстракорпоральные методы в стационарных условиях.
- Синдромная терапия. Для этого составляющие синдрома полиорганной недостаточности в острой форме, например, гиповолемия, проблемы со свертываемостью, дистресс-синдром, острые болезни печени требуют индивидуального подхода для всех пациентов. Методы терапии разработаны для устранения симптомов, в них входят лекарственное замещение и поддержание тех или иных жизненно важных органов.
- Снижение инвазивного действия. Комплексная методика, которая включает инвазивность инновационных технологий, чтобы снизить критичность проявления симптомов. В противном случае осложнения на фоне данного синдрома могут привести к ятрогенной полиорганной недостаточности. Несмотря на это многие врачи отказываются от инвазивных методов, ведь помимо пользы в их скрывается реальная угроза жизни и здоровью пациента.
На втором этапе выздоровления, могут назначить следующее лечение:
- Искусственную вентиляцию легких (если есть проблемы с дыханием).
- Использование кардиотонических лекарственных средств.
- Очищение крови от токсинов, тяжелых металлов (капельницы).
- Гемодиалез.
- Поддержание сердечного ритма искусственными методами.
Длительность комплексных мер лечения напрямую зависит от степени сложности и количества затронутых органов, длится от 7 до 20 суток. Немаловажное значение имеет возраст пациентов.
Большую роль играют профилактические мероприятия, особенно в ведении тяжелых пациентов, у которых есть высокая вероятность развития данного синдрома.
Профилактические техники являются идеальным выбором лечебного воздействия на пострадавших при сложных критических состояниях. Особенно сложно протекают такие патологии на фоне данного синдрома, как острые формы инфекционного воспаления, кровопотеря.
В комплексе профилактических мероприятий предусмотрено систематическое диагностирование, осмотр, лечение патологических, хронических процессов в организме. Кроме того, важно обеспечить поддержку всех функций организма в целом, обогатить ткани микроэлементами и витаминами, чтобы предотвратить необратимые явления и дальнейшее долгое лечение.
Результативность выбранного способа напрямую зависит от правильной оценки состояния и своевременной диагностики количества затронутых систем и органов.
Когда лечение носит профилактический, предупредительный характер, риск летального исхода существенно снижается и выздоровление больного возможно. Осведомленность о механизмах патофизических процессов позволяет вовремя определить развитие синдрома полиорганной недостаточности, предпринять грамотно построенную лечебную тактику.
Полиорганная недостаточность: как проявляется, что это такое, каковы причины развития – важнейшая информация для тех, кто предрасположен к болезни. Она представляет собой группу системных заболеваний, при которых наблюдаются нарушения функционирования 2-х и более органов.
Такое состояние одинаково встречается, как у взрослых, так и у детей. Особенность развития полиорганной недостаточности в том, что органы и системы организма человека повреждаются настолько, что могут полностью отказать, не способны выполнять функции и задачи, поддерживать жизнедеятельность человека.
Оформление статьи: Лозинский Олег
Видео о полиорганной недостаточности
Все о синдроме полиорганной недостаточности:
Принцип процедуры гемодиализа:
Полиорганная недостаточность - симптомы болезни, профилактика и лечение Полиорганной недостаточности, причины заболевания и его диагностика на EUROLAB
Причиной может быть травма, инфекция, гипоперфузия тканей, воспаление, гиперметаболизм. Эти факторы не обязательно становятся причиной полиорганной недостаточности. Но любой из них может привести к развитию мультифокальных патофизиологических процессов. В клеточных повреждениях важную роль играют медиаторы. Количество их при выбросе зависит от тяжести повреждающего фактора.
В патогенезе полиорганной недостаточности у человека важное место занимаются серьезные метаболические нарушения. В терминальной стадии заболевания выражен катаболизм протеинов мышц. Он возникает из-за углеводов и жиров, если пациент находится в очень тяжелом состоянии, и если формируется невосполнимый энергетический дефицит. Развивается протеинозависимый энергетический обмен, в основе которого лежат активация протеолиза и распад структурных белков жизненно важных органов, мышечной ткани.
Активированные вирусные и микробные токсины, а также мастоциты и макрофаги выделяют вещества, которые, в свою очередь, могут провоцировать тканевые и клеточные повреждения. В патогенез имеет месте свободнорадикальное окисление. Оно повреждает клетки.
В развитии полиорганной недостаточности играет роль нарушение иммунитета, а также септические процессы. Наиболее частыми причинами сепсиса становятся грамотрицательные бактерии, которые попадают из желудочно-кишечного тракта взрослого или ребенка в кровоток и органы. Потому исследователи предполагают, что ЖКТ – своеобразный генератор полиорганной недостаточности.
В патогенезе важная роль отводится:
- медиаторам воспаления
- бактериальным токсинам
- нарушениям гомеостаза
- повреждениям эндотелия
- повреждениям микроциркуляции
В организме происходят явления гипоксии и реперфузии, в результате чего происходит агрегация и адгезия нейтрофилов, а эндотелий активируется. Медиаторы нейтрофилов разрушают клеточную мембрану в органах и тканях, из-за чего тканевая гипоксия становится еще хуже. В начале шока активируется система комплемента, фибринолиза, коагуляции. Тканевая травма активирует комплемент по альтернативному пути, а бактерии – по классическому и альтернативному.
Увеличиваются темпы выработки провоспалительных цитокинов. Нарастают тканевые повреждения, что усугубляет тяжесть полиорганной недостаточности. В начальной стадии тяжелой травмы активируется большое количество клеток, которые синтезируют медиаторы, токсически действующие на ткани. Возникает системная воспалительная реакция. Часто системное воспаление вызывает гипоксию и повреждение функции органов.
В самом начале развития процессов система коагуляции участвует в патогенезе полиорганной недостаточности. Активация системы коагуляции и угнетение фибринолиза вызывают тяжелую органную гипоперфузию.
Проявляющиеся при полиорганной недостаточности симптомы и их прогресс вызваны, в большинстве случаев, сочетанием нарушений в дыхательной и сердечнососудистой системе, а также нарушениями в печени и почках человека. Исследователями выделено 4 стадии заболевания:
- латентная (скрытая)
- явная
- декомпенсированная
- терминальная
Вовремя диагностировать полиорганную недостаточность затруднительно. Специальное исследование или ретроспективный анализ показывают, что еще в начале нарушений и человека была латентная недостаточность нескольких или многих органов. Современные методы диагностики этой болезни несовершенны.
Синдром полиорганной недостаточности проявляется у детей с инфекционными болезнями при тяжелой их форме. При легкой форме болезни поражения органов выявить не удается. Но лабораторные и инструментальные методы позволяют выявить компенсированную или субкомпенсированную полиорганную недостаточность, которая говорит о том, что состояние может усугубиться, функционирование этих органов станет в будущем еще хуже.
Нарастание токсического синдрома приводит к прогрессированию нарушений кровотовка в почках, коже, печени, в крайних случаях развивается ишемия и циркуляторная блокада, которые типичны для терминальной стадии заболевания. Также в крови человека происходит накопление метаболитов, которые оказывают токсическое действие на организм, что проявляется в нарушении выделительной функции почек, печени и желудочно-кишечного тракта.
Нарушение биохимических процессов детоксикации в печени доказывается накоплением аммиака в крови детей и взрослых с токсикозами. В крови собирается свободный фенол, в печени происходит его связывание с глюкуроновой или серной кислотой, он должен выделяться с мочой. О почечной недостаточности говорит скопление пептидов средней массы в крови.
К развитию эндотоксемии приводит реакция централизации системного кровообращения, которая вызывает и циркуляторную гипоксию органов и тканей организма. Что касается легких, возникает респираторный дистресс-синдром. Нарушается дыхание, отекают легкие, в организм не поступает достаточное количество кислорода. У человека учащается пульс и появляется одышка. Врачи могут обнаружить признаки цианоза: бледность или посинение кожи, пятная на коже. Конечности становятся прохладными.
Что касается почек, при полиорганной недостаточности высокий риск появления олигурии. В организме задерживается моча. Если человек взрослый, он может заметить это сам. Если ребенок мало «ходит в туалет по-маленькому», это могут заметить родители или его воспитатели. Этот симптом проявляется не только при полиорганной недостаточности, потому исключительно по нему делать выводы о диагнозе нельзя.
Если работа почек нарушена, в моче находят содержание белка, лейкоцитов и эпителия выше нормы, также могут быть найдены эритроциты. Когда олигурия прогрессирует, развивается анурия.
Что касается печени, при полиорганной недостаточности возникает холестатическая желтуха. Проявления такие:
- повышение билирубина
- понижено число метаболитов билирубина в моче и кале
- кожный зуд
- склеры желтые
- зуд кожи постепенно нарастает
- в крови повышен уровень желчных кислот и холестерина
При полиорганной недостаточности часто возникает ДВС-синдром, при котором фиксируют рассеянное свертывание крови. Блокируется микроциркуляция, что приводит к изменениям дистрофического характера. ДВС-синдром может проявляться геморрагическим синдромом, в основном это появление подкожных гематом и кровоподтеков в подкожно-жировой клетчатке.
Одно из проявлений полиорганной недостаточности у детей и взрослых – нарастающая острая сердечная недостаточность. ОСН считается одним из самых тяжелых нарушений кровообращения. Мышца сердца теряет свое свойство сокращения, потому перекачивание перетекающей по нему крови в разы усложняется, что приводит неминуемо к застою крови. Следствием развивающейся ОСН может стать астма или отек легких, все эти состояния крайне опасны для жизни человека.
При правожелудочковой недостаточности как проявлении полиорганной недостаточности может увеличиться печень; все органы и ткани очень плохо снабжаются кислородом, появляются отеки. Человеку становится всё сложнее дышать.
Одно из проявлений полиорганной недостаточности – язвы желудка и 12-перстной кишки. В верхней части живота появляются боли, которые в большинстве случаев постепенно усиливаются. Язвенную болезнь неминуемо сопровождает изжога. Дети маленького возраста не могут сказать о своих ощущениях, потому у них нельзя заподозрить язву по выше перечисленным симптомам.
Со стороны ЦНС полиорганная недостаточность проявляется заторможенностью, острым психозом, а крайнее состояние – коматозное.
Если Вами ранее были выполнены какие-либо исследования, обязательно возьмите их результаты на консультацию к врачу. Если исследования выполнены не были, мы сделаем все необходимое в нашей клинике или у наших коллег в других клиниках.
У Вас ? Необходимо очень тщательно подходить к состоянию Вашего здоровья в целом. Люди уделяют недостаточно внимания симптомам заболеваний и не осознают, что эти болезни могут быть жизненно опасными. Есть много болезней, которые по началу никак не проявляют себя в нашем организме, но в итоге оказывается, что, к сожалению, их уже лечить слишком поздно. Каждое заболевание имеет свои определенные признаки, характерные внешние проявления – так называемые симптомы болезни. Определение симптомов – первый шаг в диагностике заболеваний в целом. Для этого просто необходимо по несколько раз в год проходить обследование у врача, чтобы не только предотвратить страшную болезнь, но и поддерживать здоровый дух в теле и организме в целом.
Если Вы хотите задать вопрос врачу – воспользуйтесь разделом онлайн консультации, возможно Вы найдете там ответы на свои вопросы и прочитаете советы по уходу за собой. Если Вас интересуют отзывы о клиниках и врачах – попробуйте найти нужную Вам информацию в разделе Вся медицина. Также зарегистрируйтесь на медицинском портале Eurolab, чтобы быть постоянно в курсе последних новостей и обновлений информации на сайте, которые будут автоматически высылаться Вам на почту.
Полиорганная недостаточность — Википедия
У слова СПОН есть и другие значения, см.Спон
Полиорганная недостаточность (Синдром полиорганной недостаточности, СПОН, ПОН) — тяжёлая неспецифическая стресс-реакция организма, совокупность недостаточности нескольких функциональных систем, развивающаяся как терминальная стадия большинства острых заболеваний и травм. Главной особенностью полиорганной недостаточности является неудержимость развития повреждения органа или системы до такой степени, что он не способен поддерживать жизнеобеспечение организма. На долю синдрома приходится до 80 % общей летальности палат реанимации и интенсивной терапии хирургических стационаров.
Следует отличать синдром полиорганной недостаточности от терминальной поливисцеропатии, когда в результате хронического патологического процесса или старости последовательно и необратимо утрачивают функции все структурно-функциональные системы организма.
История
Термин «полиорганная недостаточность» впервые появился в работе N. Тylney и сотр. «Последовательная системная недостаточность после разрыва аневризмы брюшной аорты. Нерешённая проблема послеоперационного лечения» (1973). В дальнейшем другими учёными — А.Baue (1975), B.Eisman (1977) и D.Fry (1980-1982), были окончательно выделены особенности этого состояния и его дефиниции.
Этиопатогенез
Полиорганная недостаточность развивается как исход тяжёлой сочетанной травмы, эклампсии, сепсиса, инфекционно-токсического и геморрагического шока, комы, вызванной диабетом, менингоэнцефалитом, отравлениями.
В основе развития синдрома лежит острое снижение обмена веществ и энергообразования в результате расстройств метаболизма и микроциркуляции в тканях, что приводит к нарушению функций и структуры органов. Этиологические факторы (тяжёлая травма, токсические агенты и др.), повреждая клеточные и сосудистые мембраны, приводят полиморфноядерные нуклеары (гранулоциты) и эндотелиоциты в состояние «кислородного взрыва», что провоцирует выброс огромного количества медиаторов полиорганной недостаточности, обладающих разнонаправленными эффектами. Всего известно более двухсот медиаторов, в том числе:
Развивается комплекс патологических изменений как в очаге поражения, так и на уровне формирования механизмов адаптации (гипофиз, гипоталамус, кора надпочечников).
Выделяют 3 фазы патологического процесса:
- Индукционная фаза — синтез ряда гуморальных факторов, запускающих реакцию системного воспалительного ответа
- Каскадная фаза — развитие острого лёгочного повреждения, активация каскадов калликреин-кининовой системы, системы арахидоновой кислоты, свёртывающей системы крови и др.
- Фаза вторичной аутоагрессии, предельно выраженной органной дисфункции и стабильного гиперметаболизма — потеря организмом способности самостоятельно поддерживать гомеостаз.
Клиника
Клиника синдрома состоит из проявлений недостаточности каждой из затронутых систем организма. Кроме того, медиаторы повреждения формируют синдром системного воспалительного ответа (ССВО) — генерализованную системную воспалительную реакцию. ССВО характеризуется следующими проявлениями:
Прогноз
При развитии недостаточности 3 и более органов и систем прогноз неблагоприятный. Летальность по разным авторам колеблется от 35% до 70%.
Для оценки тяжести полиорганной недостаточности и прогнозирования её исхода были предложены различные системы объективной оценки тяжести больных. Одной из первых шкал, разработанных с данной целью, является шкала MOF (Multiple Organ Faicore), которая оценивает недостаточность 7 систем организма – дыхательной, сердечно-сосудистой, мочевыделительной, печени, гематологической, желудочно-кишечного тракта и центральной нервной системы[1]. Возрастание количества баллов коррелирует с увеличением летальности.
Шкала MOF (Multiple Organ Failure Score)
| Система | Баллы | ||
| 0 | 1 | 2 | |
| Дыхательная | Нет ИВЛ | ИВЛ с положительным давлением в конце выдоха ≤ 10 см вод. ст. и FiO2 ≤ 0,4 | ИВЛ с положительным давлением в конце выдоха > 10 вод. ст. и/или FiO2 > 0,4 |
| Сердечно-сосудистая | Нормальное АД, нет потребности в вазоактивных препаратах | Периоды с гипотензией, требующие манипуляций, таких как введение объёмов жидкостей для поддержания АД свыше 100 мм рт. ст., инфузии дофамина гидрохлорида ≤ 10 мкг/кг/мин или нитроглицерина ≤ 20 мкг/мин | Периоды с гипотензией ниже 100 мм рт. ст., инфузии дофамина гидрохлорида > 10 мкг/кг/мин или нитроглицерина > 20 мкг/мин |
| Мочевыдели- тельная | Креатинин сыворотки < 2 мг% | Креатинин сыворотки >= 2 мг% | Необходимость в гемодиализе или перитонеальном диализе |
| Печень | АсАТ < 25 МЕ/л и общий билирубин < 2 мг% | АсАТ >= 25 МЕ/л и < 50 МЕ/л и/или общий билирубин>= 2 мг% и < 6 мг% | АсАТ >= 50 МЕ/л и/или общий билирубин >= 6 мг% |
| Гематологическая | Нормальное содержание лейкоцитов и тромбоцитов | Тромбоциты ≤ 50000 в мкл и/или лейкоциты >= 30000 и < 60000 в мкл | Геморрагический диатез и/или лейкоциты < 2500 в мкл или >= 60000 в мкл |
| ЖКТ | Нормальное функционирование | Акалькулезный холецистит или стрессовая язва | Кровотечение из стрессовой язвы, требующее трансфузии более 2 единиц крови за 24 ч, некротизирующий энтероколит, панкреатит и/или спонтанная перфорация желчного пузыря |
| ЦНС | Нормальное функционирование | Слегка сниженная ответная реакция | Сильно нарушенная реакция и/или диффузная нейропатия |
Лечение
1. Первое по значимости и времени направление - устранение действия пускового фактора или заболевания, запустившего и поддерживающего агрессивное воздействие на организм больного (гнойная деструкция, тяжелая гиповолемия, легочная гипоксия, высокоинвазивная инфекция и т. д.). При неустранённом этиологическом факторе любое, самое интенсивное лечение ПОН, безрезультатно.
2. Второе направление - коррекция нарушений кислородного потока, включающая восстановление кислородтранспортной функции крови, терапию гиповолемии и гемоконцентрации, купирование расстройств гемореологии.
3. Третье направление - замещение, хотя бы временное, функции повреждённого органа или системы с помощью медикаментозных и экстракоропоральных методов.
Источники
Примечания
- ↑ Goris R.J.A., te Boekhorst T.P.A., Nuytinick J.K., Gimbere J.S. Multiple-organ failure // Arch. Surg. – 1985. – Vol. 120. – P. 1109-1115.
причины, клиника. Принципы диагностики и лечения.
Полиорганная недостаточность — тяжёлая неспецифическая стресс-реакция организма, совокупность недостаточности нескольких функциональных систем, развивающаяся как терминальная стадия большинства острых заболеваний и травм. Главной особенностью полиорганной недостаточности является неудержимость развития повреждения органа или системы до такой глубины, что он не способен поддерживать жизнеобеспечение организма
Полиорганная недостаточность развивается как исход тяжёлой сочетанной травмы, эклампсии, сепсиса, инфекционнотоксического и геморрагического шока, асистолии, комы, вызванной диабетом, менингоэнцефалитом, отравлениями.
Клиника синдрома состоит из проявлений недостаточности каждой из затронутых систем организма. Кроме того, медиаторы повреждения формируют синдром системного воспалительного ответа (ССВО) — генерализованную системную воспалительную реакцию. ССВО характеризуется следующими проявлениями:
Температура тела более 38 или менее 36 градусов
Частота сердечных сокращений более 90 ударов в минуту
Частота дыхательных движений более 20 в минуту или артериальная гипокапния менее 32 мм рт.ст.
Лейкоцитоз более 12000 мм или лейкопения менее 4000 мм, либо более 10% незрелых форм нейтрофилов
Лечение:
1.Первое по значимости и времени направление - устранение действия пускового фактора или заболевания, запустившего и поддерживающего агрессивное воздействие на организм больного (гнойная деструкция, тяжелая гиповолемия, легочная гипоксия, высокоинвазивная инфекция и т.д.). При неустраненном этиологическом факторе любое, самое интенсивное лечение ПОН, безрезультатно.
2.Второе направление - коррекция нарушений кислородного потока, включающая восстановление кислородтранспортной функции крови, терапию гиповолемии и гемоконцентрации, купирование расстройств гемореологии.
3.Третье направление - замещение, хотя бы временное, функции поврежденного органа или системы с Помощью медикаментозных и экстракоропоральных методов.
42.Причины, профилактика и лечение тромбоэмболического синдрома.
Причина тромбоэмболии — оторвавшийся тромб. Он, словно пробка, перекрывает просвет сосудов, в этом месте развивается ишемия — обескровливание. Если очаг ишемии в сосуде головного мозга — развивается ишемический инсульт, тромб, локализовавший в артериях сердца, вызывает ишемию его определенного участка, которая проявляется в виде инфаркта миокарда.
Профилактика тромбоэмболического синдрома
Выявление опасности тромбообразования (анамнез, коагулограмма)
Мероприятия по неспецифической профилактике (бинтование конечностей, лечение сердечно-сосудистых заболеваний, антиагреганты)
Мероприятия по специфической профилактике (гепарин, пелентан, никотиновая кислота, фибринолизин)
Лечение тромбоэмболического синдрома
Покой Гепаринотерапия
Фибринолитическая терапия Антикоагулянты непрямого действия
Антиагреганты Симптоматическое лечение Оперативное лечение по показаниям
43. Причины, профилактика и лечение геморрагического синдрома.
Выделяют наследственные и приобретённые формы геморрагических заболеваний и синдромов. • Наследственные формы связаны с генетически детерминированными патологическими изменениями сосудистой стенки, аномалиями мегакариоцитов, тромбоцитов, адгезионных белков плазмы крови и плазменных факторов свёртывающей системы крови. • Приобретенные формы в большинстве случаев обусловлены поражением кровеносных сосудов иммунной, иммунокомплексной, токсикоинфекционной и дисметаболической этиологии (различные васкулиты), поражением мегакариоцитов и тромбоцитов различной этиологии (тромбоцитопатии), патологией адгезионных белков плазмы крови и факторов свёртывающей системы крови и многофакторными нарушениями свёртывающей системы крови (острые ДВС-синдромы).
Профилактика геморрагического синдрома
Выявление опасности геморрагического синдрома (анамнез, коагулограмма)
Мероприятия по неспецифической профилактике (очистить ЖКТ с помощью зонда и клизмы, назначение десенсибилизирующих средств, ангиопротектеров, техника операции, ведение наркоза)
Мероприятия по специфической профилактике (гемостатические средства, переливание свежезамороженной плазмы, криопреципитата, тромбоцитов, аминокапроновая кислота, фибриноген)
Лечение геморрагического синдрома
Гемостатические средства :нативная и сухая плазма
антагонисты гепарина - протамин сульфат ингибиторы фибринолиза - аминокапроновая кислота, амбен (памба) препараты животного происхождения – фибриноген, криопреципитат, фибринная и тромбиновая пленка препараты растительного происхождения - листья крапивы, трава тысячелистника, кора и плоды калины
тромбообразующие препараты – тромбовар, этоксисклерол, фибровейн Серотонин, витамин К, препараты кальция
Ангиопротекторы
Симптоматическое лечение
Полиорганная недостаточность — Википедия
У слова СПОН есть и другие значения, см.Спон
Полиорганная недостаточность (Синдром полиорганной недостаточности, СПОН, ПОН) — тяжёлая неспецифическая стресс-реакция организма, совокупность недостаточности нескольких функциональных систем, развивающаяся как терминальная стадия большинства острых заболеваний и травм. Главной особенностью полиорганной недостаточности является неудержимость развития повреждения органа или системы до такой степени, что он не способен поддерживать жизнеобеспечение организма. На долю синдрома приходится до 80 % общей летальности палат реанимации и интенсивной терапии хирургических стационаров.
Следует отличать синдром полиорганной недостаточности от терминальной поливисцеропатии, когда в результате хронического патологического процесса или старости последовательно и необратимо утрачивают функции все структурно-функциональные системы организма.
История
Термин «полиорганная недостаточность» впервые появился в работе N. Тylney и сотр. «Последовательная системная недостаточность после разрыва аневризмы брюшной аорты. Нерешённая проблема послеоперационного лечения» (1973). В дальнейшем другими учёными — А.Baue (1975), B.Eisman (1977) и D.Fry (1980-1982), были окончательно выделены особенности этого состояния и его дефиниции.
Этиопатогенез
Полиорганная недостаточность развивается как исход тяжёлой сочетанной травмы, эклампсии, сепсиса, инфекционно-токсического и геморрагического шока, комы, вызванной диабетом, менингоэнцефалитом, отравлениями.
В основе развития синдрома лежит острое снижение обмена веществ и энергообразования в результате расстройств метаболизма и микроциркуляции в тканях, что приводит к нарушению функций и структуры органов. Этиологические факторы (тяжёлая травма, токсические агенты и др.), повреждая клеточные и сосудистые мембраны, приводят полиморфноядерные нуклеары (гранулоциты) и эндотелиоциты в состояние «кислородного взрыва», что провоцирует выброс огромного количества медиаторов полиорганной недостаточности, обладающих разнонаправленными эффектами. Всего известно более двухсот медиаторов, в том числе:
Развивается комплекс патологических изменений как в очаге поражения, так и на уровне формирования механизмов адаптации (гипофиз, гипоталамус, кора надпочечников).
Выделяют 3 фазы патологического процесса:
- Индукционная фаза — синтез ряда гуморальных факторов, запускающих реакцию системного воспалительного ответа
- Каскадная фаза — развитие острого лёгочного повреждения, активация каскадов калликреин-кининовой системы, системы арахидоновой кислоты, свёртывающей системы крови и др.
- Фаза вторичной аутоагрессии, предельно выраженной органной дисфункции и стабильного гиперметаболизма — потеря организмом способности самостоятельно поддерживать гомеостаз.
Клиника
Клиника синдрома состоит из проявлений недостаточности каждой из затронутых систем организма. Кроме того, медиаторы повреждения формируют синдром системного воспалительного ответа (ССВО) — генерализованную системную воспалительную реакцию. ССВО характеризуется следующими проявлениями:
Прогноз
При развитии недостаточности 3 и более органов и систем прогноз неблагоприятный. Летальность по разным авторам колеблется от 35% до 70%.
Для оценки тяжести полиорганной недостаточности и прогнозирования её исхода были предложены различные системы объективной оценки тяжести больных. Одной из первых шкал, разработанных с данной целью, является шкала MOF (Multiple Organ Failure), которая оценивает недостаточность 7 систем организма – дыхательной, сердечно-сосудистой, мочевыделительной, печени, гематологической, желудочно-кишечного тракта и центральной нервной системы[1]. Возрастание количества баллов коррелирует с увеличением летальности.
Шкала MOF (Multiple Organ Failure Score)
| Система | Баллы | ||
| 0 | 1 | 2 | |
| Дыхательная | Нет ИВЛ | ИВЛ с положительным давлением в конце выдоха ≤ 10 см вод. ст. и FiO2 ≤ 0,4 | ИВЛ с положительным давлением в конце выдоха > 10 вод. ст. и/или FiO2 > 0,4 |
| Сердечно-сосудистая | Нормальное АД, нет потребности в вазоактивных препаратах | Периоды с гипотензией, требующие манипуляций, таких как введение объёмов жидкостей для поддержания АД свыше 100 мм рт. ст., инфузии дофамина гидрохлорида ≤ 10 мкг/кг/мин или нитроглицерина ≤ 20 мкг/мин | Периоды с гипотензией ниже 100 мм рт. ст., инфузии дофамина гидрохлорида > 10 мкг/кг/мин или нитроглицерина > 20 мкг/мин |
| Мочевыдели- тельная | Креатинин сыворотки < 2 мг% | Креатинин сыворотки >= 2 мг% | Необходимость в гемодиализе или перитонеальном диализе |
| Печень | АсАТ < 25 МЕ/л и общий билирубин < 2 мг% | АсАТ >= 25 МЕ/л и < 50 МЕ/л и/или общий билирубин>= 2 мг% и < 6 мг% | АсАТ >= 50 МЕ/л и/или общий билирубин >= 6 мг% |
| Гематологическая | Нормальное содержание лейкоцитов и тромбоцитов | Тромбоциты ≤ 50000 в мкл и/или лейкоциты >= 30000 и < 60000 в мкл | Геморрагический диатез и/или лейкоциты < 2500 в мкл или >= 60000 в мкл |
| ЖКТ | Нормальное функционирование | Акалькулезный холецистит или стрессовая язва | Кровотечение из стрессовой язвы, требующее трансфузии более 2 единиц крови за 24 ч, некротизирующий энтероколит, панкреатит и/или спонтанная перфорация желчного пузыря |
| ЦНС | Нормальное функционирование | Слегка сниженная ответная реакция | Сильно нарушенная реакция и/или диффузная нейропатия |
Лечение
1. Первое по значимости и времени направление — устранение действия пускового фактора или заболевания, запустившего и поддерживающего агрессивное воздействие на организм больного (гнойная деструкция, тяжёлая гиповолемия, лёгочная гипоксия, высокоинвазивная инфекция и т. д.). При неустранённом этиологическом факторе любое, самое интенсивное лечение ПОН, безрезультатно.
2. Второе направление — коррекция нарушений кислородного потока, включающая восстановление кислородтранспортной функции крови, терапию гиповолемии и гемоконцентрации, купирование расстройств гемореологии.
3. Третье направление — замещение, хотя бы временное, функции повреждённого органа или системы с помощью медикаментозных и экстракоропоральных методов.
Источники
Примечания
- ↑ Goris R.J.A., te Boekhorst T.P.A., Nuytinick J.K., Gimbere J.S. Multiple-organ failure // Arch. Surg. – 1985. – Vol. 120. – P. 1109-1115.
Полиорганная недостаточность - это... Что такое Полиорганная недостаточность?
Полиорганная недостаточность (Синдром полиорганной недостаточности, СПОН, ПОН) — тяжёлая неспецифическая стресс-реакция организма, совокупность недостаточности нескольких функциональных систем, развивающаяся как терминальная стадия большинства острых заболеваний и травм. Главной особенностью полиорганной недостаточности является неудержимость развития повреждения органа или системы до такой глубины, что он не способен поддерживать жизнеобеспечение организма. На долю синдрома приходится до 80 % общей летальности палат реанимации и интенсивной терапии хирургических стационаров.
Следует отличать синдром полиорганной недостаточности от терминальной поливисцеропатии, когда в результате хронического патологического процесса или старости последовательно и необратимо утрачивают функции все структурно-функциональные системы организма.
История
Термин «полиорганная недостаточность» впервые появился в работе N.Тylney и сотр. «Последовательная системная недостаточность после разрыва аневризмы брюшной аорты. Нерешенная проблема послеоперационного лечения» (1973). В дальнейшем другими учёными — А.Baue (1975), B.Eisman (1977) и D.Fry (1980-1982), были окончательно выделены особенности этого состояния и его дефиниции.
Этиопатогенез
Полиорганная недостаточность развивается как исход тяжёлой сочетанной травмы, эклампсии, сепсиса, инфекционно-токсического и геморрагического шока, асистолии, комы, вызванной диабетом, менингоэнцефалитом, отравлениями.
В основе развития синдрома лежит острое снижение обмена веществ и энергообразования в результате расстройств метаболизма и микроциркуляции в тканях, что приводит к нарушению функций и структуры органов. Этиологические факторы (тяжёлая травма, токсические агенты и др.), повреждая клеточные и сосудистые мембраны, приводят полиморфноядерные нуклеары (гранулоциты) и эндотелиоциты в состояние «кислородного взрыва», что провоцирует выброс огромного количества медиаторов полиорганной недостаточности, обладающих разнонаправленными эффектами. Всего известно более двухсот медиаторов, в том числе:
Развивается комплекс патологических изменений как в очаге поражения, так и на уровне формирования механизмов адаптации (гипофиз, гипоталамус, кора надпочечников).
Выделяют 3 фазы патологического процесса:
- Индукционная фаза — синтез ряда гуморальных факторов, запускающих реакцию системного воспалительного ответа
- Каскадная фаза — развитие острого лёгочного повреждения, активация каскадов калликреин-кининовой системы, системы арахидоновой кислоты, свёртывающей системы крови и др.
- Фаза вторичной аутоагрессии, предельно выраженной органной дисфункции и стабильного гиперметаболизма — потеря организмом способности самостоятельно поддерживать гомеостаз.
Клиника
Клиника синдрома состоит из проявлений недостаточности каждой из затронутых систем организма. Кроме того, медиаторы повреждения формируют синдром системного воспалительного ответа (ССВО) — генерализованную системную воспалительную реакцию. ССВО характеризуется следующими проявлениями:
Прогноз
При развитии недостаточности 3 и более органов и систем прогноз неблагоприятный. Летальность по разным авторам колеблется от 35% до 70%.
Источники
Полиорганная недостаточность - это... Что такое Полиорганная недостаточность?
Полиорганная недостаточность (Синдром полиорганной недостаточности, СПОН, ПОН) — тяжёлая неспецифическая стресс-реакция организма, совокупность недостаточности нескольких функциональных систем, развивающаяся как терминальная стадия большинства острых заболеваний и травм. Главной особенностью полиорганной недостаточности является неудержимость развития повреждения органа или системы до такой глубины, что он не способен поддерживать жизнеобеспечение организма. На долю синдрома приходится до 80 % общей летальности палат реанимации и интенсивной терапии хирургических стационаров.
Следует отличать синдром полиорганной недостаточности от терминальной поливисцеропатии, когда в результате хронического патологического процесса или старости последовательно и необратимо утрачивают функции все структурно-функциональные системы организма.
История
Термин «полиорганная недостаточность» впервые появился в работе N.Тylney и сотр. «Последовательная системная недостаточность после разрыва аневризмы брюшной аорты. Нерешенная проблема послеоперационного лечения» (1973). В дальнейшем другими учёными — А.Baue (1975), B.Eisman (1977) и D.Fry (1980-1982), были окончательно выделены особенности этого состояния и его дефиниции.
Этиопатогенез
Полиорганная недостаточность развивается как исход тяжёлой сочетанной травмы, эклампсии, сепсиса, инфекционно-токсического и геморрагического шока, асистолии, комы, вызванной диабетом, менингоэнцефалитом, отравлениями.
В основе развития синдрома лежит острое снижение обмена веществ и энергообразования в результате расстройств метаболизма и микроциркуляции в тканях, что приводит к нарушению функций и структуры органов. Этиологические факторы (тяжёлая травма, токсические агенты и др.), повреждая клеточные и сосудистые мембраны, приводят полиморфноядерные нуклеары (гранулоциты) и эндотелиоциты в состояние «кислородного взрыва», что провоцирует выброс огромного количества медиаторов полиорганной недостаточности, обладающих разнонаправленными эффектами. Всего известно более двухсот медиаторов, в том числе:
Развивается комплекс патологических изменений как в очаге поражения, так и на уровне формирования механизмов адаптации (гипофиз, гипоталамус, кора надпочечников).
Выделяют 3 фазы патологического процесса:
- Индукционная фаза — синтез ряда гуморальных факторов, запускающих реакцию системного воспалительного ответа
- Каскадная фаза — развитие острого лёгочного повреждения, активация каскадов калликреин-кининовой системы, системы арахидоновой кислоты, свёртывающей системы крови и др.
- Фаза вторичной аутоагрессии, предельно выраженной органной дисфункции и стабильного гиперметаболизма — потеря организмом способности самостоятельно поддерживать гомеостаз.
Клиника
Клиника синдрома состоит из проявлений недостаточности каждой из затронутых систем организма. Кроме того, медиаторы повреждения формируют синдром системного воспалительного ответа (ССВО) — генерализованную системную воспалительную реакцию. ССВО характеризуется следующими проявлениями:
Прогноз
При развитии недостаточности 3 и более органов и систем прогноз неблагоприятный. Летальность по разным авторам колеблется от 35% до 70%.