Натрия гидрокарбонат физико химические свойства
430. Natrii hydrocarbon as - PharmSpravka
430. Natrii hydrocarbon as
Натрия гидрокарбонат
Natrium hydrocarbonicum
Natrium bicarbonicum Натрия бикарбонат
NaHC03 М. в. 84,01
Описание. Белый кристаллический порошок без запаха, соленощелочного вкуса, устойчив в сухом воздухе, 'медленно разлагается во влажном. Водные растворы имеют щелочную реакцию.
Растворимость. Растворим в воде, практически нерастворим в 95% спирте.
Подлинность. Препарат дает характерные реакции на натрий и гидрокарбонаты (стр. 745; 744).
Прозрачность и цветность раствора. Раствор 0,5 г препарата в 10 мл воды должен быть бесцветным и по мутности не превышать эталон № 4.
Хлориды. 2,5 г препарата растворяют в 50 мл воды. 2 мл этого раствора, разведенные водой до 10 мл, должны выдерживать испытание на хлориды (не более 0,02% в препарате).
Сульфаты. 10 мл того же раствора должны выдерживать испытание на сульфаты (не более 0,02% в препарате).
Железо. 10 мл того же раствора должны выдерживать испытание на железо (не более 0,006% в препарате).
Тяжелые металлы. 10 мл того же раствора не должны давать реакции на тяжелые металлы.
Кальций. 0,6 г препарата, растворенные в 10 мл воды, должны выдерживать испытание на кальций (не более 0,05% в препарате).
Соли аммония. При нагревании 1 г препарата с 10 мл раствора едкого натра выделяющиеся пары не должны окрашивать красную лакму-совую бумагу в синий цвет.
Мышьяк. 0,25 г препарата должны выдерживать испытание на мышьяк (не более 0,0002 % в препарате).
Потеря в весе при прокаливании. Около 1 г препарата (точная навеска) нагревают при 280-300° до постоянного веса. Потеря в весе должна быть не менее 36,6%.
Количественное определение. Около 1 г препарата (точная навеска) растворяют в 20 мл свежепрокипяченной и охлажденной воды и титрую г €,5 н. раствором соляной кислоты (индикатор - метиловый оранжевый).
1 мл 0,5 н. раствора соляной кислоты соответствует 0,04200 г NaHC03, которого в препарате должно быть не менее 99,0%.
Хранение. В хорошо укупоренной таре.
Примечание. Натрия гидрокарбонат для инъекций, кроме перечисленных выше требований, должен выдерживать следующее испытание: 5% раствор препарата должен быть прозрачным и бесцветным.
29.06.2015
Гидрокарбонат натрия — Википедия
| Гидрокарбонат натрия | |
|---|---|
| Систематическое наименование | гидрокарбонат натрия |
| Традиционные названия | пищевая (питьевая) сода, сода двууглекислая, двууглекислый натрий, бикарбонат натрия, кислый углекислый натрий |
| Хим. формула | CHNaO₃ |
| Рац. формула | NaHCO 3 |
| Состояние | твёрдое |
| Молярная масса | 84,0066 г/моль |
| Плотность | 2,159 г/см³ |
| 60—200 °C | |
| Растворимость в воде | 9,59 г/100 мл |
| Рег. номер CAS | 144-55-8 |
| PubChem | 516892 |
| Рег. номер EINECS | 205-633-8 |
| SMILES | |
| InChI | |
| Рег. номер EC | 205-633-8 |
| Кодекс Алиментариус | E500(ii) |
| RTECS | VZ0950000 |
| ChEBI | 32139 |
| ChemSpider | 8609 |
| ЛД50 | 4220 мг/кг |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Гидрокарбона́т на́трия (лат. Natrii hydrocarbonas), другие названия: бикарбона́т на́трия, ча́йная со́да , питьева́я или пищева́я сода, двууглеки́слый натрий — неорганическое соединение, натриевая кислая соль угольной кислоты с химической формулой NaHCO3.
В обычном виде — мелкокристаллический порошок белого цвета.
Используется в промышленности, пищевой промышленности, в кулинарии, в медицине как нейтрализатор химических ожогов кожи и слизистых оболочек концентрированными кислотами и для снижения кислотности желудочного сока. Также применяется в буферных растворах.
Химические свойства
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты. Проявляет все свойства соли сильного основания и слабой кислоты. В водных растворах имеет слабощелочную реакцию. В широком диапазоне концентраций в водном растворе pH раствора изменяется незначительно, на этом основано применение раствора вещества в качестве буферного раствора.
Реакция с кислотами
Гидрокарбонат натрия реагирует с кислотами с образованием соответствующей кислоте соли, например, хлорида натрия, сульфата натрия и угольной кислоты, которая в процессе реакции распадается на углекислый газ и воду, при этом углекислый газ выделяется из раствора в виде пузырьков:
- NaHCO3+HCl→NaCl+h3CO3,{\displaystyle {\mathsf {NaHCO_{3}+HCl\rightarrow NaCl+H_{2}CO_{3}}},}
- h3CO3→h3O+CO2↑,{\displaystyle {\mathsf {H_{2}CO_{3}\rightarrow H_{2}O+CO_{2}\uparrow }},}
- 2NaHCO3+h3SO4→Na2SO4+2h3O+2CO2↑.{\displaystyle {\mathsf {2NaHCO_{3}+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+2H_{2}O+2CO_{2}\uparrow }}.}
В быту обычно применяется реакция «гашения соды» уксусной кислотой, с образованием ацетата натрия или гашение лимонной кислотой с образование цитрата натрия, реакция с уксусной кислотой:
- NaHCO3+Ch4COOH→Ch4COONa+h3O+CO2↑.{\displaystyle {\mathsf {NaHCO_{3}+CH_{3}COOH\rightarrow CH_{3}COONa+H_{2}O+CO_{2}\uparrow }}.}
Термическое разложение
При температуре выше 60 °C гидрокарбонат натрия начинает распадаться на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200 °C, при более высоких температурах карбонат натрия начинает распадаться на оксид натрия и углекислый газ):
- 2NaHCO3→60−200∘CNa2CO3+h3O+CO2↑.{\displaystyle {\mathsf {2NaHCO_{3}{\xrightarrow {60-200^{\circ }C}}Na_{2}CO_{3}+H_{2}O+CO_{2}\uparrow }}.}
При этом процессе выделения воды в виде водяного пара и углекислого газa масса исходного продукта уменьшается примерно на 37 %[источник не указан 320 дней].
Получение
В промышленности гидрокарбонат натрия получают аммиачно-хлоридным способом[1]. В концентрированный раствор хлорида натрия, насыщенный аммиаком, под давлением пропускают углекислый газ. В процессе синтеза происходят две реакции:
- Nh4+CO2+h3O→Nh5HCO3{\displaystyle {\mathsf {NH_{3}+CO_{2}+H_{2}O\rightarrow NH_{4}HCO_{3}}}}
- Nh5HCO3+NaCl→NaHCO3↓+Nh5Cl.{\displaystyle {\mathsf {NH_{4}HCO_{3}+NaCl\rightarrow NaHCO_{3}\downarrow +NH_{4}Cl}}.}
В холодной воде гидрокарбонат натрия мало растворим, и его отделяют от охлаждённого раствора фильтрованием, а из полученного после фильтрования раствора хлорида аммония снова получают аммиак, возвращаемый в производство вновь:
- 2Nh5Cl+Ca(OH)2→2Nh4↑+CaCl2+2h3O.{\displaystyle {\mathsf {2NH_{4}Cl+Ca(OH)_{2}\rightarrow 2NH_{3}\uparrow +CaCl_{2}+2H_{2}O}}.}
Применение
Двууглекислый натрий (бикарбонат) применяется в химической, пищевой, лёгкой, медицинской, фармацевтической промышленности, цветной металлургии, в быту. Зарегистрирован в качестве пищевой добавки E500 (ii), входит в состав пищевой добавки E500.
В химической промышленности
Применяется для производства красителей, пенопластов и других органических продуктов, фторорганических соединений, продуктов бытовой химии, наполнителей в огнетушителях, Реагент для отделения диоксида углерода, сероводорода из газовых смесей, например, отходящих газов топливосжигающих установок. В этом процессе углекислый газ поглощается раствором гидрокарбоната натрия при повышенном давлении и пониженной температуре, далее поглощённый углекислый газ выделяется из раствора при подогреве и снижении давления;
В лёгкой промышленности — в производстве резины для подошв обуви и в производстве искусственных кож, кожевенном производстве при дублении и нейтрализации кожи после кислого дубления, текстильной промышленности при отделке шёлковых и хлопчатобумажных тканей;
В пищевой промышленности — в хлебопечении, производстве кондитерских изделий, приготовлении газированных напитков.
В кулинарии
Основное применение пищевой соды в пищевой промышленности и в быту — кулинария, где применяется, преимущественно, в качестве основного или дополнительного разрыхлителя в составе кислого и пресного теста. При добавлении питьевой соды в кислое тесто происходит реакция с молочной кислотой, продуцированной при заквашивании дрожжевыми микроорганизмами, при этой реакции выделяется углекислый газ, вспучивающий тесто.
При добавлении в пресное тесто углекислый газ выделяется при выпечке из-за термического разложения.
При применении соды в чистом виде важно соблюсти правильную дозировку, так как она оставляет в продукте карбонат натрия, дающий определённый привкус. Порядок замешивания для теста: соду — в муку, кислые компоненты (уксус, кефир и пр.) — в жидкость.
В медицине
Традиционно раствор питьевой соды используется для дезинфекции зубов и дёсен при зубных болях[2] и полости рта и горла, при сильном кашле, ангине, фарингите[3], а также как общепринятое средство от изжоги и болей в желудке.
Применяется при заболеваниях, сопровождающиеся выраженным ацидозом (при диабете, инфекциях и др), для борьбы с ацидозом при хирургических вмешательствах (назначается 3-5 г. внутрь)[4].
Применяется в качестве антиаримтмического средства[4].
Как антацидной средство (как и все другие щелочи) применяется при язвенной болезни желудка, и двенадцатиперстной кишки, при повышенной кислотности желудочного сока[4].
Имеются так же данные о применении препарата (в виде капельных и внутривенных вливаний) при гипертонической болезни, симптоматической почечной гипертонии[5], и хронической почечной недостаточности[6]. Эффект связан с увеличением выделения ионов натрия и хлора и возрастанием осмотического диуреза[4].
В виде свечей применяется против укачивания при морской и воздушной болезнях[4]
Применяется в качестве отхаркивающего средства, т.к. повышая щелочные резервы крови, сдвигает в щелочную сторону реакцию бронхиальной слизи, делая мокроту менее вязкой[4].
При ринитах, конъюнктивитах, стоматитах, ларингитах и т.п. применяют для полосканий, промываний, ингаляций 0,5 - 2% р-ры гидрокарбоната натрия[4].
Иногда применяется внутривенно — с целью быстрого устранения метаболического ацидоза во время реанимационных мероприятий, инфекциях, заболеваниях почек, наркозах[4].
Нужно иметь ввиду, что в результате применения может возникнуть т.н. кислотный рикошет (при реакции содой с соляной кислотой происходит выделение СО2, который оказывает раздражающее действие на стенку желудка, усиливая выделение гастрина[4]).
В альтернативной медицине питьевая сода иногда заявляется как «лекарство» от рака, однако, никакой экспериментально подтверждённой эффективности применения такого «лечения» не существует[7].
Противопоказания к применению в медицинских целях
Индивидуальная гиперчувствительность; состояния, сопровождающиеся развитием алкалоза; гипокальциемия, при приеме внутрь повышается риск алкалоза и развития тетанических судорог, гипохлоремия — снижение концентрации в крови ионов Cl-, в том числе вызванная рвотой, или снижением всасывания в желудочно-кишечном тракте, может привести к тяжёлому алкалозу.
Отёки, артериальная гипертензия, при приёме состояние больного может ухудшиться, анурия или олигурия, при этих заболевания повышается риск избыточной задержки натрия в организме.
Пожаротушение
Гидрокарбонат натрия вместе с карбонатом аммония используется в качестве наполнителя в огнетушителях с сухим наполнением и в стационарных системах сухого пожаротушения. Это применение обусловлено тем, что от воздействия высокой температуры в очаге горения вещество выделяет углекислый газ, атмосфера которого затрудняет доступ кислорода воздуха в очаг горения.
В быту
Применяется как безопасное для здоровья средство для чистки поверхностей столовой и кухонной посуды, поверхностей кухонных столов, иных поверхностей, соприкасающихся с пищей, путем протирки их с помощью влажной тряпки с сухим порошком питьевой соды.
В транспорте
Применяется для нейтрализации следов электролита — серной кислоты на поверхности пластмассовых корпусов свинцовых аккумуляторов насыщенным водным раствором питьевой соды.
Производство
В Российской Федерации двууглекислый натрий выпускается в соответствии с требованиями[8] и техническими условиями[9], выпускается на предприятиях АО «Башкирская содовая компания» в г. Стерлитамак, Республика Башкортостан, а также на Крымском содовом заводе в г. Красноперекопск, Крымский полуостров[10].
Хранение
Гидрокарбонат натрия хранят в закрытых упаковках, в сухом месте вдали от источников огня. Гарантийный срок хранения натрия двууглекислого — 12 месяцев со дня изготовления. Срок годности не ограничен.
Безопасность
Вещество нетоксично, пожаро- и взрывобезопасно.
Имеет солоноватый, мыльный вкус. При попадании пыли вещества на слизистые оболочки глаз и носа вызывает лёгкое раздражение. При частой работе в атмосфере, загрязнённой пылью двууглекислого натрия, может возникнуть раздражение верхних дыхательных путей. Предельно допустимая концентрация пыли бикарбоната натрия в воздухе производственных помещений 5 мг/м3[11].
Примечания
- ↑ Глинка Н. Л. Общая химия. — М.: «Химия», 1977, переработанное. — С. 441. — 720 с.
- ↑ Полоскание при зубной боли - рекомендации » Аденто.ру
- ↑ Полоскание рта содой как средство от воспалений
- ↑ 1 2 3 4 5 6 7 8 9 Машковский М.Д. Лекарственные средства (пособие по фармокотерапии для врачей). — Медицина, 1998. — С. 112. — 688 с.
- ↑ Шульцев Г.П., Захарченко В.Н., Барицкий В.Н. и др. К применению гидрокарбоната натрия при гипертонической болезни и почечных гипертониях.. — Киев: Клиническая медицина №10, 1974. — С. 134-138.
- ↑ Рябов С.И. Современные методы лечения хронической почечной недостаточности.. — Киев: Клиническая медицина №10, 1974. — С. 134-138.
- ↑ Sodium Bicarbonate (копия Archive.org) // American Cancer Society, 11/28/2008 (англ.): «Available peer-reviewed medical journals do not support claims that sodium bicarbonate works as a cancer treatment.»
- ↑ ГОСТ 2156-76 «Натрий двууглекислый. Технические условия» и ГОСТ 32802-2014
- ↑ «Добавки пищевые. Натрия карбонаты Е500. Общие технические условия» на предприятии «Сода»
- ↑ Данный объект расположен на территории Крымского полуострова, бо́льшая часть которого является объектом территориальных разногласий между Россией, контролирующей спорную территорию, и Украиной, в пределах признанных международным сообществом границ которой спорная территория находится. Согласно федеративному устройству России, на спорной территории Крыма располагаются субъекты Российской Федерации — Республика Крым и город федерального значения Севастополь. Согласно административному делению Украины, на спорной территории Крыма располагаются регионы Украины — Автономная Республика Крым и город со специальным статусом Севастополь.
- ↑ ГОСТ 2156-76 «Натрий двууглекислый. Технические условия» Архивная копия от 13 января 2010 на Wayback Machine
Литература
- ГОСТ 2156-76. Натрий двууглекислый. Технические условия (с Изменениями № 1, 2, 3, 4).
- ГОСТ 32802-2014. Добавки пищевые. Натрия карбонаты E500. Общие технические условия.
формула, состав, применение :: SYL.ru
Пищевая, или питьевая сода, — широко известное в медицине, кулинарии и бытовом потреблении соединение. Это кислая соль, молекула которой образована положительно заряженными ионами натрия и водорода, анионом кислотного остатка угольной кислоты. Химическое название соды — бикарбонат или гидрокарбонат натрия. Формула соединения по системе Хилла: CHNaO3 (брутто-формула).
Отличие кислой соли от средней
Угольная кислота образуют две группы солей — карбонаты (средние) и гидрокарбонаты (кислые). Тривиальное название карбонатов — соды — появилось еще в древности. Следует различать среднюю и кислую соли по названиям, формулам и свойствам.
Na2CO3 — карбонат натрия, динатриевая соль угольной кислоты, кальцинированная стиральная сода. Служит сырьем для получения стекла, бумаги, мыла, используется как моющее средство.

NaHCO3 — натрия гидрокарбонат. Состав подсказывает, что вещество является мононатриевой солью угольной кислоты. Это соединение отличается наличием двух разных положительных ионов — Na+ и Н+. Внешне кристаллические белые вещества похожи, их трудно отличить друг от друга.
Вещество NaHCO3 считается питьевой содой не потому, что употребляется внутрь для утоления жажды. Хотя с помощью этого вещества можно приготовить шипучий напиток. Раствор этого гидрокарбоната принимают внутрь при повышенной кислотности желудочного сока. При этом происходит нейтрализация избытка протонов Н+, которые раздражают стенки желудка, вызывают боль и жжение.
Физические свойства пищевой соды
Бикарбонат — это белые моноклинные кристаллы. В составе этого соединения присутствуют атомы натрия (Na), водорода (Н), углерода (С) и кислорода. Плотность вещества составляет 2,16 г/см3. Температура плавления — 50–60 °С. Натрия гидрокарбонат — порошок молочно-белого цвета — твердое мелкокристаллическое соединение, растворимое в воде. Питьевая сода не горит, а при нагревании свыше 70 °С разлагается на карбонат натрия, углекислый газ и воду. В производственных условиях чаще применяется гранулированный бикарбонат.

Безопасность пищевой соды для человека
Соединение не обладает запахом, его вкус — горько-соленый. Однако не рекомендуется нюхать и пробовать вещество на вкус. Вдыхание гидрокарбоната натрия может вызвать чихание и кашель. Одно из применений основано на способности пищевой соды нейтрализовать пахнущие вещества. Порошком можно обработать спортивную обувь, чтобы избавиться от неприятного запаха.
Питьевая сода (гидрокарбонат натрия) — безвредное вещество при контакте с кожей, но в твердом виде может вызвать раздражение слизистой оболочки глаз и пищевода. В низких концентрациях раствор не токсичен, его можно принимать внутрь.
Гидрокарбонат натрия: формула соединения
Брутто-формула CHNaO3 редко встречается в уравнениях химических реакций. Дело в том, что она не отображает связь между частицами, которые образуют гидрокарбонат натрия. Формула, обычно используемая для характеристики физических и химических свойств вещества, — NaHCO3. Взаимное расположение атомов отражает шаро-стержневая модель молекулы:
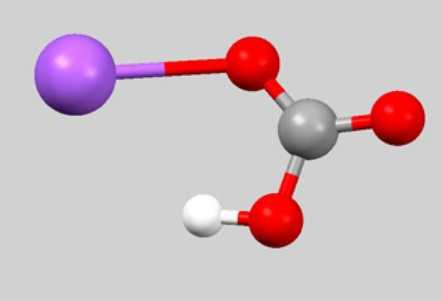
Если узнать из периодической системы значения атомных масс натрия, кислорода, углерода и водорода. то можно подсчитать молярную массу вещества гидрокарбонат натрия (формула NaHCO3):
Ar(Na) — 23;
Ar(O) — 16;
Ar(C) — 12;
Ar(H) — 1;
М (CHNaO3) = 84 г/моль.
Строение вещества
Гидрокарбонат натрия — ионное соединение. В состав кристаллической решетки входит катион натрия Na+, замещающий в угольной кислоте один атом водорода. Состав и заряд аниона — НСО3–. При растворении происходит частичная диссоциация на ионы, которые образуют гидрокарбонат натрия. Формула, отражающая структурные особенности, выглядит так:
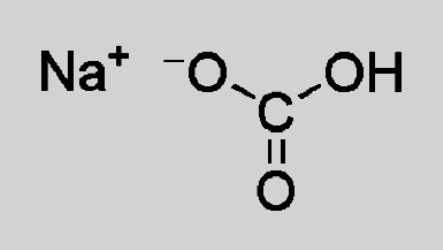
Растворимость питьевой соды в воде
В 100 г воды растворяется 7,8 г гидрокарбоната натрия. Вещество подвергается гидролизу:
NaHCO3 = Na+ + НСО3–;
Н2О ↔ Н+ + ОН–;
НСО3– + Н+ = Н2О + СО2↑.
При суммировании уравнений выясняется, что в растворе накапливают гидроксид-ионы (слабощелочная реакция). Жидкость окрашивает фенолфталеин в розовый цвет. Окраска универсальных индикаторов в виде бумажных полосок в растворе соды меняется с желто-оранжевой на серую или синюю.
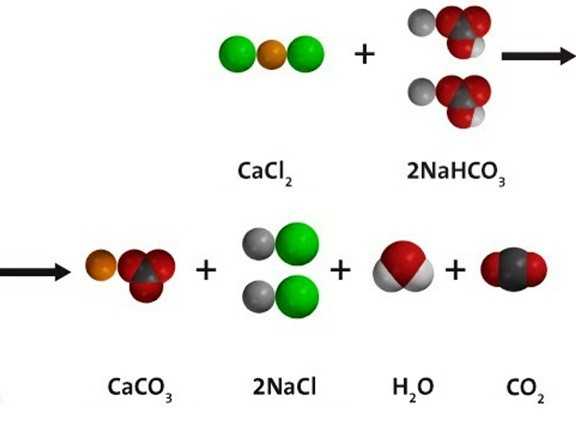
Реакция обмена с другими солями
Водный раствор гидрокарбоната натрия вступает в реакции ионного обмена с другими солями при условии, что одно из вновь получившихся веществ — нерастворимое; либо образуется газ, который удаляется из сферы реакции. При взаимодействии с хлоридом кальция, как показано на схеме ниже по тексту, получается и белый осадок сарбоната кальция, и углекислый газ. В растворе остаются ионы натрия и хлора. Молекулярное уравнение реакции:
Взаимодействие питьевой соды с кислотами
Гидрокарбонат натрия взаимодействует с кислотами. Реакция ионного обмена сопровождается образованием соли и слабой угольной кислоты. В момент получения она разлагается на воду и углекислый газ (улетучивается).
Стенки желудка человека вырабатывают соляную кислоту, существующую в виде ионов
Н+ и Cl–. Если принимать внутрь натрия гидрокарбонат, реакции происходят в растворе желудочного сока с участием ионов:
NaHCO3 = Na+ + НСО3–;
HCl = Н+ + Cl–;
Н2О ↔ Н+ + ОН–;
НСО3– + Н+ = Н2О + СО2↑.
Врачи не рекомендуют постоянно использовать при повышенной кислотности желудка гидрокарбонат натрия. Инструкция к препаратам перечисляет различные побочные действия ежедневного и длительного приема питьевой соды:
- повышение давления крови;
- отрыжка, тошнота и рвота;
- тревожность, плохой сон;
- снижение аппетита;
- боли в животе.
Получение пищевой соды
В лаборатории бикарбонат натрия можно получить из кальцинированной соды. Такой же метод применялся раньше в химическом производстве. Современный промышленный способ основан на взаимодействии аммиака с углекислым газом и слабой растворимости питьевой соды в холодной воде. Через раствор хлорида натрия пропускают аммиак и диоксид углерода (углекислый газ). Образуются хлорид аммония и раствор гидрокарбоната натрия. При охлаждении растворимость питьевой соды понижается, тогда вещество легко отделяется с помощью фильтрования.
Где используется гидрокарбонат натрия? Применение пищевой соды в медицине
Многим известно, что атомы металлического натрия энергично взаимодействуют с водой, даже ее парами в воздухе. Реакция начинается активно и сопровождается выделением большого количества теплоты (горением). В отличие от атомов, ионы натрия — стабильные частицы, не наносящие вреда живому организму. Наоборот, они принимают активное участие в регуляции его функций.
Как используется неядовитое для человека и полезное во многих отношениях вещество — гидрокарбонат натрия? Применение основано на физических и химических свойствах питьевой соды. Важнейшие направления — бытовое потребление, пищевая промышленность, здравоохранение, народная медицина, получение напитков.
Среди основных свойств бикарбоната натрия — нейтрализация повышенной кислотности желудочного сока, кратковременное устранение болевого синдрома при гиперацидности желудочного сока, язвенной болезни желудка и 12-перстной кишки. Антисептическое действие раствора питьевой соды применяется при лечении боли в горле, кашля, интоксикации, морской болезни. Промывают им полости рта и носа, слизистые оболочки глаз.

Широко используются разные лекарственные формы бикарбоната натрия, например порошки, которые растворяют и применяют для инфузий. Назначают растворы для приема пациентами внутрь, промывают ожоги кислотами. Для изготовления таблеток и ректальных суппозиториев также используется гидрокарбонат натрия. Инструкция к препаратам содержит подробное описание фармакологического действия, показаний. Список противопоказаний очень короткий — индивидуальная непереносимость вещества.
Использование пищевой соды в быту
Гидрокарбонат натрия — это «скорая помощь» при изжоге и отравлении. С помощью питьевой соды в домашних условиях отбеливают зубы, уменьшают воспаление при угревой болезни, протирают кожу для удаления избытка жирного секрета. Бикарбонат натрия смягчает воду, помогает очистить загрязнения с разных поверхностей.
При ручной стирке вещей из шерстяного трикотажа можно добавить в воду питьевую соду. Это вещество освежает цвет ткани и удаляет запах пота. Нередко при глажении изделий из шелка появляются желтые подпалины от утюга. В таком случае поможет кашица из питьевой соды и воды. Вещества надо как можно быстрее смешать и нанести на пятно. Когда кашица подсохнет, ее следует почистить щеткой, а изделие прополоскать в холодной воде.
В реакции с уксусной кислотой получается ацетат натрия и бурно выделяется углекислый газ, вспенивающий всю массу: NaHCO3 + СН3СООН = Na+ + СН3СОО– + Н2О + СО2↑. Этот процесс идет всякий раз, когда при изготовлении шипучих напитков и кондитерских изделий питьевую соду «гасят» уксусом.

Вкус выпечки будет нежнее, если использовать не магазинный синтетический уксус, а сок лимона. На крайний случай можно заменить его смесью 1/2 ч. л. порошка лимонной кислоты и 1 ст. л. воды. Питьевая сода с кислотой добавляется в тесто в числе последних ингредиентов, чтобы можно было сразу ставить выпечку в духовку. Кроме бикарбоната натрия, иногда в качестве разрыхлителя используется гидрокарбонат аммония.
ФС.2.2.0011.15 Натрия гидрокарбонат | Фармакопея.рф
Содержимое (Table of Contents)
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФАРМАКОПЕЙНАЯ СТАТЬЯ
Натрия гидрокарбонат ФС.2.2.0011.15
Натрия гидрокарбонат
Natrii hydrocarbonas Взамен ГФ X, ст. 430
Гидрокарбонат натрия
NaHCO3 М. м. 84,01
Содержит не менее 99,0 % натрия гидрокарбоната NaHCO3 в пересчете на сухое вещество.
Описание
Белый или почти белый кристаллический порошок без запаха.
Растворимость
Растворим в воде, практически нерастворим в спирте 96 %.
Подлинность
Субстанция дает характерные реакции на натрий (реакция А) и гидрокарбонаты (ОФС «Общие реакции на подлинность»).
*Прозрачность раствора
5 г субстанции растворяют в 100 мл воды, свободной от диоксида углерода (раствор А). Полученный раствор должен быть прозрачным для субстанции, предназначенной для производства стерильных лекарственных форм, или мутность раствора не должна превышать эталон II для субстанции, предназначенной для производства нестерильных лекарственных форм (ОФС «Прозрачность и степень мутности жидкостей»).
*Цветность раствора
Раствор, полученный в испытании «Прозрачность раствора», должен быть бесцветным (ОФС «Степень окраски жидкостей»).
Карбонаты
Значение рН свежеприготовленного раствора А должно быть не более 8,6 (ОФС «Ионометрия», метод 3).
Хлориды
Не более 0,015 % (ОФС «Хлориды»). К 7 мл раствора А прибавляют 2 мл азотной кислоты концентрированной и разводят полученный раствор до 15 мл водой.
Сульфаты
Не более 0,015 % (ОФС «Сульфаты»). 1,0 г субстанции суспендируют в 10 мл воды. К полученной смеси прибавляют хлористоводородную кислоту концентрированную до нейтральной реакции среды и 1 мл сверх того, и разводят полученный раствор до 15 мл водой.
Железо
Не более 0,005 % (ОФС «Железо»). 0,6 г субстанции растворяют в 10 мл воды.
Тяжелые металлы
Не более 0,001 % (ОФС «Тяжёлые металлы»). 1,0 г субстанции растворяют в 10 мл воды.
Кальций
Не более 0,01 % (ОФС «Кальций»). 1,0 г субстанции суспендируют в 10 мл воды. К полученной смеси прибавляют хлористоводородную кислоту концентрированную до нейтральной реакции среды и разводят полученный раствор до 15 мл водой.
Аммоний
Не более 0,002 % (ОФС «Аммоний»). 1,0 г субстанции растворяют в 10 мл воды.
Мышьяк
Не более 0,0002 % (ОФС «Мышьяк»). Для определения используют 0,25 г субстанции.
Потеря в массе при высушивании
Не более 0,25 %. Около 4 г (точная навеска) субстанции сушат над силикагелем в течение 4 ч.
*Бактериальные эндотоксины
Не более 0,04 ЕЭ на 1 мг субстанции (ОФС «Бактериальные эндотоксины»).
Микробиологическая чистота
В соответствии с требованиями ОФС «Микробиологическая чистота».
Количественное определение
Около 0,2 г (точная навеска) субстанции растворяют в 20 мл воды, свободной от углерода диоксида, и титруют 0,1 М раствором хлористоводородной кислоты (индикатор – 0,1 мл 0,1 % спиртового раствора метилового оранжевого).
Параллельно проводят контрольный опыт.
1 мл 0,1 М раствора хлористоводородной кислоты соответствует
8,401 мг натрия гидрокарбоната NaHCO3.
Хранение
В хорошо укупоренной упаковке.
*Контроль по показателям качества «Прозрачность раствора», «Цветность раствора» и «Бактериальные эндотоксины» проводят в субстанциях, предназначенных для производства лекарственных препаратов для парентерального применения.
Скачать в PDF ФС.2.2.0011.15 Натрия гидрокарбонат
Поделиться ссылкой:
Натрия гидрокарбонат физико химические свойства
Гидрокарбонат натрия – кислая соль, образованная сильным основанием – гидроксидом натрия и слабой кислотой – угольной; гидролизуется по аниону. Кристаллогидратов не образует.
Это мелкокристаллическое вещество белого цвета. При нагревании в температурном диапазоне разлагается:
Способен вступать в реакции взаимодействия с кислотами, щелочами, солями более сильных кислот, галогенами, кислотными оксидами (натрия гидрокарбонат физико химические свойства).
Гидрокарбонат натрия получают, пропуская под давлением углекислый газ через концентрированный раствор хлорида натрия, насыщенный аммиаком.
Если связь образована двумя одинаковыми атомами, то электроны в равной степени принадлежат обоим атомам и молекула неполярная. В том случае, когда связь образована двумя разными атомами, электронная плотность смещена в сторону более электроотрицательного атома. Такая связь называется полярной. Например, в молекуле HCl электронная пара смещена к атому хлора, на котором возникает эффективный отрицательный заряд (-), а на атоме водорода — равный ему положительный (+). Величина этого заряда для HCl равна 0,18 абсолютного заряда электрона. При увеличении разности электроотрицательностей атомов, образующих связь, эффективный заряд увеличивается, и в предельном случае можно считать, что электроны полностью переходят к более электроотрицательному атому. Предельным случаем полярной ковалентной связи является ионная связь.
Гидрокарбонаты — Википедия
Материал из Википедии — свободной энциклопедии
Модель иона гидрокарбоната HCO3−Гидрокарбона́ты — кислые соли угольной кислоты H2CO3. Формула аниона: HCO−
3. Устаревшие названия гидрокарбонатов: кислый, углекислый, двууглекислый, бикарбонаты.
Гидрокарбонаты щелочных металлов растворимы в воде. Также в воде хорошо растворимы гидрокарбонаты щёлочноземельных металлов, в отличие от карбонатов.
- Гидрокарбонаты образуются при длительном пропускании CO2 через раствор, содержащий карбонат:
- CaCO3+h3O+CO2→Ca(HCO3)2{\displaystyle {\mathsf {CaCO_{3}+H_{2}O+CO_{2}\rightarrow Ca(HCO_{3})_{2}}}}
- NaCl+Nh4+CO2+h3O→NaHCO3+Nh5Cl{\displaystyle {\mathsf {NaCl+NH_{3}+CO_{2}+H_{2}O\rightarrow NaHCO_{3}+NH_{4}Cl}}}
Гидрокарбонат натрия плохо растворим в холодной воде, поэтому его можно отделить от хлорида аммония фильтрованием.
- При нагревании гидрокарбонаты разлагаются на соответствующий карбонат, воду и углекислый газ:
- 2NaHCO3→Na2CO3+h3O+CO2{\displaystyle {\mathsf {2NaHCO_{3}\rightarrow Na_{2}CO_{3}+H_{2}O+CO_{2}}}}
- Гидролиз гидрокарбонат-иона происходит по схеме:
- HCO3−+h3O⇄OH−+h3CO3{\displaystyle {\mathsf {HCO_{3}^{-}+H_{2}O\rightleftarrows OH^{-}+H_{2}CO_{3}}}}
В итоге раствор гидрокарбонатов имеет щелочную реакцию.
- Реагирует со щелочами:
- HCO3−+OH−→CO32−+h3O{\displaystyle {\mathsf {HCO_{3}^{-}+OH^{-}\rightarrow CO_{3}^{2-}+H_{2}O}}}
- HCO3−+H+→h3O+CO2↑{\displaystyle {\mathsf {HCO_{3}^{-}+H^{+}\rightarrow H_{2}O+CO_{2}\uparrow }}}
Гидрокарбонат натрия (сода) используется в производстве искусственных минеральных вод и заправки огнетушителей, в кондитерском деле и хлебопечении, в быту, в медицине.
Гидрокарбонаты кальция и магния Са(НСО3)2, Mg(НСО3)2 обусловливают временную жёсткость воды[1].
В организме гидрокарбонаты являются буферными веществами, регулирующими постоянство реакции крови[1].
- Кнунянц И. Л. и др. т. 3 Мед-Пол // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1992. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8.
- Ф. Н. Капуцкий, В. Ф. Тикавый. Пособие по химии для поступающих в вузы. — Минск: Выш. школа, 1979. — С. 384.
- Г. П. Хомченко. Химия для поступающих в вузы. — М.: Высшая школа, 1994. — С. 447.
- ↑ 1 2 [1]XuMuK.ru — гидрокарбонаты
Гидрокарбонат натрия - это... Что такое Гидрокарбонат натрия?
Гидрокарбонат натрия NaHCO3 (другие названия: питьевая сода (пищевая добавка E-500), пищевая сода, бикарбонат натрия, натрий двууглекислый) — кислая соль угольной кислоты и натрия. Обыкновенно представляет собой мелкокристаллический порошок белого цвета. Используется в пищевой промышленности, в кулинарии, в медицине как нейтрализатор ожогов кожи человека кислотами и снижения кислотности желудочного сока. Также — в буферных растворах, так как в широком диапазоне концентраций растворов его pH незначительно изменяется.
Безопасность
Двууглекислый натрий не токсичен, пожаро- и взрывобезопасен.
Представляет собой мелкокристаллический порошок солоноватого (мыльного) вкуса, который при попадании на слизистые оболочки вызывает раздражение. При постоянной работе в атмосфере, загрязненной пылью двууглекислого натрия, может возникнуть раздражение дыхательных путей.[1]
Химические свойства
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты.
Молекулярная масса (по международным атомным массам 1971 г.) — 84,00.[1]
Реакция с кислотами
Гидрокарбонат натрия реагирует с кислотами с образованием соли и угольной кислоты, которая тут же распадается на углекислый газ и воду:
В быту чаще встречается такая реакция с уксусной кислотой, с образованием ацетата натрия:
Термическое разложение
При температуре 60 °C гидрокарбонат натрия распадается на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200 °C):
При дальнейшем нагревании до 1000 °C (например при тушении пожара порошковыми системами) полученный карбонат натрия распадается на углекислый газ и оксид натрия:
Применение
Двууглекислый натрий (бикарбонат), применяется в химической, пищевой, легкой, медицинской, фармацевтической промышленности, цветной металлургии, поставляется в розничную торговлю.
Зарегистрирован в качестве пищевой добавки E500.
Применение:
- в химической промышленности — для производства красителей, пенопластов и других органических продуктов, фтористых реактивов, товаров бытовой химии, наполнителей в огнетушителях, для отделения двуокиси углерода, сероводорода из газовых смесей (газ поглощается в растворе гидрокарбоната при повышенном давлении и пониженной температуре, раствор восстанавливается при подогреве и пониженном давлении).
- в легкой промышленности — в производстве подошвенных резин и искусственных кож, кожевенном производстве (дубление и нейтрализация кож), текстильной промышленности (отделка шелковых и хлопчатобумажных тканей).
- в пищевой промышленности — хлебопечении, производстве кондитерских изделий, приготовлении напитков.
Кулинария
Основное применение пищевой соды — кулинария, где она применяется, преимущественно, в качестве основного или дополнительного разрыхлителя при выпечке (так как при нагревании выделяет углекислый газ), самостоятельно или в составе комплексных разрыхлителей (например, пекарского порошка, вместе с карбонатом аммония) и в готовых смесях для выпечки (кексы, торты и пр.). При применении в чистом виде важно соблюсти правильную дозировку, так как оставляет в продукте не безвкусный карбонат натрия.
Медицина
Раствор питьевой соды используется в качестве слабого антисептика для полосканий, лечения больных почечной недостаточностью[2][3], а также как традиционное кислотонейтрализующее средство от изжоги и болей в желудке (современная медицина не рекомендует применять из-за побочных эффектов, в том числе, из-за «кислотного рикошета») для устранения ацидоза и т. п.
Пожаротушение
Гидрокарбонат натрия входит в состав порошка, применяемого в порошковых системах пожаротушения, утилизируя тепло и оттесняя кислород от очага горения выделяемым углекислым газом.
Производство
В Российской Федерации производят соду по ГОСТ 2156-76 «Натрий двууглекислый. Технические условия» на предприятии «Сода» (г. Стерлитамак, Республика Башкортостан).
Хранение
Хранить в закрытых упаковках, не допуская попадания влаги.
Гарантийный срок хранения натрия двууглекислого — 12 месяцев со дня изготовления.
Срок годности не ограничен.
См. также
Примечания
Плазмозамещающие и перфузионные растворы — АТХ код: B05
| B05A |
| ||
|---|---|---|---|
| B05B |
| ||
| B05C |
| ||
| B05D |
| ||
| B05X |
| ||
| B05Z |
Гидрокарбонат натрия - Госстандарт
NaHCO3
Сода
(натрон, бикарбонат натрия, гидрокарбонат натрия) - нейтрализующая кислоту натриевая соль. Питьевая сода - это гидрокарбонат натрия NaHCO3, двууглекислый натрий.В общем случае «сода» представляет собой техническое название натриевых солей угольной кислоты H2CO3. В зависимости от химического состава соединения различается питьевая сода (пищевая сода, бикарбонат натрия, двууглекислый натрий, гидрокарбонат натрия) - NaHCO3, кальцинированная сода (карбонат натрия, безводный углекислый натрий) - Na2CO3 и кристаллическая сода - Na2CO3•10H2O, Na2CO3•7H2O, Na2CO3•H2O.Искусственная пищевая сода (NaHCO3) - белый кристаллический порошок.
Современные содовые озера известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Серлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США).
В США природная сода удовлетворяет более 40% потребности страны в этом полезном ископаемом. В России из-за отсутствия крупных месторождений сода из минералов не добывается.
Сода была известна человеку примерно за полторы-две тысячи лет до нашей эры, а может быть, и раньше. Ее добывали из содовых озер и извлекали из немногочисленных месторождений в виде минералов. Первые сведения о получении соды путем упаривания воды содовых озер относятся к 64 году нашей эры. Алхимикам всех стран вплоть до 18 века представлялась неким веществом, которое шипело с выделением какого-то газа при действии известных к тому времени кислот - уксусной и серной. Во времена римского врача Диоскорида Педания о составе соды никто не имел понятия. В 1736 году французский химик, врач и ботаник Анри Луи Дюамель де Монсо впервые смог получить из воды содовых озер очень чистую соду. Ему удалось установить, что сода содержит химический элемент «Натр». В России еще во времена Петра Первого соду называли «зодой» или «зудой» и вплоть до 1860 года ее ввозили из-за границы. В 1864 году в России появился первый содовый завод по технологии француза Леблана. Именно благодаря появлению своих заводов сода стала более доступной и начала свой победный путь в качестве химического, кулинарного и даже лекарственного средства.
Химические свойства
Гидрокарбонат натрия - кислая натриевая соль угольной кислоты.Молекулярная масса (по международным атомным массам 1971 г.) - 84,00.
Реакция с кислотами
Гидрокарбонат натрия реагирует с кислотами, с образованием соли и угольной кислоты, которая тут же распадается на углекислый газ и воду:
NaHCO3 + HCl → NaCl + H2CO3
H2CO3 → H2O + CO2↑
в кулинарии чаще встречается такая реакция с уксусной кислотой, с образованием ацетата натрия:
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
Сода хорошо растворяется в воде. Водный раствор питьевой соды имеет слабощелочную реакцию. Шипение соды - результат выделения углекислого газа CO2 в результате химических реакций.
Термическое разложение
При температуре 60° C гидрокарбонат натрия распадается на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200° C):
2NaHCO3 → Na2CO3 + H2O + CO2↑
При дальнейшем нагревании до 1000° C (например при тушении пожара порошковыми системами) полученный карбонат натрия распадается на углекислый газ и оксид натрия:
Na2CO3 → Na2O + CO2.
Физико-химические показатели
Бикарбонат натрия представляет собой кристаллический порошок белого цвета со средним размером кристал лов 0,05 - 0,20 мм. Молекулярная масса соединения равна 84,01, плотность составляет 2200 кг/м³, насыпная плотность - 0,9 г/см³. Теплота растворения бикарбоната натрия исчисляется 205 кДж (48,8 ккал) на 1 кг NaHCO3, теплоемкость достигает 1,05 кДж/кг•К(0,249 ккал/кг•°С).
Гидракарбонат натрия термически малоустойчив и при нагревании разлагается с образованием твердого карбоната натрия и выделением диоксида углерода, а также воды в газовую фазу:
2NaHCO3(тв.) ↔ Na2CO3(тв.) + CO2(г.) + H2O(пар) - 126 кДж (- 30 ккал)Аналогично разлагаются и водные растворы бикарбоната натрия:
2NaHCO3(р.) ↔ Na2CO3(р.) + CO2(г.) + H2O(пар) - 20,6 кДж (- 4,9 ккал) Водный раствор бикарбоната натрия имеет слабо выраженный щелочной характер, в связи с чем на животные и растительные ткани он не действует. Растворимость гидрокарбоната натрия в воде невелика и с повышением температуры она несколько повышается: с 6,87 г на 100 г воды при 0° С до 19,17 г на 100 г воды при 80° С.
Вследствие небольшой растворимости плотность насыщенных водных растворов бикарбоната натрия сравнительно мало отличается от плотности чистой воды.
Температура кипения (разлагается): 851° C;
Температура плавления: 270° C;
Плотность: 2,159 г/см³;
Растворимость в воде, г/100 мл при 20° C: 9.
Применение
Двууглекислый натрий (бикарбонат), применяется в химической, пищевой, легкой, медицинской, фармацевтической промышленности, цветной металлургии, поставляется в розничную торговлю.
Зарегистрирован в качестве пищевой добавки E500.
Широко примененяется в:
- химической промышленности - для производства красителей, пенопластов и других органических продуктов, фтористых реактивов, товаров бытовой химии, наполнителей в огнетушителях, для отделения двуокиси углерода, сероводорода из газовых смесей (газ поглощается в растворе гидрокарбоната при повышенном давлении и пониженной температуре, раствор восстанавливается при подогреве и пониженном давлении).
- легкой промышленности - в производстве подошвенных резин и искусственных кож, кожевенном производстве (дубление и нейтрализация кож).
- текстильной промышленности (отделка шелковых и хлопчатобумажных тканей). Применение бикарбоната натрия в производстве резиновых изделий также обусловлено выделением CO2 при нагревании, способствующем приданию резине необходимой пористой структуры.
- пищевой промышленности - хлебопечении, производстве кондитерских изделий, приготовлении напитков.
- медицинской промышленности - для приготовления инъекционных растворов, противотуберкулезных препаратов и антибиотиков.
- металлургии - при осаждении редкоземельных металлов и флотации руд.
Кулинария
Основное применение питьевой соды - кулинария, где она применяется, преимущественно, в качестве основного или дополнительного разрыхлителя при выпечке (так как при нагревании выделяет углекислый газ), изготовлении кондитерских изделий, производстве газированных напитков и искусственных минеральных вод, самостоятельно или в составе комплексных разрыхлителей (например, пекарского порошка, в смеси с карбонатом аммония), например, в бисквитном и песочном тесте. Это связано с легкостью ее разложения при 50-100° С.
Пищевая сода, применяемая преимущественно при изготовлении мелкого печенья, кондитерских крошек, листов для тортов и слоеных пирожков. В последнюю четверть XIX в. началось ее применение в кондитерском деле, вначале только во Франции и Германии и лишь в самом конце XIX века и в начале XX столетия - также в России.
Применение соды открыло путь к фабричному производству современного печенья - штамповочного. Вместе с тем многие старые виды печенья - бисквитные, слоеные, битые, пряничные, вздувные, меренги - отошли в область прошлого, исчезли не только из общественного, но и из домашнего обихода.
Сода - необходимый повседневный помощник на кухне для мытья посуды, тары для косервирования, некоторых плодов и ягод перед сушкой. Она обладает свойством нейтрализовать и убивать запахи.
Ошибочно думать, что сода - специя только для кондитерского дела. Помимо кондитерского производства, сода применяется также для приготовления английских мармеладов, в мясные фарши для блюд молдавской, румынской и узбекской кухни (калийная сода) и при приготовлении напитков. Количества соды, вносимые во все перечисленные изделия, крайне малы - от "на кончике ножа" до щепотки и четверти чайной ложки. В напитках с содой доля ее гораздо выше - по половине и полной чайной ложке на литр жидкости. Для кондитерских и других целей соду кладут по предписанию рецептов, обычно это очень малые дозы. Хранят ее в герметичной таре, берут сухим предметом.
Получение соды промышленным способом дало широкие возможности в приготовлении многих видов современной кондитерской продукции в европейских странах. Россия долгое время шла традиционным путем, предпочитая дрожжевое и другие виды теста.
В России совершенно не применяли до второй половины XIX века соду в хлебопечении и кондитерском деле. Да и в самом конце XIX века изделия такого рода производились более всего на Украине и в Польше, а также в Прибалтике. У русского населения, привыкшего испокон веков к натуральным видам теста - либо дрожжевого, заквасочного, либо медово-яичного, где в качестве подъемного средства не применялись искусственные химические вещества, а использовались естественно возникавшие при печении газы, в результате взаимодействия таких продуктов, как мед (сахар), яйца, сметана, алкоголь (водка) или винный уксус, - содовое печенье имело крайне низкую популярность и невысокий спрос.
Кондитерские изделия на соде считались «немецкими» и игнорировались как из чисто кулинарно-вкусовых, так и из «патриотических» соображений.
Кроме того, русские национальные кондитерские изделия - медовые пряники и коврижки, глазированные жемки и вареные в меду орешки - имели столь неповторимо превосходный вкус, что успешно конкурировали с западно-европейскими, более утонченными по форме, но «хлипкими» с точки зрения сытости, добротности и вкуса французскими бисквитами, где привлекательность достигалась вовсе не особым характером теста, а применением экзотических пряностей, в основном ванили.
Кроме кондитерских изделий, сода в русской кухне никогда не применялась и не применяется фактически до сих пор. Между тем в Прибалтике, Молдове, Румынии, на Балканах соду применяют как разрыхляющее средство в ряде блюд, приготавливаемых путем жарения. Так, соду вносят в разнообразные полутестяные жареные блюда: оладьи из картофеля, куда входит и пшеничная мука; разнообразные блинчики, сметанные лепешки и пышки, сырники, приготовленные из сочетания творога и муки, а также в мясные фарши, если они состоят только из мяса и лука, без добавления мучных компонентов (муки, белого хлеба, панировочных сухарей). Такой сырой мясной фарш (говяжий, свиной) оставляют с содовой добавкой на выстойку в холодильнике на несколько часов, а затем легко формуют из этого фарша «сосиски», которые быстро (за 10-15 минут) гриллируют в духовом шкафу любой домашней плиты (газовой, дровяной или электрической).
Аналогичное использование соды в мясные фарши известно и в армянской кухне, с той только разницей, что в таких случаях фарш не выстаивается, а подвергается сразу же интенсивному взбиванию с добавлением нескольких капель (5-8) коньяка, и превращается фактически в мясное суфле, используемое для приготовления различных национальных блюд (в основном калолаков).
В англоязычных странах Европы и Америки (Англии, Шотландии, на Восточном побережье США и в Канаде) соду применяют как непременную добавку в варенье из цитрусовых (апельсинов, пампельмозов, лимонов, грейпфрутов), а также для приготовления цукатов. В результате достигается особая развариваемость цитрусов, их жестких корок, превращение такого варенья в подобие густого мармелада, и одновременно снижается (но не исчезает совсем!) степень неприятной горечи, всегда присутствующей в кожуре цитрусовых плодов. Корки апельсинов, составляющих у нас своего рода балласт, отходы при употреблении этих фруктов, с помощью соды становятся ценным сырьем для получения ароматного, высокопитательного мармелада.
В среднеазиатских кухнях сода применяется при приготовлении некондитерских видов простого теста с целью придать ему особую эластичность и превратить в вытяжное тесто без применения для этого растительного масла, как это принято в южноевропейских, средиземноморских и балканских кухнях. В Средней Азии кусочки простого пресного теста после обычной получасовой выстойки смачивают небольшим количеством воды, в котором растворены 0,5 чайной ложки соли и 0,5 чайной ложки соды, а затем растягивают их руками в тончайшую лапшу (т. н. дунганская лапша), которая обладает нежным, приятным вкусом и идет на приготовление национальных блюд (лагмана, монпара, шимы и др.).
Соду в качестве мизерных добавок к любой пище в процессе приготовления, и именно во время тепловой обработки, добавляют во многих национальных кухнях, учитывая, что это дает в ряде случаев не только неожиданный вкусовой эффект, но и обычно очищает пищевое сырье и все блюдо от различных случайных побочных запахов и привкусов.
Вообще роль соды на кухне, даже помимо кулинарного процесса, - весьма значительна. Ведь без соды практически невозможна идеальная чистка столовой и кухонной эмалированной, фарфоровой, стеклянной и фаянсовой посуды, а также кухонного инструментария и оборудования от посторонних запахов и различных налетов и патины. Особенно незаменима и необходима сода при чистке чайной посуды - заварочных чайников и чашек от образующегося на их стенках чайного налета, пленки.
Столь же необходимо применение соды при мытье посуды, в которой приготавливалась рыба, чтобы отбить рыбный запах. Обычно поступают следующим образом: стойкий рыбный запах отбивают тем, что протирают посуду луком, а затем уничтожают (смывают) луковый запах, чистя эту посуду содой.
Словом, сода - непременный компонент кухонного производства, и на хорошей кухне без нее нельзя обойтись. Более того, ее отсутствие в арсенале повара или хозяйки немедленно становится заметным, ибо оно связывает того, кто работает у плиты или за разделочным столом, во многих его действиях.
Современные экологические обстоятельства вызвали еще одно новое применение соды на кухне как средства, повышающего качество овощного сырья. Можно, например, рекомендовать обмывать все обработанные, но еще не нарезанные овощи - перед их закладкой в котел или на сковородку - в растворе соды в воде. Или засыпать одной-двумя чайными ложками соды уже очищенный картофель, залитый холодной водой и предназначенный для отваривания или приготовления пюре. Это не только очистит картофель от химикатов, которые использовались при его выращивании, но и сделает сам продукт светлее, чище, красивее, снимет все побочные запахи, приобретенные при транспортировке или неправильном хранении, а также порче. Сам картофель станет после готовности рассыпчатым, вкусным. Таким образом, применение соды до приготовления, при холодной обработке (затем продукт тщательно промывается холодной водой), способно повысить качество овощного пищевого сырья, в частности у крахмалосодержащих овощей, у корнеплодов и листовых культур (капусты, салатов, шпината, петрушки и т. д.).
Сода столь прочно заняла место щелочного агента, что до сих пор ничем не удалось сдвинуть ее с этой позиции. Пищевая сода как разрыхлитель может действовать двояко. Во-первых, она разлагается при нагревании по реакции:
2NaHCO3 (сода) → Na2CO3 (соль) + H2O (вода) + CO2 (углекислый газ).
И в этом случае, если добавить в песочное тесто излишнее количество соды, за небольшое время выпечки она может не успеть термически разложиться без остатка и печенье или кекс получат неприятный «содовый» привкус.
Точно так же, как и поташ, сода реагирует с кислотами, содержащимися в тесте или добавленными туда искусственно:
NaHCO3 (сода) + R-COOH (кислота) → R-COONa (соль) + H2O (вода) + CO2 (углекислый газ)
Множество различных фирменных пакетиков и их доступность не отменяют развлечения для юных химиков - самостоятельно изготовить порошок для выпечки.
пропорциональный состав такого традиционного порошка:
2 части кислой виннокаменной соли,
1 часть пищевой соды,
1 часть крахмала или муки.
Медицина
Как выглядит сода, прекрасно знают все - это белый порошок, который впитывает воду и отлично в ней растворяется. Но мало кто знает об удивительных целебных свойствах этого «простого» вещества. Между тем, сода - гидрокарбонат натрия - один из главных ингредиентов нашей крови. Результаты исследования влияния соды на организм человека превзошли все ожидания. Оказалось, что сода способна выравнивать кислотно-щелочное равновесие в организме, восстанавливать обмен веществ в клетках, улучшать усвоение кислорода тканями, а также препятствовать потере жизненно необходимого калия. Помогает сода при изжоге, при морской болезни, при простудах, при сердечных заболеваниях и головных болях, при кожных заболеваниях. Как видите, сода - лекарство первой помощи.
Раствор питьевой соды используется в качестве слабого антисептика для полосканий, а также как традиционное кислотонейтрализующее средство от изжоги и болей в желудке (современная медицина не рекомендует применять из-за побочных эффектов, в том числе, из-за «кислотного рикошета») или для устранения ацидоза и т. п.
Пищевая сода применяется для лечения заболеваний, связанных с повышенной кислотностью; раствор питьевой соды применяется для полоскания горла, для промывания кожи при попадании кислот.
Бикарбонат натрия (пищевая сода) может замедлять развитие хронического заболевания почек. К такому выводу пришли ученые из Королевской клиники Лондона (Royal London Hospital), Великобритания. Они исследовали 134 человека с запущенным хроническим заболеванием почек и метаболическим ацидозом.
Одна группа испытуемых проходила обычное лечение, а вторая помимо традиционного лечения ежедневно получала небольшое количество пищевой соды в виде таблеток. У тех больных, кто пил бикарбонат натрия, функции почек ухудшались на 2/3 медленнее, чем у прочих.
Быстрое прогрессирование заболевания почек наблюдалось только у 9% подопытных из «содовой группы» против 45% испытуемых, лечившихся традиционно. Кроме того, у принимавших соду реже развивалась терминальная стадия почечной недостаточности, которая требует диализа. Примечательно, что повышение содержания бикарбоната натрия в организме не вызывало у больных повышения кровяного давления.
Cода является недорогим и эффективным средством лечения хронического заболевания почек. Однако исследователи предостерегают: прием соды должен проходить под наблюдением врача, который должен правильно рассчитать дозировку для больного.
Лечебные свойства пищевой соды
Раньше гидрокарбонат натрия применялся очень широко (как и другие щелочи) в качестве антацидного средства при повышенной кислотности желудочного сока, язвенной болезни желудка и 12-типерстной кишки. При приеме внутрь пищевая сода быстро нейтрализует соляную кислоту желудочного сока и оказывает выраженный антацидный эффект. Однако применение соды заключается не только в блестяще отмытой посуде и избавлении от изжоги. Пищевая сода занимает достойное место в домашней аптечке.
Как и древние египтяне, получавшие природную соду из озерных вод методом выпаривания, люди использовали и другие свойства соды. Она обладает нейтрализующими качествами, используется в медицинской практике для лечения гастритов с повышенной кислотностью. Способна убивать микробов, используется как дезинфицирующее средство: соду применяют для ингаляций, полосканий, очищения кожи.
Широкое применение сода имеет и в здравохранении.
Профилактика кариеса.
Кислоты, образующиеся во рту в результате жизнедеятельности бактерий, разрушают эмаль зубов. Эти кислоты можно нейтрализовать, несколько раз в день полоща рот раствором пищевой соды. Можно поступить иначе: смочите зубную щетку водой, опустите ее в соду и почистите зубы. Сода, кроме того, оказывает легкое абразивное действие: она отполирует зубы, не повреждая эмали.
От неприятного запаха ног.
Добавленная в воду для ножной ванны сода нейтрализует выделяемые бактериями кислоты, которые и придают ногам неприятный запах. Сода поможет также устранить резкий запах пота под мышками.
При укусах насекомых.
Не расчесывайте до крови укусы комаров и прочих кровососов. Лучше приготовьте кашеобразную смесь из воды и соды и нанесите на место укуса. Содовая кашица облегчит также зуд, вызванный ветряной оспой или контактом кожи с борщевиком, крапивой.
При опрелостях.
Содовые примочки значительно улучшают состояние малышей с опрелостями. Они уменьшают зуд и ускоряют заживление кожи.
При цистите.
Болезнетворные бактерии живут в мочевом пузыре в слегка кислой среде. Если ваш мочевой пузырь пал жертвой инфекции, идеальный послеобеденный напиток для вас - шипучий коктейль из пищевой соды с водой.
При солнечных ожогах.
Добавьте в теплую ванну немного пищевой соды: она смягчит воду, превратив ее в успокаивающую примочку для раздраженной кожи.
От боли в горле.
Размешайте 0,5 чайн. ложки соды в стакане воды и каждые 4 часа полощите горло приготовленным раствором: он нейтрализует кислоты, вызывающие боль. Полоскание таким раствором рта поможет снять и воспаление слизистой ротовой полости.
От неприятного запаха изо рта.
В сочетании с перекисью водорода пищевая сода дает мощный окислительный эффект и разрушает бактерии, порождающие неприятный запах во рту. Добавьте 1 стол. ложку соды в стакан раствора перекиси водорода (2-3%) и прополощите рот.
При простуде.
Полезно делать ингаляцию. Для этого можно взять небольшой чайник, вскипятить в нем 1 стакан воды с 1 чайн. ложкой соды. Сделать из твердой бумаги трубочку, надеть ее на носик чайника и вдыхать пар в течение 10-15 минут. Данная ингаляция очень помогает для отделения мокроты.
Для отхаркивания вязкой мокроты 2 раза в день выпивать натощак по 1/2 стакана теплой воды, в которой растворены 0,5 чайн. ложки соды и щепотка соли.
При частых мигренях.
Каждый день принимать раствор кипяченой воды с пищевой содой. В 1-й день за 30 минут до обеда выпивать 1 стакан раствора (0,5 чайн.ложки соды + вода), 2-й день - 2 стакана и т.д., доведя до 7 стаканов. После уменьшать дозу в обратном порядке.
Прочее.
При ринитах, стоматитах, ларингитах, конъюнктивитах применяют 0,5-2% раствор соды.
Для обеззараживания слизистой оболочки рта полезно полоскать рот некрепким раствором (сода - 85 г, соль - 85 г, мочевина - 2,5 г) после еды.
Средство от курения: полоскать рот раствором пищевой соды (1 столовая ложка на 200 мл воды).
При сухости кожи, сухих дерматитах, ихтиозе и псориазе полезны лечебные ванны (сода - 35 г, карбонат магнезии - 20 г, перборат магния - 15 г). Температура воды должна быть не выше 38-39° С, сначала нужно садиться просто в теплую ванну, потом постепенно увеличивать температуру. Длительность ванны 15 минут.
Пожаротушение
Гидрокарбонат натрия входит в состав порошка, применяемого в порошковых системах пожаротушения, утилизируя тепло и оттесняя кислород от очага горения выделяемым углекислым газом.
Очистка оборудования. Технология абразиво-струйной очистки (АСО)
Производится очистка оборудования и поверхностей от различных покрытий и загрязнений с применением технологии абразиво-струйной очистки (АСО) оборудования. В качестве абразива используется бикарбонат натрия (пищевая сода, двууглекислый натрий, гидрокарбонат натрия, NaHCO3, кислый углекислый натрий).
Технология АСО с применением бикарбоната натрия - это новый эффективный способ очистки оборудования с помощью «мягкого» абразива. Абразив приведен в движение сжатым воздухом, производимым компрессором. Этот способ получил коммерческое признание и широко используется в Европе и США уже в течение 25 лет благодаря своей универсальности и экономической целесообразности.
Обработка поверхности оборудования подобна обычной пескоструйной очистке. Различие заключается в том, что частицы соды являются «мягким» абразивным материалом, то есть не повреждают саму поверхность.
Принцип:
Хрупкая частица кислого углекислого натрия при соприкосновении с очищаемой поверхностью взрывается.
Энергия, выпущенная этой вспышкой, и удаляет загрязнение от очищаемой поверхности. Абразивные частицы соды полностью разбиваются в тонкую пыль, которая легко разлетается в разные стороны перпендикулярно падению, увеличивая очистительный эффект. В целях пылеподавления содо-струйная очистка оборудования обычно выполняется с применением увлажнения, то есть гидро-абразиво-струйной очистки (ГАСО) оборудования. Углекислый натрий растворяется в воде. Поэтому использованный абразив будет растворен или может смываться после окончания чистки.
Это отличие от кварцевого песка, который срезает покрытие. Кварцевый песок также еще стирает часть очищаемой поверхности, которую сода оставляет фактически невредимой. Существует еще много различий между этими видами очистки оборудования, но они являются уже следствием свойств абразивов.
Растворимые абразивы на основе бикарбоната натрия специально разработаны для абразиво-струйной очистки оборудования. Сыпучие качества абразивов уменьшают плотность потока, связанную с плохой текучестью обычного углекислого натрия.
Гидрокарбонат натрия — Википедия
Гидрокарбонат натрия NaHCO3 (другие названия: питьевая сода, пищевая сода, бикарбонат натрия, натрий двууглекислый) — кислая соль угольной кислоты и натрия. Обыкновенно представляет собой мелкокристаллический порошок белого цвета. Используется в пищевой промышленности, в кулинарии, в медицине как нейтрализатор ожогов кожи и слизистых оболочек человека кислотами и снижения кислотности желудочного сока. Также — в буферных растворах, так как в широком диапазоне концентраций растворов его pH незначительно изменяется.
Двууглекислый натрий нетоксичен, пожаро- и взрывобезопасен.
Представляет собой мелкокристаллический порошок солоноватого (мыльного) вкуса, который при попадании на слизистые оболочки вызывает раздражение. При постоянной работе в атмосфере, загрязненной пылью двууглекислого натрия, может возникнуть раздражение дыхательных путей[1].
Химические свойства[править]
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты.
Молекулярная масса (по международным атомным массам 1971 г.) — 84,00[1].
Реакция с кислотами[править]
Гидрокарбонат натрия реагирует с кислотами с образованием соли и угольной кислоты, которая тут же распадается на углекислый газ и воду:
В быту чаще встречается такая реакция с уксусной кислотой, с образованием ацетата натрия:
Термическое разложение[править]
При температуре 60 °C гидрокарбонат натрия распадается на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200 °C):
В ходе испарения водяного пара и углекислого газа, масса продукта уменьшается примерно на 37%.
В промышленности гидрокарбонат натрия получают аммиачно-хлоридным способом[2]. В концентрированный раствор хлорида натрия, насыщенный аммиаком, под давлением пропускают углекислый газ. В процессе синтеза происходят две реакции:
В холодной воде гидрокарбонат натрия мало растворим, и его можно отделить от остального раствора фильтрованием, а из полученного раствора хлорида аммония снова получают аммиак, возвращаемый в производство вновь:
Двууглекислый натрий (бикарбонат), применяется в химической, пищевой, легкой, медицинской, фармацевтической промышленности, цветной металлургии, поставляется в розничную торговлю.
Зарегистрирован в качестве пищевой добавки E500.
Применение:
- в химической промышленности — для производства красителей, пенопластов и других органических продуктов, фтористых реактивов, товаров бытовой химии, наполнителей в огнетушителях, для отделения диоксида углерода, сероводорода из газовых смесей (газ поглощается в растворе гидрокарбоната при повышенном давлении и пониженной температуре, раствор восстанавливается при подогреве и пониженном давлении).
- в легкой промышленности — в производстве подошвенных резин и искусственных кож, кожевенном производстве (дубление и нейтрализация кож), текстильной промышленности (отделка шелковых и хлопчатобумажных тканей).
- в пищевой промышленности — хлебопечении, производстве кондитерских изделий, приготовлении напитков.

Кулинария[править]
Основное применение пищевой соды — кулинария, где она применяется, преимущественно, в качестве основного или дополнительного разрыхлителя при выпечке (так как при нагревании выделяет углекислый газ), самостоятельно или в составе комплексных разрыхлителей (например, пекарского порошка, вместе с карбонатом аммония) и в готовых смесях для выпечки (кексы, торты и пр.). При применении соды в чистом виде важно соблюсти правильную дозировку, так как она оставляет в продукте не безвкусный карбонат натрия. Порядок замешивания для теста: соду — в муку, кислые компоненты (уксус, кефир и пр.) — в жидкость.
Медицина[править]
Раствор питьевой соды используется в качестве слабого антисептика[источник не указан 2232 дня] для полосканий, а также как традиционное кислотонейтрализующее средство от изжоги и болей в желудке (современная медицина не рекомендует применять из-за побочных эффектов, в том числе, из-за «кислотного рикошета»). Коррекция метаболического ацидоза в условиях реанимации.
В альтернативной медицине питьевая сода иногда позиционируется в качестве «лекарства» от рака, однако никаких научных обоснований и доказательств эффективности такого «лечения» не существует.[3]
Пожаротушение[править]
Гидрокарбонат натрия входит в состав порошка, применяемого в порошковых системах пожаротушения, утилизируя тепло и оттесняя кислород от очага горения выделяемым углекислым газом.
В Российской Федерации производят соду по ГОСТ 2156-76 «Натрий двууглекислый. Технические условия» на предприятии «Сода» (г. Стерлитамак, Республика Башкортостан), а также на Публичном акционерном обществе «Крымский содовый завод» (г. Красноперекопск, Республика Крым).
Натрия гидрокарбонат хранят в закрытых упаковках, в сухом месте вдали от источников огня. Гарантийный срок хранения натрия двууглекислого — 12 месяцев со дня изготовления. Срок годности не ограничен.
| B05A |
| ||
|---|---|---|---|
| B05B |
| ||
| B05C |
| ||
| B05D | |||
| B05X |
| ||
| B05Z |
|
|
Алф. указатель: 1-9 A-Z А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Щ Э Я
Синонимы:
сода питьевая
Внешний вид:
бесцветн. моноклинные кристаллыБрутто-формула (система Хилла): CHNaO3Формула в виде текста: NaHCO3Молекулярная масса (в а.е.м.): 84,01Температура разложения (в °C): 50Продукты термического разложения:натрия карбонат, углерода (IV) оксид, водаРастворимость (в г/100 г или характеристика):вода: 6,9 (0°C)вода: 8,2 (10°C) вода: 9,6 (20°C) вода: 10,4 (25°C) вода: 11,1 (30°C) вода: 12,7 (40°C) вода: 16,4 (60°C) вода: 20,2 (80°C) вода: 24,3 (100°C) глицерин: 7,9 (20°C) этанол: 1,2 (15,5°C) Плотность:2,16 (20°C, г/см3)Стандартная энтальпия образования ΔH (298 К, кДж/моль):-947,7 (т)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):-851,9 (т)Стандартная энтропия образования S (298 К, Дж/моль·K):102 (т)Стандартная мольная теплоемкость Cp (298 К, Дж/моль·K):87,61 (т)
Источники информации:Алф. указатель: 1-9 A-Z А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Щ Э Я Еще по теме: |

|
Гидрокарбонат натрия | Info-Farm.RU
Бикарбонат натрия или натрий гидрокарбонат — химическое соединение с формулой NaHCO 3. Бикарбонат натрия — белое твердое вещество. Имеет слегка соленый щелочной вкус, напоминающий вкус стиральной соды (карбонат натрия). Естественная форма — минерал нахколит. Бикарбонат натрия является одним из компонентов минерального соды и находится во многих минеральных источниках. Он находится в растворенном виде в желчи, где он служит для нейтрализации кислотности соляной кислоты, которая производится в желудке и выводится в двенадцатиперстную кишку тонкого кишечника. Это вещество известно с давних времен и широко используется. В разговорной речи, ее называют питьевая сода.
История
Древние египтяне использовали природные месторождения соды, смесь, состоящую главным образом из карбоната натрия, бикарбоната декагидрат, и натрия. Сода использовалась в качестве средства для чистки, как мыло. Широко используется с 1800-х годов в коммерческом рыболовстве, чтобы предотвратить порчу свеже-пойманной рыбы.
Производство
NaHCO 3 в основном производится реакцией хлорида натрия, аммиака и углекислого газа в воде. Карбонат кальция используется как источник CO 2 и, как следствие оксида кальция. Используется для восстановления аммиака из хлористого аммония. Производство около 100.000 тонн / год (по состоянию на 2001 г.).
NaHCO 3 может быть получен в результате реакции углекислого газа с водным раствором с гидроксидом натрия Первичная реакция производит карбонат натрия:
- СО 2 + 2NaOH → Na 2 CO 3 + H 2 O
Дальнейшее добавление двуокиси углерода образует бикарбонат натрия, который при достаточно высокой концентрации будет оседать:
- Na 2 CO 3 + СО 2 + H 2 O → 2NaHCO 3
Добыча
Природные месторождения нахколину (NaHCO 3) найдены в пластах эоцена (55.8-33.9 млн лет) в Колорадо. Нахколин наносился как осадок в периоды высокого испарения в водоеме. Сода коммерчески добываемого растворением нахколину в горячей воде и восстанавливается естественным процессом кристаллизации при охлаждении.
Химические свойства
Бикарбонат натрия — амфотерна соединение. Водные растворы имеют слабощелочной свойства в связи с образованием углекислоты и гидроксид-иона. Реакция бикарбоната натрия и кислоты образует соли и углекислоту, которая легко разлагается на углекислый газ и воду:
- NaHCO 3 + HCl → NaCl + H 2 CO 3
- H 2 CO 3 → H 2 O + CO 2
Бикарбонат натрия вступает в реакцию с уксусной кислотой, с образованием ацетата натрия, воды и углекислого газа:
- NaHCO 3 + СН 3 COOH → CH 3 COONa + H 2 O + CO 2
Бикарбонат натрия вступает в реакцию с основами, такими как гидроксид натрия с образованием карбонатов:
- NaHCO 3 + NaOH → Na 2 CO 3 + H 2 O
Бикарбонат натрия вступает в реакцию с карбоксильной группой белков, по созданию СО2. Эта реакция используется для проверки наличия карбоксильных групп.
Термическое разложение
Выше 70 ° С, бикарбонат натрия постепенно распадается на карбонат натрия, воду и углекислый газ. Разложение при температуре 200 ° C:
- 2NaHCO 3 → Na 2 CO 3 + H 2 O + CO 2
Большинство бикарбонатов вступает в реакцию дегидратации. При дальнейшем нагревании превращается в оксид натрия (при температуре около 1000 ° С.):
- Na 2 CO 3 → Na 2 O + CO 2
Эти преобразования используются при использования NaHCO 3 в пожаротушения («BC порошок») как порошкообразный огнетушитель.
Применение
Кухня
Бикарбонат натрия преимущественно используется в кулинарии для выпечки, в качестве разрыхлителя. Он вступает в реакцию с кислыми компонентами жидкого теста, выпуская углекислый газ, который вызывает расширение теста и формирует характерные текстуры в блинах, пирогах, хлебе и другие хлебобулочных изделиях. Многие виды выпечки содержат бикарбонат натрия в сочетании с одним или несколькими кислыми фосфатами (которые особенно хорошо вступают в реакцию).
Бикарбонат натрия иногда используется в приготовлении овощей, чтобы размягчить их, хотя это вышло из моды, так как большинство людей теперь предпочитают свежие, так как они содержат больше питательных веществ. И все же, все еще используется в азиатской кухне, чтобы розмякшиты мясо. Бикарбонат натрия может реагировать с кислотами в продуктах питания, в том числе с витамином С (L-аскорбиновая кислота).
Термическое разложение бикарбоната натрия действует как разрыхлитель, выпуская углекислый газ при высоких температурах. Образование углекислого газа начинается при температуре выше 80 ° C.
Нейтрализация кислот и оснований
Многие лаборатории держат бикарбонат натрия под рукой, поскольку он проявляет амфотерные свойства, реагируя с кислотами и основаниями. Кроме того, он относительно безвреден в большом количестве, следовательно, нет ничего плохого в использовании избытка бикарбоната натрия. Широкий спектр его использования вызванный его нейтрализующими свойствами, в частности для сокращения распространения белого фосфора с зажигательными пулями внутри раны, для повышения pH воды (увеличение общей щелочности), где содержатся высокие концентрации хлора (2-5 промилле) в плавательных бассейнах и аквариумах.
Медицинское применение
Как лечебное средство соду применяют:
- для смягчения кашля: сода способствует разжижению мокроты;
- в виде полосканий при боли в горле как бактерицидное и противовоспалительное средство;
- при внезапном нападении аритмии (слабый раствор соды поможет успокоить сердцебиение)
- при гипертонии (выводит жидкость из организма, тем самым помогая снизить артериальное давление)
- для пополнения потерянной жидкости организмом: при поносах, рвоте;
- для снятия зуда при укусах насекомых;
- для чистки кишечника (клизмы с раствором соды)
- при простуде (ингаляции содовым раствором)
- при конъюнктивитах (промывают глаза слабым раствором соды)
- при лечении грибковых заболеваний ног (примочки из слабого раствора соды)
- для очистки и отбеливания зубов;
- для размягчения ороговевшей кожи на локтях и ступнях ног (теплые ванночки с содой)
- при изжоге (как препарат, активно нейтрализует соляную кислоту в желудке).
Бикарбонат натрия может быть использован в первой медицинской помощи, при лечении ожогов, для предотвращения образования пузырей и рубцов. Это связано с эндотермическим реакцией, которая происходит между бикарбонатом натрия и водой. Натрий бикарбонат обладает антисептическими свойствами. Он используется также для лечения гиперкалиемии. Так как бикарбонат натрия может привести к алкалоза, его иногда используют для лечения передозировки аспирина. Аспирина нужно кислую среду для надлежащего поглощения и щелочная среда предотвращает поглощению в случае передозировки. Бикарбонат натрия также используется в лечении передозировки антидепрессантами. Он может также применяться местно в виде пасты, чтобы уменьшить укусы насекомых.
Личная гигиена
Бикарбонат натрия может быть использован как эксфолиант. Его частицы округлой и тонкой текстуры идеально подходят для пилинга. Сода как отшелушивающий скраб удаляет бесцветные клетки кожи, пострадавших от гиперпигментации и рубцов.
Бикарбонат натрия также используется в качестве ингредиента в жидкостях для полоскания рта. Он работает как механический очиститель для на зубов и десен, нейтрализует производство кислоты во рту, а также в качестве антисептика, чтобы предотвратить заражение инфекциями.
Паста, произведенная из бикарбоната натрия и 3% перекиси водорода, может быть использована в качестве альтернативы пастам без фтору.Паста с бикарбонатом натрия в сочетании с другими ингредиентами может быть использована в качестве сухого или влажного дезодоранта. Сода может быть использована и как шампунь.
Пищевая сода в спорте
Небольшие количества бикарбоната натрия полезны в качестве добавки для спортсменов в скоростно-событий на основе, как и средние дистанции бега, продолжительностью от одной до семи минут. Но передозировки представляет серьезную опасность, поскольку бикарбонат натрия слаботоксичный. Кроме того, такая практика приводит к значительному увеличению натрия в рационе.
Как очищающее средство
Паста из соды может быть очень эффективной в уборке и очищены. Для очистки алюминиевых объектов, использование бикарбоната натрия не рекомендуется, поскольку он уничтожает тонкий защитный инертный слой оксида и делает этот металл очень реактивным. Разведение в теплой воде может удалить пятна из серебра.
Соду обычно добавляют при стирке в качестве смягчения, а также для удаления запахов с одежды. Бикарбонат натрия также эффективен в удалении пятен от чая и кофе в чашках при разведении с теплой водой.
Как биопестицидов
Бикарбонат натрия может быть эффективным способом контроля роста грибка, и в Соединенных Штатах зарегистрирован как биопестицидов.
Разное
Бикарбонат натрия может быть использован для тушения небольших пожаров которые были вызывании возгоранием жира или возгоранием электричества. Тем не менее, он не может быть использован при пожарах глубоких фритюрниц, это может привести к разбрызгивания масла.
Его можно вводить в бассейны, спа, и садовые пруды для поднятия рН уровня. Он слаб дезинфицирующее средство, и может быть эффективным фунгицидом против некоторых организмов.
Так как он действует в качестве нейтрализующего агента, то он может быть использован для поглощения запахов, вызванных сильными кислотами. Это его свойство используется для поглощения запаха в старых книгах.
Производство в Украине
Единственным производителем пищевой соды в Украине до 2010 года был Лисичанский содовый завод. В этом же году производство заводе остановилось в связи с банкротством. Начиная с 2013 года основным производителем пищевой соды в стране становится Крымский содовый завод.
ПАО «Крымский содовый завод» занимает около 80% украинского рынка кальцинированной соды и более 2% мирового. В 2013 году завод выпустил 582 тыс. Тонн соды кальцинированной, в том числе сода марки «А» — 427,5 тыс. Тонн, 24,4 тыс. Тонн пищевой соли, а также более 4 тыс. Тонн пищевой соды. С 2004 года «Крымский содовый завод» входит в международную группу компаний Group DF.