Молярная масса кальций
Карбонат кальция — Википедия
Карбона́т ка́льция (углеки́слый кальций) — неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула CaCO3{\displaystyle {\mathsf {CaCO_{3}}}}.
В природе встречается в виде многочисленных минералов, например, кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора, мела, входит в состав скорлупы яиц птиц.
Нерастворим в воде и этаноле.
Зарегистрирован как белый пищевой краситель (E170).
Используется как белый пищевой краситель Е170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование[править | править код]
Таблетки из карбоната кальцияОчищенный от примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, в качестве наполнителя при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве.
При производстве бумаги карбонат кальция применяют одновременно в качестве отбеливателя, наполнителя, а также раскислителя.
Используется при производстве силикатного стекла, — материала для производства оконного стекла, стеклянных бутылок, стекловолокна.
Применяется при производстве предметов гигиены (например, зубной пасты), в медицине.
В пищевой промышленности часто используется в качестве препарата препятствующего слеживанию и для препятствования слипания в комки сухих молочных продуктах.
При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей[источник не указан 475 дней].
Производители пластмассы — одни из основных потребителей чистого карбоната кальция (более 50% всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т.п. Карбонат кальция составляет порядка 20% красящего пигмента, используемого при производстве красок[источник не указан 475 дней ].
В строительстве[править | править код]
Строительство — ещё один из основных потребителей карбоната кальция. Например, в качестве наполнителя шпаклёвок и герметиков.
Также карбонат кальция является важным составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция широко применяется для раскисления кислых почв.
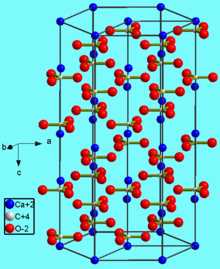
Карбонат кальция находится в минералах в виде полиморфов:
Тригональная кристаллическая структура кальцита является наиболее распространенной.
Минералы карбоната кальция находятся в следующих горных породах:
Залежи карбоната кальция в виде меловых пластов — отложений известковых раковин моллюсков, в основном, мелового периода является распространенным минералом на всех континентах.
В природе встречаются три кристаллические модификации (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит, арагонит и фатерит (ватерит).
Некоторые горные породы (известняк, мел, мрамор, травертин и другие известковые туфы) практически полностью состоят из карбоната кальция с различными примесями.
Кальцит является устойчивой кристаллической модификацией карбоната кальция и встречается в самых разнообразных геологических условиях: в осадочных, метаморфических и магматических горных породах.
Около 10 % всех осадочных пород составляют известняки, сложенные преимущественно кальцитовыми остатками раковин морских организмов. Арагонит является второй по распространённости кристаллической модификацией CaCO3 и в основном формируется в раковинах моллюсков и скелетах некоторых других организмов[каких?].
Также арагонит может образовываться и в неорганических процессах, например в карстовых пещерах или гидротермальных источниках.
Фатерит является наименее стабильной разновидностью этого карбоната, и очень быстро превращается в воде либо в кальцит, либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями.
Подавляющее количество карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из природного минерала с малым количеством вредных примесей, например, из мрамора.
В лаборатории карбонат кальция может быть приготовлен предварительным гашением оксида кальция — негашеной извести. При этом образуется гидроксид кальция, и затем в суспензию продувается углекислый газ для получения карбоната кальция[2]:
- CaO+h3O⟶Ca(OH)2,{\displaystyle {\mathsf {CaO+H_{2}O\longrightarrow Ca(OH)_{2}}},}
- Ca(OH)2+CO2⟶CaCO3+h3O.{\displaystyle {\mathsf {Ca(OH)_{2}+CO_{2}\longrightarrow CaCO_{3}+H_{2}O}}.}
При нагревании до 900—1000 °C разлагается на кислотный оксид — углекислый газ CO2 и основный оксид — негашёную известь CaO:
- CaCO3⟶CaO+CO2↑.{\displaystyle {\mathsf {CaCO_{3}\longrightarrow CaO+CO_{2}\uparrow }}.}
Растворяется в воде при избытке углекислого газа образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2:
- CaCO3+CO2+h3O⟶Ca(HCO3)2.{\displaystyle {\mathsf {CaCO_{3}+CO_{2}+H_{2}O\longrightarrow Ca(HCO_{3})_{2}}}.}.
Из-за этой реакции образуются сталактиты, сталагмиты. Природные подземные воды, обильные углекислом газом, растворяют плохо растворимый карбонат кальция с образованием много лучше растворимого в воде гидрокарбоната кальция, при выделении подземной воды в виде капель с потолков пещер при попадании в воздух с низкой концентрацией углекислого газа происходит обратная реакция превращения гидрокарбоната кальция в плохо растворимый осадок карбоната кальция, образующего красивые природные формы в пещерах, и из-за этого же механизма образуются карстовые пещеры.
При обжиге с температурой свыше 1500 °C с углеродом, например, в форме кокса, образует карбид кальция и угарный газ:
- CaCO3+4C⟶CaC2+3CO↑{\displaystyle {\mathsf {CaCO_{3}+4C\longrightarrow CaC_{2}+3CO\uparrow }}}.
Сульфат кальция — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 11 августа 2013; проверки требуют 25 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 11 августа 2013; проверки требуют 25 правок.| Сульфат кальция | |
|---|---|
 ( ({{{изображение}}}) | |
| Систематическое наименование | Сульфат кальция |
| Традиционные названия | кальций сернокислый, "ангидрит" |
| Хим. формула | CaSO4 |
| Состояние | кристаллическое |
| Молярная масса | 136,1406 г/моль |
| Плотность | 2,96 г/см³ |
| Температура | |
| • плавления | 1450°C (с частичным разложением) |
| • разложения | 1560°C |
| Мол. теплоёмк. | 99.660 Дж/(моль·К) |
| Энтальпия | |
| • образования | −1434,5 кДж/моль |
| Удельная теплота плавления | 28 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст.[1] |
| Растворимость | |
| • в воде | 0,2036 г/100 мл воды |
| Рег. номер CAS | 7778-18-9 |
| PubChem | 24497 |
| Рег. номер EINECS | 231-900-3 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E516 |
| RTECS | WS6920000 |
| ChEBI | 31346 |
| ChemSpider | 22905 |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Сульфа́т ка́льция (CaSO4) — неорганическое соединение, кальциевая соль серной кислоты.
Находится в природе в виде дигидрата CaSO4•2H2O (гипс, селенит) и в безводном состоянии — ангидрит.
Кристаллическая структура гамма-сульфата кальцияБезводный сульфат кальция — бесцветные кристаллы при нормальных условиях — с ромбической кристаллической решёткой, плотность 2,96 г/см³, температура плавления 1450 °C. При повышенных температурах (свыше 1200 °C) может существовать в виде стабильной кубической модификации или двух метастабильных α- и β-гексагональных модификаций. Очень медленно присоединяет воду, гидратируясь до кристаллогидрата с 1/2 или 2 молекулами воды на 1 молекулу сульфата, соответственно CaSO4 · 0,5H2О и CaSO4 · 2H2О. В воде растворим незначительно. Растворимость падает с повышением температуры: если при 20 °C она составляет 0,2036 г/100 г воды, то вблизи точки кипения воды (100 °C) снижается до 0,067 г сульфата на 100 г воды. Растворённый в природной воде сульфат кальция является одним из факторов, определяющих жёсткость воды.
Физические свойства двуводного сульфата кальция[править | править код]
При повышении температуры, но не более чем до 180 °C двуводный сульфат кальция теряет часть воды, переходя в полуводный — так называемый «жжёный гипс», пригодный для дальнейшего применения как вяжущее вещество. При дальнейшем нагреве до 220 °C гипс полностью теряет воду, образуя безводный CaSO4, который лишь при длительном хранении поглощает влагу и переходит в полугидрат. Если обжиг вести при температуре выше 220 °C, то получается безводный CaSO4, который влагу уже не поглощает и не «схватывается» при смешивании с водой (это вещество нередко называют «мёртвый гипс»). При дальнейшем нагревании до 900—1200 °C можно получить «гидравлический гипс», который после охлаждения вновь обретает свойства связываться с водой. Первый способ частичной дегидратиции применяют в промышленных условиях для получения полугидрата сульфата кальция (жжёного гипса, алебастра) CaSO4 ∙ 0,5H2O, нагревая дигидрат примерно до 140 °C, уравнение реакции: CaSO4 · 2H2О = CaSO4 · 0,5H2О + 1,5H2О.
В индустриальных масштабах добывают в составе природных минералов, например гипса, селенита или алебастра или получают синтетическим путём — сплавлением CaCl2 с K2SO4.
Может быть получен действием серной кислоты на оксид, гидроксид, карбонат, оксалат или ацетат кальция. Образуется в результате окисления сульфида кальция при нагреве до 700—800 °C по реакции CaS + 2O2 = CaSO4.
Значительные объёмы алебастра используются в строительстве (из него изготавливают сухую штукатурку, плиты и панели для перегородок, гипсовые камни, архитектурные детали и др.). Изделия из гипса характеризуются сравнительно небольшой плотностью, несгораемостью и относительно невысокой теплопроводностью. Свойство алебастра затвердевать при смешении с водой нашло применение и в медицине, и в искусстве. «Это свойство гипса широко используют в ортопедии, травматологии и хирургии для изготовления гипсовых повязок, обеспечивающих фиксацию отдельных частей тела. Отвердевание замешанного с водой гипса сопровождается небольшим увеличением объёма. Это позволяет проводить тонкое воспроизведение всех деталей лепной формы, что широко используют скульпторы и архитекторы.» [2].
Безводный сульфат кальция в силу своих гигроскопичных свойств применяется как влагопоглотитель. Нередко с помощью специальных добавок ему в этом качестве придают дополнительные свойства. Так, осушитель Drierite, состоящий из ангидрата с добавкой хлорида кобальта, меняет свою изначально голубую окраску на розовую, что позволяет своевременно отследить момент исчерпания ресурса препарата.
Искусственные кристаллы сульфата кальция, легированные марганцем или самарием, применяются как термолюминесцентный материал.
Также находит применение в пиротехнике в качестве окислителя в осветительных составах, в смеси с алюминием или магнием в отношении гипс алюминий 1:1~2 в зависимости от требований. Используется как в порошкообразном так и в отверженном состоянии.
Сульфат кальция может применяться в качестве коагулянта, например, при изготовлении тофу.
В пищевой промышленности зарегистрирован в качестве пищевой добавки эмульгатора E516.
Регистрационный номер CAS:
- безводный 7778-18-9 [3];
- семигидрат 10034-76-1 [4];
- дигидрат 10101-41-4 [5].
Фторид кальция — Википедия
| Фторид кальция | |||
|---|---|---|---|
({{{картинка3D}}}) | |||
({{{изображение}}})
| |||
| Систематическое наименование | Фторид кальция | ||
| Традиционные названия | Фтористый кальций, кальция дифторид, плавиковый шпат, флюорит | ||
| Хим. формула | CaF2 | ||
| Рац. формула | CaF2 | ||
| Состояние | белое кристаллическое вещество (монокристаллы являются прозрачными) | ||
| Молярная масса | 78,07 г/моль | ||
| Плотность | 3,18 г/см³ | ||
| Температура | |||
| • плавления | 1418 °C | ||
| • кипения | 2533 °C | ||
| • вспышки | негорюч °C | ||
| Мол. теплоёмк. | 67,03 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | -1221 кДж/моль | ||
| Удельная теплота плавления | 30 Дж/кг | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 1 | ||
| Растворимость | |||
| • в воде | (18 °C) 0,0015 г/100мл (20 °C) 0,0016 г/100 мл | ||
| • в ацетоне | нерастворим | ||
| Показатель преломления | 1,4328 | ||
| Кристаллическая структура | кубическая кристаллическая структура | ||
| Рег. номер CAS | 7789-75-5 | ||
| PubChem | 24617 | ||
| Рег. номер EINECS | 232-188-7 | ||
| SMILES | |||
| InChI | |||
| RTECS | EW1760000 | ||
| ChEBI | 35437 | ||
| ChemSpider | 23019 | ||
| ЛД50 | (перорально, крысы) 4250 мг/кг | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
Фторид кальция — неорганическое бинарное ионное химическое соединение. Химическая формула CaF2.
Бесцветные диамагнитные кристаллы (в измельчённом состоянии — белые). До температуры 1151 °C существует α-CaF2 с кубической решеткой (а = 0,54626 нм, z=4, пространственная группа Fm3m), выше 1151 °C — разупорядоченная модификация тетрагональной сингонии, температура плавления у этой модификации — 1418 °C.
Плохо растворим в воде (16 мг/л при 18 °C).
В природе CaF2 встречается в виде минерала флюорита (плавиковый шпат), который содержит до 90-95 % CaF2 и 3,5-8 % SiO2. Это хрупкий и мягкий минерал с большой вариацией в цвете: бесцветный, белый, жёлтый, оранжевый, красный, бурый, зелёный, зеленовато-голубой, фиолетово-синий, серый, пурпурный, синевато-чёрный, розовый и малиновый. Окраска связана с примесями хлора, железа, урана, дефектами кристаллической структуры, которая весьма тонко реагирует на нагревание. Является основным источником фтора в мире. Мировое производство ~4,5 млн т/год (1983 год).
В лабораторных условиях фторид кальция обычно получают из карбоната кальция и плавиковой кислоты:
- CaCO3+2HF→CaF2↓+CO2↑+h3O{\displaystyle {\mathsf {CaCO_{3}+2HF{\xrightarrow {}}CaF_{2}\downarrow +CO_{2}\uparrow +H_{2}O}}}
Чисто теоретический интерес представляет способ получения непосредственно из простых веществ:
- Ca+F2→CaF2{\displaystyle {\mathsf {Ca+F_{2}{\xrightarrow {}}CaF_{2}}}}
Разбавленная плавиковая кислота взаимодействует с оксидом кальция:
- CaO+2HF→CaF2↓+h3O{\displaystyle {\mathsf {CaO+2HF{\xrightarrow {}}CaF_{2}\downarrow +H_{2}O}}}
Фторид кальция можно получить обменными реакциями, например:
- CaCl2+2Nh5F→CaF2↓+2Nh5Cl{\displaystyle {\mathsf {CaCl_{2}+2NH_{4}F{\xrightarrow {}}CaF_{2}\downarrow +2NH_{4}Cl}}}
Фторид кальция химически относительно пассивен. При высокой температуре подвергается гидролизу:
- CaF2+h3O→800oCCaO+2HF{\displaystyle {\mathsf {CaF_{2}+H_{2}O{\xrightarrow {800^{o}C}}CaO+2HF}}}
- CaF2+h3O+SiO2→1450oCCaSiO3+2HF{\displaystyle {\mathsf {CaF_{2}+H_{2}O+SiO_{2}{\xrightarrow {1450^{o}C}}CaSiO_{3}+2HF}}}
Разлагается концентрированной серной кислотой, что используется в промышлености для получения HF:
- CaF2+h3SO4→130−200oCCaSO4+2HF↑{\displaystyle {\mathsf {CaF_{2}+H_{2}SO_{4}{\xrightarrow {130-200^{o}C}}CaSO_{4}+2HF\uparrow }}}
При избытке HF образует сложный кристаллогидрат:
- CaF2+2HF+6h3O→Ca(HF2)2⋅6h3O↓{\displaystyle {\mathsf {CaF_{2}+2HF+6H_{2}O{\xrightarrow {}}Ca(HF_{2})_{2}\cdot 6H_{2}O\downarrow }}}
При температуре в 600—700 °C фторид лития реагирует с оксидом кальция, давая на выходе оксид лития и фторид кальция:
- 2LiF+CaO→600−700oCCaF2+Li2O{\displaystyle {\mathsf {2LiF+CaO{\xrightarrow {600-700^{o}C}}CaF_{2}+Li_{2}O}}}
Фторид лития с насыщенным раствором гидроксида кальция реагирует образовывая гидроксид лития и фторид кальция:
- 2LiF+Ca(OH)2→CaF2+2LiOH{\displaystyle {\mathsf {2LiF+Ca(OH)_{2}{\xrightarrow {}}CaF_{2}+2LiOH}}}
Фторид кальция является основным источником фтора и его соединений. Начиная с конца 1990-х годов добывалось ~5 млн тонн данного вещества в год.
Фторид кальция является компонентом металлургических флюсов, специальных стекол, эмалей, керамики, оптических и лазерных материалов. Он также используется в качестве флюса при плавке и переработке жидких чугуна и стали.
В лаборатории фторид кальция широко применяется в качестве оптического материала для инфракрасного и ультрафиолетового излучений, а также как материал с чрезвычайно низким показателем преломления. В первые годы 21-го века цена на рынке фторида кальция упала, и многие крупные заводы были закрыты. Canon и другие производители используют синтетически выращенные кристаллы фторида кальция в качестве компонентов в объективах, уменьшающих рассеивание света.
Применяется в стоматологии, для глубокого фторирования – насыщения твердых тканей зуба минеральными соединениями, путём обработки(очистка, просушивание струёй воздуха зуба и нанесение) поврежденных мест. Благодаря этому, терапевтический эффект по сравнению с применением фторлаков, усиливается в 100 раз.
Отличные механические, технические и эксплуатационные характеристики в сочетании с прозрачностью в широком спектральном диапазоне, высокой оптической однородностью, высокой радиационной устойчивостью позволяют использовать оптические монокристаллы фторида кальция в:
Монокристаллы используются для изготовления окон, призм, линз и других оптических деталей, работающих в диапазоне излучения от ультрафиолетового до инфракрасного. Оптические детали из фторида кальция используются без защитных покрытий.[1]
Фторид кальция считается относительно безвредным в силу его малой растворимости в воде. Ситуация схожа и с BaSO4, где токсичность, обычно связанная с Ba2+, компенсируется очень низкой растворимостью сульфата.
Оксид кальция — Википедия
Окси́д ка́льция (окись кальция, негашёная и́звесть) — белое кристаллическое вещество, формула CaO.
Негашёная известь и продукт её взаимодействия с водой — Ca(OH)2 (гашёная известь, или «пушонка») находят обширное использование в строительном деле.
В промышленности оксид кальция получают термическим разложением известняка (карбоната кальция):
- CaCO3→CaO+CO2{\displaystyle {\mathsf {CaCO_{3}\rightarrow CaO+CO_{2}}}}
Также оксид кальция можно получить при взаимодействии простых веществ, на практике в виде корки на металле:
- 2Ca+O2→2CaO{\displaystyle {\mathsf {2Ca+O_{2}\rightarrow 2CaO}}}
или при термическом разложении гидроксида кальция и кальциевых солей некоторых кислородсодержащих кислот:
- 2Ca(NO3)2→2CaO+4NO2+O2{\displaystyle {\mathsf {2Ca(NO_{3})_{2}\rightarrow 2CaO+4NO_{2}+O_{2}}}}
Оксид кальция — белое кристаллическое вещество, кристаллизующееся в кубической кристаллической решётке, по типу хлорида натрия.
Оксид кальция относится к основным оксидам. Энергично взаимодействует с водой с выделением тепла и образованием гидроксида кальция, насыщенный раствор которого является сильным основанием:
- CaO+h3O→Ca(OH)2{\displaystyle {\mathsf {CaO+H_{2}O\rightarrow Ca(OH)_{2}}}} + 63,7 кДж/моль.
При температуре выше 580 °C [источник не указан 698 дней] эта реакция обратима.
Как основной оксид реагирует с кислотными оксидами и кислотами, образуя соли:
- CaO+SO2→CaSO3{\displaystyle {\mathsf {CaO+SO_{2}\rightarrow CaSO_{3}}}}
- CaO+2HCl→CaCl2+h3O{\displaystyle {\mathsf {CaO+2HCl\rightarrow CaCl_{2}+H_{2}O}}}
При нагревании с углеродом в высокотемпературной печи или электрической дуге образует карбид кальция (используемый для получения ацетилена):
- CaO+3C→CaC2+CO{\displaystyle {\mathsf {CaO+3C\rightarrow CaC_{2}+CO}}}
Несмотря на массовое промышленное производство ацетилена более эффективными способами, эта реакция сохраняет небольшое практическое значение, так как карбид кальция является удобным источником ацетилена в лабораторной практике и в аппаратах для сварочных работ.
В настоящее время в основном используются в производстве строительных материалов, высокоглиноземистого цемента, силикатного кирпича и тд.
До второй половины XX века известь широко использовали в качестве строительной побелки — прокаленный мел или известняк (оксид кальция) при смешивании с водой образует ярко-белую гашеную известь (Ca(OH)2), обладающую хорошими адгезионными свойствами к различным поверхностям. Далее известь медленно поглощает из воздуха углекислый газ, покрываясь коркой карбоната кальция. В настоящее время известковый раствор при строительстве жилых домов практически не применяется в виду значительной гигроскопичности (склонности поддерживать высокую влажность, провоцирующую рост плесени) и сложности производства работ, уступив место более эффективным материалам.
В лабораторной практике оксид кальция используется как дешевый и эффективный агент для осушения растворителей и жидких веществ.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E-529.
В промышленности водный раствор используют в одном из способов удаления диоксида серы из дымовых газов. В результате реакции гашеной извести Са(OH)2 и диоксида серы получается осадок сульфита кальция СаSO3. В настоящее время вытеснен современными абсорберами на основе четвертичных аммонийных соединений, способных обратимо связывать SO2 и CO2.
Использовался в «саморазогревающейся» посуде. Оксид кальция, помещенный между двух стенок емкости, при прокалывании капсулы с водой реагирует с ней с выделением тепла.
Оксид кальция относится к высокоопасным веществам (Класс опасности 2). Это едкое вещество, особенно опасен при смешивании с водой.
В виде пыли или капель взвеси раздражают слизистые, вызывая чихание и кашель.
Действие CaO, подобно действию щелочи, состоит в омылении жиров, поглощении из кожи влаги, растворении белков, раздражении и прижигании тканей.
Сильно действует на слизистую глаз. На слизистой рта и носа наблюдаются поверхностные изъязвления; иногда прободение носовой перегородки.
Страдают также глубокие дыхательные пути. Вдыхание известковой пыли может вызвать воспаление легких.
Гидроксид кальция — Википедия
Материал из Википедии — свободной энциклопедии
Гидрокси́д ка́льция (гашёная известь, едкая[2]) — химическое вещество с формулой Ca(OH)2, сильное основание. Представляет собой мелкокристаллический порошок белого цвета, малорастворимый в воде.
Некоторые распространённые названия[править | править код]
- Гашёная известь — так как её получают путём «гашения» (то есть взаимодействия с водой) «негашеной» извести (оксида кальция).
- Известковое молоко — взвесь (суспензия), образуемая при смешивании избытка гашёной извести с водой. Внешне похожа на молоко.
- Известковая вода — прозрачный бесцветный раствор гидроксида кальция, получаемый при фильтровании или отстаивании известкового молока.
- Известь-пушонка — при гашении негашёной извести ограниченным количеством воды образуется белый рассыпающийся мелкокристаллический пылевидный порошок.
Получают путём взаимодействия оксида кальция (негашёной извести) с водой (процесс получил название «гашение извести»):
- CaO+h3O→Ca(OH)2.{\displaystyle {\mathsf {CaO+H_{2}O\rightarrow Ca(OH)_{2}}}.}
Эта реакция сильно экзотермическая, происходит с выделением 16 ккал на моль (67 кДж на моль).
| Температура, °C | Растворимость, г Ca(OH)2/100 г H2O |
|---|---|
| 0 | 0,173 |
| 20 | 0,166 |
| 50 | 0,13 |
| 100 | 0,08 |
По внешнему виду представляет собой белый порошок, малорастворимый в воде. Растворимость в воде падает с ростом температуры.
При нагреве вещества до температуры 512 °C парциальное давление водяного пара, находящегося в равновесии с гидроксидом кальция становится равным атмосферному давлению (101,325 кПа) и гидроксид кальция начинает терять воду, превращаясь в оксид кальция, при температуре 600 °C процесс потери воды практически полностью завершается[3]:
- Ca(OH)2→600oCCaO+h3O.{\displaystyle {\mathsf {Ca(OH)_{2}{\xrightarrow[{}]{600^{o}C}}CaO+H_{2}O}}.}
Кристаллизуется в гексагональной кристаллической структуре.
Гидроксид кальция является довольно сильным основанием, из-за чего водный раствор имеет сильнощелочную реакцию.
Как и все основания, реагирует с кислотами; как щелочь участвует в реакциях нейтрализации кислот (см. реакция нейтрализации) с образованием соответствующих солей кальция, например:
- Ca(OH)2+h3SO4→CaSO4↓+2h3O.{\displaystyle {\mathsf {Ca(OH)_{2}+H_{2}SO_{4}\rightarrow CaSO_{4}\downarrow +2H_{2}O}}.}
Реакцией нейтрализации обусловлено постепенное помутнение раствора гидроксида кальция при стоянии на воздухе, так как гидроксид кальция, взаимодействует с поглощённым из воздуха углекислым газом, как и растворы других сильных оснований, эта же реакция происходит при пропускании углекислого газа через известковую воду, — реакции качественного анализа на углекислый газ:
- Ca(OH)2+CO2→CaCO3↓+h3O{\displaystyle {\mathsf {Ca(OH)_{2}+CO_{2}\rightarrow CaCO_{3}\downarrow +H_{2}O}}}
При дальнейшем пропускании углекислого газа через известковую воду раствор снова становится прозрачным, так как при этом образуется кислая соль — гидрокарбонат кальция, имеющий более высокую растворимость в воде, причём при нагревании раствора гидрокарбоната кальция он снова разлагается с выделением углекислого газа и при этом выпадает осадок карбоната кальция:
- CaCO3+h3O+CO2⇄Ca(HCO3)2.{\displaystyle {\mathsf {CaCO_{3}+H_{2}O+CO_{2}\rightleftarrows Ca(HCO_{3})_{2}}}.}
Гидроксид кальция реагирует с оксидом углерода при температуре около 400 °C:
- Ca(OH)2+CO→400oCCaCO3+h3.{\displaystyle {\mathsf {Ca(OH)_{2}+CO{\xrightarrow[{}]{400^{o}C}}CaCO_{3}+H_{2}}}.}
Реагирует с некоторыми солями, но реакция происходит только в том случае, если в результате реакции одно из образующихся веществ плохо растворимое и выпадает в осадок, например:
- Ca(OH)2+Na2SO3→CaSO3↓+2NaOH.{\displaystyle {\mathsf {Ca(OH)_{2}+Na_{2}SO_{3}\rightarrow CaSO_{3}\downarrow +2NaOH}}.}
- Известковое молоко применяется при побелке стен, заборов, стволов деревьев.
- Для приготовления известкового строительного раствора. Гашёная известь применялась для строительной каменной кладки с древних времён. Такой строительный раствор обычно состоит по массе из одной части гашёной извести и трёх-четырёх частей кварцевого песка. В смесь добавляют воду до получения густой массы. В смеси происходит химическая реакция компонентов с образованием силикатов кальция, в этой реакции выделяется вода. Это является недостатком такого раствора, так как в помещениях, построенных с применением такого раствора долгое время сохраняется повышенная влажность. В том числе поэтому в современном строительстве цемент практически полностью вытеснил гашёную известь как связующее в строительных растворах.
- Для приготовления силикатного бетона и силикатного кирпича. Состав силикатного бетона аналогичен составу известкового строительного раствора, однако его отвердевание происходит на несколько порядков быстрее, так как смесь гашёной извести и кварцевого песка обрабатывают перегретым (174—197 °C) водяным паром в автоклаве при повышенном давлении 9—15 атмосфер.
- Для устранения карбонатной жёсткости воды (умягчение воды)[4].
- Для производства хлорной извести.
- Для производства известковых удобрений и снижения кислотности кислых почв.
- В производстве методом каустификации соды и поташа.
- При дублении кож.
- Для получения других соединений кальция, нейтрализация кислых растворов (в том числе сточных вод производств), получение органических кислот и проч.
- В пищевой промышленности зарегистрирован в качестве пищевой добавки E526.
- Как реактив качественной реакции на углекислый газ.
- Известковое молоко — суспензия гидроксида кальция в воде используется для рафинирования сахара в сахарном производстве.
- Для приготовления смесей для борьбы с болезнями и вредителями растений, например, входит в состав классического фунгицида — бордоской жидкости.
- В стоматологии для дезинфекции корневых каналов зубов.
- В электротехнике — при устройстве заземления в грунтах с высоким электрическим сопротивлением — в качестве добавки в грунт, для снижения удельного электрического сопротивления грунта.
- Монастырев А. Производство цемента, извести. — М., 2007.
- Штарк Йохан, Вихт Бернд. Цемент и известь / пер. с нем. — Киев, 2008.
Оксалат кальция — Википедия
Материал из Википедии — свободной энциклопедии
Оксалат кальция — соль щелочноземельного металла кальция и органической двухосновной щавелевой кислоты с формулой CaC2O4, бесцветные кристаллы, образует кристаллогидрат.
- Обменными реакциями:
- CaCl2+(Nh5)2C2O4 → CaC2O4↓+2 Nh5Cl{\displaystyle {\mathsf {CaCl_{2}+(NH_{4})_{2}C_{2}O_{4}\ {\xrightarrow {\ }}\ CaC_{2}O_{4}\downarrow +2\ NH_{4}Cl}}}
Оксалат кальция образует бесцветные кубические кристаллы. Из водных растворов образует кристаллогидрат CaC2O4•H2O — бесцветные моноклинные кристаллы. В литературе есть упоминание о кристаллогидрате CaC2O4•3H2O.
Реагирует с сильными кислотами:
- CaC2O4+2HCl →CaCl2+h3C2O4{\displaystyle {\mathsf {CaC_{2}O_{4}+2HCl\ \rightarrow CaCl_{2}+H_{2}C_{2}O_{4}}}}
Чистую щавелевую кислоту можно получить, действуя серной кислотой на оксалат кальция.
- CaC2O4+h3SO4→CaSO4↓+h3C2O4{\displaystyle {\mathsf {CaC_{2}O_{4}+H_{2}SO_{4}\rightarrow CaSO_{4}\downarrow +H_{2}C_{2}O_{4}}}}
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
Силикат кальция — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 5 августа 2017; проверки требуют 7 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 5 августа 2017; проверки требуют 7 правок.Силикат кальция — неорганическое вещество, соль щелочноземельного металла кальция и метакремниевой кислоты с формулой CaSiO3. Бесцветные кристаллы.
Известно большое количество силикатов кальция:
- CaSiO3 — метасиликат или просто силикат кальция
- Ca3Si2O7 — пиросиликат кальция
- Ca2SiO4 — ортосиликат кальция
- Около 30 гидросиликатов кальция
Т. н. цементные минералы: алит 3CaO*SiO2, белит 2CaO*SiO2.
- Обменная реакция между растворимыми солями кальция и силикатами щелочных металлов:
- CaCl2+Na2SiO3 → CaSiO3↓+2NaCl{\displaystyle {\mathsf {CaCl_{2}+Na_{2}SiO_{3}\ {\xrightarrow {\ }}\ CaSiO_{3}\downarrow +2NaCl}}}
- CaCO3+SiO2 →950−1500oC CaSiO3+CO2↑{\displaystyle {\mathsf {CaCO_{3}+SiO_{2}\ {\xrightarrow {950-1500^{o}C}}\ CaSiO_{3}+CO_{2}\uparrow }}}
- В природе встречается минерал волластонит — практически чистый силикат кальция.
Силикат кальция образует бесцветные кристаллы, нерастворимые в воде. Известен в нескольких полиморфных модификациях:
- низкотемпературная β-модификация (минерал волластонит) — кристаллы триклинной сингонии, пространственная группа P 1, параметры ячейки a = 0,794 нм, b = 0,732 нм, c = 0,707 нм, α = 90,03°, β = 95,37°, γ = 103,43°, Z = 6, плотность 2,905 г/см³.
- при температурах выше 1125°С существует α-модификация — кристаллы триклинной сингонии, пространственная группа P 1, параметры ячейки a = 0,690 нм, b = 1,178 нм, c = 1,965 нм, α = 90,00°, β = 90,80°, γ = 90,00°, Z = 8, плотность 2,915 г/см³.
- Разрушается сильными кислотами:
- CaSiO3+2HCl → CaCl2+h3SiO3{\displaystyle {\mathsf {CaSiO_{3}+2HCl\ {\xrightarrow {\ }}\ CaCl_{2}+H_{2}SiO_{3}}}}
[1]
- Справочник химика / Редколл.: Б. П. Никольский и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Химическая энциклопедия / Редколл.: И. Л. Кнунянц и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
Карбид кальция — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 3 июля 2018; проверки требуют 16 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 3 июля 2018; проверки требуют 16 правок.Карби́д ка́льция (углеро́дистый ка́льций, ацетилени́д кальция) — CaC2 — в чистом виде белое кристаллическое вещество. Бинарное неорганическое соединение кальция с углеродом.
Впервые получен в 1861 году Фридрихом Вёлером нагреванием сплава цинка и кальция с углём.
В настоящее время получают прокаливанием в электрических печах (температура 1900—1950 °C) смеси оксида кальция с коксом.
- CaO+3C→CaC2+CO{\displaystyle {\mathsf {CaO+3C\rightarrow CaC_{2}+CO}}}
Полученный таким образом технический продукт имеет чисто-черный цвет вследствие загрязнения углём и другими красящими примесями. Он содержит также примеси фосфида и сульфида кальция, вследствие чего такой карбид кальция и полученный из него ацетилен имеют неприятный запах.
- Бесцветные тетрагональные кристаллы.
- Плотность: 228 (+20 °C, г/см3).
- Удельная теплоёмкость при постоянном давлении (в Дж/г·K): 0,92 (+20—325 °C).
- Стандартная энтальпия образования ΔfH (298 К, кДж/моль): −62,8 (т).
- Стандартная энергия Гиббса образования ΔfG (298 К, кДж/моль): −67,8 (т).
- Стандартная энтропия образования S (298 К, Дж/моль·K): 70,3 (т).
- Стандартная мольная теплоёмкость Cp (298 К, Дж/моль·K): 62,34 (т).
- Энтальпия плавления ΔHпл (кДж/моль): 32,2[1].
- Карбид кальция имеет резкий чесночный запах.
При взаимодействии c водой карбид кальция гидролизуется с образованием ацетилена и гидроксида кальция (гашёной извести)[2]:
- CaC2+2h3O→Ca(OH)2+C2h3↑{\displaystyle {\mathsf {CaC_{2}+2H_{2}O\rightarrow Ca(OH)_{2}+C_{2}H_{2}\uparrow }}}
Представленная выше реакция является экзотермической.
Внешний вид и характеристики технического карбида кальция[править | править код]
Карбид кальция получают сплавлением в электрических печах кокса и негашеной извести. Расплавленный карбид кальция выпускается из печи в специальные формы — изложницы, в которых он затвердевает. Застывший карбид кальция дробится и сортируется на куски определённых размеров.
Технический карбид кальция представляет собой твёрдое кристаллическое вещество. По внешнему виду карбид кальция представляет собой твёрдое вещество тёмно-серого или коричневого цвета. Он даёт кристаллический излом серого цвета с различными оттенками в зависимости от чистоты. Карбид кальция жадно поглощает воду. При взаимодействии с водой даже на холоде карбид кальция разлагается с бурным выделением ацетилена и большого количества тепла. Разложение карбида кальция происходит и под влиянием атмосферной влаги.
По ГОСТ 1460-56 установлены следующие размеры (грануляция) кусков карбида кальция: 2×8; 8×15; 15×25; 25×80. Технический карбид кальция содержит до 80 % химически чистого карбида кальция, остальное составляют примеси — негашеная известь, углерод, кремнекислота и другое[3].
Карбид кальция используют при проведении автогенных работ и освещения, а также в производстве ацетиленовой сажи и продуктов органического синтеза, из которых главным является синтетический каучук.
Карбид кальция применяют в производстве цианамида кальция, из которого получают удобрения, цианистые соединения. Карбид кальция используют для получения карбидно-карбамидного регулятора роста растений, изготовления порошкового карбидного реагента.
Из 1 кг технического карбида получается от 235 до 285 л ацетилена в зависимости от его сорта и грануляции: чем чище и крупнее карбид кальция, тем большее количество ацетилена он даёт при разложении.
Для разложения 1 кг карбида кальция теоретически требуется 0,56 л воды. Практически берут от 5 до 20 л воды с целью лучшего охлаждения ацетилена и обеспечения безопасности при работе. Скорость разложения карбида кальция водой зависит от его чистоты, грануляции, температуры и чистоты воды. Чем чище карбид кальция, меньше размер его кусков, выше температура и чище вода, тем больше скорость[3].
- Среди всех неорганических производных кальция CaC2 очень ядовит.
- По степени воздействия на организм человека карбид кальция относится к 1-му классу опасности согласно ГОСТ 12.1.007.
- Попадание карбида кальция внутрь организма также является опасным.
- Пыль карбида кальция оказывает раздражающее действие на кожу, слизистые оболочки органов дыхания.
- Карбид кальция CaC2 чрезвычайно опасен для окружающей среды.
Кальций (Ca, Calcium) - влияние на организм, польза и вред, описание
История кальция
Кальций был открыт в 1808 году Хэмфри Дэви, который путём электролиза гашеной извести и оксида ртути получил амальгаму кальция, в результате процесса выгонки ртути из которой и остался металл, получивший название кальций. На латыни известь звучит как calx, именно это название и было выбрано английским химиком для открытого вещества.
Общая характеристика кальция
Кальций является элементом главной подгруппы II группы IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 20 и атомную массу 40,08. Принятое обозначение – Ca (от латинского - Calcium).

Физические и химические свойства
Кальций является химически активным мягким щелочным металлом серебристо-белого цвета. Из-за взаимодействия с кислородом и углекислым газом поверхность металла тускнеет, поэтому кальций нуждается в особом режиме хранения – в обязательном порядке плотно закрытая ёмкость, в которой металл заливают слоем жидкого парафина или керосина.
Суточная потребность в кальции
Кальций – наиболее известный из необходимых человеку микроэлементов, суточная потребность в нём составляет от 700 до 1500 мг для здорового взрослого человека, но она увеличивается во время беременности и лактации, это нужно учитывать и получать кальций в виде препаратов.

Нахождение в природе
Кальций имеет очень высокую химическую активность, поэтому в свободном (чистом) виде не встречается в природе. Тем не менее, является пятым по распространённости в земной коре, в виде соединений имеется в осадочных (известняк, мел) и горных породах (гранит), много кальция содержит полевой шпат анорит.
В живых организмах распространён достаточно широко, его наличие обнаружено в растениях, организмах животных и человека, где он присутствует, в основном, в составе зубов и костной ткани.
Продукты питания богатые кальцием
Источники кальция: молочные и кисломолочные продукты (основной источник кальция), брокколи, капуста, шпинат, листья репы, капуста цветная, спаржа. Кальций содержат также яичные желтки, бобы, чечевица, орехи, инжир (calorizator). Еще хороший источник пищевого кальция — мягкие кости лосося и сардин, любые морепродукты. Чемпионом по содержанию кальция является кунжут, но только – в свежем виде.
В организм кальций должен поступать в определенном соотношении с фосфором. Оптимальным соотношением этих элементов принято считать 1 : 1,5 (Са : Р). Поэтому правильно употреблять продукты питания, богатые этими минералами одновременно, например, говяжью печень и печень жирных сортов рыб, зелёный горошек, яблоки и редис.

Усвояемость кальция
Препятствием для нормального усвоения кальция из пищевых продуктов является употребление в пищу углеводов в виде сладостей и щелочей, которые нейтрализуют соляную кислоту желудка, необходимую для растворения кальция. Процесс усвоения кальция достаточно сложен, поэтому иногда недостаточно получать его только с пищей, необходим дополнительный приём микроэлемента.
Взаимодействие с другими
Для улучшения всасывания кальция в кишечнике необходим витамин D, который имеет свойство облегчать процесс усвоения кальция. При приёме кальция (в виде добавок) в процессе еды происходит блокировка всасывания железа, но приём препаратов кальция отдельно от пищи никак не влияет на этот процесс.
Полезные свойства кальция и его влияние на организм
Почти весь кальций организма (от 1 до 1,5 кг) находится в костях и зубах. Кальций участвует в процессах возбудимости нервной ткани, сократимости мышц, процессах свертываемости крови, входит в состав ядра и мембран клеток, клеточных и тканевых жидкостей, обладает антиаллергическим и противовоспалительным действием, предотвращает ацидоз, активирует ряд ферментов и гормонов. Кальций также участвует в регуляции проницаемости клеточных мембран, оказывает действие, противоположное натрию.

Признаки нехватки кальция
Признаками нехватки кальция в организме являются такие, на первый взгляд, не связанные между собой симптомы:
- нервозность, ухудшение настроения;
- учащённое сердцебиение;
- судороги, онемение конечностей;
- замедление роста и детей;
- повышенное артериальное давление;
- расслоение и ломкость ногтей;
- боль в суставах, понижение «болевого порога»;
- обильные менструации.
Причины нехватки кальция
Причинами нехватки кальция могут служить несбалансированные диеты (особенно голодания), низкое содержание кальция в пище, курение и увлечение кофе и кофеинсодержащими напитками, дисбактериоз, болезни почек, щитовидной железы, беременность, периоды лактации и менопаузы.
Признаки избытка кальция
Избыток кальция, который может возникнуть при чрезмерном употреблении молочных продуктов или неконтролируемом приёме препаратов, характеризуется сильной жаждой, тошнотой, рвотой, потерей аппетита, слабостью и усиленным мочеотделением.

Применение кальция в жизни
Кальций нашёл применение в металлотермическом получении урана, в виде природных соединений используется как сырьё для производства гипса и цемент, как средство дезинфекции (всем известная хлорка).
Автор: Виктория Н. (специально для Calorizator.ru)
Копирование данной статьи целиком или частично запрещено.
Формиат кальция — Википедия
Материал из Википедии — свободной энциклопедии
Формиа́т ка́льция (муравьинокислый кальций) Ca(HCOO)2, — кальциевая соль муравьиной кислоты, HCOOH. Также известен как пищевая добавка E238 в пищевой промышленности. В природе встречается крайне редко в некоторых минералах.
Формиат кальция получают воздействием муравьиной кислоты на кальций, его оксид и карбонат (мел или мрамор), а также высокотемпературным растворением монооксида углерода в твёрдом гидроксиде кальция.
Формиат кальция является сильным гидрофилом, что позволяет применять его в качестве водоотъёмного вещества. Гидролизуется, из-за чего имеет щелочную реакцию. Реагирует с более сильными, чем муравьиная, кислотами с образованием соответствующих солей кальция и муравьиной кислоты. Является антисептиком.
Из-за высокой гидрофильности чистый формиат кальция используется в качестве ускорителя затвердевания строительных смесей и бетона, а также антиморозной присадки в бетон. Также использование формиата кальция в качестве составляющей бетона в размере от двух до четырёх процентов по массе увеличивает прочность бетона на сжатие.[1]
В РФ использовалась (не разрешена) как соль и консервант в безалкогольных напитках, но количество не должно было превышать 210 мг на литр (комбинировалась с муравьиной, либо другим видом кислоты, но не более 360 мг на литр). Формиат кальция используют при квашении различных овощей (особенно капусты), но не для консервирования, а для того, чтобы был уплотнитель растительной ткани. E238 активно используют как заменитель соли во всех диетических продуктах. При применении учитывается особое свойство формиатов, которые способны проявлять своё антимикробное свойство только тогда, когда попадают в кислую среду. Некоторое время назад добавка использовалась и в консервировании рыбы, теперь же это также является нарушением, поэтому для консервирования применяются более безопасные консерванты. Биологическая добавка используется для предотвращения порчи косметических средств, но дозировка не должна превышать 0,5 %. Также E238 применяют в процессе дубления кожи и крашении ткани, при печати цветных обоев.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.