Химическая формула йодной настойки
Cоединения йода
Йодоводород, йодоводородная кислота (HI)
Способы получения йодоводорода
В промышленности
- Взаимодействие йода с гидразином:
2l2 + N2H4 = 4HI↑ + N2
- Взаимодействие простых веществ происходит только при нагревании и протекает не до конца:
I2 + H2 = 2HI
В лаборатории
- Вытеснение HI из йодидов ортофосфорной кислотой:
КI + H3PO4 = НI↑ + КН2PO4
РI3 + ЗН2O = H3PO3 + 3HI↑
- восстановление свободного йода :
l2 + H2S = 2HI↑ + S↓
Физические свойства йодоводорода
Водный раствор HI — иодоводородная кислота. Это бесцветная жидкость с резким запахом. Иодоводородная кислота является сильной кислотой.
В 100 г воды при обычном давлении и 20 °C растворяется 132 г HI, а при 100 °C — 177 г.
Химические свойства йодоводорода
Йодоводород – сильный восстановитель.
4HI + O2 → 2I2 + 2H2O
- Взаимодействует с концентрированной серной кислотой с образованием сероводорода и свободного йода:
8HI + H2SO4 → 4I2 + H2S + 4H2O
- Окисляется другими неметаллами:
2HI + S → I2 + H2S
- Окисляется даже слабыми окислителями:
2HI + 2FeCl3 → I2 + 2FeCl2 + 2HCl
2HI + Fe2(SO4)3 → 2FeSO4 + I2 + H2SO4
2HI + NO2 → I2 + NO + H2O
HI + CH3 – CH = CH2 → CH3 – CHI – CH3
- Образуют полииоды, присоединяя элементарный иод:
RI + I2 = R(I3)x
Кислородные кислоты и окислы иода
Иодноватистая кислота (HIO)
Иодноватистая кислота HIO — существует только в очень разбавленных растворах, окрашена в зеленоватый цвет. Очень неустойчива.
Получение йодноватистой кислоты
Образуется при взаимодействии иода с водой. Реакция обратима, а равновесие сильно сдвинуто в сторону исходных веществ:
I2 + H2O = HI + HIO3
Химические свойства йодноватистой кислоты
- Проявляет амфотерные свойства – слабая кислота и слабое основание. Диссоциирует и как кислота, и как основание:
HIO = H+ + IO-
HIO = I+ + OH-
- Разлагается при комнатной температуре с течением времени:
5HIO = HIO3 + 2I2↓ + 2H2O
- Разлагается щелочами:
3HIO + 3NaOH = 2NaI + NaIO3 + 3H2O
Соли иодноватистой кислоты называют гипоиодитами.
Иодноватая кислота (HIO3 )
Йодноватая кислота HIO3— белое кристаллическое вещество со стеклянным блеском и горьковато-кислым вкусом. При обычной температуре устойчива. Сильная одноосновная кислота, имеющая склонность к полимеризации в концентрированных растворах
Получение иодноватой кислоты
Получают в водных растворах при окислении иода хлором, пероксидом водорода либо дымящей азотной кислотой:
I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl
I2 + 5H2O2 = 2HIO3 + 4H2O
I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O
Химические свойства йодноватой кислоты
- хорошо растворима в воде:
nHIO3 = (HIO3)n
- При медленном нагревании до 110ºС она частично плавится, частично образует ангидроиодноватую кислоту HI3O8.
При нагревании HIO3 выше 230°C образует порошок иодноватого ангидрида I 2O5, при растворении в воде, которого вновь образуется иодноватая кислота:
2HIO3 = I2O5 + H2O
- Нейтрализуется щелочами:
HIO3 + NaOH = NaIO3 + H2O
- Проявляет окислительные свойства:
HIO3 + 5HI = 3I2 + 3H2O
- При электролизе йодноватой кислоты образуется йодная кислота:
HIO3 + 3H2O = H2↑(катод) + H5IO6(анод)
Соли иодноватой кислоты — иодаты
- Они довольно устойчивы и разлагаются при температуре выше 400 °C.
2NaIO3 = 2NaI + 3O2
- Обладают сильными окислительными свойствами в кислой среде:
2NaIO3 + 12HCl = I2↓ + 5Cl2↑ + 2NaCl + 6H2O
2NaIO3 + 3H2SO4 + 5NaI = 3I2↓ + 3Na2SO4 + 3H2O
- При электролизе раствора иодаты распадаются на водород и периодаты:
NaIO3 + H2O = H2↑(катод) + NaIO4(анод)
Иодная кислота (HIO4)
Иодная кислота HIO4 — белое гигроскопичное кристаллическое вещество. В водном растворе Н5IO6 является слабой кислотой. В растворах образует гидраты состава mHIO4•nН2О, например, H3IO5, H4I2O9, H5IO6 и т. д Их устойчивость зависит от концентрации раствора. Проявляет сильные окислительные свойства
Получение йодной кислоты
- При воздействии хлорной кислоты на иод в присутствии катализатора:
2HClO4 + I2 = 2HIO4 + Cl2
- Электролизом раствора иодноватой кислоты:
NaIO3 + H2O = H2↑(катод) + NaIO4(анод)
Химические свойства йодной кислоты
- При растворении в воде образует гидраты:
НIO4 + 2Н2O ⇔ Н5IO6
- НIO4 разлагается при нагревании выше 122ºС:
2HIO4 = H2O + I2O5 + O2
- Щелочами нейтрализуется не полностью:
H5IO6 + 3NaOH = Na3H2IO6↓ + 2NaNO3
- Сильные окислительные свойства:
H5IO6 + 2NO2 = HIO3 + 2HNO3 + H2O
H5IO6 + 2MnSO4 = 5HIO3 + 2HMnO4 + 2H2SO4 + 7H2O
Cоли йодной кислоты — периодаты
Йодная кислота может образовать соли, содержащие ионы, IO65−, IO53−, IO4— и I2O94− — соответственно орто-, мезо-, мета- и дипериодаты.
Получение периодатов
Периодаты можно получить при окислении иодатов сильными окислителями в щелочной среде:
NaIO3 + 2NaOH + Cl2 = NaIO4 + 2NaCl + H2O
Химические свойства периодатов
- Периодаты — сильные окислители, при нагревании выше 300ºС разлагаются с выделением кислорода:
2NaIO4 = 2NaIO3 + O2
- Разлагаются концентрированными кислотами:
NaIO4 + HNO3 + 2H2O = H5IO6 + NaNO3
- Разлагаются концентрированными щелочами:
NaIO4+ 2NaOH = Na3H2IO6
- Проявляют окислительные свойства:
5NaIO4 + 3H2O + 2MnSO4 = 5NaIO3 + 2HMnO4 + 2H2SO4
Оксиды йода
Пентаоксид (пятиокись) иода, йодноватый ангидрид (I2O5)
Иодноватый ангидрид I2O5 – белое, гигроскопичное вещество. На свету темнеет из-за частичного разложения.
Получение пентаоксида йода
Получают при медленном нагревании йодноватой или йодной кислоты
2НIO3 → I2O5 + Н2O
2Н5IO6 → I2O5 + 5Н2O + O2
Химические свойства пентаоксида йода
- На свету разлагается:
2I2O5 = 2I2 + 5O2
- Как кислотный оксид реагирует с водой, со щелочами:
I2O5+ H2O = 2HIO3
I2O5+ NaOH = 2NaIO3 + H2O
- Легко фторируется:
2I2O5+ 2F2 = 4IO2F + O2
- Восстанавливается монооксидом углерода:
I2O5+ 5CO = 5CO2 + I2
Химия йода и его соединений
Репетитор ЕГЭ
Химия элементов
Химия йода и его соединений
История открытия:
История открытия этого элемента, напрямую связана с именем французского химика–технолога и фармацевта Бернара Куртуа, родившегося в 1777 и умершего в 1838 году. Свое великое открытие ученый сделал в 1811 г. В этот период, как раз, когда шли Наполеоновский войны, государство нуждалось в больших объемах селитры, которая использовалась для производства пороха. Страна уже имела большие запасы натриевой селитры, но она была малопригодна для производства пороха, так как быстро сырела на воздухе. Однако, уже был известен способ превращения натриевой селитры в калийную, с использованием золы морских водорослей. Этим и занимался Куртуа в своей лаборатории, т.е. в тот период он являлся производителем селитры. По ходу своей работы он заметил, что в золе водорослей находится какое-то вещество, которое разъедает железные и медные сосуды, но ни он сам и ни один из его помощников не знали, как это вещество выделить. Очень распространена версия о том, что совершить открытие Куртуа помог его кот. Говорят, что Бернар Куртуа не только работал в своей лаборатории, но и зачастую любил обедать в ней. А его кот часто находился рядом с ним. В один из таких дней, что-то напугало кота, и он бросился бежать, столкнув на своем пути несколько колб, в одной из которых находился спиртовой экстракт золы водорослей, а в другой серная кислота. Колбы разбились и находящиеся в них вещества смешались вместе, при этом в воздух поднялись фиолетовые пары, а затем выпали в мелкие темные кристаллики вокруг. Действительно, при действие серной кислоты на йодные соли щелочных металлов (NaI, KI), выделяется йодоводород (HI), который является непрочным веществом и в присутствие серной кислоты разлагается с образованием молекулярного йода и некоторых других продуктов: H2SO4 + 8HI = H2S + 4I2 + 4H2O
Куртуа сильно заинтересовался наблюдаемым явлением и хорошо изучил новое вещество. Некоторое время спустя Куртуа сообщил о своем открытие двум друзьям Н. Клеману и Ш.Б. Дезорму. А спустя еще какое-то время, новым элементом заинтересовались двое знаменитых ученых – француз Ж.Л. Гей-Люссак и англичанин Г. Дэви. Начав исследования данного элемента, эти ученые долгое время вели между собой горячие научные споры, а когда пришло время выбирать название химического элемента Гей-Люссак предложил – Йод, а Дэви – Йодин, причем оба руководствовались цветом (от греч. Iodes – фиолетовый).
Физические свойства:
Йод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. При нагревании под атмосферным давлением он сублимируется (возгоняется), превращаясь в пар фиолетового цвета; при охлаждении пары йода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки йода от нелетучих примесей. Мало растворим в воде, хорошо во многих органических растворителях.


Нахождение в природе
Йод — редкий элемент. Он чрезвычайно сильно рассеян в природе и, будучи далеко не самым распространенным элементом, присутствует практически везде. Йод находится в виде йодидов в морской воде (20—30 мг на тонну морской воды). Присутствует в живых организмах, больше всего в водорослях (2,5 г на тонну высушенной морской капусты, ламинарии). Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны, — в термальных источниках Везувия и на острове Вулькано (Италия). Запасы природных йодидов оцениваются в 15 млн тонн, 99 % запасов находятся в Чили и Японии. В настоящее время в этих странах ведётся интенсивная добыча йода.
Сырьём для промышленного получения йода в России служат нефтяные буровые воды
Природный йод состоит только из одного изотопа — йода-127
Строение атома и атомные характеристики йода
Электронная формула йода: 1s22s22p63s23p63d104s24p64d105s25p5.
Конфигурация внешнего электронного слоя — 5s2p5.
В соединениях проявляет степени окисления −1, 0, +1, +3, +5 и +7 (валентности I, III, V и VII).
Химические свойства
Йод относится к группе галогенов.
Химически йод довольно активен, хотя и в меньшей степени, чем хлор и бром.
Известной качественной реакцией на йод является его взаимодействие с крахмалом, при котором наблюдается синее окрашивание в результате образования соединения включения.
С металлами йод при легком нагревании энергично взаимодействует, образуя йодиды:
Hg + I2 → HgI2
Йод легко реагирует с алюминием, причем катализатором в этой реакции является вода:
Н2О
3I2 + 2AI = 2AII3
С водородом йод реагирует только при нагревании и не полностью, образуя йодоводород:
H2 + I2 → 2HI
Йод является окислителем, менее сильным, чем фтор, хлор и бром. Сероводород H2S, Na2S2O3 и другие восстановители восстанавливают его до иона I−:
I2 + H2S → S + 2HI
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Последняя реакция также используется в аналитической химии для определения йода.
Йод может также окислять сернистую кислоту:
H2SO3 + I2 + H2O = H2SO4 + HI
При растворении в воде йод частично реагирует с ней
I2 + H2O → HI + HIO
Йод окисляется концентрированной кислотой:
3I2 + 10HNO3 → 6HIO3 + 10NO2 + 2H2O
В горячих водных растворах щелочей образуются йодид и йодат
I2 + 2KOH = KI + KIO + h3O
3KIO = 2KI + KIO3
При нагревании йод взаимодействует с фосфором:
3I2 + 2P = 2PI3
а йодид фосфора в свою очередь взаимодействует с водой, образуя йодоводород и фосфоновую (трив. фосфористую) кислоту:
2PI3 + H2O = 3HI + H2 (PHO3)
Соединения йода
Образует ряд кислот: йодоводородную (HI), йодноватистую (HIO), йодистую (HIO2), йодноватую (HIO3), йодную (HIO4).
Йодоводород, газ, очень похож по своим свойствам на хлороводород, но отличается более выраженными восстановительными свойствами. Очень хорошо растворим в воде (425:1), концентрированный раствор йодоводорода дымит вследствие выделения паров HI, образующего с водяными парами туман.
В водном растворе принадлежит к числу наиболее сильных кислот.
Йодоводород уже при комнатной температуре постепенно окисляется кислородом воздуха, причем под действием света реакция сильно ускоряется: 
свет
4HI + O2 = 2I2 + 2H2O
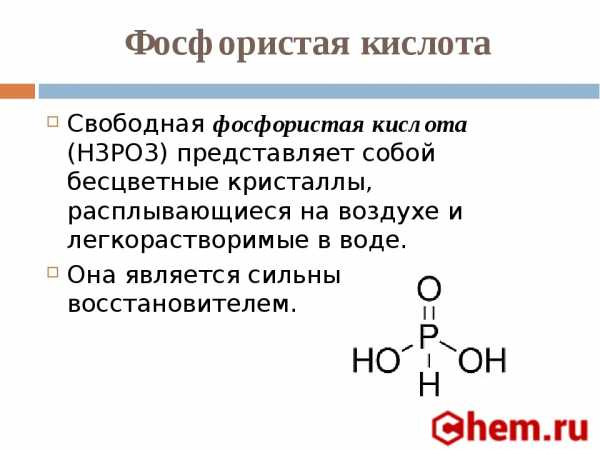
Восстановительные свойства йодоводорода заметно проявляются при взаимодействии с концентрированной серной кислотой, которая при этом восстанавливается до свободной серы или даже до H2S. Поэтому HI невозможно получить действием серной кислоты на иодиды. Обычно йодоводород получают действием воды на соединения йода с фосфором - РI3. Последний подвергается при этом полному гидролизу, образуя фосфористую кислоту и йодоводород: РI3 + ЗН2О = Н3РО3 + 3HI
Раствор йодоводорода (вплоть до 50%-ной концентрации) можно также получить, пропуская H2S в водную суспензию йода.
Йодоводород реагирует с хлоридом железа (III) с образованием молекулярного йода:
2HI + 2FeCl3 = I2 + 2FeCl2 + 2HCl
или с сульфатом железа (III):
2HI + Fe2(SO4)3 = 2FeSO4 + I2 + H2SO4
Йодоводород легко окисляется соединениями азота, например, оксидом азота (IV):
2HI + NO2 → I2 + NO + H2O
или молекулярной серой при нагревании:
2HI + S → I2 + H2S
Кислородосодержащие соединения йода
ГалогенКлассификация
Соединения йода со степенью окисления
+1
+3
+4
+5
+7
йод
оксид
-
-
IO2
I2O5
-
кислота
HIO
HIO2 *
-
HIO3
HIO4
соль
KIO
KIO2 *
-
KIO3
KIO4
Иодноватистая кислота - HOI является амфотерным соединением, у которого основные свойства несколько преобладают над кислотными. Может быть получена в растворе взаимодействием йода с водой
I2 + Н2О = НI + НОI
Иодноватая кислота - НIO3 может быть получена окислением йодной воды хлором:
I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl
Бесцветные кристаллы, вполне устойчивые при комнатной температуре. Сильная кислота, энергичный окислитель. Соли - иодаты, сильные окислители в кислой среде.
При нагревании кислоты она распадается, с образованием наиболее стойкого оксида галогенов:
2HIO3 = I2O5 + h3O
Оксид йода(V), иодноватый ангидрид, может быть получен при осторожном нагревании НIO3 до 200°С, порошок. При нагревании выше 300°С распадается на иод и кислород, проявляет окислительные свойства, в частности используется для поглощения CO в анализе:
5СО + I2O5 = I2 + 5CO2
Иодная кислота - HIO4 и ее соли (перйодаты)
Сама кислота может быть получена действием НСlO4 на йод:
2НСIО4 + I2=2НIO4 + Сl2
или электролизом раствора НIO3:
НIO3+Н2О = Н2 (катод) + НIO4 (анод)
Из раствора йодная кислота выделяется в виде бесцветных кристаллов, имеющих состав НIO4 ·2Н2О. Этот гидрат следует рассматривать как пятиосновную кислоту H5IO6 (ортоиодную), так как в нем все пять атомов водорода могут замещаться металлами с образованием солей (например, Ag5IO6).
Йодная кислота - слабая, но более сильный окислитель, чем НСlO4.
Оксид йода (VII) I2О7 не получен.
Фториды йода, IF5, IF7 - жидкости, гидролизуются водой, фторирующие агенты.
Хлориды йода, ICl, ICl3 – кристаллические вещества, в растворах хлоридов растворяются с образованием комплексов [ICl2]- и [ICl4]-, йодирующие агенты.
Получение йода.
Йод получают окислением ионов I– сильными окислителями.
Например, хлор окисляет йодид калия:
2KI + Cl2 = I2 + 2KCl
Соединения марганца также окисляют йодид-ионы.
Например, оксид марганца (IV) в кислой среде окисляет йодид калия:
2KI + MnO2 + 2H2SO4 = I2 + K2SO4 + MnSO4 + 2H2O
При взаимодействии H2SO4 и KI образуется йод и серная кислота восстанавливается до H2S
8KI + 9H2SO4 = 4I2 + 8KHSO4 + SO2 + H2O
При окислении йодид-иона йодат-ионом в кислой среде образуется свободный йод:
5KI + KIO3 + 3H2SO4 = 3I2 + 3K2SO4 + 3H2O
Качественная реакция на галогенид-ионы – взаимодействие с растворимыми солями серебра.
При взаимодействии соляной кислоты с нитратом серебра (I) образуется белый осадок хлорида серебра:
HCl + AgNO3 = AgCl↓ + HNO3
Осадок бромида серебра – бледно-желтого цвета:
HBr + AgNO3 = AgBr↓ + HNO3
Осадок иодида серебра – желтого цвета:
HI + AgNO3 = AgI↓ + HNO3
Применение йода и его соединений
В медицине
5 % спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците йода в организме. Йодосодержащие препараты - Йодинол, Йокс, Бетадин являются более мягкими антисептиками.
При большом количестве внутримышечных инъекций, на их месте пациенту делается йодная сетка, — йодом рисуется сетка на площади, в которую делаются инъекции. Это нужно для того, чтобы быстро рассасывались «шишки», образовавшиеся в местах внутримышечных инъекций.
В рентгенологических и томографических исследованиях широко применяются йодсодержащие контрастные препараты.
Йод-131, как и некоторые радиоактивные изотопы йода (125I, 132I) применяются в медицине для диагностики и лечения заболеваний щитовидной железы. Изотоп широко применяется при лечении диффузно-токсического зоба (болезни Грейвса), некоторых опухолей.
В криминалистике
В криминалистике пары йода применяются для обнаружения отпечатков пальцев на бумажных поверхностях, например, на купюрах.
В технике: рафинирование металлов
Источники света
Йод используется в источниках света: галогеновых лампах — в качестве компонента газового наполнителя колбы для осаждения испарившегося вольфрама нити накаливания обратно на неё. Металлогалогеновых дуговых лампах — в качестве газовой среды разряда используются галогениды ряда металлов, использование различных смесей которых позволяет получать лампы с большим разнообразием спектральных характеристик.
Производство аккумуляторов
Йод используется в качестве компонента положительного электрода (окислителя) в литиево-ионных аккумуляторах для автомобилей.
Радиоэлектронная промышленность
В последние годы резко повысился спрос на йод со стороны производителей жидкокристаллических дисплеев.
Биологическая роль
Йод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, ламинария, фукус и другие) накапливают до 1 % йода. Богаты йодом водные растения семейства рясковых. Йод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
Йод и щитовидная железа
У животных и человека йод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой — тироксина и трийодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма. В организме человека (масса тела 70 кг) содержится 12—20 мг йода. Суточная потребность человека в йоде определяется возрастом, физиологическим состоянием и массой тела. Для человека среднего возраста нормальной комплекции суточная доза йода составляет 0,15 мг.
Отсутствие или недостаток йода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом йода, с профилактической целью добавляют йодид калия, йодид натрия или йодат калия (йодированная соль).
Недостаток йода приводит к заболеваниям щитовидной железы (например, к базедовой болезни, кретинизму). Также при небольшом недостатке йода отмечается усталость, головная боль, подавленное настроение, природная лень, нервозность и раздражительность; слабеет память и интеллект. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Избыток йода в пище обычно легко переносится организмом, однако в отдельных случаях в людях с повышенной чувствительностью этот избыток может также привести к расстройствам щитовидной железы.
Токсичность
Йод токсичен. Смертельная доза— 3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров йода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, повышение температуры, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день появляется кровь в моче. Через 2 дня появляются почечная недостаточность и миокардит. Без лечения наступает летальный исход.
Проверь себя
Задание 32: реакции, подтверждающие взаимосвязь различных классов неорганических веществ
№ 1. Вещество, полученное на аноде при электролизе раствора йодида натрия с инертными электродами, прореагировало с сероводородом. Образовавшееся твёрдое вещество сплавили с алюминием и продукт растворили в воде. Напишите уравнения описанных реакций.
Электролиз раствора йодида натрия с инертными электродами
катод анод
2NaI + 2H2O = H2 + I2 +2NaOH
Йод реагирует с сероводородом. При этом йод окислитель, а сера — восстановитель:
I20 + H2S-2 = 2HI— + S0
Образуется сера, которая реагирует с алюминием при сплавлении, образуя сульфид алюминия.
3S0 + 2Al0 = Al2+3S3-2
Продукт реакции алюминия с серой — сульфид алюминия — при растворении в воде необратимо гидролизуется на гидроксид алюминия и сероводород:
Al2S3 + 12H2O = 2Al(OH)3 + 3H2S
№ 2. Вещество, полученное на аноде при электролизе расплава йодида натрия с инертными электродами, выделили и ввели во взаимодействие с сероводородом. Газообразный продукт последней реакции растворили в воде и к полученному раствору добавили хлорное железо. Образовавшийся осадок отфильтровали и обработали горячим раствором гидроксида натрия. Напишите уравнения описанных реакций.
№ 3. Вещество, полученное на аноде при электролизе раствора йодида натрия с инертными электродами, ввели в реакцию с калием. Продукт реакции нагрели с концентрированной серной кислотой и выделившийся газ пропустили через горячий раствор хромата калия. Напишите уравнения описанных реакций.
№ 4. Бесцветные газы выделяются при выдерживании концентрированной серной кислоты как с хлоридом натрия, так и с йодидом натрия. При пропускании этих газов через водный раствор аммиака образуются соли. Напишите уравнения описанных реакций.
№ 5. Йод нагревали с избытком фосфора и продукт реакции обработали небольшим количеством воды. Газообразный продукт реакции полностью нейтрализовали раствором едкого натра и добавили в полученный раствор нитрат серебра. Напишите уравнения описанных реакций.
Используемые источники:
Р.А. Лидин, В.А. Молочко, Л.Л.Андреева. Химические свойства неорганических веществ. Под редакцией Р.А. Лидина. Издание третье, исправленное, Москва, «Химия», 2000, с.270-286
В.Н. Доронькин, А.Г. Бережная, В.А. Февралёва. ЕГЭ 2020. Химия. 30 тренировочных вариантов. Легион, Ростов – на - Дону, 2019
http://www.kontren.narod.ru/x_el/info53.htm
https://chemege.ru/halogens/
Йод
| Иод | |
|---|---|
| Атомный номер | 53 |
| Внешний вид простого вещества | |
| Свойства атома | |
|
Атомная масса (молярная масса) |
126,90447 а. е. м. (г/моль) |
| Радиус атома | n/a пм |
|
Энергия ионизации (первый электрон) |
1 008,3 (10,45) кДж/моль (эВ) |
| Электронная конфигурация | [Kr] 4d10 5s2 5p5 |
| Химические свойства | |
| Ковалентный радиус | 133 пм |
| Радиус иона | (+7e) 50 (-1e) 220 пм |
|
Электроотрицательность (по Полингу) |
2,66 |
| Электродный потенциал | 0 |
| Степени окисления | 7, 5, 3, 1, -1 |
| Термодинамические свойства простого вещества | |
| Плотность | 4,93 г/см³ |
| Молярная теплоёмкость | 54,44[1]Дж/(K·моль) |
| Теплопроводность | (0,45) Вт/(м·K) |
| Температура плавления | 386,7 K |
| Теплота плавления | 15,52 (I-I) кДж/моль |
| Температура кипения | 457,5 K |
| Теплота испарения | 41,95 (I-I) кДж/моль |
| Молярный объём | 25,7 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | орторомбическая |
| Параметры решётки | 7,720 Å |
| Отношение c/a | n/a |
| Температура Дебая | n/a K |
| I | 53 |
| 126,90447 | |
| 5s25p5 | |
| Иод | |
Иод, йод (от др.-греч. ιώδης, iodes — «фиолетовый») — элемент главной подгруппы седьмой группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 53. Обозначается символом I (лат. Iodum). Химически активный неметалл, относится к группе галогенов. Простое вещество иод (CAS-номер: 7553-56-2) при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Молекула вещества двухатомна (формула I2).
В медицине и биологии данное вещество обычно называют йодом (например «раствор йода»), в таблице Менделеева и химической литературе употребляется название иод.
История
Иод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент.
Символ элемента J был заменен на I относительно недавно, в 50-х годах XX века.
Нахождение в природе
В большом количестве находится в виде иодидов в морской воде. Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны, — в термальных источниках Везувия и на о. Вулькано (Италия). Запасы природных иодидов оцениваются в 15 млн тонн, 99% запасов находятся в Чили и Японии. В настоящее время в этих странах ведётся интенсивная добыча иода, например, чилийская Atacama Minerals производит свыше 720 тонн иода в год.
Сырьём для промышленного получения йода в России служат нефтяные буровые воды, тогда как в зарубежных странах, не обладающих нефтяными месторождениями, используются морские водоросли, а также маточные растворы чилийской (натриевой) селитры, что намного удорожает производство йода из такого сырья.
Физические свойства
Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например в бензоле — в отличие от бурого раствора в полярном спирте. Иод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. При нагревании при атмосферном давлении он сублимируется (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении пары иода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки иода от нелетучих примесей.
Химические свойства
Иод образует ряд кислот: иодоводородную (HI), иодноватистую (HIO), иодистую (HIO2), иодноватую (HIO3), иодную (HIO4).
Химически иод довольно активен, хотя и в меньшей степени, чем хлор и бром.
- С металлами иод при легком нагревании энергично взаимодействует, образуя иодиды:
- Hg + I2 = HgI2
- С водородом иод реагирует только при нагревании и не полностью, образуя йодистый водород:
- I2 + H2 = 2HI
- Элементный иод — окислитель, менее сильный, чем хлор и бром. Сероводород H2S , Na2S2O3 и другие восстановители восстанавливают его до иона I-:
- I2 + H2S = S + 2HI
- При растворении в воде иод частично реагирует с ней:
- I2 + H2O = HI + HIO
Применение
Медицина
5%-ный спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците йода в организме. Продукты присоединения йода к крахмалу, другим ВМС («Синий йод» — Йодинол, Йокс, Бетадин) являются более мягкими антисептиками.
Широко используется в альтернативной (неофициальной) медицине, однако его использование без назначения врача в основном мало обосновано, и нередко сопровождается различными рекламными заявлениями.
См. также
Производство аккумуляторов
Иод используется в качестве положительного электрода (окислителя) в литиево-иодных аккумуляторах для электромобилей.
Лазерный термоядерный синтез
Некоторые иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах иода (исследования в области лазерного термоядерного синтеза и промышленность).
Радиоэлектронная промышленность
В последние годы резко повысился спрос на иод со стороны производителей жидкокристаллических дисплеев.
Динамика потребления иода
Мировое потребление иода в 2005 составило 25,5 тыс. тонн.
Важность для человека
Недостаток йода приводит к заболеваниям щитовидной железы (например, к базедовой болезни, кретинизму) Так же при небольшом недостатке йода отмечается усталость, головная боль, подавленное настроение, природная лень, слабеет память и интеллект, нервозность и раздражительность. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Биологическая роль
Иод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, или ламинария, фукус и другие) накапливают до 1% иода. Иод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
У животных и человека иод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой — тироксина и трииодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
В организме человека (масса тела 70 кг) содержится 12-20 мг иода, суточная потребность в иоде составляет около 0,2 мг (200 мкг). Отсутствие или недостаток иода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом иода, с профилактической целью добавляют иодид калия, иодид натрия или иодат калия (иодированная соль).
Токсичность
Иод — токсичное вещество. Смертельная доза 2-3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров йода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день воспаляются почки, появляется кровь в моче. Если не лечить через 2-3 дня могут отказать почки и наступить миокардит. Без лечения наступает летальный исход.
Иод. Мини-справочник по химическим веществам (3340 веществ)
Алф. указатель: 1-9 A-Z А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Щ Э Я
Синонимы:
йод
Внешний вид:
темно-фиолетов. кристаллы
Кристаллические модификации, цвет растворов и паров:
Кристаллы иода (на фото слева) очень летучи.Окраска растворов иода в растворителях зависит от способности иода давать комплекы с растворителем (на фото справа: в воде, этаноле, бензоле и тетрахлорметане (слева направо)).
Пары иода имеют фиолетовый цвет.
Брутто-формула (система Хилла): I2
Формула в виде текста: I2
Молекулярная масса (в а.е.м.): 253,81
Температура плавления (в °C): 114
Температура кипения (в °C): 185,5
Растворимость (в г/100 г или характеристика):
ацетон: 5,3 (-30°C)ацетон: 2,36 (0°C)
бензол: 16,4 (25°C)
бензол: 19,19 (30°C)
бензол: 25,08 (40°C)
бензол: 34,25 (50°C)
вода: 0,016 (0°C)
вода: 0,028 (20°C)
вода: 0,034 (25°C)
вода: 0,096 (60°C)
вода: 0,45 (100°C)
гексан: 13,9 (25°C)
глицерин: 0,97 (25°C)
диэтиловый эфир: 20 (17°C)
сероуглерод: 17,1 (20°C)
сероуглерод: 20,4 (25°C)
тетрахлорметан: 2,9 (25°C)
хлороформ: 2,63 (20°C)
этанол: 20 (15°C)
Природные и антропогенные источники:
В сухой массе водоросли ламинарии (морской капусты) содержится 0,5% иода в виде солей.Плотность:
4,94 (20°C, г/см3)3,96 (120°C, г/см3)
Давление паров (в мм.рт.ст.):
0,1 (12,1°C)0,31 (25°C)
1 (39,4°C)
10 (73,2°C)
100 (115,8°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
0 (т)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
0 (т)Стандартная энтропия образования S (298 К, Дж/моль·K):
116,15 (т)Стандартная мольная теплоемкость Cp (298 К, Дж/моль·K):
54,43 (т)Аналитические
С крахмалом дает комплекс синего цвета (на фото)
История:
Открыт иод был в общем-то случайно. На селитряном заводе заводские рабочие погнались за кошкой, которая убегая опрокинула сосуд с серной кислотой на остатки солей от выработки селитры. Из образовавшейся смеси неожиданно пошли густые фиолетовые пары. Это явление заинтересовало парижского заводчика Бернарда Куртуа, и он в 1811 г. выделил иод.
Дополнительная информация:
Растворяется в водном растворе иодида калия за счет образования полииодидов. С водным раствором аммиака дает черный, взрывчатый осадок аммиаката нитрида трииода.
- "Справочник химика" т.3, Л.-М.: Химия, 1965 стр. 303
- "Энциклопедия для детей" т.17: Химия, М.:Аванта+, 2004 стр. 83, 246-247
- Гурвич Я.А. "Справочник молодого аппаратчика-химика" М.:Химия, 1991 стр. 48, 50
- Девяткин В.В., Ляхова Ю.М. "Химия для любознательных, или о чем не узнаешь на уроке" Ярославль:Академия Холдинг, 2000 стр. 29
- Рабинович В.А., Хавин З.Я. "Краткий химический справочник" Л.: Химия, 1977 стр. 65
Источники информации:
Алф. указатель: 1-9 A-Z А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Щ Э Я
Еще по теме:
химический элемент Иод Iodium-Jodium — "Химическая продукция"
Что такое Иод, iodium-jodium, характеристики, свойства
Иод — это химический элемент I
Иод класс химических элементов
Элемент I — относится к группе, классу хим элементов ((тривиальное (общеупотребительное) название — йод; от греч. ἰώδης — «фиалковый (фиолетовый)») — химический элемент с атомным номером 53 Принадлежит к 17-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы, или к группе VIIA), находится в пятом периоде таблицы. Атомная масса элемента 126,90447 а. е. м..
Обозначается символом I (от лат. Iodum). Химически активный неметалл, относится к группе галогенов. Простое вещество иод при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Элементарный иод высокотоксичен.
Молекула простого вещества двухатомна) (формула I2 ).
Элемент I свойство химического элемента Иод Iodium-Jodium
Основные характеристики и свойства элемента I…, его параметры. 17-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы, или к группе VIIA), находится в 5 периоде.
Название и обозначение
Название элемента предложено Гей-Люссаком и происходит от др.-греч. ἰο-ειδής (букв. «фиалкоподобный»), что связано с цветом пара, который наблюдал французский химик Бернар Куртуа , нагревая маточный рассол золы морских водорослей с концентрированной серной кислотой. В медицине и биологии данный элемент и простое вещество обычно называют йодом , например, «раствор йода», в соответствии со старым вариантом названия, существовавшим в химической номенклатуре до середины XX века.
В современной химической номенклатуре используется наименование иод . Такое же положение существует в некоторых других языках, например, в немецком: общеупотребительное Jod и терминологически корректное Iod. Одновременно с изменением названия элемента в 1950-х годах Международным союзом общей и прикладной химии символ элементаJ был заменен на I .
История
Иод был открыт в 1811 г. Куртуа. При кипячении серной кислоты с рассолом золы морских водорослей он наблюдал выделение фиолетового пара, при охлаждении превращающегося в темные кристаллы с ярким блеском.
Элементарная природа иода установлена в 1811-1813 гг. Л.Ж. Гей-Люссаком ( а чуть позже и Х.Дэви). Гей-Люссак получил также многие производные ( HI , HIO 3 , I2 O5 , ICl и др.). Важнейшим природным источником иода служат буровые воды нефтяных и газовых скважин.
Нахождение в природе
Иод — редкий элемент. Его кларк — всего 400 мг/т. Однако он чрезвычайно сильно рассеян в природе и, будучи далеко не самым распространенным элементом, присутствует практически везде. Иод находится в виде иодидов в морской воде (20—30 мг на тонну морской воды). Присутствует в живых организмах, больше всего в водорослях (2,5 г на тонну высушенной морской капусты , ламинарии ).
Известен в природе также в свободной форме, в качестве минерала , но такие находки единичны, — в термальных источниках Везувия и на острове Вулькано ( Италия ). Запасы природных иодидов оцениваются в 15 млн тонн, 99 % запасов находятся в Чили и Японии . В настоящее время в этих странах ведётся интенсивная добыча иода, например, чилийская Atacama Minerals производит свыше 720 тонн иода в год. Наиболее известный из минералов иода — лаутарит Ca(IO 3 )2 . Некоторые другие минералы иода — иодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br), майерсит CuI·4AgI.
Сырьём для промышленного получения иода в России служат нефтяные буровые воды, тогда как в зарубежных странах, не обладающих нефтяными месторождениями, используются морские водоросли, а также маточные растворы чилийской (натриевой) селитры, щёлок калийных и селитряных производств, что намного удорожает производство иода из такого сырья
Физические свойства
Пары иода
Жидкий иод на дне химического стакана
Природный иод состоит только из одного изотопа — иода-127. Конфигурация внешнего электронного слоя — 5s 2 p5 . В соединениях проявляет степени окисления −1, 0, +1, +3, +5 и +7 (валентности I, III, V и VII).
Радиус нейтрального атома иода 0,136 нм, ионные радиусы I− , I5+ и I7+ равны, соответственно, 0,206; 0,058-0,109; 0,056-0,067 нм. Энергии последовательной ионизации нейтрального атома иода равны, соответственно: 10,45; 19,10; 33 эВ. Сродство к электрону −3,08 эВ. По шкале Полинга электроотрицательность иода — 2,66, иод принадлежит к числу неметаллов.
Иод при обычных условиях — твёрдое вещество, чёрно-серые или тёмно-фиолетовые кристаллы со слабым металлическим блеском и специфическим запахом.
Пары имеют характерный фиолетовый цвет , так же, как и растворы в неполярных органических растворителях, например, в бензоле — в отличие от бурого раствора в полярном этиловом спирте. Слабо растворяется в воде (0,28 г/л), лучше растворяется в водных растворах иодидов щелочных металлов с образованием трииодидов (например трииодида калия KI 3 ).
При нагревании при атмосферном давлении иод сублимирует (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении при атмосферном давлении пары иода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки иода от нелетучих примесей.
Жидкий иод можно получить, нагревая его под давлением.
Изотопы
Известны 37 изотопов иода с массовыми числами от 108 до 144. Из них только 127 I является стабильным, период полураспада остальных изотопов иода составляет от 103 мкс до 1,57⋅10 7 лет ; отдельные изотопы используются в терапевтических и диагностических целях.
Радиоактивный нуклид 131 I распадается с испусканием β-частиц (наиболее вероятные максимальные энергии — 0,248, 0,334 и 0,606 МэВ), а также с излучением γ-квантов с энергиями от 0,08 до 0,723 МэВ/
Химические свойства
Иод относится к группе галогенов.
Электронная формула ( Электронная конфигурация ) иода: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 5 .
Образует ряд кислот: иодоводородную (HI) , иодноватистую (HIO) , иодистую (HIO 2 ) , иодноватую (HIO 3 ) , иодную (HIO 4 ) .
Химически иод довольно активен, хотя и в меньшей степени, чем хлор и бром .
- Довольно известной качественной реакцией на иод является его взаимодействие с крахмалом , при котором наблюдается синее окрашивание в результате образования соединения включения. Эту реакцию открыли в 1814 году Жан-Жак Колен (Jean-Jacques Colin) и Анри-Франсуа Готье де Клобри (Henri-François Gaultier de Claubry) [13] .
- С металлами иод при легком нагревании энергично взаимодействует, образуя иодиды:
-
- Hg+I2→HgI2 {\\displaystyle {\\mathsf {Hg+I_{2}\\rightarrow HgI_{2}}}}
- С водородом иод реагирует только при нагревании и не полностью, образуя иодоводород :
-
- h3+I2→2HI {\\displaystyle {\\mathsf {H_{2}+I_{2}\\rightarrow 2HI}}}
- Иод является окислителем , менее сильным, чем фтор , хлор и бром . Сероводород H2 S , Na 2 S2 O3 и другие восстановители восстанавливают его до иона I− :
Последняя реакция также используется в аналитической химии для определения иода.
- При растворении в воде иод частично реагирует с ней (По «Началам Химии» Кузьменко: реакция не идёт даже при нагревании, текст нуждается в проверке)
-
- pKc =15,99
- Реакция образования нитрида трииода :
Нитрид трииода в сухом кристаллическом состоянии разлагается с выделением фиолетовых паров иода, что демонстрируется как эффектная химическая реакция.
- Иодиды щелочных металлов очень склонны в растворах присоединять (растворять) молекулы галогенов с образованием полииодидов (периодидов) — трииодид калия , дихлороиодат(I) калия :
Применение
В медицине
5 % спиртовой раствор иода
5-процентный спиртовой раствор иода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците иода в организме. Продукты присоединения иода к крахмалу (т. н. « Синий йод » — Йодинол , Йокс , Бетадин и др.) являются более мягкими антисептиками .
При большом количестве внутримышечных инъекций , на их месте пациенту делается йодная сетка — йодом рисуется сетка на площади, в которую делаются инъекции (например, на ягодицах ). Это нужно для того, чтобы быстро рассасывались «шишки», образовавшиеся в местах внутримышечных инъекций.
В качестве антисептика применяется всё реже и реже.
В рентгенологических и томографических исследованиях широко применяются йодсодержащие контрастные препараты .
Иод-131, как и некоторые радиоактивные изотопы иода (125 I, 132 I) применяются в медицине для диагностики и лечения заболеваний щитовидной железы . Изотоп широко применяется при лечении диффузно-токсического зоба (болезни Грейвса), некоторых опухолей. Согласно нормам радиационной безопасности НРБ-99/2009 , принятым в России, выписка из клиники пациента, лечившегося с использованием иода-131, разрешается при снижении общей активности этого нуклида в теле пациента до уровня 0,4 ГБк
В криминалистике
В криминалистике пары иода применяются для обнаружения отпечатков пальцев на бумажных поверхностях, например, на купюрах.
В технике: рафинирование металлов
Источники света
Иод используется в источниках света:
- галогеновых лампах — в качестве компонента газового наполнителя колбы для осаждения испарившегося вольфрама нити накаливания обратно на неё.
- металлогалогеновых дуговых лампах — в качестве газовой среды разряда используются галогениды ряда металлов, использование различных смесей которых позволяет получать лампы с большим разнообразием спектральных характеристик.
Производство аккумуляторов
Иод используется в качестве компонента положительного электрода (окислителя) в литиево-ионных аккумуляторах для автомобилей.
Лазерный термоядерный синтез
Некоторые иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах иода (исследования в области лазерного термоядерного синтеза).
Радиоэлектронная промышленность
В последние годы резко повысился спрос на иод со стороны производителей жидкокристаллических дисплеев.
Динамика потребления иода
Мировое потребление иода в 2005 году составило 25,8 тыс. тонн
Биологическая роль
Иод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли ( морская капуста , ламинария , фукус и другие) накапливают до 1 % иода. Богаты иодом водные растения семейства рясковых. Иод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
Иод и щитовидная железа
У животных и человека иод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой — тироксина и трииодтиронина , оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
В организме человека (масса тела 70 кг) содержится 12—20 мг иода. Суточная потребность человека в иоде определяется возрастом, физиологическим состоянием и массой тела. Для человека среднего возраста нормальной комплекции (нормостеник) суточная доза иода составляет 0,15 мг.
Отсутствие или недостаток иода в рационе (что типично для некоторых местностей) приводит к заболеваниям ( эндемический зоб , кретинизм, гипотиреоз). В связи с этим к поваренной соли , поступающей в продажу в местностях с естественным геохимическим дефицитом иода, с профилактической целью добавляют иодид калия , иодид натрия или иодат калия ( иодированная соль ).
Недостаток иода приводит к заболеваниям щитовидной железы (например, к базедовой болезни , кретинизму ). Также при небольшом недостатке иода отмечается усталость, головная боль, подавленное настроение, природная лень, нервозность и раздражительность; слабеет память и интеллект. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Избыток йода в пище обычно легко переносится организмом, однако в отдельных случаях в людях с повышенной чувствительностью этот избыток может также привести к расстройствам щитовидной железы/
Токсичность
Иод токсичен. Смертельная доза (LD50) — 3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров иода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, повышение температуры, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день появляется кровь в моче. Через 2 дня появляются почечная недостаточность и миокардит. Без лечения наступает летальный исход/
ПДК иода в воде 0,125 мг/дм³, в воздухе 1 мг/м³.
Радиоактивный иод-131 (радиойод), являющийся бета- и гамма-излучателем, особенно опасен для организма человека, так как радиоактивные изотопы биохимически не отличаются от стабильных. Поэтому почти весь радиоактивный иод, как и обычный, концентрируется в щитовидной железе, что приводит к её облучению и дисфункции. Основным источником загрязнения атмосферы радиоактивным иодом являются атомные станции и фармакологическое производство.
Свойство радиоиода позволяет использовать его для борьбы с опухолями щитовидной железы и диагностики её заболеваний (см. выше).
формула химического элемента Иод Iodium-Jodium
Химическая формула Иода:
Атомы Иод Iodium-Jodium химических элементов
Атомы Iodium-Jodium хим. элемента
Iodium-Jodium Иод ядро строение
Строение ядра химического элемента Iodium-Jodium — I,
История открытия Иод Iodium-Jodium
Открытие элемента Iodium-Jodium —
Иод Iodium-Jodium происхождение названия
Откуда произошло название Iodium-Jodium …
Распространённость Иод Iodium-Jodium
Как любой хим. элемент имеет свою распространенность в природе, I …
Получение Иод Iodium-Jodium
Iodium-Jodium — получение элемента
Физические свойства Иод Iodium-Jodium
Основные свойства Iodium-Jodium
Изотопы Iodium-Jodium Иод
Наличие и определение изотопов Iodium-Jodium
I свойства изотопов Иод Iodium-Jodium
…
Химические свойства Иод Iodium-Jodium
Определение химических свойств Iodium-Jodium
Меры предосторожности Иод Iodium-Jodium
Внимание! Внимательно ознакомьтесь с мерами безопасности при работе с Iodium-Jodium
Стоимость Иод Iodium-Jodium
Рыночная стоимость I, цена Иод Iodium-Jodium
Примечания
Список примечаний и ссылок на различные материалы про хим. элемент I
Химический элемент йод - формула, строение и свойства
История открытия
Йод был открыт в 1811 году французским химиком Бернаром Куртуа (1777—1838). Одна из первых его работ в начале 1800-х годов состояла в том, чтобы помочь своему отцу в изготовлении соединений натрия и калия (нитрат калия, KNO3) из морских водорослей.
Куртуа и его отец собирали водоросли на побережьях Нормандии и Бретани во Франции. Затем они жгли их и смачивали пепел водорослей в воде, чтобы растворить соединения натрия и калия. Однажды в 1811 году Бернар добавил серную кислоту и увидел фиолетовые пары, которые конденсировались, образуя кристаллы с металлическим блеском. Куртуа догадался, что это был новый элемент, который он назвал в честь его цвета (на греческом языке слово «иодес» означает «фиолетовый»).
Куртуа дал небольшое количество этого вещества Шарлю-Бернару Десормесу и Николя Клеману, которые провели систематическое расследование. В ноябре 1813 года они выставили йод в Императорском институте в Париже. То, что это действительно новый элемент, было доказано Джозефом Гей-Люссаком и подтверждено Хамфри Дэви, который отправил отчёт в Королевское учреждение в Лондоне, где ошибочно предположили, что он был первооткрывателем, и это убеждение сохранялось более 50 лет.
Основная информация
Йод является важным элементом, необходимым для жизни. Он наиболее известен своей ролью в выработке гормонов щитовидной железы у людей, а также у всех позвоночных. Дефицит йода может привести к серьёзным проблемам со здоровьем, включая зоб (увеличение щитовидной железы), умственную отсталость и кретинизм.
В качестве чистого элемента он представляет собой блестящий пурпурно-чёрный неметалл, твёрдый при стандартных условиях. Он легко переходит из твёрдого в газообразное состояние, минуя жидкую форму, и выделяет пурпурный пар. Хотя это технически неметалл, он обладает некоторыми металлическими качествами. Основными характеристиками элемента являются:
- Название: Йод.
- Символ: I.
- Атомный номер: 53.
- Атомная масса: 126,90447 а. е. м.
- Температура плавления: 113,5 °C.
- Температура кипения: 184,0 °C.
- Электронная формула йода (Электронная конфигурация): 1s22s22p63s23p63d104s24p64d105s25p5.
- Строение атома: количество протонов — 53, электронов — 53, нейтронов — 74.
- Валентность переменная: -1, +1, (+3), (+4), +5, +7.
- Классификация: галоген.
- Кристаллическая структура: ромбическая.
- Плотность при 20°C: 4,93 г / см3.
- Цвет: чёрно-серый.
Физические свойства
Йод является одним из самых ярких и красивых элементов. Как твёрдое вещество, это тяжёлый, серовато-черный, металлический материал. Среди его основных физических свойств можно выделить:
- При нагревании не плавится. Вместо этого он испаряется. Сублимация — это процесс, при котором твёрдое вещество превращается непосредственно в газ без предварительного плавления. Образующийся пар йода имеет фиолетовый цвет и резкий запах. Если в эти пары помещается холодный объект, йод снова превращается в твёрдое вещество. Образует привлекательные, нежные металлические кристаллы.
- Растворяется в воде лишь незначительно. Но он растворяется во многих других жидкостях, образуя характерные пурпурные растворы.
- При нагревании в надлежащих условиях его можно заставить испаряться при 113,5°C и закипеть при 184 °C. Плотность элемента составляет 4,93 грамма на кубический сантиметр.
- Имеет умеренное давление паров при комнатной температуре, и в открытом сосуде медленно сгущается до глубоких фиолетовых паров, которые раздражают глаза, нос и горло (высококонцентрированный йод является ядовитым и может нанести серьёзный ущерб коже и тканям.) По этой причине йод лучше всего взвешивать в закупоренной бутылке. Для приготовления водного раствора флакон может содержать раствор йодида калия, что значительно снижает давление паров йода.
Химические свойства
Как и другие галогены, йод является активным элементом. Однако он менее активен, чем три галогена, стоящие над ним в периодической таблице. Основные химические свойства йода:
- Его наиболее распространёнными соединениями являются щелочные металлы, натрий и калий. Но он также образует соединения с другими элементами, в том числе с галогенами. Некоторыми примерами являются монобромид йода (IBr), монохлорид йода (ICl) и пентафторид йода (IF 5).
- Молекулярная решётка йода содержит дискретные двухатомные молекулы, которые также присутствуют в расплавленном и газообразном состояниях. Выше 700 °C диссоциация на атомы йода становится заметной.
- Молекула элемента может действовать, как кислота Льюиса в том смысле, что она сочетается с различными основаниями Льюиса. Взаимодействие, однако, слабое, и лишь немногие твёрдые комплексные соединения были выделены. Они легко обнаруживаются в растворе и называются комплексами с переносом заряда. Например, йод слабо растворяется в воде и даёт желтовато-коричневый раствор. Коричневые растворы также образуются со спиртом, эфиром, кетонами и другими соединениями, действующими, как основания Льюиса через атом кислорода.
- Даёт красный раствор в бензоле, который рассматривается, как результат другого типа комплекса с переносом заряда. В инертных растворителях, таких как четырёххлористый углерод или сероуглерод, получаются растворы фиолетового цвета, которые содержат несогласованные молекулы йода.
- Реагирует также с йодид-ионами, поскольку последние могут действовать, как основания Льюиса, и по этой причине растворимость элемента в воде значительно повышается в присутствии йодида. При добавлении йодида цезия кристаллический трийодид цезия может быть выделен из красновато-коричневого водного раствора.
- Образует синий комплекс с крахмалом, и этот цветовой тест используется для обнаружения небольших количеств йода.
- Это более слабый окислитель, чем бром, хлор или фтор.
- Легко соединяется с большинством металлов и некоторыми неметаллами с образованием йодидов. Например, серебро и алюминий легко превращаются в их соответствующие йодиды, а белый фосфор легко объединяется с йодом.
- Водный раствор йодистого водорода (HI), известный как йодистоводородная кислота, является сильной кислотой, которая используется для приготовления йодидов путём реакции с металлами или их оксидами, гидроксидами и карбонатами.
- Проявляет степень окисления +5 в умеренно сильной йодной кислоте (HIO 3), которая может быть легко обезвожена с образованием белого твёрдого пентоксида йода (I 2 O 5).
Наличие в природе
Йода не очень много в земной коре. По оценкам, его количество составляет от 0,3 до 0,5 частей на миллион. Он находится в нижней трети элементов, с точки зрения изобилия. Но, тем не менее, он более распространён, чем кадмий, серебро, ртуть и золото. Его содержание в морской воде ещё меньше — около 0,0003 частей на миллион.
Этот элемент, как правило, концентрируется в земной коре лишь в нескольких местах, когда-то покрытых океанами. За миллионы лет океаны испарились и оставили химические соединения, которые были растворены в них и сегодня существуют под землёй, как соляные копи.
Существует возможность собирать этот элемент из морской воды, солоноватой воды, рассола или морских водорослей. Морская вода имеет разные названия, в зависимости от количества растворенных в ней твёрдых веществ. Водоросли являются популярным источником йода, так как поглощают элементы из морской воды. Со временем они начинают иметь гораздо более высокую концентрацию йода, чем морская вода. Морскую водоросль собирают, сушат и сжигают для сбора вещества. Процесс мало чем отличается от того, который использовал Куртуа в 1811 году.
Изотопы элемента
Известен только один природный изотоп элемента — йод-127. Изотопы — это две или более формы элемента. Они отличаются друг от друга по их массовому числу. Число, написанное справа от названия элемента, является массовым числом. Оно представляет количество протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого одного элемента может варьироваться. Каждая вариация является изотопом.
Примерно 30 радиоактивных изотопов йода были изготовлены искусственно. Это такие изотопы, которые распадаются на части и выделяют некоторую форму радиации. Они образуются, когда очень маленькие частицы обжигают атомы. Эти частицы прилипают к атомам и делают их радиоактивными.
Применение изотопов
Ряд изотопов йода имеет коммерческое использование. В медицинских целях они вводятся в организм пациента через рот, а затем проходят через тело в кровотоке. Когда они путешествуют, то излучают радиацию. Это излучение обнаруживается с помощью рентгеновской плёнки. Медицинский специалист может сказать, насколько хорошо организм функционирует, наблюдая диаграмму направленности. Изотопы йода используются и в следующих целях:
- Йод-123 — в исследованиях мозга, почек и щитовидной железы.
- Йод-125 — для исследования поджелудочной железы, кровотока, печени, поглощения минеральных веществ в костях и потери белков в организме.
- А йод-131 — при исследованиях печени, почек, кровотока, лёгких, мозга, поджелудочной железы.
Наиболее распространённым изотопом является йод-131. При попадании в организм он имеет тенденцию поступать непосредственно в щитовидную железу, а затем используется для выработки гормонов щитовидной железы.
Получение и нахождение
Этот элемент коммерчески производится из йодсодержащих рассолов. Природные рассолы или рассолы, извлечённые из нефтяных скважин, содержащие до 150 мг на литр (0,02 унции на галлон), обнаружены в Яве, Калифорнии и северной Италии. В число ведущих мировых производителей входят Чили, Япония, Китай, Россия и Азербайджан.
Примеси, такие как глина, песок и масло, удаляются фильтрацией, а раствор пропускается через поток диоксида серы, а затем через несколько контейнеров, в которых содержатся пучки медной проволоки. Образующийся йодид меди удаляют фильтрацией, промывают водой, сушат и тонко измельчают. Продукт нагревают с карбонатом калия, получая йодид калия, который затем окисляют до свободного элемента дихроматом и серной кислотой.
Использование и применение
Около 2/3 всего йода и его соединений используется в системах санитарии или в производстве различных антисептиков и лекарств. Вещество также используется для изготовления красителей, фотоплёнки и специального мыла. Он применяется в некоторых отраслях промышленности в качестве катализатора — вещества, используемого для ускорения или замедления химической реакции. Он не претерпевает никаких изменений во время реакции.
Элемент может оказывать как благоприятное, так и неблагоприятное воздействие на живые организмы. Он имеет тенденцию убивать бактерии и другие болезнетворные организмы. Это свойство вещества вызывает его использование в системах санитарии и в качестве антисептика — химического вещества, останавливающего рост микробов.
Настойка йода всегда была одним из самых популярных антисептических препаратов Её наносили на порезы и раны, чтобы предотвратить заражение. Сегодня она часто заменяется другими антисептиками.
Одной из причин того, что сегодня настойка используется реже, является то, что она также может вызвать проблемы. В более высоких дозах йод может раздражать или сжигать кожу. Он также может быть довольно ядовитым, если принимать его внутрь, поэтому важно использовать его согласно инструкции.
Другими важными областями применения йода являются:
- Поскольку он преобразуется в тироксин в щитовидной железе, небольшое его количество имеет важное значение для организма, который содержит в среднем 14 мг (0,00049 унции) элемента. Тироксин — это гормон, необходимый для поддержания нормального обмена веществ во всех клетках организма. Он способен возбудить нервную систему, в особенности кору головного мозга и промежуточный мозг. Во многих местах питьевая вода содержит достаточно йода для этой цели.
- Элемент и его соединения широко используются в аналитической химии. Многие процедуры основаны на выделении или поглощении йода и его последующем титровании с тиосульфатом натрия (йодометрия). Ненасыщенность жиров (то есть количество двойных или тройных связей между атомами углерода) определяется добавлением свободного йода (йодного числа).
- Используется в фотографии, как йодид серебра и йодид калия.
- Йодид серебра также применяется для посадки облаков, чтобы вызвать дождь.
- Используется в производстве красителей.
Биологическая роль
Йод является важным элементом для людей, которым требуется суточное его потребление в количестве около 0,1 мг. Максимальная безопасная для здоровья доза единовременного потребления — 0.5 г (500 мкг). Тело человека содержит до 20 миллиграмм этого элемента, главным образом в щитовидной железе, которая помогает регулировать рост и температуру тела.
Обычно люди получают достаточно йода из пищи, которую они едят. Дефицит же этого микроэлемента может вызвать опухоль щитовидной железы (известный, как зоб). Зоб вызывает большой комок в шее, поскольку щитовидная железа выходит из-под контроля. (Он может вырасти до размера виноградного плода.) Зоб пытается производить гормоны щитовидной железы, но он не получает достаточного количества йода из рациона человека, поэтому продолжает расширяться, пытаясь сделать свою работу.
Недостаток йода может вызвать и другие проблемы. Например, гормоны щитовидной железы необходимы для нормального развития мозга у нерожденного ребёнка и продолжения этого развития после рождения. Люди, которые не включают в свой рацион достаточного количества микроэлемента, не развиваются нормально.
Сегодня эксперты говорят, что низкий уровень йода является основной причиной умственной отсталости, глухоты, мутизма (неспособности говорить) и паралича. К менее серьёзным проблемам относятся сонливость, неуклюжесть и неспособность к обучению.
Количество йода в организме человека очень мало. Для определения его количества вес человека делится на 2 500 000. Полученное число и есть вес элемента в организме. Для нормальных людей эта сумма примерно равна размеру головки булавки, но эта крошечная точка может иметь большое значение для здоровья.
Низкий уровень микроэлемента может быть легко исправлен. Сегодня в большинстве развитых стран компании, производящие поваренную соль, добавляют небольшое количество йодида калия (KI) в соль, которая обозначается «йодированная соль». Люди, которые её используют, получают необходимое количество для нормальной работы щитовидной железы.
Но те, кто живет в развивающихся странах, могут не получать йодированной соли. Всемирная организация здравоохранения (ВОЗ) пытается найти способы обеспечения микроэлементом этих людей. По оценкам ВОЗ, 1,5 млрд человек живут в районах с низким уровнем йода. До 20 млн из этих людей могут иметь психические расстройства из-за его недостатка. ВОЗ начала программу по обеспечению будущего поколения в таких регионах этим микроэлементом, необходимым для нормального развития и функционирования.
Настойка йода - Повторная публикация в Википедии // WIKI 2
Настойка йода , настойка йода или слабый раствор йода - антисептик. Обычно это 2–7% элементарного йода вместе с йодидом калия или йодидом натрия, растворенным в смеси этанола и воды. Растворы настойки характеризуются наличием спирта. Он использовался с 1908 года для предоперационной подготовки кожи хирургом Антонио Гроссихом. [1] [2]
В Соединенном Королевстве разработка йодного раствора для стерилизации кожи была впервые осуществлена Лайонелом Стреттоном. British Medical Journal опубликовал подробную информацию о его работе в Киддерминстерской больнице в 1909 году. [3] Стреттон использовал гораздо более слабый раствор, чем тот, который использовал Гроссих. В 1915 году он утверждал, что Гроссич использовал жидкость, родственную ликёру Йоди Фортис, и что именно он, Стреттон, представил метод с использованием настойки йода BP (?), Которая стала применяться по всему миру. [4]
Энциклопедия YouTube
-
1/3
Просмотры:3 109
3917
1035 446
-
Настойка йода демонстрационная
-
Йод, незаменимые микроэлементы для лечения кист, щитовидной железы, PCOD и др.
Содержание
Формулы Фармакопеи США
USP Настойка йода определена в U.S. Национальный формуляр (NF) содержит в каждых 100 мл от 1,8 до 2,2 граммов элементарного йода и от 2,1 до 2,6 граммов йодида натрия. Спирт 50 мл, остальное - очищенная вода. Этот раствор «2% свободного йода» обеспечивает около 1 мг свободного йода на каплю («2% свободного йода» основано на количестве элементарного йода, а не йодида натрия / калия; 1,8-2,2 грамма I 2 в 100 мл вода соответствует 0,070919-0,086679 MI 2 [MW = 253,80894 а.е.м.]).
Настойка сильного йода USP определяется в NF как содержащая в каждых 100 мл 6.От 8 до 7,5 граммов йода и от 4,7 до 5,5 граммов йодида калия. Вода очищенная - 50 мл, остальное - спирт. Этот 7% раствор настойки примерно в 3,5 раза более концентрирован, чем 2% настойка USP. [необходима ссылка ]
Как и в случае йода Люголя, роль йодида в растворе заключается в увеличении растворимости элементарного йода, превращая его в растворимый трииодид-анион I 3 - . Однако, поскольку йод имеет умеренную растворимость в этаноле, ему также напрямую способствует этот растворитель.Йод Люголя, напротив, не содержит спирта и имеет вдвое большую массу йодида калия, чем элементарный йод. Содержание алкоголя в настойке йода можно определить методами Алкока, Роско - Шорлеммера и Терстона - Терстона. [5]
Использование
Поскольку оба раствора USP содержат элементарного йода , который является умеренно токсичным при проглатывании в количествах, превышающих те, которые требуются для дезинфекции воды, настойка йода продается с пометкой «только для наружного применения» и используется в основном в качестве дезинфицирующего средства.
Настойка йода часто входит в комплекты аварийного спасения, которые используются как для дезинфекции ран, так и для дезинфекции поверхностных вод для питья. Когда спиртовой раствор для этой цели нежелателен, можно использовать йод Люголя без спирта, водный раствор йода в растворе йодида калия или повидон-йод (торговые марки Wokadine, Betadine), раствор PVPI.
Небольшие количества могут быть добавлены в питьевую воду в качестве дезинфицирующего средства (обычно 5 мг свободного йода на литр или 5 капель 2% настойки).Хотя это лечение эффективно против бактерий и вирусов, оно не защищает от простейших паразитов, таких как Cryptosporidium и Giardia . [6]
Раствор йода используется для дезинфекции поверхности фруктов и овощей от бактерий и вирусов. Обычная концентрация для дезинфекции составляет 25 частей на миллион идофора в течение 1 минуты. [7] Однако эффективность зависит от того, проникает ли раствор в трещины и удаляется ли сначала грязь.Но ооциты простейших паразитов не погибнут, а также сомнительно, что споры бактерий погибнут. Растворы йода не следует считать способными дезинфицировать или дезинфицировать салат, фрукты или овощи, загрязненные фекалиями. Таким образом, не следует считать безопасным употребление сырых фруктов, салатов и овощей, продезинфицированных йодом, если они могут быть загрязнены фекалиями. [8]
Настойка йода не является рекомендуемым источником исключительно пищевого йода.Пищевой йод лучше поставляется в форме менее токсичного йодида (см. SSKI) или йодатных солей, которые организм может легко преобразовать в гормон щитовидной железы.
Тем не менее, йодид в настойке йода, используемый в качестве дезинфицирующего средства для воды, действительно обеспечивает более чем достаточный пищевой йод, возможно, в 30 или более раз больше рекомендуемой суточной нормы на литр или кварту. Нанесение настойки или препарата Люголя на кожу также приводит к абсорбции и биодоступности некоторой умеренной доли йода.
См. Также
Список литературы
Внешние ссылки
Эта страница последний раз была отредактирована 29 октября 2020 в 17:59 .Простая английская Википедия, бесплатная энциклопедия
Йод - химический элемент. Его атомный номер (то есть количество протонов в нем) составляет 53, а его атомная масса (количество протонов плюс нейтроны) составляет 127. Он является частью группы 7 (галогены) периодической таблицы элементов и его электронной конфигурация 2,8,8,18,17. [1] Это неметалл.
Физические свойства [изменить | изменить источник]
Йод - твердое вещество темно-пурпурно-черного цвета.Это также неметалл и галоген. При нагревании он возвышается, образуя ярко-фиолетовый пар. Этот пар очень раздражает, хотя и красочен. Йод не растворяется в воде, но он растворяется в растворе йодида в воде. Легко растворяется в органических растворителях.
Химические свойства [изменить | изменить источник]
Йод находится в нижней части галогенов и является наименее химически активным из галогенов. Йод является окислителем, хотя и не таким сильным, как бром или хлор.Он может стать бесцветным иодид-ионом, если другой атом или молекула отдает атому йода один из своих электронов. Это называется редукцией. Йод реагирует с сероводородом или гидразином с образованием иодоводородной кислоты. Йод растворяется в олеуме с образованием ярко-голубого раствора I 2 + и диоксида серы. Этот катион также образуется, когда йод реагирует с пентафторидом сурьмы.
Йод реагирует с основаниями с образованием гипойодита и йодида. Гипойодит непропорционален иодату и йодиду.Йод реагирует с азотной кислотой и хлоратами с образованием йодатов. Йод бурно реагирует с некоторыми металлами, такими как алюминий, с выделением большого количества тепла и токсичных паров.
Химические соединения [изменить | изменить источник]
Йод образует химические соединения в нескольких степенях окисления: -1, +1, +3, +5 и +7. Это типично для галогенов, за исключением фтора. -1 соединения, такие как йодиды, являются наиболее распространенными. Большинство органических соединений йода находятся в степени окисления -1. Большинство йодидов бесцветны или красновато-желтые и являются слабыми восстановителями.Соединения +1 и +3 встречаются довольно редко. Оба они являются окислителями. Соединения +1 встречаются в виде монохлорида йода и гипойодитов. +3 соединения обнаружены как трихлорид йода или трифторид йода. +5 соединений находятся в виде йодатов и йодистой кислоты. Пентафторид йода и пятиокись йода являются соединениями йода в состоянии +5. Соединения +5 и +7 - сильные окислители. +7 обычно встречаются в виде периодатов и периодной кислоты. Гептафторид йода также находится в степени окисления +7.
Йодид калия - один из наиболее распространенных йодидов. Йодиды обычно бесцветны, но на воздухе желтеют, потому что йодид окисляется до йода. Иодиды реагируют с подкисленным диоксидом марганца или хлором с образованием иода. Монохлорид йода - жидкость красного или коричневого цвета. Трихлорид йода, а также трифторид йода представляют собой твердые вещества желтого цвета. Йодаты, такие как йодат калия, представляют собой бесцветные твердые вещества, похожие на хлораты. Йодная кислота - единственная стабильная галогенокислота-окислитель. Хлорная кислота по сравнению с этим очень нестабильна и опасна.Пятиокись йода представляет собой белое твердое вещество, а пентафторид йода - желтоватую жидкость. Периодаты, как и периодат натрия, представляют собой бесцветные твердые вещества, похожие на перхлораты, но более слабые окислители. При нагревании они разлагаются до йодатов. Периодическая кислота не так стабильна, как йодная кислота. Гептафторид йода - единственное соединение йода (VII).
Он был обнаружен Барнардом Куртуа в 1811 году.Он сжег водоросли, чтобы получить карбонат натрия, и прореагировал остаток с серной кислотой. Однажды он вылил слишком много серной кислоты на водоросли, и вышел пурпурный пар, который образовал темно-сине-черные кристаллы на холодной поверхности. У него не хватило денег, чтобы посмотреть, новый это элемент или нет. Он дал образцы нескольким химикам, которые идентифицировали его как элемент в 1813 году.
Йод слишком реактивен, чтобы быть в природе как элемент. Соединения йода в земле встречаются нечасто. В сухих пустынях есть минерал под названием калише.В нем есть йодат. Йодид содержится в морской воде. Келп содержит довольно большое количество йода. Йод - один из самых тяжелых элементов, необходимых живым существам. Если мы не получаем его в достаточном количестве, мы получаем болезнь, известную как зоб. Большая часть соли содержит йод в форме йодида или йодата. Мы также можем принимать таблетки с йодом, чтобы насытиться.
Водоросли были сожжены, а йод извлечен из пепла в 18 и 19 веках, но сейчас их недостаточно для общего пользования. Большая часть йода сейчас извлекается из морской воды.Хлор реагирует с морской водой, превращая йодид в йод. Для испарения йода воду обдувают воздухом. Затем йод восстанавливают диоксидом серы до водоводородной кислоты. Затем иодоводородная кислота снова окисляется хлором с образованием йода. Этот процесс повторяется до тех пор, пока йод не станет чистым.
Очень чистая форма йода образуется при взаимодействии сульфата меди и йодида калия. Это делает иодид меди (II) нестабильным. Он распадается на йодид меди (I) и йод, который является чистым.
Йод используется в качестве катализатора для получения уксусной кислоты. Корм для животных также содержит йод для питания. Йод используется в качестве дезинфицирующего средства. Настойка йода - распространенное йодное дезинфицирующее средство. Йод можно использовать для предотвращения рака щитовидной железы после ядерного взрыва. После ядерного взрыва воздух наполняется радиоактивным йодом. Радиоактивный йод легко проникает в щитовидную железу и вызывает рак. Когда люди принимают таблетки йода, они наполняют щитовидную железу нерадиоактивным йодом, который предотвращает попадание радиоактивного йода внутрь.
Соединения йода можно использовать в рентгеновских лучах, потому что рентгеновские лучи не могут легко проходить через них. Некоторые металлы очищают с использованием их йодидов. Йодид серебра используется в фотопленке и засева облаков. Эритрозин - это пищевой краситель, содержащий йод. Йод может использоваться для изготовления запрещенных препаратов, поэтому в некоторых регионах его использование ограничено. Йод можно использовать как тест на восстановители. Йод становится бесцветным при смешивании с восстановителем. Йод также становится черным при смешивании с крахмалом. Йодиды окрашиваются при смешивании с окислителями.
Йод может раздражать кожу. Его пары раздражают легкие. Однако он менее токсичен, чем другие галогены. 2-3 грамма йода могут убить. Йодиды токсичны только в больших количествах.
.Настойка йода - Простая английская Википедия, бесплатная энциклопедия
Настойка йода - дезинфицирующее средство. Он содержит йод и йодид калия, растворенные в этаноле и воде. Обычно йод не растворяется в воде. Но когда йодид калия добавлен, йод может растворяться. Также этанол способствует растворению йода. Настойка йода содержит примерно равное количество йода и йода. Не пригоден для употребления. Настойка йода бывает двух видов:
Настойка йода USP: на каждые 100 мл приходится 1.От 8 до 2,2 г йода, от 2,1 до 2,6 г йодида натрия и 50 мл этанола. Остальное - вода.
Настойка сильного йода USP : на каждые 100 мл содержится от 6,8 до 7,5 граммов йода, от 4,7 до 5,5 граммов йодида калия и 50 мл этанола. Остальное - вода.
Может использоваться как дезинфицирующее средство для кожи и как дезинфицирующее средство для воды. Применяется для дезинфекции мелких порезов, ожогов и царапин. Поскольку в нем есть йод, он токсичен в больших количествах. Йод Люголя - безалкогольный вариант.Он обычно используется в экспериментах в научных лабораториях средней школы. Это спиртовой раствор йода.
.Настойка йода Информация о лекарствах, профессиональный
Общее название: ЙодВА КЛАССИФИКАЦИЯ
Первичная: DE101
Некоторые часто используемые наименования: настойка йода
{02} {04} {16} и сильная настойка йода. {04} {16}
Примечание: Перечень лекарственных форм и торговых марок по странам доступности см. В разделе (ах) Лекарственные формы .
† В Канаде не продается.
Категория:
Антибактериальные (актуальные) {01} {03} {05} {06} {08} {09} {10} {11 } {13} -
Показания
Допущены
Кожные инфекции, бактериальные, незначительные (профилактика и лечение) - Йод показан как антисептическое и дезинфицирующее средство при местной профилактике и лечении поверхностных кожных инфекций. вызванные чувствительными грамположительными и грамотрицательными бактериями при незначительных ссадинах, ожогах или порезах.Это наиболее эффективное дезинфицирующее средство для неповрежденной кожи, которое используется для дезинфекции кожи перед операцией или перед взятием посевов крови путем венепункции. {01} {03} {05} {07} {08} {09} {10} {11} {13}
Фармакология / Фармакокинетика
Физико-химические характеристики:
Молекулярная масса -
126.9 {01} {23}
Механизм действия / Эффект:
Хотя механизм действия местного йода до конца не изучен, считается, что антимикробное действие лекарства может быть связано с присутствием двухатомной элементарной формы йода (свободный йод). Считается, что йод осаждает белки микроорганизмов путем образования солей путем прямого галогенирования. Примерно 90% йода, абсорбированного бактериальными клетками, снова появляется в виде йодида, тем самым подтверждая окислительное взаимодействие как основной бактерицидный механизм местного действия йода. {01} {06} {13}
Противомикробная активность значительно зависит от pH и выше в кислых условиях.
Растворы йода обычно содержат йодид калия или натрия для повышения растворимости йода за счет образования полииодид-иона. {26}
Другие действия / эффекты:
Йод также обладает фунгицидным, протозоацидным (например, трихомоницидным), цистицидным, вирулицидным, {01} {08} {09} { 13} и некоторые спороцидные активности. {10}
Абсорбция:
Незначительно абсорбируется в виде йодида при местном нанесении на неповрежденную кожу. Поглощение поврежденной кожей и слизистыми оболочками может быть обширным и может привести к 10 4 -кратному увеличению концентрации йода в сыворотке по сравнению с нормой. {01} {26}
Распространение:
Может абсорбироваться щитовидной железой и может появляться в слюне, потом и молоке. {01}
Биотрансформация:
Проходит минимальный метаболизм и превращается в йодид. {01}
Выведение:
Выводится с мочой в неизмененном виде. {01} {18} {26}
Меры предосторожности, которые следует учитывать
Беременность / размножение
Беременность—
Йод проникает через плаценту; не рекомендуется использовать во время беременности из-за возможной абсорбции и побочных эффектов на плод, таких как гипотиреоз и зоб. {01} {14} {19} {20}
Роды и роды -
Использование может привести к значительному поглощению как матерью, так и плодом; Преходящий гипотиреоз был обнаружен у младенцев, подвергавшихся местному воздействию йода после вагинального или промежностного применения перед родами. {19} {21} {22}
Кормление грудью
При местном применении йод может попадать в грудное молоко; Использование не рекомендуется кормящим матерям, поскольку это может привести к перегрузке йодом и преходящему гипотиреозу у грудных детей. {01} {14} {18} {19} {20} {21}
Педиатрия
Использование не рекомендуется для новорожденных из-за их способности к повышенной абсорбции ; местное применение йода может вызвать гиперчувствительность кожи, йодидную перегрузку и преходящий гипотиреоз. {01} {14} {18} {19} {22} {26}
Гериатрия
Соответствующие исследования зависимости возраста от воздействия местного йод не проводился в гериатрической популяции. Однако до настоящего времени не было зарегистрировано никаких проблем, связанных с гериатрией. {01}
Dental
Раствор йода можно наносить на слизистую оболочку полости рта, зубы или резиновые прокладки в антибактериальных целях.Однако это может вызвать раздражение слизистой оболочки, что приведет к ощущению жара или зуда или образованию пузырей. Йод также может обратимо окрашивать слизистую оболочку полости рта, зубы, резиновые прокладки и реставрации из акрила, силиката и фарфора. Эти пятна можно удалить спиртом. {15} {17}
Медицинские соображения / противопоказания
Включенные медицинские соображения / противопоказания были выбраны на основе их потенциальной клинической значимости (причины указаны в скобках, где это уместно) - не обязательно включительно ( » = основное клиническое значение).
Риск-выгода следует рассматривать при наличии следующих медицинских проблем
» Укусы животных или
» Ожоги, тяжелые или обширные или
» Колотые раны, глубокие (риск побочных эффектов, связанных повышенное всасывание и раздражение тканей {01} {02} {06} {09} {13} )
Повышенная чувствительность к йоду {01} {07} {08} {09} {10} {14}
Побочные / побочные эффекты
Следующие побочные / нежелательные эффекты были выбраны на основе их потенциальной клинической значимости (возможные признаки и симптомы указаны в скобках где возможно) - не обязательно включает:
Те, кто указывает на необходимость медицинской помощи
Заболеваемость редко
Дерматит 9002 7 (образование волдырей, образование корок, раздражение, зуд или покраснение кожи) {01} {02} {07} {10} {25}
Симптомы передозировки (при приеме внутрь)
Боль в животе
анурия (не мочеиспускание)
диарея
чрезмерная жажда
0
900
рвота {01} {25}
Консультация пациента
В качестве помощи при консультации пациента см. Рекомендации для пациента, Йод (местный) .
При проведении консультации рассмотрите возможность выделения следующей выбранной информации ( » = основное клиническое значение):
Перед использованием этого лекарства
» Условия, влияющие на использование, особенно:
Повышенная чувствительность к йоду {01} {07} {08} {09} {10}
Беременность - может вызвать проблемы со щитовидной железой у новорожденного. {01} {14} {19} {20}
Кормление грудью - может вызвать проблемы с щитовидной железой у грудных детей
Использование у детей - Может вызвать проблемы с кожей и щитовидной железой у младенцев {01} {14} {18} {19} {22}
Другие проблемы со здоровьем, особенно укусы животных, глубокие раны или серьезные ожоги
Правильное использование этого лекарства
Использование только по назначению
»900 03 Лекарство не глотает
» Держать лекарство подальше от глаз; промывание водой при случайном попадании лекарства в глаза
» Не применять на глубоких колотых ранах, укусах животных или серьезных ожогах
» Не накладывать тугую повязку или повязку на рану, на которую нанесен местный йод применено
» Правильная дозировка
Использование лекарств на протяжении всего курса лечения
Пропущенная доза: Применение как можно скорее; не применять, если почти время для следующей дозы
» Надлежащее хранение
Меры предосторожности при использовании этого лекарства
Обратиться к врачу, если проблема с кожей ухудшается или появляется постоянное раздражение.
Может окрашивать кожу и одежду; удаление пятен на коже спиртом; {08} {09} удаление пятен с одежды путем стирки и ополаскивания в разбавленном аммиаке или с мылом и водой
Побочные / побочные эффекты
Волдыри, образование корок, раздражение, зуд или покраснение кожи { 01} {02} {07} {10} {25}
Общая информация по дозировке
Местный йод не следует использовать при укусах диких или домашних животных.Вместо этого следует немедленно обратиться к врачу для получения надлежащего ухода. {02}
Местный йод не следует использовать для лечения глубоких или колотых ран, а также серьезных ожогов, так как это может усилить абсорбцию и вызвать раздражение тканей. {02}
Поскольку йод может вызвать ожоги окклюзированной кожи, раны, обработанные местным йодом, не следует закрывать плотной повязкой или повязкой. {02}
Для дезинфекции кожи перед медицинскими процедурами, такими как венепункция, люмбальная пункция или плевроцентез, местный йод следует втирать в кожу, работая от центра дезинфицируемой области к периферии концентрическим движением. мода.После нанесения раствору необходимо дать высохнуть в течение не менее 2 минут (время, необходимое йоду для достижения полного эффекта), а затем смыть 70% спиртом, чтобы предотвратить любую возможность повреждения кожи. {03} {09}
Для лечения побочных эффектов и / или передозировки
Рекомендуемое лечение состоит из следующего:
• При тяжелой кожной реакции - местный йод следует удалить с помощью 70% раствора. спиртом {08} {09} или промыть кожу большим количеством воды в течение 15 минут. {16}
• При случайном проглатывании - если пациент находится в сознании, молоко можно давать перорально каждые 15 минут для снятия раздражения желудка; кроме того, раствор крахмала, приготовленный путем добавления 15 мг кукурузного крахмала или муки в 500 мл воды, может быть введен для поглощения оставшегося йода. Не следует проводить рвоту и промывание пищевода при травме пищевода. {25} {26}
• Использование других поддерживающих мер для поддержания жизненно важных функций, включая введение кислорода для поддержания дыхания и введение антигистаминных препаратов, адреналина или кортикостероидов для лечения анафилаксии, особенно если у пациента имеется серьезная болезнь. {25} {26}
Лекарственные формы для местного применения
НАСТОЙКА ЙОДА USP
Обычная доза для взрослых и подростков
Антибактериальные (местные)
Местные, по мере необходимости, на пораженную область. {02}
Примечание: Это лекарство не следует использовать более десяти дней. {02}
Обычная педиатрическая доза
Антибактериальный (местный)
Дети до 1 месяца: использование не рекомендуется. {01} {14} {18} {19} {22}
Дети в возрасте 1 месяц и старше - см. Обычная доза для взрослых и подростков. {01}
Прочность (я) обычно имеется
США -
2% (OTC) [Generic] (спирт 47%) (йодид натрия 2,4%)
Канада -
Нет в продаже.
Упаковка и хранение:
Хранить при температуре ниже 40 ° C (104 ° F), предпочтительно от 15 до 30 ° C (59 и 86 ° F), в герметичном контейнере, если иное не указано производителем. {16} {27}
Несовместимость:
Настойка йода несовместима с аммиаком; соли железа, висмута, меди, свинца и ртути; хлорат калия и другие окислители; минеральные кислоты; стрихнина гидрохлорид; и сульфат хинина и другие соли алкалоидов. {01} {16}
Дополнительная маркировка:
• Только для внешнего использования. {02}
• Хранить в недоступном для детей месте. {02}
НАСТОЙКА СИЛЬНОГО ЙОДА {04} {16} USP
Обычная доза для взрослых и подростков
См. Настойка йода USP.
Обычная педиатрическая доза
См. Настойку йода USP.
Крепость (я) обычно имеется
США -
7% (OTC) [Generic] (спирт 83%) (йодид калия 5%)
Канада -
Нет в продаже.
Упаковка и хранение:
Хранить при температуре ниже 40 ° C (104 ° F), предпочтительно от 15 до 30 ° C (59 и 86 ° F), в герметичном контейнере, если иное не указано производителем. {16} {27}
Несовместимость:
Сильная настойка йода несовместима с аммиаком; соли железа, висмута, меди, свинца и ртути; хлорат калия и другие окислители; минеральные кислоты; стрихнина гидрохлорид; и сульфат хинина и другие соли алкалоидов. {01} {16}
Дополнительная маркировка:
• Только для внешнего использования.
• Хранить в недоступном для детей месте.
Разработано: 22.02.1994
Ссылки
- Dollery C, редактор. Лечебные препараты. Эдинбург: Черчилль Ливингстон, 1991: 149-51.
- Этикетка для бутылок с настойкой йода (Камберленд-Свон - США), Рек. 8/93.
- Strand CL, Wajsbort RR, Sturmann K.Влияние препарата для кожи йодофора и йодной настойки на уровень загрязнения гемокультуры. JAMA 1993; 269 (8): 1004-6.
- Олин Б.Р., редактор. Факты о наркотиках и сравнения. Сент-Луис: Facts and Comparisons Inc, 1992: 634.
- Kuipers JS, Van Weering HK. Обеззараживание кожи соединениями йода. Arch Chir Neerl 1973; 25 (1): 53-65.
- Gottardi W. Влияние химического поведения йода на бактерицидное действие дезинфицирующих растворов, содержащих йод.J Hosp Infect, март 1985 г .; 6 Дополнение A: 1-11.
- Грант Дж. Химическая дезинфекция: выбор и применение. Trop Doct 1977 Apr; 7 (2): 73-5.
- Явец Э. Дезинфицирующие и антисептические средства. В: Кацунг Б.Г., редактор. Фундаментальная и клиническая фармакология. Норуолк: Эпплтон и Ланге, 1992: 691-4.
- Белый JJ, Уоллес СК, Бернетт LS. Дезинфекция кожи. Johns Hopkins Med J, 1970, март; 126 (3): 169-76.
- Селвин С.Оценка дезинфицирующих средств кожи in vivo с помощью эксцизионной биопсии и других методов. J Hosp Infect, март 1985 г .; 6 Дополнение A: 37-43.
- Селвин С., Эллис Х. Кожные бактерии и дезинфекция кожи пересмотрены. Br Med J 1972 Jan; 1: 136-40.
- Тейлор Г.Р., Батлер М. Сравнение вирулицидных свойств хлора, диоксида хлора, хлорида брома и йода. J Hyg 1982; 89: 321-8.
- Aursnes J. Ототоксическое действие йодных дезинфицирующих средств.Acta Otolaryngol 1982; 93 (3-4): 219-26.
- Бюллетень Всемирной организации здравоохранения (ВОЗ) по фармацевтике, октябрь 1992 г .; 10: 5-6.
- Ciancio SG, Bourgault PC. Клиническая фармакология для стоматологов. 2-е изд. Литтлтон: PSG Publishing Co., 1984: 76-7.
- Паспорт материала йода (лаборатория Humco - США), Rec 7/93.
- Допустимые стоматологические терапевтические средства. 40-е изд. Чикаго: Американская стоматологическая ассоциация, 1984: 318-21.
- Chanoine JP, Bourdoux P, Vo Thi NB, Ermans AM. Йодное загрязнение проб мочи тест-полосками. Clin Chem 1987; 33 (10): 1935.
- L'Allemand D, Gruters A, Beyer P, Weber B. Йод в контрастных веществах и дезинфицирующих средствах для кожи является основной причиной гипотиреоза у недоношенных детей во время интенсивной терапии. Horm Res 1987; 28 (1): 42-9.
- Льюис П., редактор. Клиническая фармакология в акушерстве. Бристоль: John Wright & Sons, Ltd., 1983: 139-40.
- Бриггс Г.Г., Фриман Р.К., Яффе С.Дж. Справочное руководство по риску для плода и новорожденного. Препараты при беременности и кормлении грудью. 3-е изд. Балтимор: Уильямс и Уилкинс, 1990: 32.
- Gruters A, L'Allemand D, Heidemann PH, Schurnbrand P. Частота йодного загрязнения при неонатальной транзиторной гипертиротропинемии. Eur J Pediatr, сентябрь 1983 г .; 140 (4): 299-300.
- Fleeger CA, редактор. USAN 1993. USAN и словарь названий лекарств USP.Роквилл, Мэриленд: Фармакопейная конвенция Соединенных Штатов, Inc., 1992: 333.
- Подписка на оценку лекарств. Чикаго: Американская медицинская ассоциация, весна 1990: 4.4-6.
- Dreisbach RH, Робертсон WO. Справочник по отравлениям: профилактика, диагностика и лечение. 12-е изд. Норуолк, Коннектикут: Appleton and Lange, 1987: 362-4.
- Хаддад Л.М., Винчестер Дж. Ф. Тактика ведения при отравлении и передозировке наркотиками. Филадельфия: W.Б. Сондерс Ко., 1983: 697-703.
- Фармакопея США. Национальный формуляр. 22-я редакция Фармакопеи США (1 января 1990 г.). NF 17-е изд (1 января 1990 г.). Роквилл, Мэриленд: Фармакопейная конвенция Соединенных Штатов, Inc., 1990: 703.
Дополнительная информация
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, отображаемая на этой странице, применима к вашим личным обстоятельствам.
Заявление об отказе от ответственности
.Йод - Информация об элементе, свойства и использование
Расшифровка:
Химия в ее элементе: йод
(Promo)
Вы слушаете Химию в ее элементе, представленную вам журналом Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Здравствуйте, на этой неделе кретины, крекеры и чистая вода.История начинается в Италии, а вот и Андреа Селла.
Андреа Селла
Когда я был ребенком, я обычно проводил пару недель каждое лето высоко в итальянских Альпах в идиллической маленькой деревушке под названием Конь, которая тихо уютно устроилась между высокими покрытыми льдом пиками. Для большинства итальянцев это имя ассоциируется с сенсационным убийством. Другие знают, что зимой в долине одни из лучших мест для ледолазания в Альпах. Но для меня Cogne всегда будет связан с йодом.
Однажды днем, когда мне было около 10 лет, возвращаясь с отцом из долгой прогулки, мы миновали унылое серое здание на окраине деревни. Он был окружен высоким металлическим забором и выглядел как учреждение. На скамейке в одиночестве сидел странно выглядящий старик - у него были довольно взлохмаченные волосы, пустой вид и большой вздутый мешочек кожи на месте шеи. Я был совершенно потрясен этим странным существом. Я приставал к отцу вопросами.Кто был он? Что с ним не так? Почему он выглядел таким грустным?
Мой отец, чье терпение перед шквалом вопросов было почти безграничным, объяснил, что бедняк вырос с недостаточным содержанием йода в рационе. Йод, продолжал он, необходим для правильного развития щитовидной железы в области шеи, и что, если человек не будет есть правильную соль, особенно в детстве, у него может развиться зоб, а также пострадает умственное развитие . Позже я читал об английских путешественниках, проезжающих через Альпы, о Кретинских долинах - путевые книги того периода часто включают мрачные иллюстрации этих несчастных.Цифры ошеломляют; Наполеоновская перепись населения кантона Вале в 1800 году обнаружила 4000 кретинов при населении в 70 000 человек - более чем у 50% был бы зоб.
Болезнь была известна медицинским писателям на протяжении веков. Гален, например, рекомендовал лечение морскими губками. В 1170 году Роджер Салерно рекомендовал морские водоросли. Аналогичные предложения были сделаны и в Китае.
Парацельс, великий целитель, алхимик и писатель эпохи Возрождения, был одним из первых, кто заметил связь между зобом и кретинизмом, и первым предположил, что минералы в питьевой воде могут играть роль в возникновении этого состояния.Но что это за загадочные минералы, оставалось загадкой.
В 1811 году молодой французский химик Бернар Куртуа, работая в Париже, наткнулся на новый элемент. Фирма его семьи производила селитру, необходимую для производства пороха для наполеоновских войн. Для этого использовали древесную золу. Нехватка древесины во время войны заставила их вместо этого сжигать водоросли, которых было много на побережье северной Франции. Добавив к золе концентрированную серную кислоту, Куртуа получил удивительно пурпурный пар, который кристаллизовался на стенках контейнера.Пораженный этим открытием, он запаковал кристаллы в бутылки и отправил их одному из ведущих химиков своего времени Жозефу Гей-Люссаку, который подтвердил, что это новый элемент, и назвал его иодом - йод - в честь греческого слова, обозначающего фиолетовый. Куртуа продолжал играть с элементом и был довольно шокирован, обнаружив, что при смешивании с аммиаком он дает твердое вещество шоколадного цвета, которое сильно взрывается при малейшей провокации. Его современнику, Пьеру Дюлонгу, повезло меньше: он потерял глаз и часть руки при изучении материала, став первым в длинном списке жертв из-за этого неприятного материала.
Ядовитые качества йода вскоре были обнаружены, и настойка, представляющая собой желтовато-коричневый раствор, стала широко использоваться в качестве дезинфицирующего средства. Даже сегодня самые распространенные таблетки для очистки воды, которые можно купить в туристических магазинах, содержат йод.
Спустя всего два года после его открытия врач в Женеве Франсуа Коиндэ начал задаваться вопросом, не является ли йод в водорослях отсутствующим минералом, ответственным за зоб. Поэтому он начал давать своим пациентам настойку йода перорально, что было неприятным занятием, но, по его словам, это привело к исчезновению опухоли через 6-10 недель.Однако его коллеги обвинили его в том, что он отравил своих пациентов, и в какой-то момент он, как утверждается, не мог выходить на улицу из-за страха подвергнуться нападению.
Но, хотя элементарный йод явно был токсичен , Коиндет был на правильном пути, и в течение 19 -го века, сделав шаг вперед на два шага назад, гипотеза постепенно получила подтверждение, поскольку эксперименты с использованием более вкусной соли , йодид калия, показал, что зоб можно вылечить. К началу 1920-х годов швейцарские кантоны начали вводить йодированную соль, и в последующие десятилетия многие страны, страдающие от зоба, последовали их примеру, и эта политика была настолько эффективной, что многие из нас в развитом мире не знали, насколько серьезным было это заболевание слово кретин во многом потеряло свое значение.
Когда прошлым летом я вернулся в Конь, я попытался вспомнить, где был институт. Все, что я смог найти, это летний лагерь отдыха, где дети весело играли за воротами, где я видел старика. Я позвонил своему отцу, чтобы спросить его, и мы поговорили о былых временах - плохих старых временах кретинов - и о призраках, изгнанных этим уникальным пурпурным элементом - йодом.
Крис Смит
Призраки, которые явно живут среди британской аристократии. Это был химик из UCL Андреа Селла, рассказывающий о йоде, элементе номер 53.На следующей неделе мы направим внимание на вещество, которое вообще не нуждается в освещении, потому что оно излучает собственный свет.
Brian Clegg
Его считали источником энергии и яркости, его использовали в зубных пастах и патентованных лекарствах - его даже втирали в кожу головы как средство для восстановления волос.
Но применение радия, которое принесло ему известность, заключалось в его использовании в светящейся в темноте краске. Жуткое синее свечение радия, часто используемое для обеспечения световых индикаторов на часах, переключателях самолетов и циферблатах приборов, считалось безобидным и практичным источником ночного освещения.И только когда несколько рабочих, которые красили светящиеся циферблаты, начали страдать от язв, анемии и рака вокруг рта, стало ясно, что что-то не так.
Крис Смит
И вы можете услышать историю радия от Брайана Клегга на следующей неделе в «Химии в его стихии». Надеюсь, вы присоединитесь к нам. Я Крис Смит, спасибо за внимание и до свидания.
(промо)
(конец промо)
.Молекулярная масса йода
Молярная масса of I = 126,90447 г / моль
Перевести граммы йода в моль или моль йода в граммы
| Элемент | Условное обозначение | Атомная масса | Количество атомов | Массовый процент |
| Йод | I | 126.90447 | 1 | 100,000% |
В химии вес формулы - это величина, вычисляемая путем умножения атомного веса (в единицах атомной массы) каждого элемента в химической формуле на количество атомов этого элемента, присутствующего в формуле, с последующим сложением всех этих продуктов вместе.
Формула веса особенно полезна при определении относительного веса реагентов и продуктов в химической реакции. Эти относительные веса, вычисленные по химическому уравнению, иногда называют весами по уравнениям.
Определение молярной массы начинается с единиц граммов на моль (г / моль). При расчете молекулярной массы химического соединения он говорит нам, сколько граммов содержится в одном моль этого вещества. Вес формулы - это просто вес в атомных единицах массы всех атомов в данной формуле.
Часто на этом сайте просят перевести граммы в моль. Чтобы выполнить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать. Причина в том, что на конверсию влияет молярная масса вещества. Этот сайт объясняет, как найти молярную массу.
Атомные веса, используемые на этом сайте, получены от NIST, Национального института стандартов и технологий. Мы используем самые распространенные изотопы. Вот как рассчитывается молярная масса (средняя молекулярная масса), которая основана на изотропно взвешенных средних.Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов. Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные веса и вычислить молекулярную массу вещества.
Если формула, используемая при расчете молярной массы, является молекулярной формулой, вычисленная формула веса является молекулярной массой.Весовой процент любого атома или группы атомов в соединении можно вычислить, разделив общий вес атома (или группы атомов) в формуле на вес формулы и умножив на 100.
.