Фенол кислотные свойства
Химические свойства фенолов | Химия онлайн
Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
I. Реакции с участием гидроксильной группы
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Кислотные свойства
Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода:
Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет.
1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
Видеоопыт «Взаимодействие фенола с металлическим натрием»
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
Видеоопыт «Взаимодействие фенола с раствором щелочи»
Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов. Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:
По кислотным свойствам фенол превосходит этанол в 106 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2- , Br- )
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной.
3) Образование сложных и простых эфиров
Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот:
Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами:
II. Реакции, с участием бензольного кольца
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях (+М-эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Реакции замещения
1) Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов:
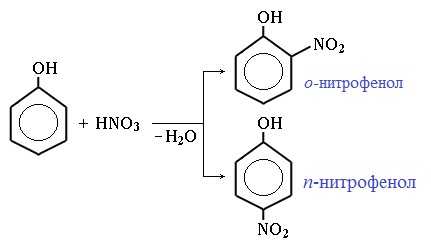
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной.
Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы.

2) Галогенирование
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол!):
Образуется белый осадок трибромфенола.
Видеоопыт «Взаимодействие фенола с бромной водой»
3) Сульфирование
Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер: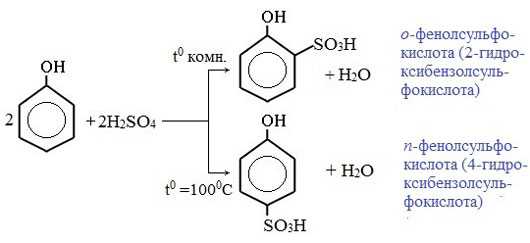 Реакции присоединения
Реакции присоединения
1) Гидрирование фенола
Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
2) Конденсация с альдегидами
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола.
Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол.
III. Реакция окисления
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет.
1) Горение (полное окисление)
Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды.
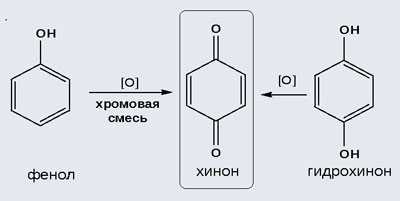
2) Окисление хромовой смесью
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
IV. Качественная реакция! - обнаружение фенола
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Видеоопыт «Качественная реакция на фенол»
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол:
Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.
Фенолы
Кислотные свойства фенолов
Для фенолов, как и для других енолов, характерная кето-енольная таутомерия. Однако большинство одноатомных фенолов существует исключительно в енольной форме. Такая устойчивость енольной формы по сравнению с кетонами обусловлена ароматичностью бензольного ядра, а также высокой степенью сопряжения пары электронов атома гидроксильного кислорода с $\pi$-электронной системой бензольного кольца ($\rho-\pi$-сопряжение):
Рисунок 1.
В результате указанного сопряжения электронная плотность кислорода смещается к бензольному ядру и усиливает его электронодонорные свойства, несмотря на $-I$-эффект $OH$-группы. При этом $O-H$-связь становится более полярной, что способствует ее ионизации с образованием протона и фенолят-аниона. Итак, фенолы - это типичные $OH$-кислоты:
Рисунок 2.
В фенолят-анионе отрицательный заряд атома кислорода значительно делокализован, что повышает его устойчивость, но уменьшает основность по сравнению с алкоксид-анионом $RO^-$. Рассредоточение отрицательного заряда можно передать с помощью резонансных структур I-IV, которые невозможны для алифатических спиртов:
Рисунок 3.
Фенолы как кислоты
Как кислоты фенолы сильнее, чем вода и спирты, но слабее, чем угольная, цианидная и карбоновые кислоты:
Рисунок 4.
Поэтому фенолы взаимодействуют не только с натрием, но и, в отличие от алканолов, с сильными основаниями - щелочами. Со слабыми основаниями вроде гидрокарбонатов щелочных металлов фенолы не взаимодействуют:
Рисунок 5.
Это используют для разделения смесей спиртов, фенолов и карбоновых кислот по схеме:
Рисунок 6.
Приведенный способ разделения не может быть применен, если все три исходных соединения растворяются в воде.
Феноляты щелочных металлов аналогично солям сильных оснований и слабых кислот легко гидролизуются водой, и раствор проявляет сильнощелочную реакцию:
Рисунок 7.
Зависимость кислотности фенолов зависит от заместителя в ядре
Кислотность фенолов зависит от природы заместителя в ядре. Электроноакцепторные заместители увеличивают кислотность, а электронодонорные - уменьшают. Влияние природы заместителя на фенолы противоположна его действия на основность ароматических аминов. Так, введение сильной акцепторной нитрогруппы изменяет значение показателя кислотности $pK_a$ фенолов следующим образом:
Рисунок 8.
Повышение кислотности объясняется способностью $NO_2$-группы участвовать в делокализации отрицательного заряда феноксидного аниона. При наличии в молекуле фенола трех нитрогрупп кислотные свойства, например, пикриновой кислоты достигают уровня минеральных.
В таблице 1 приведены значение показателя кислотности $pK_a$ некоторых замещенных фенолов в воде при 25$^\circ$С с расположением заместителя в орто-, мета- и пара- положении.
Значение $pK_a$ орто-, мета- и пара-замещенных фенолов в воде при 25$^\circ$С:
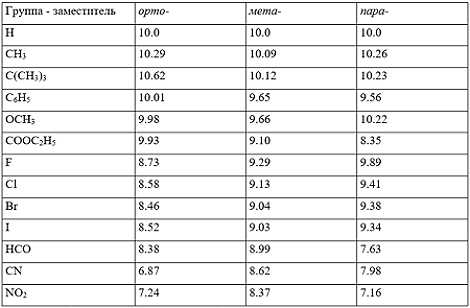
Рисунок 9.
В таблице 2 приведены значение показателя кислотности $pK_a$ некоторых замещенных фенолов в воде при 25$^\circ$С.
Значение $pK_a$ замещенных фенолов в воде при 25$^\circ$С:
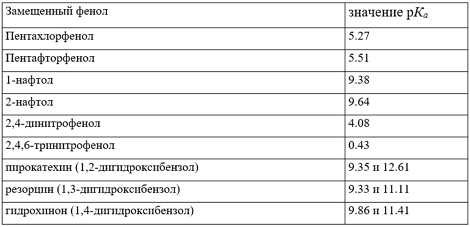
Рисунок 10.
Феноляты тяжелых металлов
Фенолы способны образовывать феноляты не только со щелочными металлами, но и с солями тяжелых металлов. Так, с солями железа (III) они дают окрашенные в фиолетовый цвет комплексные соединения, поэтому соли $Fe$(III) выступают как реактивы на енольный (фенильный) гидроксил:
Рисунок 11.
Химические свойства фенолов Кислотные свойства фенолов
Несмотря на то, что фенолы по строению подобны спиртам, они являются намного более сильными кислотами, чем спирты. Вместе с тем делокализация заряда в феноксид-ионе происходит в меньшей степени, чем в карбоксилат-ионе, соответственно фенолы более слабые кислоты по сравнению с карбоновыми кислотами. Фенолы растворяются в водном растворе гидроксида натрия, но они не реагируют c гидрокарбонатом натрия. Это простейший, хотя и не очень надежный тест, по которому можно различать фенолы и карбоновые кислоты, которые взаимодействуют c гидрокарбонатом натрия c выделением углекислого газа. Влияние заместителя в бензольном кольце на кислотность фенолов согласуется с представлениями об их электронных эффектах. Электронодонорные заместители понижают, a электроноакцепторные - усиливают кислотные свойства фенолов. Фенолы диссоциируют в водных растворах с образованием фенолят-ионов и ионов водорода:
В отличие от спиртов, фенолы реагируют не только с щелочными и щелочноземельными металлами, но и с растворами щелочей, образуя феноляты:
С увеличением длины углеводородного радикала скорость этой реакции замедляется. В присутствии следов влаги образующиеся алкоголяты разлагаются до исходных спиртов.
Таутомерия фенолов
Между амбидентными феноксид- и енолят-ионами существует определенная аналогия. Фенол также является аналогом енола и между ним и его кето-формами (2,4- и 2,5-циклогексадиенами) должны существовать отношения, подобные тем, которые наблюдаются для равновесия кето- и енольной форм кетонов.
Соотношение двух таутомерных форм здесь полностью обратно тому, которое наблюдается для кетонов, где преобладает кето-форма. Устойчивость таутомерных кето-форм возрастает при переходе к полиатомным фенолам. Так, при плавлении 1,4-дигидроксинафталина получается равновесная смесь, содержащая 10%-дикетоформы.
В 1968 году В.А.Коптюг с сотрудниками предложил простой и чрезвычайно эффективный способ стабилизации кето-формы разнообразных фенолов с помощью сильных кислот Льюиса - хлорида или бромида алюминия. Эти жесткие кислоты Льюиса связывают жесткий карбонильный кислород кето-формы в очень стабильный комплекс, который может быть зафиксирован. Кето-енольная таутомерия лежит в основе замещения фенольного гидроксила на аминогруппу, которое происходит при нагревании 1- или 2-гидроксинафталина, сульфопроизводных α- и β-нафтолов, 6- или 8-гидроксихинолинов и других гидроксипроизводных нафталина, антрацена, хинолина с водным раствором сульфита или гидросульфита аммония при 130-150оС.
2.3 Этерификация фенолов
Ариловые эфиры карбоновых кислот получают ацилированием фенолов или их Na-, K-солей галогенангидридами или ангидридами кислот.
Реакции электрофильного замещения в ароматическом кольце
Гидроксильная группа относится к числу групп, активирующих электрофильное замещение в ароматическом кольце и направляющих заместитель в орто- и пара- положения. Активирующее влияние гидроксильной группы настолько сильно, что в отдельных случаях реакцию трудно остановить на стадии введения только одного заместителя. Фенолы вступают практически во все типичные реакции электрофильного замещения как с сильными, так и со слабыми электрофильными агентами.
Галогенирование фенолов
Галогенирование фенолов не требует катализа кислотами Льюиса (FeCl3, FeBr3, AlCl3 и др.) и легко осуществляется под действием молекулярного галогена. Галогенирование фенола молекулярным бромом или хлором в полярной среде практически невозможно остановить на стадии моногалогенирования, поскольку реагирующей частицей здесь является фенолят-ион. Фенолят-ион содержит очень сильную активирующую группу - анион кислорода и скорость галогенирования фенолят-иона по крайней мере в тысячу раз выше, чем фенола. Галогензамещенный фенол является более сильной кислотой, чем фенол, он легче диссоциирует, что облегчает введение второго и третьего атома галогена в орто- и пара-положения.
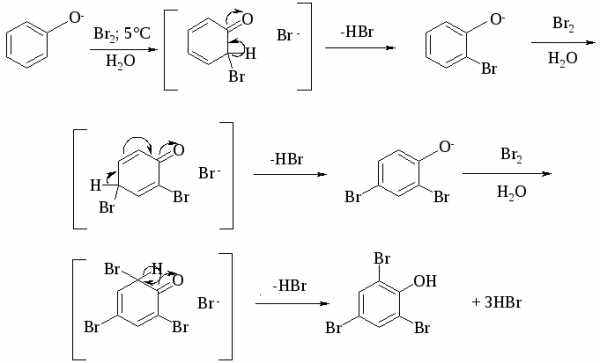
При бромировании фенола в растворе бромистоводородной кислоты или при хлорировании в соляной кислоте диссоциация полностью подавляется и галогенированию подвергается сам фенол. При этом в зависимости от условий и количества галогена может быть получен п-бромфенол или 2,4-дибромфенол.
Аналогичным образом протекает и хлорирование фенола, но здесь получается значительное количество о-хлорфенола. Моногалогензамещенные производные фенолов удобно получать при галогенировании в неполярной среде, что также исключает диссоциацию фенолов.
Во всех случаях соотношение пара- и орто-изомеров при бромировании и иодировании значительно выше, чем при хлорировании.
Фенол: общая и структурная формулы, химические свойства, применение
Закрыть- Болезни
- Инфекционные и паразитарные болезни
- Новообразования
- Болезни крови и кроветворных органов
- Болезни эндокринной системы
- Психические расстройства
- Болезни нервной системы
- Болезни глаза
- Болезни уха
- Болезни системы кровообращения
- Болезни органов дыхания
- Болезни органов пищеварения
- Болезни кожи
- Болезни костно-мышечной системы
- Болезни мочеполовой системы
- Беременность и роды
- Болезни плода и новорожденного
- Врожденные аномалии (пороки развития)
- Травмы и отравления
- Симптомы
- Системы кровообращения и дыхания
- Система пищеварения и брюшная полость
- Кожа и подкожная клетчатка
- Нервная и костно-мышечная системы
- Мочевая система
- Восприятие и поведение
- Речь и голос
- Общие симптомы и признаки
- Отклонения от нормы
- Диеты
- Снижение веса
- Лечебные
- Быстрые
- Для красоты и здоровья
- Разгрузочные дни
- От профессионалов
- Монодиеты
- Звездные
- На кашах
- Овощные
- Детокс-диеты
- Фруктовые
- Модные
- Для мужчин
- Набор веса
- Вегетарианство
- Национальные
- Лекарства
- Антибиотики
- Антисептики
- Биологически активные добавки
- Витамины
- Гинекологические
- Гормональные
- Дерматологические
- Диабетические
- Для глаз
- Для крови
- Для нервной системы
- Для печени
- Для повышения потенции
- Для полости рта
- Для похудения
- Для суставов
- Для ушей
- Желудочно-кишечные
- Кардиологические
- Контрацептивы
- Мочегонные
- Обезболивающие
- От аллергии
- От кашля
- От насморка
- Повышение иммунитета
- Противовирусные
- Противогрибковые
- Противомикробные
- Противоопухолевые
- Противопаразитарные
- Противопростудные
- Сердечно-сосудистые
- Урологические
- Другие лекарства
- Врачи
- Клиники
- Справочник
- Аллергология
- Анализы и диагностика
- Беременность
- Витамины
- Вредные привычки
- Геронтология (Старение)
- Дерматология
- Дети
- Женское здоровье
- Инфекция
- Контрацепция
- Косметология
- Народная медицина
- Обзоры заболеваний
- Обзоры лекарств
- Ортопедия и травматология
- Питание
- Пластическая хирургия
- Процедуры и операции
- Психология
- Роды и послеродовый период
- Сексология
- Стоматология
- Травы и продукты
- Трихология
- Другие статьи
- Словарь терминов
- [А] Абазия .. Ацидоз
- [Б] Базофилы .. Богатая тромбоцитами плазма
- [В] Вазектомия .. Выкидыш
- [Г] Галлюциногены .. Грязи лечебные
- [Д] Дарсонвализация .. Дофамин
- [Ж] Железы .. Жиры
- [З] Заместительная гормональная терапия
- [И] Игольный тест .. Искусственная кома
- [К] Каверна .. Кумарин
- [Л] Лапароскоп .. Лучевая терапия
- [М] Магнитотерапия .. Мутация
- [Н] Наркоз .. Нистагм
- [О] Общий анализ крови .. Отек
- [П] Паллиативная помощь .. Пульс
- [Р] Реабилитация .. Родинка (невус)
- [С] Секретин .. Сыворотка крови
- [Т] Таламус .. Тучные клетки
- [У] Урсоловая кислота
- [Ф] Фагоциты .. Фитотерапия
- [Х] Химиотерапия .. Хоспис
- [Ц] Цветовой показатель крови .. Цианоз
- [Ш] Штамм
- [Э] Эвтаназия .. Эстрогены
- [Я] Яд .. Язва желудка
Фенолы кислотные свойства - Справочник химика 21
Химические свойства фенолов Кислотные свойства [c.42]Кислотность фенолов зависит от характера заместителей в ядре. Введение в бензольное ядро электроноакцепторных заместителей (нитрогруппы, атомов галогенов и др.) приводит к увеличению кислотных свойств фенола. Например, тринитрофенол (пикриновая кислота) по силе приближается к соляной кислоте (р/Са = 0,4). [c.311]
Так вот, атом водорода карбоксильной группы отделяется от нее в миллион раз легче, чем от гидроксильной группы фенола. Поэтому всякое органическое вещество, содержащее карбоксильную группу, обладает ярко выраженными кислотными свойствами. Такие вещества носят название карбоновых кислот. [c.153]
У фенола кислотные свойства выражены сильнее, чем у одноатомных спиртов. Это объясняется тем, что л-связь бензольного кольца взаимодействует с неподе-леиной электронной парой атома кислорода в ОН-группе, увеличивая полярность связи О—С. В результате фенол способен взаимодействовать не только с щелочными металлами, но и с щелочами (вот почему С(,НбОН относили и к кислотам, а пе только к спиртам) [c.226]
Чем объяснить, что функциональная группа спиртов у фенола обусловливает его кислотные свойства [c.77]
Каждая из приведенных резонансных структур демонстрирует возможное крайнее смещение электронной плотности в бензольное кольцо. Все в совокупности они передают характер взаимодействия гидроксильной группы с бензольным ядром. Важным при этом оказывается еще более сильная, чем в спиртах, поляризация связи Оч-Н и как следствие этого — резкое усиление кислотных свойств фенолов, которые в отличие от спиртов взаимодействуют со щелочами [c.152]
КИСЛОТНЫЕ СВОЙСТВА СПИРТОВ И ФЕНОЛОВ [c.151]
Ниже приведены в произвольном порядке константы кислотности (Ка). 1) феноля, 2) этилового спирта, 3) воды, 4) уксусной кислоты, 5) угольной кислоты 1,3-10- 0 1,8-10- б 4,9-10-7 1,76-10-5 1,0-10- 8. Какое значение Ка принадлежит каждому из этих соединений Чем обусловлены кислотные свойства фенола [c.165]
Как уже было указано, ароматическими спиртами называются производные бензола, имеющие гидроксильную группу в боковой цепи. По химическим свойствам эти соединения близки спиртам жирного ряда, а не фенолам. Они не растворяются в водных щелочах, и, следовательно, кислотные свойства у них выражены значительно слабее, чем у фенолов обычно они имеют приятный ароматический запах. Способы получения ароматических спиртов также аналогичны способам получения спиртов жирного ряда они получаются из соответствующих галоидпроизводных или путем восстановления альдегидов и эфиров кислот, а не из сульфокислот или солей диазония, подобно фенолам. [c.563]
Благодаря наличию у фенолов кислотных свойств простейший из фенолов получил в свое время название карболовая кислота . [c.44]
Объясните, почему фенолы имеют более сильные кислотные свойства, чем спирты. При наличии каких заместителей усиливаются кислотные свойства фенола Приведите примеры. [c.61]
Кислотные свойства фенола проявляются при взаимодействии с основаниями. Образующиеся феноляты в отличие от алкоголятов способны существовать в водных растворах щелочей [c.367]
Кислотные свойства. Сопряжение неподеленной пары электронов атома кислорода гидроксильной группы с я-электронной системой бензольного кольца (р, я-сопряжение) приводит к смещению в его сторону электронной плотности. В результате связь О—Н настолько ослаблена, что атом водорода гидроксильной группы может отщепляться в виде протона с образованием фенолят-иона [c.310]
При замещении водорода ароматического кольца на гидроксид-ную группу образуется фенол. Под влиянием бензольного кольца полярность связи кислород — водород возрастает, поэтому фенолы диссоциируют в большей степени, чем спирты, проявляют кислотные свойства. Атом водорода в гидроксидной группе фенола может быть замещен на катион металла под воздействием основания [c.308]
Напишите уравнение реакции фенола с бромной водой. По какому механизму она идет Какую роль в ней играет вода Как влияет бром на кислотные свойства гидроксильной группы [c.167]
В качестве катализаторов реакции ацетилена со спиртами можно использовать алкоголяты, с фенолом — феноляты и т, д., но чаще всего применяют гидроксиды щелочных металлов. Лучшие результаты дает едкое кали, образующее с органическим реагентом, обладающим кислотными свойствами, металлическое производное [c.302]
Такое электронное смещение в фенолят-ионе объясняет и его повышенную устойчивость. Поэтому фенолы значительно превосходят по кислотным свойствам алифатические спирты (для фенола р/(а = = 9,99, а р/Са алифатических спиртов равно 16—18, т. е. на 6—8 порядков меньше). [c.311]
Фенол СбНзОН — бесцветные кристаллы (темп, плавл. 41 °С). Обладает характерным запахом и антисептическими (обеззараживающими — подавляющими развитие вредных микроорганизмов) свойствами. Как уже указывалось, кислотные свойства гидроксильного водорода выражены у фенола значительно сильнее, чем у спиртов замещение этого водорода металлом может происходить не только при действии щелочных металлов, но и при действии щелочей. Поэтому фенол называют также карболовой кислотой. [c.573]
Именно кислотные свойства фенолов предопределили их использование как антисептиков (карболовая кислота и др.). [c.43]
Дли получения моноокснэтплированных производных карбоновых кислот, фенолов, меркаптанов и других веществ с кислотными свойствами мольное отношение исходных реагентов может быть близким к единице (величина (Зг на рис. 83, б), причем уже небольшой избыток непревращенного кислотного реагента обеспечивает образование монооксиэтильного производного с выходом, близк м к 100%. В отличие от этого, при синтезе полиоксиэтили-рован ых соединений (полигликоли, неионогенные моющие вещества) необходим избыток а-оксида, соответствуюш,ий желаемой длине цепи. [c.287]
Помимо
Общая характеристика фенолов
Реферат на тему:
«Фенолы»
Преподаватель: Петришек
Ирина Александровна
Выполнил:
студент 2 курса 9 группы
фармацевтического факультета
Владлен Ардисламов
Фенолами называются производные аренов, в которых один или несколько атомов водорода замещены на гидроксильные группы
ОН-группы фенолов называют фенольными гидроксильными группами.
Многие фенолы и их производные представлен в растительном мире (пигменты, дубильные вещества, лигниновые компоненты древесины). Фенолы используются в медицине (является мощным противогрибковым и противобактериальным антисептиком; при попадании в организм человека в достаточном количестве вызывает отравление с поражением большинства органов и систем), в фармацевтической промышленности, в производстве полимеров, красителей, душистых веществ, средств защиты растений. Фенолы и их производные используются в нефтяной промышленности (в качестве антиполяримезаторов). Гидрохинон применяется в качестве косметического средства для устранения дефектов кожи, в качестве ингибитора реакции свободнорадикальной полимеризации метилметакрилата входит в состав стоматологических композиционных материалов химического отверждения. Пирокатехин применяют в фотографии как проявитель, в производстве красителей, лекарственных веществ (например, адреналина).
По числу гидроксильных групп в ароматическом кольце различают одно и многоатомные фенолы. Для большинства фенолов и некоторых их гомологов используются тривиальные названия, принятые номенклатурой ИЮПАК.
Представители:
Фенол:

О-Крезол м-Крезол п-Крезол
а-нафтол b-нафтол
Пирокатехин Резорцин Гидрохинон
Пирогаллол
Физические свойства фенолов
Фенол и его низшие гомологи представляют собой бесцветные низкоплавкие кристаллические вещества или жидкости с довольно сильным характерным запахом. Запах фенола в воздухе при низких концентрациях (4мг/м3). Двух- и трехатомные фенолы- твердые вещества, без запаха, с достаточно высокими температурами плавления. Фенолы менее летучи чем спирты с близкой молекулярной массой, так как образуют более прочные межмолекулярные водородные связи.
Фенол умеренно растворим в воде (8.2% при 15С*). Другие одноатомные фенолы в воде малорастворимы, но легко растворяются в эфире, бензоле, спирте и хлороформе. Увеличение числа гидроксильных групп обуславливает повышение растворимости многоатомных фенолов в воде. В полярных многоатомных растворителяхмногоатомные фенолы так же ххорошо растворимы.
Фенолы и особенно нафтолы относятся к высокотоксичным веществам. Их выброс в водоемы причиняет непоправимый вред природе.
Получение фенолов
Кумольный метод (Сергеева)
Большую часть фенола в настоящее время производят из изопропилбензола – кумола. Окислением кумола воздухом получают гидроперекись кумола, разлагающуюся под действием водных растворов минеральных кислот на фенол и ацетон. Кумол синтезируют из бензола и пропилена.
Кумол
Гидроперекись кумола
Механизм:
(М 3)
и т.д.
(М 4)
Аналогично ведет себя гидроперекись втор-бутила.
Гидролиз арилгалогенидов
Хлор в хлорбензоле малоподвижен и поэтому гидролиз ведут 8%-ным раствором NaOH в автоклаве при 250оС в присутствии солей меди:
Феноксид натрия
По методу Рашига хлорбензол получают окислением бензола в присутствии хлороводорода:
Гидролиз хлорбензола осуществляют перегретым паром в присутствии медного катализатора. Образующийся при этом хлороводород возвращают на первую стадию процесса:
Гидролиз в присутствии щелочи проходит при более низкой температуре, но при этом теряется ценная соляная кислота, сохраняющаяся в методе Рашига.
Сплавление арилсульфонатов со щелочью
При сплавлении со щелочью арилсульфонаты претерпевают реакцию замещения:
Бензолсульфокислота Бензолсульфонат натрия
Превращение фенолята натрия в фенол осуществляется с помощью диоксида серы, который образуется на второй стадии:
Фенол получают в виде водного раствора, из которого его выделяют дистилляцией. Этот метод синтеза фенола является самым старым (1890 г.). Метод используется для получения и других фенолов, например:
Разложение солей диазония
Прямое окисление бензола
С6Н6+О2 (боксит, 300-750С*) С6Н5ОН
Сложность данного превращения заключалась в том, что бензол окисляется легче, чем фенол. Известно как каталиитическое окисление кислородом воздуха (на схеме реакции), так и с применением различных комбинаций окислителей (пероксиды) и катализаторов (соли меди, железа, титана и т.д.).
Выделение из природного сырья
Фенолы выделяют из каменноугольной смолы при перегонке и химической обработке, получая смесь фенолов; из отходов переработки нефти.
4. Гидроксилирование аренов
Для прямого введения гидроксильной группы в бензольное кольцо используют пероксид водорода в присутствии катализаторов (солей железа (П) или меди (П):
5. Окислительное декарбоксилирование карбоновых кислот
Фенолы получают из ароматических кислот пропуская в реактор водяной пар и воздух при температуре 200-3000С в присутствии солей меди (П):
6. Получение из солей диазония
При нагревании арендиазониевых солей в водных растворах выделяется азот с получением фенолов:
Физические свойства фенолов
Простейшие фенолы при обычных условиях представляют собой низкоплавкие бесцветные кристаллические вещества с характерным запахом.
Фенолы малорастворимы в воде, но хорошо растворимы в органических растворителях. При хранении на воздухе темнеют вследствие процессов окисления.
Являются токсичными веществами, вызывают ожоги кожи.
Электронное строение фенола
Строение и распределение электронной плотности в молекуле фенола можно изобразить следующей схемой:

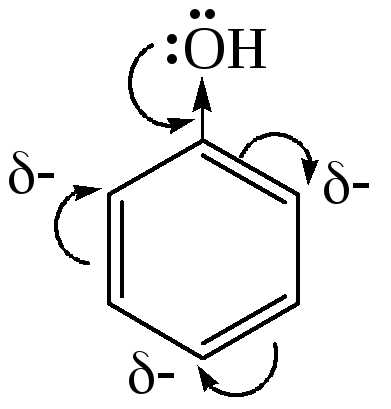
Гидроксильная группа является заместителем 1 рода, т.е. электроно-донорным заместителем.
Это обусловлено тем, что одна из неподеленных электронных пар гидроксильного атома кислорода вступает в р,π-сопряжение с π-системой бензольного ядра, проявляя +М-эффект.
С другой стороны, гидроксильная группа, вследствие большей электроотрицательности кислорода, проявляет –I-эффект.
Однако +М-эффект в фенолах значительно сильнее противоположно направленного –I-эффекта (+М > -I).
Результатом эффекта сопряжения является:
1) увеличение полярности связи О-Н, приводящее к усилению кислотных свойств фенолов по сравнению со спиртами;
2) вследствие сопряжения связь С-ОН у фенолов становится короче и прочнее в сравнении со спиртами, так как носит частично двойной характер. Поэтому затрудняются реакции замещения ОН-группы;
3) повышение электронной плотности на атомах углерода в орто- и пара-положениях бензольного ядра облегчает реакции электрофильного замещения атомов водорода в этих положениях.
Химические свойства фенолов Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
1. Реакции по гидроксильной группе
1. Кислотные свойства
Фенолы являются слабыми ОН-кислотами, но значительно более сильными по сравнению с алканолами. Константа кислотности рКа фенола равна 10.
Более высокая кислотность фенола объясняется двумя факторами:
1) большей полярностью связи О-Н в фенолах, в результате чего атом водорода гидроксильной группы приобретает большую подвижность и может отщепляться в виде протона с образованием фенолят-иона;
2) Фенолят-ион за счет сопряжения неподеленной пары кислорода с бензольным кольцом мезомерно стабилизирован, т.е. отрицательный заряд на атоме кислорода фенолят-иона значительно делокализован:
Ни одна из этих граничных структур в отдельности не описывает реального состояния молекулы, но их использование позволяет объяснять многие реакции. Электроноакцепторные заместители увеличивают кислотные свойства фенола.
Оттягивая электронную плотность из бензольного ядра на себя, они способствуют усилению р,π-сопряжения (+М-эффект), тем самым повышают поляризацию связи О-Н и увеличивают подвижность атома водорода гидроксильной группы.
Например:
фенол 2-нитрофенол 2,4-динитрофенол пикриновая кислота
рКа 9,98 7,23 4,03 0,20
Электронодонорные заместители уменьшают кислотность фенолов.
Почему фенол проявляет кислотные свойства и его относят к кислотам
По электронному строению фенолы являются полярными соединениями, или диполями. Отрицательный конец диполя – это бензольное кольцо, положительный – группа –OH. Дипольный момент направлен к бензольному кольцу.
Поскольку гидроксильная группа – заместитель I рода, она повышает электронную плотность, особенно для орто- и пара-положений, в бензольном кольце. Это объясняется сопряжением, возникающим между одной из неподеленных электронных пар атома кислорода в OH-группе и π-системой кольца. Такое смещение неподеленной пары электронов приводит к повышению полярности связи O-H.
Взаимное влияние атомов и атомных групп в фенолах отражается на свойствах этих веществ. Так, увеличивается способность к замещению водородных атомов в орто- и пара-положениях бензольного ядра, и обычно в результате таких реакций замещения образуются тризамещенные производные фенола. Повышение полярности связи между кислородом и водородом обусловливает появление достаточно большого положительного заряда (δ+) на атоме водорода, в связи с чем фенол диссоциирует в водных растворах по кислотному типу. В результате диссоциации образуются фенолят-ионы и катионы водорода.
Фенол C6H5OH – слабая кислота, называемая также карболовой кислотой. В этом заключается главное отличие фенолов от спиртов – неэлектроолитов.
По физическим свойствам C6H5OH – бесцветное кристаллическое вещество с температурой плавления 43˚C и температурой кипения 182˚C. На воздухе он окисляется и приобретает розовую окраску. При обычных условиях фенол ограниченно растворим в воде, но при нагревании выше 66˚C смешивается с h3O в любых отношениях. Это токсичное для человека вещество, способное вызывать ожоги кожи, антисептик.
Подобно всем кислотам, фенол диссоциирует в водных растворах, а также взаимодействует со щелочами с образованием фенолятов. Например, реакция C6H5OH и NaOH дает в итоге фенолят натрия C6H5ONa и воду h3O:
C6H5OH+NaOH=C6H5ONa+h3O.
Это свойство отличает фенолы от спиртов. Сходство со спиртами – реакция с активными металлами с образованием солей – фенолятов:
2C6H5OH+2K=2C6H5OK+h3↑.
Феноляты натрия и калия, образующиеся в результате двух последних реакций, легко разлагаются под действием кислот, даже такой слабой, как угольная. Из этого можно сделать вывод, что фенол – более слабая кислота, чем h3CO3:
C6H5ONa+h3O+CO2=C6H5OH+NaHCO3.
Химические свойства фенолов
Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
Реакции по гидроксильной группе
Фенолы, так же, как и алифатические спирты, обладают кислыми свойствами, т.е. способны образовывать соли – феноляты. Однако они более сильные кислоты и поэтому могут взаимодействовать не только со щелочными металлами (натрий, литий, калий), но и со щелочами и карбонатами:
Константа кислотности рКа фенола равна 10. Высокая кислотность фенола связана с акцепторным свойством бензольного кольца (эффект сопряжения) и объясняется резонансной стабилизацией образующегося фенолят-аниона. Отрицательный заряд на атоме кислорода фенолят-аниона за счет эффекта сопряжения может перераспределяться по ароматическому кольцу, этот процесс можно описать набором резонансных структур:
Ни одна из этих структур в отдельности не описывает реального состояния молекулы, но их использование позволяет объяснять многие реакции.
Феноляты легко взаимодействуют с галогеналканами и галогенангидридами:
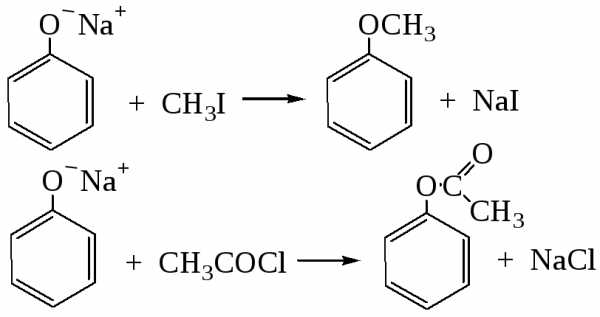
Взаимодействие солей фенола с галогеналканами – реакция О-алкилирования фенолов. Это способ получения простых эфиров (реакция Вильямсона, 1852 г.).
Фенол способен взаимодействовать с галогенангидридами и ангидридами кислот с получением сложных эфиров (О-ацилирование):
Реакция протекает в присутствии небольших количеств минеральной кислоты или при нагревании.
Реакции по бензольному кольцу
Гидроксил является электронодонорной группой и активирует орто- и пара-положения в реакциях электрофильного замещения:
Галогенирование
Галогенирование фенолов действием галогенов или галогенирующих агентов протекает с большой скоростью:
Нитрование
При действии азотной кислоты в уксусной кислоте (в присутствии небольшого количества серной кислоты) на фенол получается 2-нитрофенол:
Под действием концентрированной азотной кислоты или нитрующей смеси фенол интенсивно окисляется, что приводит к глубокой деструкции его молекулы. При использовании разбавленной азотной кислоты нитрование сопровождается сильным осмолением несмотря на охлаждение до 0°С и приводит к образованию о- и п-изомеров с преобладанием первого из них:
При нитровании фенола тетраоксидом диазота в инертном растворителе (бензол, дихлорэтан) образуется 2,4-динитрофенол:
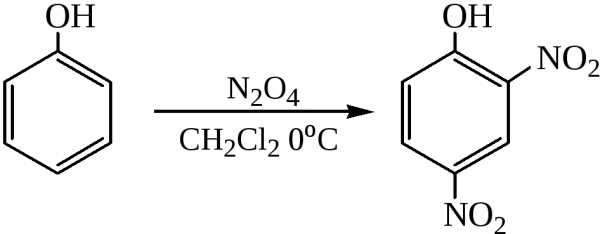
Нитрование последнего нитрующей смесью протекает легко и может служить методом синтеза пикриновой кислоты:
Эта реакция идет с саморазогреванием.
Пикриновую кислоту получают также через стадию сульфирования. Для этого обрабатывают фенол при 100°С избыточным количеством серной кислоты, получают 2,4-дисульфопроизводное, которое не выделяя из реакционной меси обрабатывают дымящей азотной кислотой:
Введение двух сульфогрупп (также как и нитрогрупп) в бензольное ядро делает его устойчивым к окисляющему действию дымящей азотной кислоты, реакция не сопровождается осмолением. Такой метод получения пикриновой кислоты удобен для производства в промышленном масштабе.
Сульфирование. Сульфирование фенола в зависимости от температуры протекает в орто- или пара-положение:
Алкилирование и ацилирование по Фриделю-Крафтсу. Фенолы образуют с хлористым алюминием неактивные соли ArOAlCl2, поэтому для алкилирования фенолов в качестве катализаторов применяют протонные кислоты (H2SO4) или металлооксидные катализаторы кислотного типа (Al2O3). Это позволяет использовать в качестве алкилирующих агентов только спирты и алкены:
Алкилирование протекает последовательно с образованием моно-, ди- и триалкилфенолов. Одновременно происходит кислотно-катализируемая перегруппировка с миграцией алкильных групп:
Конденсация с альдегидами и кетонами. При действии щелочных или кислотных катализаторов на смесь фенола и альдегида жирного ряда происходит конденсация в о- и п-положениях. Эта реакция имеет очень большое практическое значение, так как лежит в основе получения важных пластических масс и лаковых основ. При обычной температуре рост молекулы за счет конденсации идет в линейном направлении:
Если реакцию проводить при нагревании, начинается конденсация с образованием разветвленных молекул:
В результате присоединения по всем доступным о- и п-положениям образуется трехмерный термореактивный полимер – бакелит. Бакелит отличается высоким электрическим сопротивлением и термостойкостью. Это один из первых промышленных полимеров.
Реакция фенола с ацетоном в присутствии минеральной кислоты приводит к получению бисфенола:
Последний используют для получения эпоксисоединений.
Реакция Кольбе – Шмидта. Синтез фенилкарбоновых кислот.
Феноляты натрия и калия реагируют с углекислым газом, образуя в зависимости от температуры орто- или пара-изомеры фенилкарбоновых кислот:
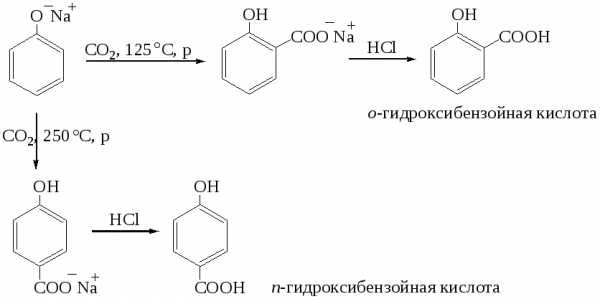
Окисление
Фенол легко окисляется под действием хромовой кислоты до п-бензохинона:
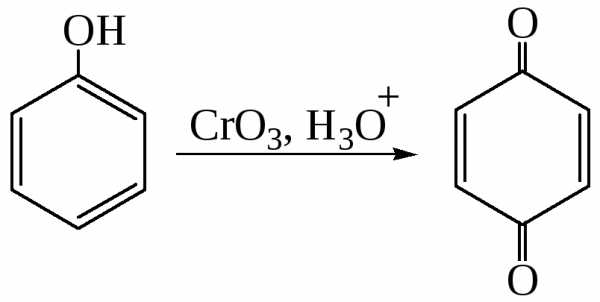
Фенолы, содержащие разветвленные алкильные группы в орто- и пара-положении к гидроксильной группе являются антиоксидантами, стабилизаторами полимерных материалов.
Восстановление
Восстановление фенола в циклогексанон используют для получения полиамида (найлон-6,6)
Фенол
Фенолы – это производные ароматических углеводородов, в молекулах которых один или несколько атомов водород, непосредственно связанных с бензольным кольцом, замещены на гидроксильные группы.
Число гидроксильных групп определяет атомность фенола. Первый представитель этого класса называется фенол – С6Н5ОН. От его названия и происходит название класса – фенолы. Группу С6Н5– называют фенильной группой.
Рассмотрим электронное строение молекулы фенола. Одна неподелённая пара электронов от атома кислорода вступает в сопряжение с π-электронной системой бензольного кольца. Происходит смещение электронной плотности в сторону бензольного кольца, это приводит к усилению С – О связи и ослаблению О – Н связи.
Сопряжение неподелённой пары электронов атома кислорода с π-электронной системой приводит также к перераспределению электронной плотности. Эта электронная плотность понижается на атоме углерода, который связан с гидроксильной группой, но повышается у атомов углерода в положениях два, четыре, шесть. Поэтому гидроксильная группа и бензольное кольцо взаимно влияют друг на друга.
Фенол представляет собой бесцветное кристаллическое вещество с резким характерным запахом. Фенол незначительно растворим в воде при обычной температуре, но хорошо растворяется в горячей воде. Фенол ядовит, при попадании на кожу вызывает сильнейшие ожоги.
Химические свойства фенола будут обусловлены взаимным влиянием гидроксильной группы и бензольного кольца.
Фенол проявляет кислотные свойства, поэтому в водных растворах он диссоциирует по типу кислоты с образованием протона водорода, поэтому фенол называют карболовой кислотой.
Фенол, как и спирты, взаимодействует со щелочными металлами. Так, в реакции фенола с натрием образуется фенолят натрия и водород.
Фенол реагирует с растворами щелочей, так как кислотные свойства у него выражены сильнее, чем у спиртов. Например, в реакции фенола с гидроксидом натрия образуется фенолят натрия и вода.
Кислотные свойства у фенола выражены слабее, чем у неорганических кислот, даже таких, как угольная кислота. Поэтому, если добавить к водному раствору фенолята натрия соляную кислоту, то образуется фенол и хлорид натрия.
Реакции галогенирования у фенола протекают с замещением атомов водорода в бензольном кольце. Так, в реакции фенола с бромной водой образуется белый осадок 2, 4, 6-трибромфенола. Эта реакция используется для качественного обнаружения фенола.
Фенол также даёт фиолетовое окрашивание с водным раствором хлорида железа (III), при этом образуется комплексная соль железа. Эту реакцию используют для качественного обнаружения фенола.
Фенол, как и бензол, реагирует с азотной кислотой. Но у фенола эта реакция идёт легче. В реакции фенола с азотной кислотой образуется 2, 4, 6-тринитрофенол, или пикриновая кислота.
Пикриновая кислота является сильной кислотой, так как наличие трёх заместителей в положении 2, 4, 6 усиливают её кислотные свойства. Пикриновая кислота является взрывоопасным веществом. Её соли используют в качестве взрывчатых веществ.
Одним из основных способов получения фенола в промышленности является кумольный метод. Для этого берут исходные вещества: бензол и пропен.
Сначала в реакцию вступает бензол с пропеном, образуется при этом изопропилбензол, или кумол. Затем кумол окисляют, продукт окисления кумола разлагается серной кислотой и получается фенол и ацетон.
Ранее фенол получали из каменноугольной смолы.
Фенол можно получить и из бензола: сначала хлорируют бензол, получают при этом хлорбензол, затем хлорбензол обрабатывают водным раствором щёлочи с образованием фенолятов. Затем на фенолят действуют минеральными кислотами и получают фенол.
Фенол находит широкое применение: на его основе синтезируют фенолформальдегидные смолы, фенол является сырьём для производства лаков и красок, пластмасс, клея, лекарственных препаратов (аспирина), красителей, пестицидов, антисептиков.
Гидрохинон – представитель класса фенолов – применяется в фотографии в качестве проявителя. Пирокатехин применяют для получения адреналина. Резорцин – антисептик при кожных заболеваниях, его используют в производстве красителей, стабилизаторов, пластификаторов.
Таким образом, фенол является простейшим представителем одноатомных фенолов. Химические свойства фенола обусловлены взаимным влиянием гидроксильной группы и бензольного кольца. Фенол проявляет большую активность в реакциях замещения и большую кислотность по сравнению со спиртами. Для фенола характерны реакции гидроксильной группы: со щелочными металлами, щелочами, а также реакции бензольного кольца: галогенирование и нитрирование. Фенол в основном получают кумольным методом. Фенол и его производные – основа синтеза многих ценных продуктов.