Диффузный рак желудка
прогноз, сколько живут после операции, лечение и стадии, классификация
Аденокарцинома желудка — это одна из наиболее часто встречающихся разновидностей рака данной локализации. На ее долю приходится до 95% всех злокачественных новообразований желудка. Заболевание коварно тем, что на начальных стадиях никак себя не проявляет, затем возникают боли, тошнота, потеря аппетита, на фоне этих симптомов нарастает слабость и потеря веса. Единственный на сегодняшний день радикальный метод лечения аденокарциномы это хирургическая операция. Лучевая терапия и химиотерапия назначаются в качестве дополнительного лечения или при невозможности хирургического вмешательства.
Причины развития
Причина злокачественной трансформации клеток слизистой оболочки до конца не выявлены, но ученые определили несколько факторов, которые достоверно повышают такую вероятность:
- Хронический атрофический гастрит. На его фоне развивается до 60% всех случаев рака желудка. При локализации атрофического процесса в теле желудка, риск увеличивается в 3-5 раз, в антральной его части — в 18 раз, а если поражен весь желудок — в 90 раз.
- Нарушение питания — употребление большого количества острых и соленых продуктов, маринадов, копченостей, вяленого мяса, а также жиров, особенно подвергшихся термической обработке. Имеет значение характер приема пищи. Переедание, недостаточно тщательное пережевывание пищи может привести к хронической травматизации стенки желудка и на этом фоне — к злокачественному перерождению клеток.
- Инфицирование бактерией Хеликобактер пилори увеличивает риски в 3-4 раза.
- Курение и злоупотребление алкоголем.
- Наличие в анамнезе операций на желудке. Риск развития рака увеличивается в 4 раза.
- Пернициозная анемия — злокачественная анемия, связанная с невозможностью усвоения витамина В12. На этом фоне происходит снижение иммунитета, что в 10% случаев приводит к развитию рака.
- Иммунодефицитные состояния, в том числе СПИД.
- Наследственная предрасположенность по данным разных авторов увеличивает риск на 5-20%. В научной литературе описаны случаи наследования аденокарциномы желудка.
- Работа с вредными производственными факторами (никель, асбест).
- Язва желудка. При ее расположении в теле желудка, риски малигнизации увеличиваются в 2 раза, а при поражении антрального отдела данной закономерности не отмечается.

Виды аденокарциномы желудка
Согласно современной классификации выделяют следующие виды аденокарцином, поражающих желудок:
- Папиллярная — визуально напоминает полип.
- Тубулярная. Произрастает из клеток кубического или цилиндрического эпителия.
- Муцинозная. Произрастает из слизисто-продуцирующих клеток.
По степени дифференцировки выделяют следующие формы:
- Высокодифференцированная аденокарцинома желудка. Клетки опухоли имеют высокий уровень дифференцировки и «напоминают» здоровую ткань. Характеризуется медленным ростом и, при своевременной диагностике, хорошо поддается излечению. Главная проблема заключается в том, что в самом начале данную опухоль сложно обнаружить, даже при эндоскопическом обследовании, а ее выявление на поздних стадиях не позволяет достичь желаемого результата.
- Умеренно дифференцированная аденокарцинома желудка. Клетки этой опухоли сложно идентифицировать с тканью, из которой она произрастает. Характеризуется умеренной злокачественностью и скоростью роста.
- Низкодифференцированная аденокарцинома желудка. Клетки данной опухоли невозможно идентифицировать с определенной тканью. Это наиболее злокачественный тип рака желудка. Характеризуется быстрым ростом и метастазированием.
Симптомы
- Потеря аппетита.
- Явления диспепсии — вздутие живота, тошнота, отрыжка, чувство тяжести. Если опухоль имеет большие размеры, она может перекрывать просвет желудка, что вызывает рвоту при приеме пищи, но это происходит уже на последних стадиях.
- Слабость и апатия.
- Боль. Как правило, она возникает не сразу, а преимущественно на распространенных стадиях. В это время она носит постоянный характер и не зависит от приема пищи. Возникает без видимых причин и часто усиливается после еды. На последних стадиях она настолько сильная, что не купируется привычными анальгетиками.
Как мы видим, эти симптомы неспецифичны, и человек может долгое время пытаться купировать их самостоятельно.

Диагностика аденокарциномы желудка
Своевременная диагностика рака желудка имеет важнейшее значение, поскольку прогноз на ранних стадиях заболевания куда более благоприятен, чем при распространенном опухолевом процессе. Но аденокарцинома на начальных стадиях характеризуется либо бессимптомным течением, либо ее симптомы воспринимаются как признаки другого заболевания, например, гастрита, язвы, желчнокаменной болезни, панкреатита. В результате пациенты не обращаются к врачу, купируя симптомы самостоятельно с помощью препаратов, купленных в аптеке.
Стадии аденокарциномы
- 0 стадия или рак in situ. Злокачественные клетки не распространяются на пределы эпителиального слоя.
- 1 стадия. Опухоль прорастает эпителий и распространяется на другие слои стенки желудка, но не выходит за ее пределы.
- 2 стадия. Опухоль увеличивается в размерах и дает метастазы в регионарные лимфатические узлы.
- 3 стадия. Аденокарцинома прорастает в соседние органы (поджелудочная железа, печень) и/или дает метастазы в несколько групп лимфатических узлов.
- На четвертой стадии, аденокарцинома дает метастазы в отдаленно расположенные органы и лимфатические узлы.
Диагностика
Диагностика аденокарциномы желудка носит комплексный характер и включает ряд обследований, которые не только помогают определить тип опухоли, но и стадию заболевания:
- ФГДС — обследование, которое осуществляется с использованием специального прибора — гибкого эндоскопа. С его помощью производится визуальный осмотр слизистой оболочки желудка, причем прибор транслирует увеличенное изображение исследуемого участка на монитор, что позволяет обнаружить незначительные изменения слизистой. Во-вторых, эндоскоп оснащен специальной манипуляционной системой, с помощью которой можно взять кусочек ткани на гистологический анализ и точно определить вид опухоли и степень дифференцировки ее клеток.
- УЗИ. Этот метод исследования позволяет уточнить размер опухоли, ее соотношение с соседними органами, наличие метастазов в регионарные лимфатические узлы.
- КТ и МРТ также помогают верифицировать размеры злокачественного новообразования и его врастание в окружающие ткани, но главной целью является поиск метастазов в лимфоузлы и отдаленные органы (например, легкие).
- ПЭТ-КТ (позитронно-эмиссионная компьютерная томография) позволяет обнаружить отдаленные метастазы размером до 1 мм.
- Определение онкомаркеров РЭА, СА72-4, СА19-9. При раке желудка эти маркеры не имеют диагностического значения как такового, но при исходном повышении нормы, их можно использовать в качестве контроля лечения и возникновения рецидива. После операции уровень онкомаркеров должен снизиться, он может достичь нормы. При возникновении рецидива или прогрессирования заболевания, он будет опять нарастать.
Доктор М.С. Бурдюков проводит диагностическое обследование желудка - ФГДС
Метастазирование аденокарциномы желудка
Для аденокарциномы характерно лимфогенное, гематогенное и имплантационное метастазирование.
Имплантационное метастазирование предполагает распространение клеток посредством контакта опухоли с воспринимающей поверхностью. В случае рака желудка такой поверхностью может быть брюшина, плевра, перикард, диафрагма. На четвертой стадии часто обнаруживается канцероматоз (массивное метастазирование в различные ткани).
Лимфогенное метастазирование подразумевает распространение опухоли по лимфатическим сосудам. Сначала поражаются близлежащие лимфатические узлы, а потом и более отдаленные. При раке желудка существуют специфические формы лимфогенных метастазов:
- Поражение узлов левой надключичной области — метастазы Вирхова.
- Поражение параректальных ЛУ — метастазы Шницлера.
- Поражение подмышечных ЛУ — метастазы Айриша.
Гематогенное метастазирование предполагает перенос раковых клеток по кровеносным сосудам. Чаще всего поражается печень в результате миграции клеток по воротной вене. Также возможно поражение легких, почек, головного мозга, костного мозга.
Лечение аденокарциномы желудка
Лечение аденокарциномы зависит от стадии заболевания и гистологического типа опухоли. Как правило, оно носит комплексный характер и предполагает сочетание хирургической операции с химио- или лучевой терапией. Хирургический компонент здесь является ключевым фактором.
В рамках лечения может проводиться удаление всего желудка (гастрэктомия), или его части (резекция желудка). Одновременно удаляются ткани, пораженные злокачественными клетками — регионарные лимфатические узлы, части органов, куда проросла опухоль (печень, тонкая кишка, брюшина и др).
Химиотерапия и лучевая терапия могут применяться в дооперационном (неоадъювантный режим) и послеоперационном периоде (адъювантный режим). В первом случае их целью является уменьшение размеров опухоли, чтобы ее можно было удалить с наименьшим объемом тканей, а во втором — уничтожение оставшихся раковых клеток. Кроме того, применение химиотерапии и лучевой терапии может уменьшить выраженность болевого синдрома.
Если радикальное удаление образования невозможно, проводится паллиативное лечение. В этом случае оно направлено на устранение осложнений, вызванных аденокарциномой, и улучшение качества жизни больного. Например, если опухоль перекрыла просвет желудка, накладываются обходные анастамозы или выводится гастростома, благодаря чему пациент сможет питаться.
Прогноз аденокарциномы желудка
Прогноз при аденокарциноме зависит от стадии заболевания. Чем раньше начать лечение, тем более эффективным оно будет:
- При первой стадии пятилетняя выживаемость достигает 80%. Причем высоки шансы на полное выздоровление. К сожалению, на этой стадии рак желудка выявляется очень редко, как правило, случайно.
- На второй стадии пятилетняя выживаемость приближается к 55%. Половина из этих людей имеет шансы на полное излечение. Согласно данным литературы, менее 10% злокачественных опухолей желудка выявляются на второй стадии.
- При третьей стадии пятилетняя выживаемость находится на уровне менее 40%, а при четвертой — не превышает 5%. К сожалению, до 75% аденокарцином выявляется именно на четвертой стадии.

Профилактика
Профилактика рака желудка направлена на предотвращение или снижение воздействия факторов риска, приводящих к развитию данного заболевания:
- Нормализация питания. Употребление в пищу достаточного количества пищевых волокон (овощи, фрукты, каши), ограничение употребления соли, пряностей, маринадов и копченостей.
- Отказ от курения и злоупотребления алкоголем.
- Лечение инфекций и предраковых заболеваний — хронический гастрит, полипы желудка.
- Поддержание достаточного уровня физической активности
Запись на консультацию круглосуточно
стадии и прогноз жизни, инфильтративный рак желудка лечение
Инфильтративный рак желудка — это морфологическая форма карциномы, для которой характерен инфильтративный рост (проростание сквозь стенку органа) и отсутствие четких границ опухоли.
Особенности инфильтративного рака:
- Характеризуется высокой степенью злокачественности — быстро растет и рано дает метастазы.
- Может встречаться у молодых людей.
- Хорошо прослеживается наследственный фактор.
- Как правило, манифестирует с симптомов диспепсии.
Причины возникновения
Причины возникновения инфильтративной формы рака желудка до конца неизвестны. Предполагается, что факторы риска аналогичны другим формам карциномы желудка:
- Хронический атрофический гастрит. Более чем у половины пациентов с раком желудка был диагностирован атрофический гастрит. При этом имеет значение его локализация. При поражении тела желудка, риск рака увеличивается в 3-5 раз, антрального отдела — в 18 раз, и если признаки атрофического гастрита обнаруживаются по всему желудку, риск развития злокачественного новообразования увеличивается в 90 раз.
- Нерациональное питание и употребление в пищу вредных продуктов. Сюда относят постоянное переедание, частое употребление в пищу маринадов, копченостей, вяленых, соленых и острых блюд, избыток в рационе жиров животного происхождения и жиров, подвергшихся термической обработке.
- Наследственная предрасположенность. Для инфильтративного рака желудка наследственный фактор прослеживается гораздо четче, чем для других форм злокачественных новообразований желудка. В пользу этого говорит и то, что опухоль часто диагностируется у молодых пациентов.
- Пьянство и алкоголизм.
- Курение.
- Хеликобактерная инфекция.
Кто входит в группу риска
Группу повышенного онкориска составляют следующие пациенты:
- С хроническим атрофическим гастритом.
- С хронической язвой желудка, особенно если она крупных размеров. Злокачественная трансформация может произойти на любом этапе язвенной болезни.
- Люди, в семье у которых были случаи рака желудка.
- Пациенты, перенесшие оперативные вмешательства на желудке в течение последних 10 лет.
- Пациенты с врожденными и приобретенными иммунодефицитами.
- Работники, занятые во вредных условиях труда, в частности на никелевых, асбестовых производствах, производстве резины, хрома и др.
- Пациенты с полипами на широком основании.
Вышеперечисленным категориям людей рекомендуется своевременно проходить медицинские осмотры с проведением фиброгастродуоденоскопии с взятием биопсии из патологических очагов. При морфологическом исследовании биоптата определяется наличие морфологических изменений: атипии клеток, структурных изменений ткани слизистой оболочки и др. Такие изменения должны расцениваться как предрак и должно проводиться соответствующее лечение.
Общие клинические проявления
Рак желудка на ранних стадиях не имеет типичных проявлений. Если симптомы и есть, то они неспецифичны и могут присутствовать при огромном количестве других заболеваний:
- Изменение общего состояния пациента — повышенная утомляемость, непонятная слабость, снижение работоспособности.
- Нарушение настроения, вплоть до депрессии — апатия, отчужденность, потеря интереса к жизни.
- Извращение аппетита, например, отвращение от некоторых продуктов (чаще всего это мясо и рыба).
- Явления «желудочного дискомфорта» — чувство тяжести или переполнения желудка, отрыжка, отсутствие физиологического удовлетворения от приема пищи.
- Болезненность в эпигастрии или под грудью.

При распространенных формах инфильтративного рака желудка клиническая картина более типична и развернута:
- Желудочные боли. У 70% больных боль присутствует постоянно, либо возникает без видимых причин, усиливается после приема пищи.
- Анорексия — потеря аппетита.
- Резкое снижение веса.
- Явления анемии — бледность и пастозность кожных покровов.
- Насыщение от приема малого объема пищи. Частый симптом при диффузном раке, поскольку он нарушает способность стенки желудка к растяжению.
- Тошнота и рвота. Инфильтративная форма рака желудка нарушает моторику органа и препятствует прохождению пищевого комка. Пища скапливается, подвергается гниению и брожению, вызывая тошноту и рвоту. В ряде случаев больные сами ее вызывают, чтобы облегчить тягостные симптомы.
- Повышение аппетита. Это казуистический симптом, который характерен только для инфильтративного рака привратника. Опухоль превращает его в зияющую трубку, через которую пища быстро покидает желудок, и чувство насыщения не наступает.
Формы патологии
- Диффузно-инфильтративный. Эта опухоль распространяется по всей толщине стенки и поражает при этом значительную часть желудка.
- Инфильтративно-язвенный, или изъязвляющийся. Обнаруживается инфильтративная опухоль, которая не имеет выраженных границ. Со временем ее поверхность изъязвляется.
Стадии заболевания
Выделяют 4 стадии инфильтративного рака желудка, в зависимости от того, насколько глубоко проросла опухоль, и дала ли она метастазы.
- 0 стадия — это рак in situ, при котором злокачественные клетки обнаруживаются в слизистом слое стенки желудка, или же имеется тяжелая дисплазия слизистой.
- 1 стадия — опухоль прорастает в слизистый и подслизистый слои желудочной стенки, обнаруживаются метастазы в 1-2 лимфоузла, либо рак распространяется на мышечный слой желудочной стенки, но данных за метастазы нет.
- 2 стадия — опухоль прорастает стенку желудка, достигает его серозной оболочки и может даже прорастать в окружающие желудок ткани. Обнаруживается поражение 7 и более лимфоузлов.
- 3 стадия — опухоль выходит за пределы желудка, поражая висцеральную брюшину, рядом расположенные органы (селезенка, толстый кишечник, печень, диафрагма и др), обнаруживаются метастазы в 10-15 лифмоузлах.
- 4 стадия — обнаруживаются отдаленные метастазы во внутренние органы и лимфоузлы.
Запись на консультацию круглосуточно
Диагностика
К сожалению, ранняя диагностика инфильтративного рака желудка часто бывает затруднена, поскольку опухоль имеет эндофитный рост и при визуальном осмотре слизистой во время эндоскопического обследования никак себя не проявляет.
Для обнаружения опухоли и постановки диагноза применяются следующие методы исследования:
- Фиброгастродуоденоскопия. Позволяет под увеличением осмотреть слизистую оболочку желудка и взять биопсию из подозрительных очагов. Как мы уже говорили, при инфильтративном раке этот метод имеет довольно низкую информативность (около 65%). И наличие опухоли в основном можно заподозрить по косвенным признакам.
- Рентгенография желудка с контрастированием. Инфильтративный рак может визуально не обнаруживаться на слизистой, вместе с тем он поражает стенку желудка, что приводит к уменьшению объема органа, нарушению перистальтики, изменению плотности стенок. Эти изменения будут четко прослеживаться при проведении рентгенографии с контрастированием. Такой метод исследования позволяет обнаружить опухоль приблизительно в 90% случаев, но он абсолютно неэффективен на начальной стадии заболевания.
- УЗИ брюшной полости и забрюшинного пространства. Этот метод позволяет определить степень инвазии рака желудка, его распространение за пределы стенки желудка и обнаружить поражение органов брюшной полости, малого таза и регионарных лимфатических узлов.
После постановки диагноза проводят уточняющее обследование, которое необходимо для уточнения стадии заболевания и выбора оптимальной схемы лечения. С этой целью проводят следующие процедуры:
- Анализы на онкомаркеры РЭА, СА 19-9, СА 72-4. С диагностической точки зрения определение этих маркеров не имеет смысла, поскольку они могут оставаться на нормальном уровне даже на 3 стадии заболевания. Однако при изначальном превышении они могут использоваться в качестве контроля лечения и обнаружения рецидива заболевания.
- КТ и/или МРТ с внутривенным контрастированием. Являются альтернативной УЗИ и применяются для определения стадии рака в экономически развитых странах. Метод позволяет обнаружить метастазы в органах брюшной полости, забрюшинного пространства, малого таза, а также обнаружить изменение лимфоузлов.
- Гинекологический осмотр у женщин и пальцевое ректальное исследование у мужчин. Это обследование позволяет обнаружить метастазы рака желудка в яичники (метастаз Крукенберга), параректальные лимфатические узлы (метастазы Шницлера).
- Рентген грудной полости. Проводится для обнаружения метастазов в легких и легочных лимфоузлах, а также поражения плевры.
Индивидуально, по показаниям, диагностика может дополняться следующими исследованиями:
- Эндосонография — чреспищеводное УЗИ. Проводится во время планирования хирургического удаления рака, когда есть данные за его распространение на пищевод и диафрагму. Это исследование позволит обнаружить верхнюю границу опухоли и спланировать объем операции.
- УЗИ и биопсия шейных, надключичных и подмышечных лимфоузлов — обнаружение метастазов Вирхова и Айриша.
- Колоноскопия.
- ПЭТ-КТ.
- Остеосцинтиграфия.
- Биопсия костного мозга при подозрении на наличие метастазов.
- Диагностическая лапароскопия. Она обязательно проводится при тотальном и субтотальном опухолевом поражении желудка, а также прорастании рака за пределы серозной оболочки желудка.
Способы лечения
Основным методом лечения инфильтративного рака является операция. При распространенных формах новообразования ее дополняют химиотерапией. Если хирургическое вмешательство не показано, проводится только химиотерапия.
Хирургия
При лечении инфильтративной формы рака желудка применяются следующие виды операций:
- Гастрэктомия.
- Субтотальная резекция желудка.
При этом пораженная часть желудка или весь желудок удаляется единым блоком с окружающими тканями, куда входят большой и малый сальник, жировая клетчатка и регионарные лимфоузлы 1-2 порядка. Пересечение органа при инфильтративном раке осуществляется не менее, чем 7 см от определяемого края опухоли. Чтобы подтвердить радикальность операции, удаленный фрагмент немедленно подвергают исследованию на наличие опухолевых клеток в краях отсечения.
При распространении рака на соседние органы, объем операции может увеличиваться и включать резекцию пораженных тканей.
Химиотерапия
Химиотерапия может применяться в рамках комбинированного лечения, совместно с операцией, или как самостоятельный метод лечения при нерезектабельных опухолях.
В рамках комбинированного лечения используются следующие виды химиотерапии:
- Периоперационная. Этот вид лечения подразумевает проведение 3 циклов химиотерапии на протяжении 8-9 недель до операции, потом проводят диагностические исследования, и если отсутствуют признаки нерезектабельности, проводят операцию и 3 цикла химиотерапии после нее. Используются схемы CF — цисплатин фторурацил, и ECF — эпирубицин, цисплатин, фторурацил. Такое лечение позволяет увеличить 5-летнюю безрецидивную выживаемость и в целом продлить жизнь пациентам с распространенной формой рака желудка.
- Адъювантная химиотерапия. Это лечение назначается через 4-6 недель после хирургического вмешательства, если не возникло осложнений. Используется пероральные формы фторпиримидина в течение 12 месяцев или схема XELOX (CAPOX) в течение 6 мес. При положительном статусе опухоли HER-2 лечение может дополняться трастузумабом.
При нерезектабельных формах рака желудка, химиотерапия является основным методом лечения. В качестве первой линии терапии назначаются схемы, включающие препараты платины и фторпиримидины. Трехкомпонентные схемы, которые дополняются доцетакселом, улучшают общую выживаемость, но являются более токсичными. Поэтому их назначают только сохранным пациентам. Если имеются метастазы в кости, могут назначаться бисфосфонаты (золедроновая кислота).
Первая линия химиотерапии проводится на протяжении 18 недель, после этого больного наблюдают до прогрессирования заболевания. Если она произошла в течение 3 месяцев после окончания химиотерапии первой линии, применяют препараты второй линии (таксаны), если после прогрессирования прошло более 6 месяцев, можно опять использовать препараты 1 линии. При положительном HER2 статусе лечение дополняется таргетными препаратами.
У ослабленных пожилых пациентов с сопутствующими заболеваниями назначают щадящее лечение, и при улучшении их состояния переходят на режим XELOX. Тяжелым больным показано симптоматическое лечение.
Лучевая терапия
Лучевая терапия в качестве самостоятельного метода лечения не используется. Некоторое время в США адъювантная химиолучевая терапия была стандартом лечения местнораспространенных форм инфильтративного рака. Но проспективные исследования показали, что такая тактика не улучшает прогноз больных, а лечение является более токсичным, по сравнению с адъювантной химиотерапией. Поэтому в настоящее время такой подход не рекомендован.
Основное применение лучевой терапии — паллиативное лечение для облегчения симптомов болезни. Например, ее используют при наличии метастазов в костях для уменьшения болевого синдрома.
Симптоматическое лечение
Симптоматическому лечению подлежат следующие категории больных:
- При 4 стадии заболевания.
- Больные с местнораспространенными нерезектабельными формами рака.
- Больные с тяжелой сопутствующей патологией, делающей невозможным проведение операции или применение цитостатиков.
Симптоматическая терапия направлена на облегчение состояния пациента и борьбу с осложнениями:
- Устранение кровотечений — часто опухоли желудка осложняются обильными кровотечениями. У больных, при этом, отмечается рвота кровавой гущей или алой кровью, мелена в стуле. Для остановки кровотечения проводятся эндоскопические операции.
- Борьба с опухолевым стенозом — здесь применяются различные технологии, от стентирования до наложения обходных анастомозов и выведения гастростомы ниже места поражения.
- Лечение боли — медикаментозная терапия, регионарная анестезия, лучевая терапия.
- Лечение асцита — внутрибрюшная химиотерапия, лапароцентез, установление дренажа.
Прогноз
Инфильтративный рак является крайне агрессивной формой злокачественного новообразования. Он очень рано дает метастазы, часто диагностируется на поздних стадиях, поэтому прогноз более неблагоприятный, по сравнению с другими формами рака желудка.
Меры профилактики
Методы профилактики инфильтративного рака такие же, как и при других злокачественных новообразованиях желудка:
- Оптимизация питания — исключение переедания, сбалансированное питание с достаточным количеством пищевых волокон и витаминов.
- Отказ от курения и злоупотребления алкоголем.
- Использование индивидуальных средств защиты при работе с производственными вредностями.
- Регулярное адекватное обследование лиц из группы риска.
Запись на консультацию круглосуточно
Экспрессионные характеристики диффузного и кишечного типов рака желудка Текст научной статьи по специальности «Фундаментальная медицина»
лабораторные и экспериментальные исследования
УДК: 616.33-006.6-091.8-076
экспрессионные характеристики диффузного и кишечного типов рака желудка
М.В. Эавьялова1-2, и.В. Степанов, С.В. Вторушин12, о.В. Савенкова1, Е.С.григорьева1 , А.В. Августинович1, С.ф.Берестень3, С.г Афанасьев1, н.В.чердынцева1, В.М. перельмутер12
фгБУ «НИИ онкологии СО РАМН», г. Томск1 фгБОУ ВпО «Сибирский государственный медицинский университет» Минздраввсоцразвития России, г. Томск2 Институт молекулярной биологии им. В.А. энгельгардта РАН, г. Москва3 634050, г. Томск, Московский тракт, 2, e-mail: [email protected]
Проведена оценка экспрессии стандартных маркеров Ki67, p53, CDX2, MUC2, MUC5, а также белков циклофилина А и AKR1B10 в разных структурах паренхиматозного компонента опухоли в операционном материале, полученной от 107 у больных с различными гистологическими типами рака желудка (РЖ) T1_3N0_3M0 стадии. При диффузном типе рака чаще наблюдался более молодой возраст больных и более выраженное лимфогенное метастазирование, кроме того, при этом гистотипе чаще регистрировалась экспрессия р53 в клетках опухоли, чем у пациентов с кишечным гистотипом, тогда как для других маркеров - Ki67, MUC5, MUC2 - не выявлено различий в зависимости от гистологического типа опухоли. При диффузном типе РЖ процент экспрессии CypA был ниже в сравнении с экспрессией этого маркера в цитоплазме клеточных элементов карциномы кишечного типа. Обнаружена закономерность снижения экспрессионной способности опухолевых клеток в отношении CDX2, MUC2, AKR1B10, циклофилина А, преимущественно в группе с кишечным типом новообразования, по мере нарастания глубины инвазии в стенку органа. Для р53, bcl2 и MUC5 такого изменения не выявлено. Таким образом, получены новые данные о связи экспрессионной способности клеток опухоли с параметрами инвазивного роста опухоли, природа данного феномена нуждается в дальнейшем изучении.
Ключевые слова: рак желудка, интестинальный, диффузный типы, экспрессия маркеров, иммуногистохимия.
EXPRESSION CHARACTERISTICS OF DIFFUSE-AND INTESTINAL- TYPE GASTRIC CARCINOMAS M.V. Zavyalova12, I.V Stepanov, S.V Vtorushin12, O.V Savenkova1, E.S. Grigoryeva1 , A.V Avgustinovich2, S.F. Beresten3,
S.G. Afanasyev1, N.V Cherdyntseva1, VM. Perelmuter12 Cancer Research Institute, SB RAMS, Tomsk1 Siberian State Medical University, Tomsk2 VA. Engelhardt Institute of Molecular Biology, Russian Academy of Sciences, Moscow3 2, Moskovsky Tract Street, 634050-Tomsk, Russia, e-mail: [email protected]
Expression of the standard markers: Ki67, p53, CDX2, MUC2 and MUC5 as well as cyclophilin A and AKR1B10 proteins in different structures of parenchimatous component of a tumor in surgical specimen obtained from 107 patients with different histological types of T1-3N0-3M0 stage gastric cancer was assessed. The diffuse-type gastric carcinoma was characterized by younger age of patients and more pronounced lymphogenic metastasis. Furthermore, p53 expression in cancer cells was registered more frequently in patients with diffuse-type than in patients with intestinal-type gastric carcinoma. However, no significant difference in expression of ki67, MUC5 and MUC2 markers between two types of gastric carcinoma was found. The level of CypA gene expression was lower in diffuse-type gastric carcinoma than in intestinal-type gastric carcinoma. In intestinal-type gastric carcinoma, the lower the levels of CDX2, MUC2, AKR1B10 and cyclophilin A, the deeper tumor invasion in the gastric wall. No such changes were found for р53, bcl2 and MUC5 markers. Thus, new findings on the relation of expression ability of tumor cells with tumor growth parameters were obtained, that requires further studies.
Key words: gastric cancer, intestinal-and diffuse-type gastric cancer, expression of markers, immunohistochemistry.
Рак желудка является одним из наиболее часто встречающихся злокачественных новообразований и характеризуется высокими показателями летальности [3, 4]. Одним из принципов гистологической классификации рака желудка является деление опухолей на кишечный и диффузный типы [15]. Данные типы рака желудка имеют существенные отличия по ряду клинических, морфологических и экспрессионных параметров. Известно, что рак желудка диффузного типа чаще возникает у молодых пациентов, он склонен к более агрессивному течению и более частому метастазированию [24, 26].
Согласно современным представлениям, молекулярный патогенез интестинального и диффузного типов рака желудка, несмотря на целый ряд общих черт, существенно различается. Спорадические злокачественные новообразования желудка диффузного типа ассоциированы с нарушениями функционирования генов RUNX3, CDh2 и FGFR2/ KSAM, CDKN2A [5, 6, 11]. К характерным для спорадических новообразований желудка кишечного типа генетическим изменениям относятся инактивация гена HMLh2 и мутации CDX2 ^audal type homeobox transcription factor 2) - транскрипционного фактора, вовлеченного в процесс диффе-ренцировки эпителия в кишечнике, поджелудочной железе и желчных путях, а также в генах ps2, RARB, HER-2/neu и др. В ряде исследований была показана связь уровня экспрессии CDX2 с риском развития рака желудка [22, 25]. Обнаружилось, что экспрессия CDX2 была значительно снижена в образцах с неполной кишечной метаплазией, при которой экспрессируются оба желудочных муцина (MUC5AC и MUC6) и кишечный муцин (MUC2), в отличие от образцов с полной кишечной метаплазией, при которой экспрессируется только кишечный муцин (MUC2) [12, 13, 19, 23]. Экспрессия CDX2 при раке желудка была обратно пропорциональна экспрессии желудочных муцинов. Неполная кишечная метаплазия связана с более высоким риском развития рака желудка. Наблюдение снижения экспрессии CDX2 при неполной кишечной метаплазии, дисплазии эпителия желез и раке желудка позволило предположить, что CDX2 играет антиканцерогенную роль [7, 8, 12]. CDX2 взаимодействует с генами опухолевой супрессии APC и E-cadherin, а также с bcl-2 [5, 11]. Потеря экспрессии CDX2 может быть сигналом прогрессии
опухоли в случаях раннего рака желудка и рака с кишечным фенотипом [21, 22, 25].
При раке желудка кишечного типа чаще, чем при раке диффузного типа, отмечается экспрессия белка опухолевой супрессии р53, одного из ключевых регуляторов процессов репарации ДНК и апоптоза, выше экспрессия маркера пролиферации Ki67 [9, 14, 16, 24]. Следует отметить, что данные различных авторов о возможности использования указанных маркеров апоптоза, пролиферации и клеточной дифференцировки для оценки прогноза клинического течения РЖ разных гистотипов не всегда согласуются между собой, и исследования в этом направлении остаются актуальными, так же как и поиск новых прогностических маркеров при раке желудка.
В наших предыдущих исследованиях при проведении 2D протеомного анализа и биоинформати-ческого поиска были выявлены 2 гена, кодирующие потенциальные белковые маркеры рака желудка: циклофилин А и AKR1B10. При этом впервые были получены сведения о дифференциальной экспрессии указанных генов в злокачественных новообразованиях желудка и нормальной слизистой при использовании парных образцов ткани одного и того же пациента, у больных раком желудка в российской популяции [1, 2]. AKR1B10 - НАД(Ф)-зависимая оксидоредуктаза, участвующая в метаболическом пути ретиноевой кислоты, играющей важную роль в регуляции клеточной дифферен-цировки и осуществляющей рост-супрессивные эффекты в трансформированных клетках [10]. Циклофилин А (CypA, PPIA) относится к семейству иммунофилинов и играет важную роль в формировании компетентного фолдинга белков, хемотаксисе и сигнальной трансдукции. В последние годы получены данные о гиперэкспрессии CypA в злокачественных опухолях различных локализаций и его прогностическом значении, однако сведений о связи с раком желудка нами не найдено [17, 20].
Таким образом, в настоящее время существует потребность в поиске новых подходов к прогнозированию прогрессии кишечного и диффузного типов карциномы желудка. С одной стороны, это предполагает поиск новых ассоциированных с РЖ маркеров, с другой - совершенствование способа оценки экспрессии белковых маркеров на основе учета экспрессионных характеристик разных структур паренхиматозного компонента новооб-
разования, располагающихся на различной глубине инвазии.
Целью исследования являлась сравнительная оценка экспрессии стандартных экспрессионных маркеров Ki67, p53, CDX2, MUC2, MUC5, а также белков циклофилина А и AKR1B10 в разных структурах паренхиматозного компонента опухоли у больных с различными гистологическими типами рака желудка.
Материал и методы
Исследован операционный материал от 107 больных раком желудка (РЖ) T1_3N0_3M0 стадии, в возрасте от 31 до 82 лет (средний возраст - 58,5 ± 10,7 года), находившихся на лечении в торако-абдоминальном отделении НИИ онкологии СО РАМН с 2003 по 2009 г. Работа проведена с соблюдением принципов добровольности и конфиденциальности в соответствии с «Основами законодательства РФ об охране здоровья граждан» (Указ Президента РФ от 24.12.93 N° 2288), получено разрешение этического комитета института, от всех пациентов получено информированное согласие на включение материала в исследование. Больные не получали неоадъювантной химиотерапии. В 66 (61,8 %) случаях была выполнена субтотальная дистальная резекция желудка, в 38 (36 %) - га-стрэктомия, в 1 (0,8 %) - проксимальная резекция желудка, в 1 (0,8 %) - панкреато-дуоденальная резекция, в 1 (0,8%) - операция по типу Льюиса.
Морфологическому исследованию подвергался операционный материал. Оценивалась ткань первичного опухолевого узла и все удаленные лимфатические узлы. Взятые образцы тканей помещались в нейтральный формалин. Материал проводился по стандартной методике и заливался в парафин. Срезы толщиной 5-6 мкм окрашивались гематоксилином и эозином. Гистологический тип рака желудка (кишечный или диффузный) устанавливался согласно классификации Lauren [15].
В паренхиматозном компоненте опухолей диффузного и кишечного типов выделялись железистоподобные, трабекулярные, солидные, кри-брозные структуры и дискретно расположенные группы опухолевых клеток, отмечалось наличие перстневидных клеток. Оценивалась глубина инвазии опухоли по отношению к толще стенки желудка разными типами опухолевых структур. В регионарных лимфатических узлах определялось наличие метастатического поражения.
Иммуногистохимическое исследование проводилось по стандартной методике. При исследовании применялись антитела фирмы <^ако» к Ю67 (клон М1В-1, RTU, мышиные), фирмы «Novocastra» к р53 (клон СМ1, рабочее разведение 1:150), к Ьс12 (клон Ьс12/100/05, рабочее разведение 1:80), к CDX2 (клон АМТ28, рабочее разведение 1:100), к РР1А (циклофилин А) (рабочее разведение 1:1200), к МиС2 (клон FPм5l3, RTU, мышиные), к МиС5 (клон FPM488, RTU, мышиные). Для детекции экспрессии белка AKR1B10 использовались высокоаффинные моноклональные антитела, полученные в Институте молекулярной биологии им. В.А. Энгельгардта РАН (НОУ-ХАУ, Протокол № 02.445.11.7354-4 от 25 марта 2008 г.). Чувствительность антител в дот-блоте составила 100 пкг, в Вестерн-блоте - 100 пкг. Использовалось рабочее разведение антител 1:300.
Экспрессия всех маркеров оценивалась по процентному содержанию положительно окрашенных клеток в каждом варианте структур паренхиматозного компонента первичной опухоли на различной глубине инвазии. Число клеток с позитивной экспрессией изучаемого маркера определялось на 100 клеток в 10 полях зрения при увеличении *400.
Обработка полученных данных выполнялась с использованием пакета программ <^а^йса 6.0». Применялся дисперсионный, корреляционный анализ по Спирмену, критерий %2. Обсуждаются результаты со значимостью различий при р<0,05 и с тенденцией различий при р<0,1.
Результаты и обсуждение
Было обнаружено 64 (60 %) случая с кишечным и 43 (40 %) - с диффузным типом рака желудка. Больные с диффузным типом опухоли были моложе. Средний возраст этих пациентов составил 54,3 ± 10,8 года, в то время как у больных с кишечном типом новообразований он составил 61,7 ± 8,9 года ^=14,7; р=0,0002). Распределение больных по полу, стадии заболевания, размерам, локализации первичной опухоли, частоте лимфогенного метастазирования в изучаемых группах было одинаковым. В то же время при диффузном типе рака желудка отмечалась тенденция к метастатическому поражению большего числа лимфатических узлов - 5,5 ± 4,1 и 9,7 ± 11,9 соответственно ^=3,4; р=0,07). Локорегионарные рецидивы и отдаленные метастазы выявлялись при кишечном и диффузном типах карциномы с одинаковой частотой.
Новацией настоящего исследования явилось то, что определяемые экспрессионные параметры оценивались не только по отношению к опухоли в целом, но и в клетках, образующих разные структуры паренхиматозного компонента новообразования, располагающиеся на различной глубине инвазии. Оказалось, что пролиферативная активность опухоли, определяемая по проценту экспрессии Ю67, не различалась при кишечном и диффузном типе рака желудка - 33,7 ± 27,7 и 24,5 ± 27,9 соответственно (р=0,21). При кишечном типе новообразования отмечалось снижение пролиферативной активности в клетках, формирующих железистоподобные структуры при нарастании инвазии опухоли в стенку органа. Доля клеток, экспрессирующих Ю67, была выше в железистоподобных структурах, располагающихся в слизистой оболочке - 33,7 ± 22,7 %, по сравнению с экспрессией в подобного рода структурах, находящихся в серозной оболочке - 4,8 ± 3,3 % (р=0,02). При диффузном типе рака уровень экспрессии Ю67 в
мелких группах опухолевых клеток, находящихся в слизистой оболочке, был также выше - 24,5 ± 27,9 %, по сравнению с этим показателем в аналогичных структурах, располагающихся в серозной оболочке - 3,2 ± 1,6 % (р=0,07).
Частота выявления случаев с позитивной экспрессией CDX2 не различалась при кишечном и диффузном типах рака желудка - 95 % и 93 % соответственно (р=0,86). Не различалась и доля клеток с позитивной экспрессией CDX2 в анализируемых группах - 31,6 ± 1б,9 % и 27,5 ± 16,7 % соответственно ^=0,4; р=0,53). При кишечном типе рака желудка по мере увеличения глубины инвазии опухоли в стенку органа, снижался уровень экспрессии CDX2 в железистоподобных структурах. Подобного рода закономерность определялась и в случаях с диффузным типом новообразования (табл. 1, 2).
Позитивная экспрессия Ьс12 чаще наблюдалась при кишечном типе рака желудка в сравнении с диффузным - 77 % и 31 % соответственно (р=0,01).
Таблица І
процент клеток с экспрессией cdx2, bcl2, р53, Muc2, Muc5, AKR1B10, cypa в железистоподобных структурах опухоли на различной глубине инвазии у больных с кишечным типом рака желудка (M ± S.D.)
Показатель Уровень опухолевой инвазии в стенку желудка
Слизистый слой Подслизистый слой Мышечный слой Серозный слой
I II III IV
СDX2 52,5 і 28,6 % (n=14) 39,7 і 3Q,8 % (n=15) 3Q,8 і 24,6 % (n=9) р^^ 7,5 і 7,7 % (n=2)
bcl2 Q,9 і 1,Q % (n=9) Q,6 і Q,9 % (n=7) 1,6 і 1,9 % (n=2) -
р53 51,Q і 39,7 % (n=6) 6Q,3 і 42,1 % (n=6) 36,Q і 17,3 % (n=3) 48,Q і 1,4 % (n=2)
MUC2 31,2 і 27,6 % (n=15) рп=°,°9 18,5 і 17,8 % (n=12) 2Q,8 і 24,6 % (n=8) -
MUC5 48,1 і 37,7 % (n=15) 47,7 і 31,1 % (n=13) 57,2 і 34,9 % (n=7) -
AKR1B1Q 87,2 і 16,9 % (n=27) 79,9 і 22,7 % (n=27) 73,4 і 31,2 % (n=16) 36,7 і 3Q,1 % (n=3) рI=Q,QQQQ рII=Q,QQ2 рIII=Q,Q38
CypA 48,Q і 33,9 % (n=23) 28,7 і 25,6 % (n=22) рI=Q,Q1 13,5 і 13,9 % (n=11) р^ДО -
Процент же клеток с позитивной экспрессией Ьс12 не различался в исследуемых группах - 0,55 ± 0,5 % и 0,7 ± 0,4 % (р=0,24). Как при кишечном, так и при диффузном типе рака желудка выраженность экспрессии Ьс12 не отличалась в разных вариантах опухолевых структур, находящихся на разной глубине инвазии (табл. 1, 2).
Позитивная экспрессия р53 чаще наблюдалась при диффузном типе рака желудка в сравнении с кишечным - 100 % и 72 % соответственно (р=0,04). Доля опухолевых клеток, экспрессирующих р53, не различалась при кишечном и диффузном типах рака желудка - 27,2 ± 33,3 % и 34,2 ± 32,3 % (р=0,36). Как при кишечном, так и при диффузном типе рака желудка выраженность экспрессии р53 не отличалась в разных вариантах опухолевых структур с учетом глубины инвазии их в стенке желудка (табл. 1, 2).
Частота случаев с позитивной экспрессией МиС2 была одинаковой при кишечном и диффузном типах рака желудка - 86% и 94% соответственно (р=0,43), так же как и процент клеток, экспрессирующих МиС2 - 19,4 ± 11,8 % и 18,1 ± 16,9 % соответственно. В случаях с кишеч-
ным типом рака желудка отмечалось снижение экспрессии МиС2 в клетках, формирующих железистоподобные структуры при нарастании глубины инвазии. При диффузном типе новообразования доля клеток, экспрессирующих МиС2, была одинаковой в разных слоях стенки органа (табл. 1, 2).
Позитивная экспрессия МиС5 наблюдалась в 83 % при кишечном и в 88 % - при диффузном типе рака желудка (р=0,73). Процент экспрессии МиС5 не различался при кишечном и при диффузном типах рака желудка - 39,0 ± 30,9 % и 57,2 ± 30,2 % (р=0,12). Ни при кишечном, ни диффузном типах РЖ не отмечено изменений уровня экспрессии МиС5 при нарастании глубины инвазии в стенку органа (табл. 1, 2).
Во всех случаях при кишечном и диффузном типах рака желудка наблюдалась экспрессия протеина AKR1B10 в цитоплазме опухолевых клеток. У пациентов с кишечным типом рака желудка экспрессия протеина AKR1B10 в опухолевых клетках железистоподобных структур снижалась по мере нарастания инвазии опухоли в стенку желудка. В паренхиматозном компоненте диффузного рака желудка уровень экспрессии протеина AKR1B10
Таблица 2
Процент клеток с экспрессией ODX2, bcl2, р53, MUC2, MUC5, AKR1B10, CypA в дискретных группах опухолевых клеток на различной глубине инвазии у больных с диффузным типом
рака желудка
Показатель Уровень опухолевой инвазии в стенку желудка
Слизистый слой Подслизистый слой Мышечный слой Серозный слой
I II III IV
СDX2 41,0 і 28,4 % (n=12) 22,9 і 20,6 % (n=14) р=0,03 13,7 і 13,9 % (n=12) р=0,003 16,3 і 20,5 % (n=3) р=0,09
bcl2 0,7 і 0,4 % (n=4) 1,2і 1,1 % (n=3) 0,5 і 0,4 % (n=2) -
р53 34,2 і 32,3 % (n=11) 49,8 і 30,2 % (n=11) 54,2 і 27,4 % (n=6) -
MUC2 18,1 і 16,9 % (n=9) 16,8 і 19,0 % (n=15) 16,2 і 17,0 % (n=7) -
MUC5 57,2 і 30,2 % (n=10) 37,2 і 26,4 % (n=12) 23,8 і 15,5 % (n=5) 21,0 і 12,7 % (n=2)
AKR1B10 70,4 і 26,3 % (n=17) 68,8 і 26,7 % (n=17) 68,4 і 30,9 % (n=11) 66,8 і 36,6 % (n=5)
CypA 9,4 і 4,9 % (n=7) 7,6 і 8,6 % (n=12) 12,2 і 15,9 % (n=7) -
в дискретных группах опухолевых клеток не зависел от глубины их расположения в стенке желудка (табл. 1, 2). Частота встречаемости случаев с позитивной экспрессией CypA не различалась у больных с кишечным и диффузным типами рака желудка - 9Q % и 88 % ^Q^). При диффузном типе рака желудка процент экспрессии CypA был ниже в сравнении с экспрессией этого маркера в цитоплазме клеточных элементов карциномы кишечного типа - 7,7 ± 7,Q % и 24,6 ± 19,3 % соответственно (F=1Q,5; р=0,002). При раздельном изучении уровня экспрессии CypA в каждом из вариантов опухолевых структур с учетом глубины инвазии выявлены следующие закономерности. Оказалось, что при кишечном типе рака желудка экспрессия CypA в опухолевых клетках железистоподобных структур снижается при нарастании глубины инвазии. В паренхиматозном компоненте при диффузном типе рака желудка процент экспрессии CypA в дискретных группах опухолевых клеток не зависел от глубины их расположения в стенке желудка (табл. 1, 2).
Результаты проведенных исследований подчеркивают биологические различия кишечного и диффузного рака желудка. Часть полученных данных согласуется с описанными в литературе фактами: более молодой возраст и более выраженное лимфогенное метастазирование отмечаются у пациентов с диффузным типом рака. В то же время мы показали, что у больных с диффузным типом РЖ чаще наблюдалась экспрессия р53 в клетках опухоли, чем у пациентов с кишечным гистотипом, тогда как для других маркеров - Кі67, MUC5, MUC2 - не выявлено различий в зависимости от гистологического типа опухоли. Эти данные не согласуются с представленными в литературе о более выраженной экспрессии указанных маркеров в опухолях кишечного типа [9, 14, 16, 24]. Такие расхождения, скорее всего, связаны с тем, что в настоящем исследовании в группе с кишечной карциномой были представлены преимущественно случаи с умеренно- и низкодифференцированными опухолями.
Таким образом, в настоящем исследовании получены новые данные о связи экспрессионной способности клеток опухоли с параметрами инвазивного роста опухоли. Обнаружена закономерность снижения экспрессионной способности опухолевых клеток, преимущественно в группе с
кишечным типом новообразования, по мере нарастания глубины инвазии в стенку органа. Таким изменениям подвергалась экспрессия показателя пролиферативной активности Ki67, показателя кишечного органогенеза CDX2, кишечного муцина MUC2, показателя дифференцировки и рост-супрессивных эффектов трансформированных клеток AKR1B10, а также циклофилина А. Не претерпевали подобной трансформации показатели апоптоза р53 и bcl2 и желудочный муцин MUC5. Природа данного феномена нуждается в дальнейшем изучении.
Работа поддержана ФЦП «Научные и научнопедагогические кадры инновационной России» на 2009-2013 гг.. госконтракт №02.740.11.0769 от 12 апреля 2010 г.
ЛИТЕРАТУРА
1. ГригорьеваЕ.С.,БукуроваЮ.А., КрасновГ.С. и др. Идентификация белков с повышенным уровнем синтеза в злокачественных опухолях желудка: сравнение результатов двумерного электрофореза и биоинформатического поиска // Молекулярная биология. 2011. Т. 45, № 4. С. 738-743.
2. Григорьева Е.С., Букурова Ю.А., Чердынцева Н.В. и др. 2D-протеомика рака желудка: идентификация белков с повышенным синтезом в опухоли // Сибирский онкологический журнал. 2009. № 5 (35). С. 37-42.
3. Злокачественные новообразования в России в 2009 году (заболеваемость и смертность) / Под ред. В.И. Чиссова, В.В. Старинского, ГВ. Петровой. М.: ФГУ «МнИоИ им. П.А. Герцена», 2011. 260 с.
4. Имянитов Е.Н. Эпидемиология и биология рака желудка // Практическая онкология. 2009. Т.10, № 1. С. 1-6.
5. Степанов И.В., Завьялова М.В., Григорьева Е.С. и др. Клинико-морфологические и молекулярно-генетические особенности интестинального и диффузного типов карцином желудка // Сибирский онкологический журнал. 2010. № 4 (40). С. 55-66.
6. Alves M.K., Ferrasi A.C., Lima VP. et al. Inactivation of COX-2, HMLh2 and CDKN2A gene by promoter methylation in gastric cancer: relationship with histological subtype, tumor location and Helicobacter pylori genotype // Pathobiology. 2011. Vol. 78 (5). P. 266-276.
7. BarrosR., da CostaL.T., Pinto-de-Sousa J. et at. CDX2 autoregulation in human intestinal metaplasia of the stomach: impact on the stability of the phenotype // Gut. 2011. Vol. 60 (3). P. 290-298.
8. Barros R., Camilo V, Pereira B. et al. Pathophysiology of intestinal metaplasia of the stomach: emphasis on CDX2 regulation // Biochem. Soc. Trans. 2010. Vol. 38 (2). P 358-363.
9. Cletus A. Ki-67 proliferation index and gastric cancer: Answers or more questions // J. Surg. Oncology. 2010. Vol. 102 (3). P. 199-200.
10. Diez-DacalB., Gayarre J., Gharbi S. et al. Identification of aldo-keto reductase AKR1B10 as a selective target for modification and inhibition by prostaglandin A(1): implications for antitumoral activity // Cancer Res. 2011. Vol. 71 (12). P. 4161-4171.
11. Ferrasi A.C., Pinheiro NA., Rabenhorst S.H. et al. Helicobacter pylori and EBV in gastric carcinomas: methylation status and micros atellite instability// World J. Gastroenterol. 2010. Vol. 16 (3). P. 312-317.
12. Kang J.M., Lee B.H., Kim N., LeeH.S. CDX1 and CDX2 expression in intestinal metaplasia, dysplasia and gastric cancer // J. Korean Med. Sci. 2011. Vol. 26 (5). P. 647-653.
13. Kim H.S., Lee J.S., Freund J.N. CDX-2 homeobox gene expression in human gastric carcinoma and precursor lesions // J. Gastroenterol. Hepatol. 2006. Vol. 21. P. 438-442.
ЭКСПРЕССИОННЫЕ ХАРАКТЕРИСТИКИ ДИФФУЗНОГО И КИШЕЧНОГО ТИПОВ РАКА ЖЕЛУДКА
--------------------------------------------------------------------------------- V3
14. Kyu Eun Lee, Hyuk-Joon Lee, Yoon Ho Kim. Prognostic significance of p53, nm23, PCNA and c-erbB-2 in gastric cancer // Jap. J. Clin. Oncol. 2003. Vol. 33. P. 173-179.
15. Lauren P. The two histological main types of gastric carcinoma: diffuse and so-called intestinal-type carcinoma // Acta. Pathol. Microbiol. Scand. 1965. № 64. P. 31^9.
16. Lazar D., Taban S., Sporea I. et al. Ki-67 expression in gastric cancer. Results from a prospective study with long-term follow-up // Rom. J. Morphol. Embryol. 2010. Vol. 51 (4). P. 655-661.
17. Lee J. Role of Cyclophilin A during Oncogenesis // Arch. Pharm. Res. 2010. Vol. 33. P. 181-187.
18. Leteurtre E., Zerimech F., Piessen G. Relationships between mucinous gastric carcinoma, MUC2 expression and survival // World J. Gastroenterol. 2006. Vol. 12. P. 3324-3331.
19. Namikawa T., HanazakiK. Mucin phenotype of gastric cancer and clinicopathology of gastric-type differentiated adenocarcinoma // World J. Gastroenterol. 2010. Vol. 16. P. 4634-4639.
20. Obchoei S., Weakley S.M., Wongkham S. et al. Cyclophilin A enhances cell proliferation and tumor growth of liver fluke-associated cholangiocarcinoma // Mol Cancer. 2011. Vol. 10. P. 102.
21. Park do Y., Srivastava A., Kim G.H. et al. CDX2 expression in the intestinal-type gastric epithelial neoplasia: frequency and significance // Mod. Pathol. 2010. Vol. 23 (1). P 54-61.
22. Qiang Liu, Ming Teh, Kosei Ito CDX2 expression is progressively decreased in human gastric intestinal metaplasia, dysplasia and cancer // Modern Pathol. 2007. Vol. 20. P 1286-1297.
23. Shin N., Kim H.Y., Kim W.K. Molecular biological characteristics of differentiated early cancer on the basis of mucin expression // Korean J. Pathol. 2011. Vol. 45. P. 69-78.
24. Sym S., Hong J., Cho E. et al. Prognostic impact of immuno-histochemical expression of Ki-67 in patients with advanced gastric cancer who underwent curative resection // J. Clin. Oncol. 2011. Vol. 29. P. 1133-1137.
25. Xie Y., Li L., Wang X. et al. Overexpression of CDX2 inhibits progression of gastric cancer in vitro // Int. J. Oncol. 2010. Vol. 36 (2). P. 509-516.
26. Zhang Y.Z., Zhang L.H., Gao Y. et al. Discovery and validation of prognostic markers in gastric cancer by genome-wide expression profiling // World J. Gastroenterol. 2011. Vol. 17 (13). P. 1710-1717.
Поступила 20.04.12
Что такое перстневидноклеточный рак желудка?
Все раки желудка можно разделить на 2 большие группы: диффузные и интестинальные. Интестинальные четко связаны с известными факторами риска, возникают в пожилом возрасте, и развиваются на фоне кишечной метаплазии – появления в желудке клеток, характерных для слизистой оболочки кишечника. Диффузные раки возникают в молодом возрасте, не связаны с воздействием факторов риска и часто имеют наследственный характер. Такие раки относительно редки, но с конца прошлого века статистика постепенно меняется: доля интестинальных раков уменьшается, тогда как диффузных – возрастает. Один из видов диффузных раков – перстневидноклеточный рак желудка.
Перстневидноклеточный рак: особенности
Клетки этого вида рака активно вырабатывают слизь, которая скапливается внутри них, оттесняя клеточное ядро к краю. Именно за эту особенность строения перстневидный рак желудка и получил свое название. Среди всех форм желудочных раков он занимает 10-20%. Соотношение мужчин и женщин среди пациентов примерно 0.8 к 1.
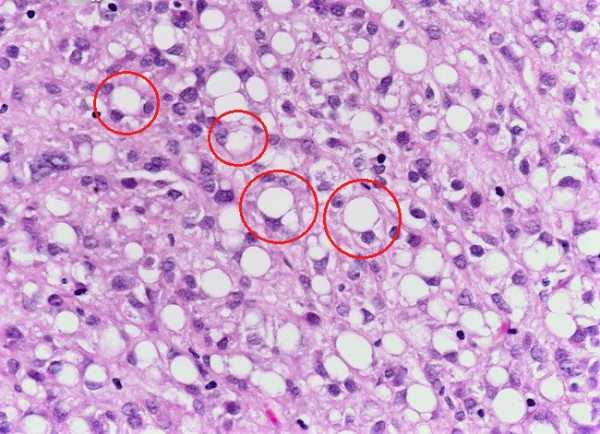
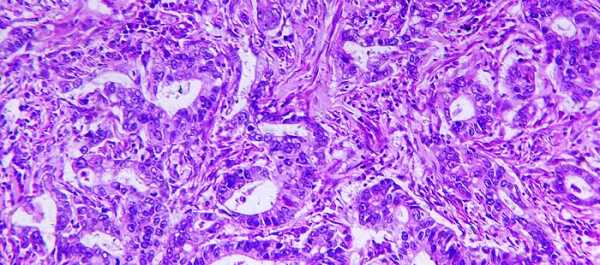
Отмечены злокачественные клетки, заполненные муцином (слизью) со смещённым к периферии ядром (тёмно-фиолетовые пятна), похожие на перстень.
Карцинома не имеет четко выраженного узла, а выглядит как слабо связанные друг с другом скопления озлокачествленных клеток. Растет она чаще всего инфильтративно, то есть не выпячиваясь в полость желудка, а под слизистую, постепенно захватывая все слои органа. На относительно поздних стадиях изъязвляется. Такая особенность делает перстневидноклеточный рак более неблагоприятным с точки зрения прогноза. Поскольку слизистая не повреждается и нет характерных изменений, его невозможно обнаружить на ранних стадиях ни при эндоскопическом, ни при рентгеновском исследовании. И до тех пор, пока не появится язва, либо опухоль не разрастется до обширных размеров, не изменяется и самочувствие пациента.
В результате, по информации отечественных врачей, более половины случаев (55%) перстневидноклеточного рака обнаруживают на стадии субтотального или тотального поражения желудка, когда вероятность излечения крайне мала. Еще одна проблема – эта карцинома достаточно быстро образует метастазы. При этом она чаще метастазирует не в лимфатические узлы, а в клетчатку вокруг желудка, сальник, распространяется по брюшине, у женщин дает местастазы в яичники (до 13%).
Клинические проявления
На ранних стадиях развития опухоль никак себя не проявляет. Когда заболевание распространяется, захватив большую часть органа, появляются следующие симптомы:
- общая слабость без видимых причин;
- самопроизвольное снижение веса;
- дискоморт в области живота – тяжесть, тупая боль, давление;
- «капризы» в питании, избирательность, часто возникает отвращение к мясной пище;
- уменьшение аппетита вплоть до анорексии;
- снижение настроение вплоть до депрессии;
- анемия.
При дальнейшем росте опухоли появляются:
- боль «под ложечкой»;
- рвота, в том числе с примесью крови;
- желтуха;
- асцит, скопление жидкости в брюшной полости;
- кахексия (истощение).
Эти признаки свидетельствуют о далеко зашедшем процессе.
Диагностика
В отличие от интестинальных форм рака, которые развиваются на фоне длительно текущего атрофического гастрита, при диагностике перстневидноклеточного рака не слишком эффективна гастроскопия. Подслизистый рост опухоли не позволяет обнаружить ее вплоть до поздних стадий развития либо появления язвы, с краев которого обязательно берется материал для гистологического исследования.
Эффективным может оказаться рентгенологическое исследование с контрастом: пациенту перед рентгенографией предлагают выпить взвесь сульфата бария, которые не пропускает рентгеновские лучи. При таком исследовании фиксируются перистальтические движения желудка, и зачастую становятся заметны относительно малоподвижные участки, проросшие опухолью. Важное условие для повышения эффективности диагностики в этом случае – получение нескольких проекций органа.
Ультразвуковое исследование выявляет утолщение стенки желудка, нарушение ее структуры в месте роста опухоли. На ранних стадиях развития рака толщина стенки не превышает 10 мм, контуры образования относительно четкие. В дальнейшем они становятся неровными, бугристыми, а толщина стенки доходит до 20 мм. Кроме того, УЗИ позволяет узнать состояние других органов брюшной полости, обнаружить метастазы.
Компьютерная томография и магнитно-резонансная томография – стандарт обследования в других странах, но в нашей это слишком дорогие методики для рутинного использования, которые рекомендуются «только в некоторых клинических ситуациях».
Лечение
Основной метод лечения перстневидноклеточного рака желудка – хирургический. Учитывая, что чаще всего карцинома обнаруживается на поздних стадиях, проводится гастрэктомия – полное удаление желудка. Реже выполняется резекция – удаление части желудка.
В связи с особенностями роста опухоли, операция чаще всего сопровождается химиотерапией. Режим химиотерапии подбирает лечащий врач – в некоторых случаях необходимо сочетание предоперационного курса химиотерапии с постоперационным, иногда достаточно только послеоперационной химиотерапии. Несмотря на то, что это метод лечения имеет множество побочных эффектов, он улучшает прогноз болезни, так как позволяет уничтожить раковые клетки, оставшиеся после резекции или невыявленные метастазы, которые могут быть и микроскопического размера.
Прогноз
Как отечественные, так и европейские врачи считают перстневидноклеточный рак желудка заболеванием с неблагоприятным прогнозом. Если опухоль не успела прорасти серозную (наружную) оболочку, 3-х летняя выживаемость составляет 56,4%, 5-летняя – 39,6%. При ее прорастании выживаемость падает до 28,5% и 20,4% соответственно.
Причины рака желудка, классификация по стадиям, сколько живут
Рак желудка — это злокачественная опухоль, развивающаяся из эпителиальных клеток слизистой оболочки органа. Образуется в результате бесконтрольного деления клеток, ДНК которых подверглась мутации.
Аденокарцинома является одним из самых распространенных в современном мире онкологических заболеваний, наряду с раком легких, груди, кишечника и простаты. Несмотря на то, что имеется устойчивая тенденция к снижению заболеваемости, каждый год в мире регистрируется около 1 миллиона заболевших этим серьезным недугом.
В России злокачественные новообразования желудка находятся на втором месте в структуре онкологической смертности, уступая раку легких у мужчин и раку груди у женщин. Ежегодно регистрируют до 38 тысяч новых случаев заболевания.
Причины возникновения болезни у женщин и мужчин
Точная причина возникновения онкологических заболеваний не установлена. На сегодняшний день в научном мире за основу принята мутационная теория развития рака: в результате воздействия ряда внешних и внутренних факторов происходит генетический сбой в здоровой клетке, и образовавшаяся клетка‒мутант начинает бесконтрольно делиться.
В основе патологического процесса лежит несостоятельность иммунной системы, из-за чего измененные клетки не удаляются из организма и начинают усиленно размножаться, образуя опухоль.
Рак желудка, как и другие разновидности онкологической патологии, не относится к инфекционным заболеваниям, поэтому не представляет опасности для окружающих.
Факторы риска (предрасполагающие факторы):
- Генетическая предрасположенность (рак желудка в анамнезе у ближайших родственников)
- Фоновые (предопухолевые) патологии желудка (язвенная болезнь, полипоз, гипертрофический и ахилический гастрит)
- Нерациональное, нерегулярное и некачественное питание с преобладанием соленой, жирной, жареной, копченой, крахмалистой пищи и недостатком растительных, кисломолочных и цельнозерновых продуктов
- Неблагоприятная экологическая обстановка, некачественная питьевая вода с повышенным содержанием солей
- Радиоактивное излучение
- Производственная вредность, неблагоприятные условия труда
- Длительный стресс
- Курение, алкоголизм
- Бесконтрольный прием медикаментов
Все эти факторы, особенно при совокупном воздействии, увеличивают риск возникновения заболевания.
Группа риска по раку желудка
К особой группе риска относятся:
- лица с отягощенным наследственным анамнезом;
- пациенты с хроническими заболеваниями ЖКТ (гастрит, особенно атрофический; язвенная болезнь; аденоматозые полипы; кишечная метаплазия; пищевод Баретта).
Такие пациенты должны проходить регулярное гастроскопическое обследование с обязательной гистологией патологических участков (не реже 1 раза в год).
Мужчины больше, чем женщины, предрасположены к возникновению заболевания. Среди мужского населения болезнь встречается в 1,7 раза чаще. Достоверная причина этого не известна, но предполагается, что распространенность вредных привычек среди мужчин приводит к повышенному риску заболевания.
Наследственность как фактор риска
Наследственным путем передается не само заболевание, а предрасположенность к нему, связанная с определенными мутациями генов, которые повышают риск развития онкологического процесса.
Рак желудка, возникший в возрасте до 40 лет (диффузный рак), определенно связан с генетическими мутациями и имеет наследственный характер. Заболевание протекает агрессивно и быстро прогрессирует. Поэтому следует в обязательном порядке провести генетический анализ на заболевание у ближайших родственников.
В онкологии существует принцип: если у кого-то в семье был выявлен рак какой-либо локализации, то родственникам необходимо тщательно проверить этот орган на 10 лет раньше, чем был установлен диагноз заболевшего.
Возрастные особенности заболевания
Рак может развиться абсолютно в любом возрасте, включая детский, однако после 50‒55 лет риск возникновения злокачественных новообразований желудка значительно возрастает. Пик заболеваемости приходится на 65‒75 лет.
Классификация рака желудка по стадиям:
- Нулевая стадия (предрак) – опухоль еще не сформирована, но клетки уже подверглись мутации. Клинические проявления отсутствуют, поэтому обнаружение заболевания на данном этапе – это большая редкость.
- 1 стадия – опухоль формируется в слизистом или подслизистом слое, размеры ее небольшие ‒ до 2 см, возможно проникновение в 1‒2 лимфатических узла. Регионарные метастазы отсутствуют. На этой стадии болезнь выявляется крайне редко, так как симптомы практически отсутствуют или являются неспецифичными: слабость, быстрая утомляемость, диспепсические явления, которым больные не придают особого значения.
- 2 стадия – опухоль проникает в мышечную оболочку стенок желудка, поражает регионарные лимфатические узлы. Отдаленных метастазов нет. Симптоматика также слабо выражена и списывается на погрешность в питании: тошнота, рвота, тяжесть в желудке. Усиливается чувство недомогания и беспричинной слабости.
- 3 стадия – опухоль прорастает во все слои стенок желудка, поражает регионарные и отдаленные лимфоузлы. Больного беспокоят боли разной степени выраженности, учащаются приступы тошноты, появляется рвота с примесью крови или «кофейной гущей», наблюдается нарушение акта глотания (дисфагия), дегтеобразный стул (мелена). Усиливается слабость, больной интенсивно худеет, теряет аппетит.
- 4 стадия – опухоль интенсивно разрастается, раковые клетки распространяются по всему организму, поражаются лимфоузлы, наблюдаются множественные метастазы в отдаленных органах (легкие, печень, яичники, головной мозг). Симптомы становятся ярко выраженными. Боли усиливаются. Появляются желудочно-кишечные кровотечения, которые часто требуют неотложного хирургического вмешательства. Может развиться кишечная непроходимость. Нарастают симптомы интоксикации. Прогрессирует кахексия (истощение).
Читайте также: формы и виды рака желудка
Классификация TNM
Чаще всего для классификации заболевания применяется TNM система (опухоль‒узел‒метастаз).
Классификация описывает:
- Т ‒ величину и распространенность основной опухоли;
- N – степень поражения лимфатической системы;
- М ‒ наличие метастазов.
Т 1 ‒ опухоль растет в пределах слизистой оболочки и подслизистого слоя
Т 2 ‒ опухоль распространяется на мышечный и субсерозный слой
Т 3 ‒ прорастание в субсерозную (поверхностную) оболочку желудка, без инвазии в соседние структуры
Т 4 ‒ полное прорастание в оболочку стенки желудка и распространение на соседние структуры (селезенка, печень, диафрагма, поджелудочная железа, почка, забрюшинное пространство)
N 0 ‒ признаки поражения регионарных узлов отсутствуют
N 1 ‒ метастазы обнаруживаются в 1‒2 регионарных лимфатических узлах
N 2 ‒ метастазы в 3‒6 лимфатических узлах
N 3 ‒ метастазы более, чем в 7 лимфатических узлах
М 0 ‒ нет метастазов в отдаленных органах
М 1 ‒ определяются метастазы в отдаленных органах
Прогноз продолжительности жизни при раке желудка
Злокачественная опухоль развивается в течение долгого времени, никак себя не проявляя. От момента возникновения патологического процесса до появления первых симптомов, может пройти более 10 лет.
Успех в лечении достигается только в результате своевременной диагностики. Индивидуальная биология опухоли отличается в каждом конкретном случае, поэтому лишь начав лечение, можно сделать выводы о дальнейшей его эффективности.
Очень важно добиться контроля над болезнью. Даже при запущенных формах заболевания, применяя современные методики лечения, можно получить стойкую ремиссию, тем самым значительно продлить жизнь и улучшить ее качество.
Прогноз при заболевании серьезный и зависит от множества факторов. Существуют усредненные статистические данные по продолжительности жизни в зависимости от стадии заболевания:
- 1 стадия ‒ более 80% больных излечиваются, возвращаясь к нормальной жизни;
- 2 стадия ‒ длительная ремиссия достигается в 60‒70% случаев;
- 3 стадия ‒ пятилетняя выживаемость менее 40%;
- 4 стадия ‒ пятилетняя выживаемость менее 10%.
По мере своего роста опухоль проникает в лимфатический аппарат желудка и кровеносные сосуды, начинает распространяться в виде метастазов. На фазе метастатического процесса рак наиболее трудно поддается лечению.
Пятилетняя выживаемость достигается в 20‒50% случаев и зависит от распространенности процесса, чувствительности опухоли к проводимой терапии, возраста и общего состояния пациента.
Смерть наступает от сильнейшей раковой интоксикации, которая сопровождается крайним истощением организма (кахексией) и от осложнений (профузное желудочно-кишечное кровотечение, перитонит, инфекции).
Психологические аспекты заболевания
В последнее время большое внимание уделяется психологическим предпосылкам развития онкологических заболеваний (психосоматика). Согласно научным исследованиям, к повышенному риску заболевания приводят подавленные обиды, гнев, конфликты, неприязнь к себе и к миру, негативные эмоции, которые разрушают организм изнутри.
Большинство врачей сходятся во мнении, что необходимо лечить не только тело, но и душу. Психологический настрой и душевное состояние больного, оказывают огромное влияние на течение заболевания и его исход.
Поэтому пациенту со злокачественным новообразованием очень важна поддержка родственников и собственная вера в успешное избавление от болезни.
Рак желудка Википедия
| Рак желудка | |
|---|---|
| Язвенное образование желудка, по данным биопсии — аденокарцинома | |
| МКБ-10 | C1616. |
| МКБ-10-КМ | C16.5, C16.6, C16.2, C16.9 и C16 |
| МКБ-9 | 151151 |
| МКБ-9-КМ | 151[1], 151.6[1], 151.5[1], 151.9[1] и 151.4[1] |
| OMIM | 137215 |
| DiseasesDB | 12445 |
| MedlinePlus | 000223 |
| eMedicine | med/845 |
| MeSH | D013274 |
| Медиафайлы на Викискладе | |
Рак желудка — злокачественная опухоль, происходящая из эпителия слизистой оболочки желудка.
Рак желудка является одним из наиболее распространённых онкологических заболеваний. Может развиваться в любом отделе желудка и распространяться на другие органы, особенно пищевод, лёгкие и печень. От рака желудка в мире ежегодно погибает до 800 000 человек (данные на 2008 год)[2].
Содержание
- 1 Эпидемиология
- 2 Этиология
- 2.1 Рак желудка и Helicobacter pylori
- 3 Симптомы
- 4 Макроскопическая картина
- 5 Гистологические типы
- 6 Локализация опухоли
- 7 Классификация по системе TNM
- 8 Стадии
- 9 Метастазирование
- 9.1 Имплантационное метастазирование